2. 黑龙江八一农垦大学动物科学技术学院, 黑龙江 大庆 163319;
3. 哈尔滨医科大学第五医院, 黑龙江 大庆 163316
2. College of Animal Science & Veterinary Medicine, Heilongjiang Bayi Agricultural University, Daqing 163319, China;
3. Department of gynecology and obstetrics, The Fifth Affiliated Hospital of Harbin Medical university, Daqing 163316, China
胃癌是最常见的恶性肿瘤之一,在我国其发病率和死亡率均列恶性肿瘤的前2位,每年新发病例占全球40%,每年约有17万人死于胃癌,几乎接近全部恶性肿瘤死亡人数的1/4,5年生存率仅为30% [1-5],严重威胁着人类的健康和生命。目前,大部分常用的抗肿瘤化学药物具有不良反应强、毒副作用大及价格昂贵等诸多问题。因此,寻求一种高效、安全、廉价的药物受到肿瘤研究者的广泛重视和青睐。
醌茜素是一种具有高效性、高选择性和细胞能透性的化合物。有研究表明,醌茜素通过调节cdc25c、雌激素、Akt及p38等蛋白有效地抑制前列腺癌、乳腺癌及肺癌等细胞的增殖,并促进其发生凋亡[6-8],但其具体的抗肿瘤分子机制尚不清楚,尤其醌茜素对胃癌的药效及其药理机制未见报道。本实验利用MTT比色法、Annexin V-FITC/PI双染法、流式细胞术及Western blotting等方法,探究醌茜素对胃癌细胞的杀伤作用和诱导胃癌细胞凋亡作用可能的分子机制,为胃癌以及其他癌症的治疗与新药开发提供理论依据。
1 材料和方法 1.1 主要试剂醌茜素(MERCK);5-氟尿嘧啶(5-FU)(上海皓元化);RPMI 1640高糖培养基、青/链霉素及0.25%胰蛋白酶均(Hyclone);胎牛血清(FBS)(Gibco);MTT(Amresco);DMSO(Sigma);Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天);β-actin、Bcl-2、Bad、Akt、p-Akt、JNK、p-JNK、p38、p-p38、ERK、p-ERK、cleavedcaspase-3、pro-caspases-3、cleaved-PARP-1抗体、HRP标记山羊抗兔IgG及HRP标记山羊抗鼠IgG(Santa Cruz);ECL化学发光试剂(Thermo);DCFH-DA(Invitrogen)。
1.2 细胞及培养人胃癌AGS、MKN-28及MKN-45细胞系,人正常肝QSG-7701细胞系均购于中国科学院细胞研究所。用含10% FBS、100 U/mL青霉素及100 µg/mL链霉素的RPMI 1640培养液,在37 ℃、5% CO2、饱和湿度的培养箱内培养。细胞满度达到70%~80%时,进行传代培养。
1.3 MTT法检测醌茜素对三种细胞的杀伤作用取对数生长期的人胃癌AGS、MKN-28及MKN-45细胞,以1×104/孔的密度接种至96孔板,5% CO2、37 ℃培养箱里孵育24 h,用含有1% FBS的培养液饥饿处理2 h,按照不同的剂量给予醌茜素(1、3、10、30及100 μmol/L)处理,阳性对照组用5-FU做相同处理;阴性对照组加入等量1 μL DMSO,处理24 h后每孔加入15 μL的MTT溶液(5 mg/mL),继续培养2~4 h后吸去培养液,每孔加入100 μL DMSO,在摇床上混匀15 min,选择490 nm波长,用酶标仪检测各孔吸光度值(A),计算细胞存活率。设置空白调零孔,不接种细胞,只加入100 μL DMSO,每组设置8个复孔,实验重复3次。
细胞存活率(%)=(A实验组-A空白对照)/(A对照组-A空白对照)×100%。
1.4 荧光显微镜观察细胞的凋亡情况取对数生长期的胃癌AGS细胞以1×105/孔的密度接种至6孔板,5% CO2、37 ℃培养箱里培养24 h,用30 μmol/L醌茜素分别处理细胞3、6、12及24 h,根据Annexin V-FITC/PI细胞凋亡检测试剂盒说明书进行染色,通过荧光显微镜观察并分析细胞凋亡情况。
1.5 流式细胞术检测细胞凋亡取对数生长期的人胃癌AGS细胞以1×105/孔的密度接种至6孔板,5% CO2、37 ℃培养箱里培养24 h,用30 μmol/L醌茜素分别处理细胞3、6、12及24 h,离心收集细胞。以PBS洗涤后,加入195 μL Annexin V-FITC结合液重悬细胞,再加入3 μL Annexin V-FITC与2 μL PI,设置空白对照组和单色对照组。室温避光孵育15 min,每组加入300 μL PBS,转移至流式管中,通过流式细胞仪检测细胞凋亡率。
1.6 流式细胞术检测细胞内活性氧簇(ROS)水平取对数生长期的人胃癌AGS细胞以1×105/孔的密度接种至6孔板,5% CO2、37 ℃培养箱里培养24 h,用不同浓度的醌茜素(10、20、30及40 μmol/L)处理24 h,用PBS洗1次,加入终浓度为10 μmol/L的DCFH-DA,37 ℃恒温水浴30 min,用PBS洗1次,离心收集细胞,500 μL PBS重悬,转移至流式管中,通过流式细胞仪检测细胞内ROS水平情况。
1.7 NAC对醌茜素诱导AGS细胞凋亡的阻断作用取对数生长期的人胃癌AGS细胞以1×105/孔的密度接种至6孔板,5% CO2、37 ℃培养箱里培养24 h,以终浓度为5 mmol/L的NAC(抗氧化剂)预处理1 h后用30 μmol/L的醌茜素处理AGS细胞24 h,收集细胞,PBS洗涤1次,加入195 μL Annexin V-FITC结合液重悬细胞后,每组依次加入3 μL Annexin V-FITC及2 μL PI,轻轻混匀,冰上避光孵育15 min后,每组加入300 μL PBS,转移至流式管中,通过流式细胞仪检测细胞凋亡率。
1.8 Western blotting法检测细胞凋亡蛋白表达变化细胞培养结束后,回收细胞提取各组细胞总蛋白,取30 μg蛋白样品,加入5×上样缓冲液,上样至12% SDS-PAGE进行电泳分离,半干转膜至硝酸纤维膜上,5%脱脂乳封闭1 h,一抗分别为Bad、Bcl-2、Akt、p-Akt、JNK、p-JNK、p38、p-p38、ERK、p-ERK、cleaved caspase-3、pro-caspases-3及cleaved PARP-1,4 ℃孵育过夜,TBST洗膜5次,二抗室温孵育2 h,ECL化学发光试剂显色,应用化学发光型凝胶成像系统呈像,通过Image J图像分析软件对条带进行分析(内参采用β-actin)。蛋白相对表达量=目的条带灰度/内参条带灰度×100%。
1.9 统计学分析采用SPSS 11.0软件进行统计学分析,数据均以均数±标准差表示,各组间比较采用t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 醌茜素对3种胃癌细胞存活率的影响MTT结果显示,醌茜素对3种胃癌细胞均具有明显的杀伤作用,且随着醌茜素处理浓度的升高,3种人胃癌细胞存活率明显降低,呈剂量相关性,IC50值分别为7.07 μmol/L、22.55 μmol/L及14.18 μmol/L。与阳性对照药物5-FU相比,差异具有统计学意义;并且对人正常肝细胞(QSG-7701)无明显毒副作用。由于AGS细胞的IC50值较低,对醌茜素比较敏感,后续实验将以AGS细胞为主要研究对象进行研究(P < 0.05,图 1)。
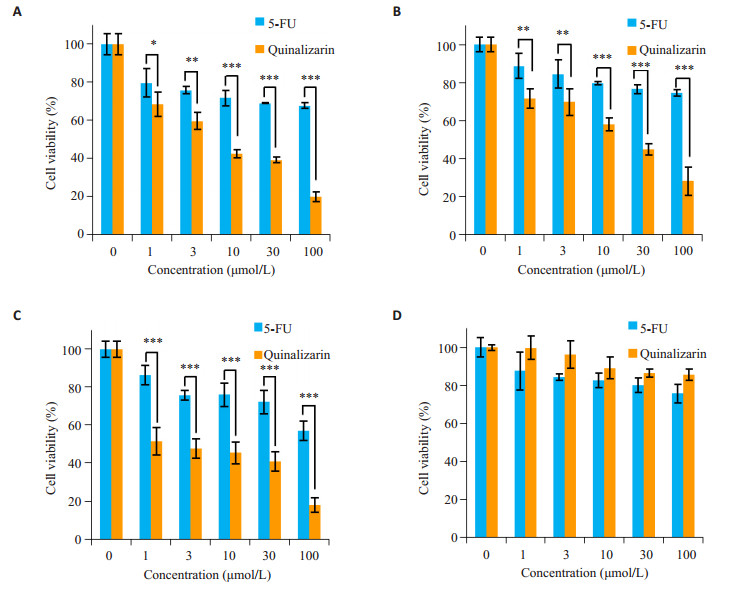
|
图 1 醌茜素对胃癌细胞AGS、MKN-28、MKN-45及正常肝QSG-7701细胞存活率的影响 Figure 1 Cytotoxic effects of quinalizarin on human gastric cancer AGS cells (A), MKN-28 cells (B), MKN-45 cells (C) and normal liver QSG-7701 cells (D). *P < 0.05; **P < 0.01; ***P < 0.001. |
通过荧光显微镜观察细胞形态及荧光强度的变化。在荧光显微镜下,与对照组(0 h)相比经30 μmol/L醌茜素处理细胞3、6、12及24 h后AGS细胞的形态发生了明显的改变。正常组中,AGS细胞呈多边形贴壁生长,状态良好;而醌茜素处理组中,细胞体变圆、缩小,部分细胞变成碎片,培养基表面漂浮死细胞。随着醌茜素处理时间的延长,细胞的荧光强度(绿色)逐渐增强,其细胞凋亡程度也显著增加(图 2A),与对照组(0 h)相比,差异具有统计学意义(P < 0.001,图 2B)。
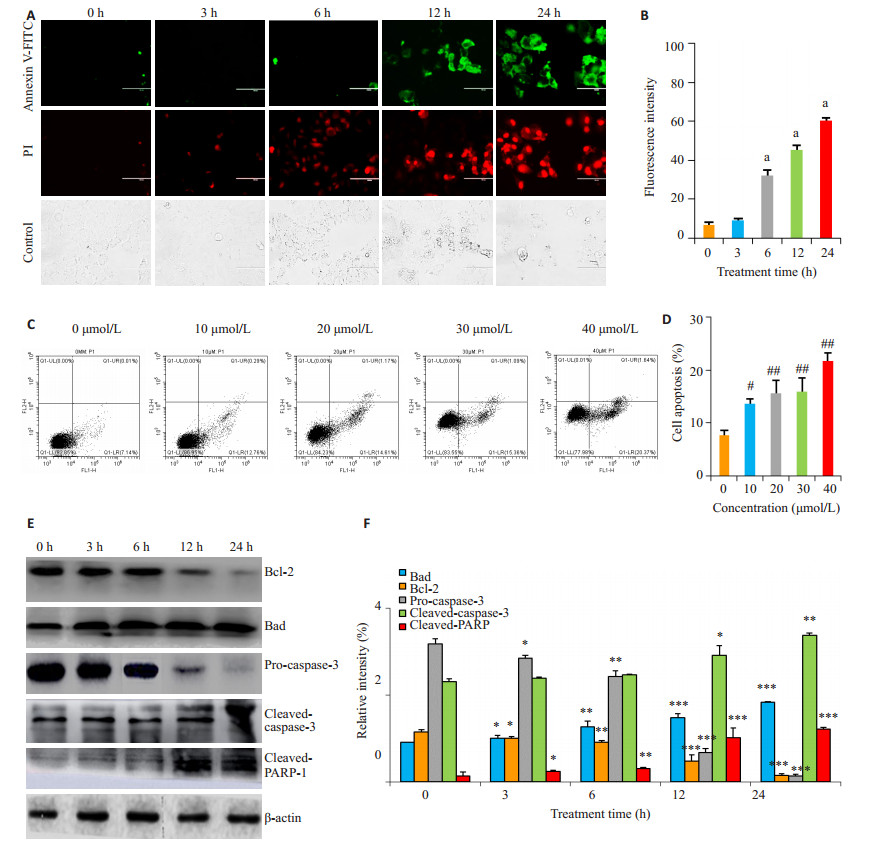
|
图 2 醌茜素对胃癌AGS细胞凋亡的影响 Figure 2 Quinalizarin-induced apoptosis in AGS cells (A-D) and its effect on expression levels of apoptosis-related proteins (E, F). aP < 0.001 vs 0 h, #P < 0.01, ##P < 0.001 vs 0 μmol/L, *P < 0.05, **P < 0.01, ***P < 0.001 vs 0 h. |
流式细胞仪检测醌茜素对细胞凋亡的影响,结果显示醌茜素可诱导胃癌癌细胞凋亡且在同一作用浓度下,随着醌茜素处理时间的增加,细胞凋亡比例逐渐升高(图 2C)。与对照组(0 μmol/L)相比,差异具有统计学意义(P < 0.001,图 2D)。
通过Western blotting法检测细胞凋亡相关蛋白表达量变化分析,随着醌茜素处理的时间不断增加,促凋亡蛋白Bad、cleaved-caspase-3及cleaved-PARP-1表达量增加,pro-caspase-3表达量逐渐减少,抗凋亡蛋白Bcl-2蛋白表达量减小。结果表明,醌茜素通过诱导细胞凋亡,进而对AGS细胞发挥良好的杀伤作用(P < 0.05,图 2E、F)。
2.3 醌茜素通过调节AGS细胞内ROS的水平诱导细胞凋亡细胞内活性氧自由基(ROS)的含量对于细胞内环境稳态具有重要作用。为了探究醌茜素诱导的AGS细胞凋亡是否与细胞内ROS的产生相关,AGS细胞经不同浓度(10、20、30及40 μmol/L)醌茜素处理24 h后,通过DCFH-DA荧光探针检测细胞内ROS变化。从图 3A中可以看出:随着醌茜素处理浓度的增加,细胞内ROS水平明显增加,峰图逐渐右移。与对照组(0 μmol/L)相比,差异具有统计学意义。结果表明,醌茜素可促进AGS细胞内ROS产生,并具有浓度依赖性(P < 0.001,图 3B)。
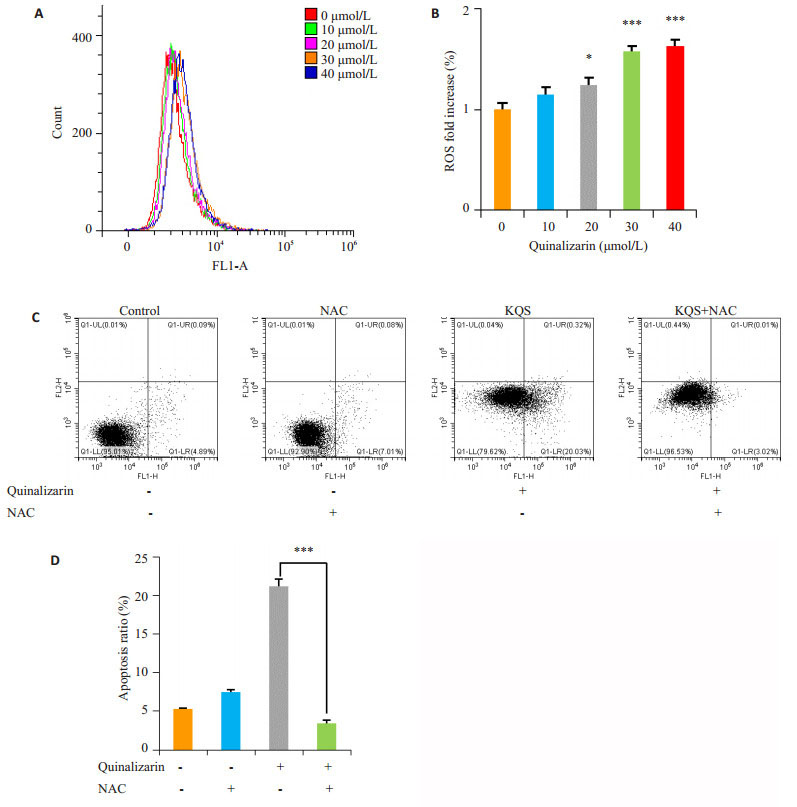
|
图 3 醌茜素调节AGS细胞内ROS的水平并诱导细胞凋亡 Figure 3 Quinalizarin induces apoptosis (C, D) through regulating intracellular ROS levels (A, B). *P < 0.05, ***P < 0.001 vs control group. |
分别用醌茜素、NAC及醌茜素+NAC处理AGS细胞24 h,进行Annexin V-FITC/PI双染,通过流式细胞仪检测细胞凋亡情况。从图 3C中可以看出:醌茜素+ NAC处理组与醌茜素单独处理组相比细胞凋亡率明显降低,差异具有统计学意义。结果表明,醌茜素通过上调AGS细胞内ROS的水平诱导细胞凋亡(P < 0.001,图 3D)。
2.4 醌茜素对上游信号通路相关蛋白表达量的影响经30 μmol/L的醌茜素处理细胞3、6、12及24 h后,通过Western blotting法检测细胞凋亡相关蛋白的表达量变化。从图 4中可以看出:随着醌茜素处理的时间不断增加,促凋亡蛋白p-p38与p-JNK表达量增加,抗凋亡蛋白p-Akt与p-ERK表达量减小,说明醌茜素通过调控凋亡相关蛋白诱导细胞凋亡,进而对AGS细胞发挥良好的杀伤作用(P < 0.05,图 4)。
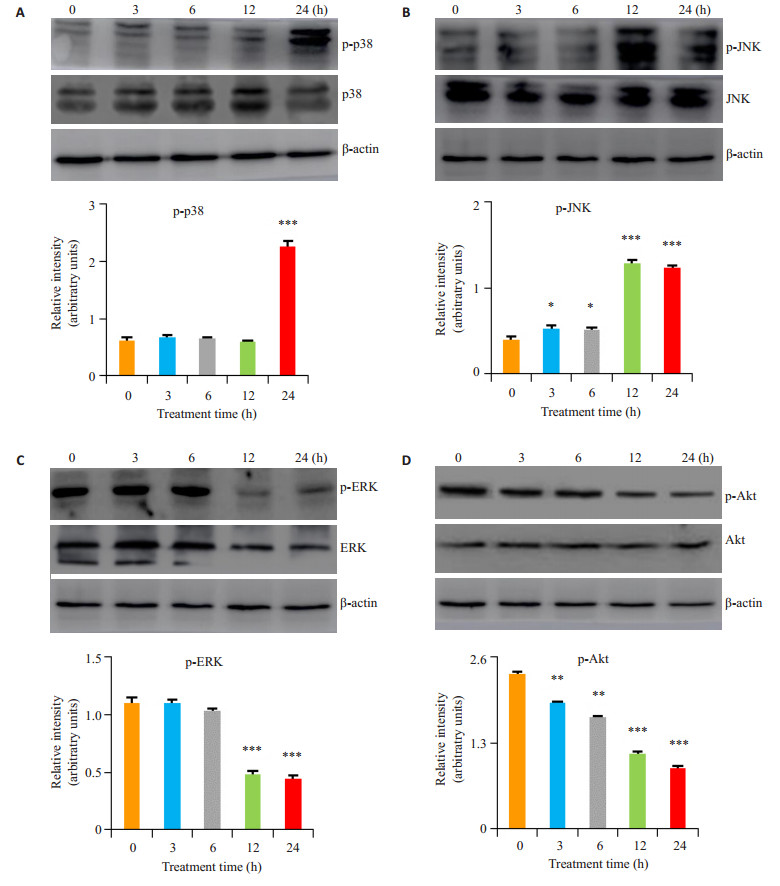
|
图 4 Western blotting检测醌茜素对AGS细胞凋亡相关信号通路上游蛋白的表达量变化 Figure 4 Effect of quinalizarin on expression levels of apoptosis-associated proteins p38 (A), JNK (B), Akt (C) and ERK (D) in AGS cells detected by Western blotting. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group. |
近年来,通过调控细胞信号转导途径诱导癌细胞细胞凋亡,已成为目前肿瘤学领域的研究热点之一[8]。醌茜素是鼠李科植物翼核果等许多中草药的主要成分之一,具有良好的抗肿瘤活性。前期研究结果发现,醌茜素可以有效地抑制人肺癌A549细胞增殖、凋亡及细胞周期阻滞[6]。本研究结果显示,醌茜素对三种胃癌AGS、MKN-28和MKN-45细胞具有良好的杀伤作用。肝脏是人体极为重要的集合成、代谢、解毒和免疫等诸多功能于一体的器官,负担着几乎所有外来物质的代谢和解毒作用,富含药物Ⅱ相代谢和Ⅱ相代谢所需的各种酶。因此,肝脏是药物代谢的主要器官,易受到药物的毒副作用导致的损伤[9-10]。所以本论文在MTT实验中选用正常肝QSG-7701细胞作为研究对象,探究醌茜素对正常细胞的毒副作用,结果发现,醌茜素对正常肝细胞并无明显的毒副作用。同时,在显微镜下观察到细胞明显固缩和凝聚,大量细胞脱离培养皿底部,这些变化与细胞发生凋亡的特征极其相似。进一步通过流式细胞仪检测发现,由于醌茜素本身是带有红颜色的化合物,随着醌茜素处理浓度的增加,醌茜素的颜色也随之变深。因此,猜测药物处理后,导致细胞主群在左下象限向上发生了一定的偏移。但是从图 2C和图 3C中明显可以看出大量细胞出现在右上和右下象限,说明醌茜素处理细胞后,能够诱导肺癌A549细胞发生了不同程度的早期凋亡和晚期凋亡。这与显微镜下观察到细胞出现典型凋亡状态的结果一致。这些结果与先前研究对比说明,醌茜素不但对人肺癌A549细胞具有诱导凋亡作用,而且还能够诱导人胃癌AGS细胞发生凋亡。
PI3K/Akt信号通路已被证实能够涉及多种细胞进程,包括细胞存活、细胞周期及细胞凋亡[11-13]。有研究发现,Akt通过磷酸化Bad的Ser112/Ser136残基,磷酸化后的Bad与Bcl-2解聚,游离的Bcl-2激活caspase-9凋亡信号通路,激活caspase-3,剪切PARP,进而对癌细胞发挥抗凋亡作用[14-16]。此外,p38信号通路在肿瘤的细胞增殖、分化,以及凋亡过程中发挥至关重要的作用,已成为研究的靶点。p38蛋白能够通过磷酸化p53蛋白在caspase上游和下游均起作用,调控细胞凋亡[17-19]。有报道指出,ERK在卵巢癌[20]、乳腺癌[21]等多种肿瘤组织中异常表达,表明ERK与肿瘤的发生密切相关,在癌的发生和发展中发挥重要的作用。研究报道指出,醌茜素能够通过调控Akt、p38及p53信号通路诱导肺癌A549细胞凋亡[6];另有研究也表明,醌茜素能够抑制蛋白激酶CK2的活性,诱导前列腺癌LNCaP细胞凋亡[7]。本实验Western blotting显示,醌茜素能够下调AGS细胞中p-Akt和p-ERK蛋白的表达量,上调p-JNK、p-p38、cleaved caspase-3及cleaved PARP-1等蛋白表达量。这些结果说明,醌茜素可通过MAPK和Akt信号通路诱导胃癌细胞的凋亡,与醌茜素诱导肺癌A549细胞凋亡的机制相似。
肿瘤细胞内的ROS水平较正常细胞高,所以肿瘤细胞处于氧化应激状态,对ROS的敏感程度较高,这为三氧化二砷、吉西他滨等促氧化性药物治疗癌症提供了理论依据[22-25]。本结果显示,当醌茜素处理后,能够明显增加细胞内ROS的水平。同时,醌茜素与ROS清除剂NAC联合处理细胞后发现,图 3C右下和右上象限的早期凋亡与晚期凋亡的细胞数明显减少,醌茜素诱导细胞凋亡的能力显著降低,说明醌茜素通过上调细胞内的ROS水平诱导胃癌细胞凋亡。
综上所述,醌茜素通过上调细胞内的ROS水平,调控MAPK和Akt信号通路,诱导人胃癌AGS细胞凋亡。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistic[J]. CA Cancer J Clin, 2012, 2015, 65(2): 87-108. https://www.researchgate.net/publication/274566622_Global_Cancer_Statistic_2012 |
| [2] | Zhao EH, Ling TL, Cao H. Current status of surgical treatment of gastric cancer in the era of minimally invasive surgery in China: Opportunity and challenge[J]. Int J Surg, 2016, 28: 45-50. DOI: 10.1016/j.ijsu.2016.02.027. |
| [3] | 邹文斌, 李兆申. 中国胃癌发病率及死亡率研究进展[J]. 中国实用内科杂志, 2014, 34(4): 408-15. |
| [4] | 肖进, 刘庆全. 影响胃癌预后因素研究进展[J]. 世界最新医学信息文摘, 2016, 16(57): 47-8. DOI: 10.3969/j.issn.1671-3141.2016.57.030. |
| [5] | 李良庆, 谢文焌, 潘敦. 巴弗洛霉素A1抑制胃癌MGC-803细胞增殖及增强奥沙利铂的敏感性[J]. 南方医科大学学报, 2015, 35(10): 1400-5. DOI: 10.3969/j.issn.1673-4254.2015.10.07. |
| [6] | 孟令旗, 刘畅, 孙虎男, 等. 醌茜素对人肺癌A549细胞增殖, 凋亡的影响及初步机制研究[J]. 中国药理学通报, 2016, 32(11): 1625-6. DOI: 10.3969/j.issn.1001-1978.2016.11.029. |
| [7] | Schneider CC, Götz C, Hessenauer A, et al. Down-regulation of CK2 activity results in a decrease in the level of cdc25C phosphatase in different prostate cancer cell lines[J]. Mol Cell Biochem, 2011, 356(1/2): 177-84. |
| [8] | Velasco G, Sánchez C, Guzmán M. Anticancer mechanisms of cannabinoids[J]. Curr Oncol, 2016, 23(2): S23-32. |
| [9] | 于乐成. 肝细胞损伤和修复研究进展[J]. 肝脏, 2015, 24(11): 883-5. DOI: 10.3969/j.issn.1008-1704.2015.11.015. |
| [10] | 明雅南, 刘晓琳, 茅益民. 药物性肝损伤发病机制研究进展[J]. 实用肝脏病杂志, 2014, 17(6): 657-60. |
| [11] | Yu JS, Cui W. Proliferation, survival and metabolism: the role of PI3K/AKT/mTOR signalling in pluripotency and cell fate determination[J]. Development, 2016, 143(17): 3050-60. DOI: 10.1242/dev.137075. |
| [12] | Jing X, Cheng W, Wang S, et al. Resveratrol induces cell cycle arrest in human gastric cancer MGC803 cells via the PTENregulated PI3K/Akt signaling pathway[J]. Oncol Rep, 2016, 35(1): 472-8. |
| [13] | Chen JC, Hsieh MJ, Chen CJ, et al. Polyphyllin G induce apoptosis and autophagy in human nasopharyngeal cancer cells by modulation of AKT and mitogen-activated protein kinase pathways in vitro and in vivo[J]. Oncotarget, 2016, 7(43): 70276-89. |
| [14] | Shin DY, Kim GY, Hwang HJ, et al. Diallyl trisulfide-induced apoptosis of bladder cancer cells is caspase-dependent and regulated by PI3K/Akt and JNK pathways[J]. Environ Toxicol Pharmacol, 2014, 37(1): 74-83. DOI: 10.1016/j.etap.2013.11.002. |
| [15] | 庞雪利, 李矿发, 魏兰, 等. IL-8通过上调Bcl-2的表达和下调caspase-3的表达抑制MCF-7乳腺癌细胞凋亡[J]. 细胞与分子免疫学杂志, 2015, 31(3): 307-11. |
| [16] | Jeong CH, Chun KS, Kundu J, et al. Phosphorylation of Smac by Akt promotes the caspase-3 activation during etoposide-induced apoptosis in HeLa cells[J]. Mol Carcinog, 2013, 54(2): 83-92. |
| [17] | Horwacik I, Rokita H. Targeting of tumor-associated gangliosides with antibodies affects signaling pathways and leads to cell death including apoptosis[J]. Apoptosis, 2015, 20(5): 679-88. DOI: 10.1007/s10495-015-1103-7. |
| [18] | 朱国华, 张琦, 戴海萍, 等. 姜黄素诱导Jurkat细胞凋亡时MAPKs及MMPs家族的表达[J]. 南方医科大学学报, 2013, 33(12): 1792-5. DOI: 10.3969/j.issn.1673-4254.2013.12.18. |
| [19] | 戚之琳, 刘银华, 齐世美, 等. 红景天苷通过抑制NOX2-ROS-MAPKs信号途径保护H2O2诱导的PC12细胞凋亡[J]. 南方医科大学学报, 2017, 37(2): 178-83. |
| [20] | 谢勇, 闫燕艳, 尉杰忠, 等. 扁塑藤素抑制卵巢癌细胞株OVCAR3生长的实验研究[J]. 中国癌症杂志, 2010, 20(11): 822-5. DOI: 10.3969/j.issn.1007-3639.2010.11.005. |
| [21] | |
| [22] | 张厚莉, 崔淑香. 活性氧与肿瘤治疗[J]. 国际肿瘤学杂志, 2012, 39(7): 504-7. |
| [23] | Jiang L, Wang L, Chen L, et al. As2O3 induces apoptosis in human hepatocellular carcinoma HepG2 cells through a ROS-mediated mitochondrial pathway and activation of caspases[J]. Int J Clin Exp Med, 2015, 8(2): 2190-6. |
| [24] | 赵巍, 胡亚男, 蒋学君, 等. 三氧化二砷诱导肝癌细胞凋亡的机制研究[J]. 四川大学学报:医学版, 2014, 45(5): 739-43. |
| [25] | Zhang ZY, Zhang Y, Fu H, et al. Gemcitabine induces apoptosis via JAK2/STAT3 signaling pathways in lung cancer[J]. Int J Clin Exp Med, 2016, 9(2): 2166-74. |
 2017, Vol. 37
2017, Vol. 37

