2. 广东药科大学, 广东 广州 510006;
3. 广州医科大学, 广东 广州 511436;
4. 复旦大学附属中山医院, 上海 200032;
5. 四川省医学科学院四川省人民医院麻醉科, 四川 成都 610072
2. Guangdong Pharmaceutical University, Guangzhou 510063, China;
3. Guangzhou Medical University, Guangzhou 511436, China;
4. Zhongshan Hospital Affiliated to Fudan University, Shanghai 200032, China;
5. Sichuan Academy of Medical Sciences & Sichuan Provincial N People's Hospital, Department of Anesthesiology, Chengdu 610072, China
由冠状动脉血管栓塞或粥样硬化导致的心梗及随后发展的心衰是严重危险人类健康的心血管疾病,有极高的发病率和死亡率,预后不良,呈逐年持续增长,且至今尚未完全阐明其疾病机制[1-4]。临床研究表明,大多数心脏病患者左室舒张功能异常发生在左室收缩功能异常之前,在心衰患者中近50%的射血分数正常,却预后不良,即使收缩功能异常,心衰进程也取决于舒张功能异常的程度[5]。小鼠心梗模型是阐明发病机制、确定药物治疗靶点以及药效评价的基本前提[6-8],应用超高分辨率小动物超声心动图是评价小鼠心梗模型无创的最有效与常用的方法[9-10],在国内外文献报道中主要采用M型超声心动图来评价心梗模型小鼠心室收缩功能,而联合脉冲多普勒(PWD)、组织多普勒(TDI)及EKVTM超声心动图综合评价心梗模型小鼠心功能与室壁运动异常情况报道罕见。这种情况致使实验研究不能紧密契合临床诊治指标,不能及时准确评估心肌梗死进程及预后。因此,本研究拟联合采用2D、M-mode、多普勒与EKVTM超声技术探讨心梗模型小鼠心脏形态结构,心功能以及局部室壁运动的改变,准确灵敏地确定心梗区域以及心梗程度,为临床心肌梗死诊断、治疗和预后评估提供了可靠的参考价值。
1 材料和方法 1.1 实验动物12周SPF级雄性C57BL/6小鼠25只,体质量26± 2 g,由广东省医学实验动物中心提供[SCXK(粤)2013-0002],无菌手术、组织取材以及无创超声在广东省实验动物监测所屏障动物实验设施内进行[SYXK(粤)2012-0122],并以实验动物使用的3R原则给予人道的关怀。
1.2 试剂与仪器异氟烷(深圳市瑞沃德生物生物科技有限公司),眼科手术显微镜(上海铁德医疗设备有限公司,SM-2000L),小动物呼吸麻醉机(Matrx,美国),MPA生物信号采集分析系统(上海奥尔科特生物科技有限公司),显微外科手术器械(苏州医疗器械厂),超高分辨率小动物超声系统(Vevo2100,Canada),显微镜(德国Leica)。
1.3 实验方法 1.3.1 动物分组及心梗模型建立按小鼠开胸后是否结扎冠状动脉左前降支将小鼠分为2组,即心梗模型组(MI)15只和假手术对照组(SH)10只。
小鼠在3.0%异氟烷吸入麻醉后取仰卧位,头部和四肢固定于手术台上,且四肢涂上导电胶并固定在电极,采用MPA生物信号采集分析系统实时监测小鼠生理指标变化。使用20号套管穿刺针针鞘从口腔进入进行气管插管,插管成功后,连接呼吸麻醉机维持麻醉。待插管与麻醉成功后,左胸部脱毛,沿左胸第2、3肋间切开皮肤、肋间肌肉,打开胸腔,剪开心包膜并充分暴露心脏。以左心耳下缘为标志,左心耳根部下2~3 mm用6-0无创缝线穿过冠状动脉左前降支,进针深度0.8 mm,缓慢结扎冠脉以防撕裂心肌。结扎后观察局部心肌变化(1 min左右左室外膜呈苍白)以及动态心电图监测ST段抬高或压低,初步认为建模成功。然后,常规关闭胸腔且在最后关闭时挤压小鼠胸腔,避免形成气胸,待心跳恢复正常后拔掉气管插管。小鼠术后注意保温及预防感染。假手术对照组开胸后,6-0无创缝线穿过冠状动脉左前降支,但不结扎,其它操作与心梗手术一致(图 1)。
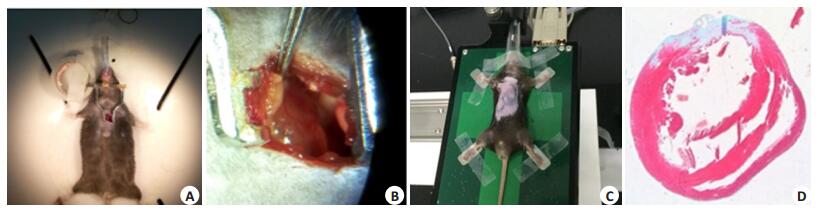
|
图 1 小鼠心梗手术过程 Figure 1 Operation of the mice for inducing myocardial infarction. A: Thoracotomy; B: The left anterior descending coronary artery; C: Position of the mice on the ultrasound fixation table; D: Papillary muscle transverse position showing the right ventricle, gray for the myocardial infarction area. |
术前3 d与术后1周,对所有实验小鼠进行心脏超声检查。小鼠在2.0%异氟烷吸入麻醉下仰卧位固定于37 ℃恒温加热板上,胸部及上腹部脱毛,充分暴露皮肤后,应用Vevo2100小动物超声机,采用MS-550D探头进行超声检测。
取胸骨长轴切面,在左室长轴切面基础上,探头顺时针旋转90°,即左室短轴切面,应用M型记录左室运动情况,测量左室舒张末期前壁厚度(LVAW;d)、左室收缩末期前壁厚度(LVAW;s),左室舒张末期后壁厚度(LVPW;d)、左室收缩末期后壁厚度(LVPW;s),左室舒张末期内径(LVED;d)、左室收缩末期内径(LVED;s),计算左室射血分数(LVEF)和左室短轴缩短率(LVFS)。此外,取胸骨长轴切面,将取样容积置于主动脉瓣上,调整角度,使取样尽可能与升主动脉血流方向一致,获得主动脉瓣口血流频谱图像,测量升主动脉血流峰值(AV)。随后将探头角度稍微转向小鼠左肩,充分显示肺动脉,将取样容积置于肺动脉瓣上,获得肺动脉瓣口血流频谱,测量肺动脉血流峰值(PV)。
取心尖四腔切面,采用PWD测定二尖瓣口血流频谱,记录舒张早期血流峰值速度(E)、舒张晚期血流峰值速度(A);采用TDI测定二尖瓣瓣环运动速度,记录二尖瓣环舒张早期峰值速度(E')、二尖瓣环舒张晚期峰值速度(A')和收缩期峰值速度(S'),计算E'/A'和E/E';在彩色多普勒血流显像下,记录二尖瓣口M型彩色多普勒图像,获得舒张早期左心室血流传播速度;在取得满意胸骨旁长轴后,彩色血流定位肺静脉左房入口处获得肺静脉频谱,记录肺静脉收缩期峰值速度(PVS),肺静脉舒张期正向峰值速度(PVD),房缩期肺静脉负向峰值速度(PV Apk)。
取心尖五腔切面,将取样容积置于主动脉瓣下,同时显示出左室流出道及流入道的血流频谱,在同一心动周期内采用PWD测量:流出道主动脉血流频谱结束至二尖瓣血流频开始时间作为等容舒张期(IRT),心电图R波顶点至左室流出道收缩期血流频谱起点的时间即等容收缩时间(ICT),左室流出道射血时间(ET),计算Tei Index=(ICT+IRT)/ ET。
取乳头肌水平左室短轴切面,在确认获得一致清晰的ECG信号后,获取B型图,选用EKVTM模式进行测量节段性室壁运动情况。计算室壁运动分数参照采用美国心脏病协会划分17节段(图 2)。室壁运动指数的计算:正常=1分,低活动性=2分,无活动性=3分,反向运动=4分,室壁瘤样运动=5分。通过观察测量心梗小鼠的室壁心内膜心脏运动幅度、评分,判断心梗小鼠室壁节段性运动异常(RWMA)情况。
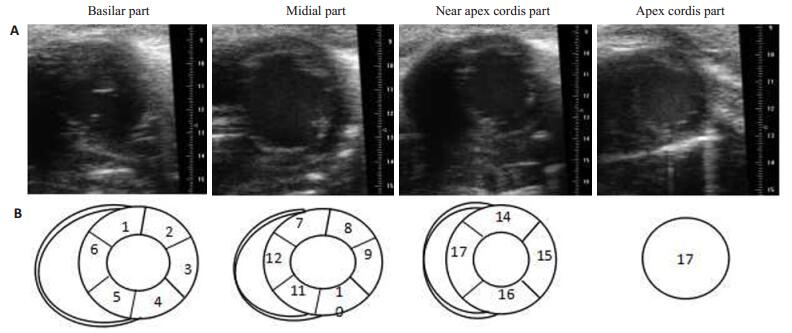
|
图 2 不同位置的短轴切面(A)和心壁运动的阶段划分(B) Figure 2 Ventricular short axis view (A) and phases of ventricular wall motion (B). 1: Anterior ventricular septum basal segment; 2: Anterior ventricular septum middle segment; 3: Posterior wall basal segment; 4: Posterior wall middle segment; 5: Posterior ventricular septum basal segment; 6: Posterior ventricular septum middle segment; 7: Posterior ventricular septum apical segments; 8: Lateral wall apical segments; 9: Lateral wall middle segment; 10: Lateral wall basal segment; 11: Inferior wall basal segment; 12: Inferior wall middle segment; 13: Inferior wall apical segments; 14: Anterior wall apical segments; 15: Anterior wall middle segments; 16: Anterior wall basal segments; 17: Crdiac apex. |
以上所有超声测量值均取3个连续心动周期以上的平均值。
1.3.3 心肌组织病理学观察术后1周,超声检测完后麻醉处死小鼠,取出心脏,用10%福尔马林固定,石蜡包埋切片,进行HE染色观察心肌组织病理学变化。
1.4 数据统计分析实验结果采用SPSS 13.0软件进行统计分析,所有数据均以均数±标准差表示,组间比较采用t检验,当P < 0.05认为差异具有统计学意义。
2 结果 2.1 心梗小鼠左室形态结构的改变术后1周,与假手术对照组比较,心梗模型组B型超声显示心脏有明显心梗区域,M超声心动图显示左心室前壁变薄(图 3)。与假手术组比较,心梗模型组小鼠的LVED;d、LVED;s、LVEV;d、LVEV;d以及AoD均明显增加(P < 0.05),LVAW;d和LVAW;s均显著变薄(P < 0.05),LVPW;d、LVPW;s、LV Mass未见明显改变(P > 0.05)且在整个超声检测过程中实验小鼠的心率无明显差异(P > 0.05,表 1)。
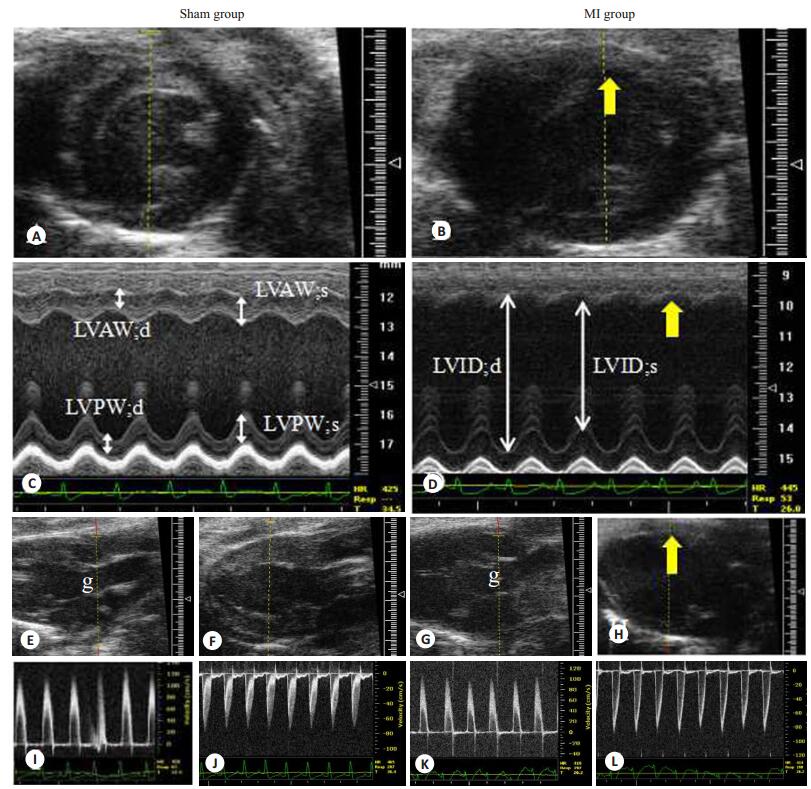
|
图 3 超声评价小鼠左室形态结构和收缩功能 Figure 3 Ultrasonic evaluation of the left ventricular structure and systolic function in mice with MI. A, C: Typical B-and M-mode images of the heart in the sham group(short axis); B, D: Typical B-and M-mode images of the heart in the MI group(short axis); E, I: Typical B-and PWD of the aorta in the sham group(long axis); F, J: Typical B-and PWD of the pulmonary artery in the sham group(long axis); G, K: Typical B-and PWD of the aorta in the MI group(long axis); H, L: Typical B-and PWD of the pulmonary artery in the MI group(long axis); g: Outflow tract of the left ventricle. The yellow arrow indicates the infarct area. |
| 表 1 心梗小鼠左室形态结构与收缩功能的超声参数 Table 1 Echocardiographic parameters of the left ventricular structure and systolic function in mice with MI (Mean±SD) |
LVEF和LVFS是评价左室收缩功能的主要指标,其中,LVEF是反应左心室心肌纤维缩短功能,LVFS是反应应力-缩短的关系。结果显示,与假手术组比较,心梗模型组的LVEF和LVFS显著下降(P < 0.05,表 1)。此外,升主动脉血流峰值也是反映心室收缩功能的重要指标之一。结果显示,与假手术对照组比较,心梗小鼠升主动脉血流峰值显著下降(P < 0.05),但肺动脉血流峰值未见明显改变(P > 0.05,表 1,图 3)。
2.3 心梗小鼠的左室舒张功能的改变结合二尖瓣环TDI频谱和二尖瓣PWD频谱综合评价左室舒张功能。与假手术组比较,心梗模型组E'峰显著下降(P < 0.05),E'/A'显著下降(P < 0.05),IRT、IVT、Tei以及E/E'(18.79±5.36 vs 22.91±6.29)增大(P < 0.05),而ET下降(P > 0.05),但无统计学意义。此外,应用PWD测定肺静脉血流也可评价心脏舒张功能[11]。与假手术组比较,PV D、PV A分别降低了33%和15%,且反应左室舒张特性PV S/PV D值亦显著增大(0.4±0.06 vs 0.79± 0.32,P < 0.05),但代表心室收缩期的PV S无明显改变(P > 0.05,表 2,图 4)。
| 表 2 心梗小鼠左室舒张功能的超声心动图参数 Table 2 Echocardiographic parameters of the left ventricular diastolic function in mice with MI (Mean±SD) |
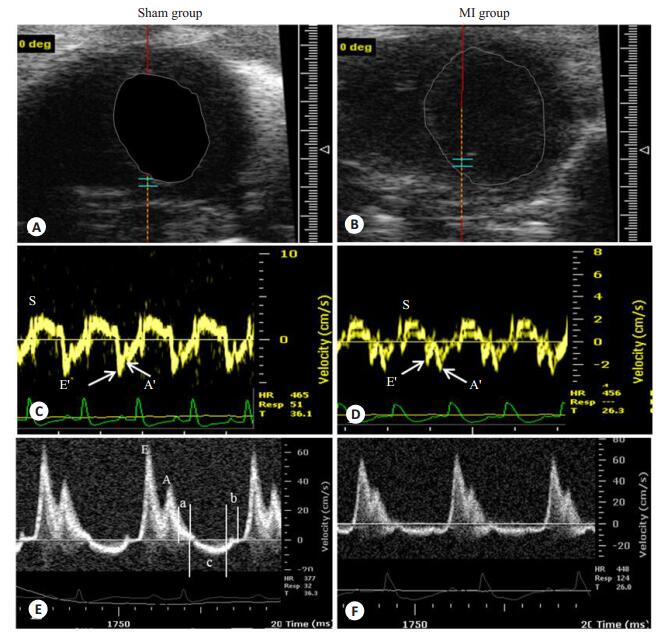
|
图 4 二尖瓣多普勒超声心动图 Figure 4 Doppler echocardiography of the mitral valve. A, B: The location of the collection mitral valve orifice and mitral annulus spectrum; C, D: The TDI of the mitral annulus; E, F: The PWD of themitral valveorifice; a: IVCT; b: IVRT; c: Aortic ejection time. |
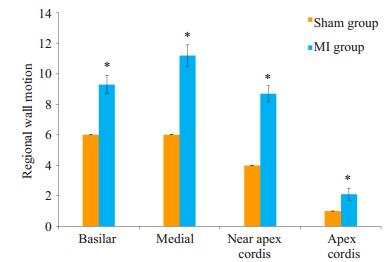
与假手术对照组比较,心梗模型组小鼠在心脏不同位置(基底部、中部、近心尖部以及心尖部)进行评分,均显示室壁运动具有显著性差异(P < 0.05,图 5)。
|
图 5 心梗小鼠心室壁运动指数的改变 Figure 5 Changes of the ventricular wall motion index in mice with myocardial infarction. *P < 0.05 vs sham group. |
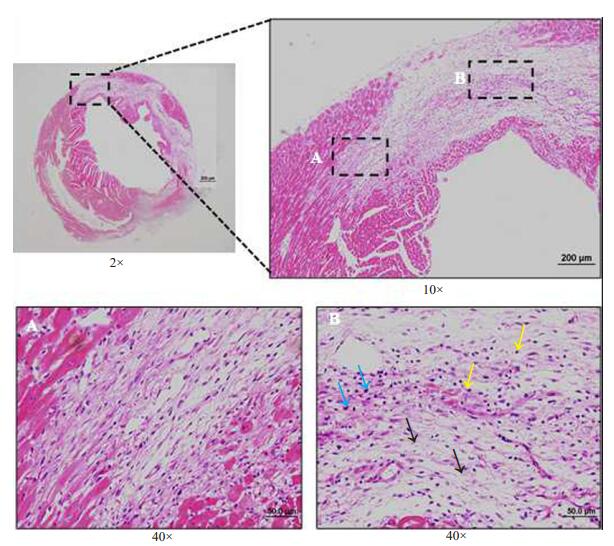
常规HE染色后,与假手术对照组比较,心梗模型组小鼠心肌可见明显的梗死区,在梗死及梗死边缘区肌纤维排列絮乱,肌丝断裂,甚至溶解,心肌细胞坏死,纤维结缔组织增生,以及大量炎性细胞浸润(图 6)。
|
图 6 心梗小鼠心肌组织HE染色 Figure 6 Myocardial HE staining in mice with MI. A: Infarction border region; B: Infarction region with lymphocyte infiltration (yellow arrows), neutrophil infiltration (blue arrows) and fibroustissue hyperplasia (black arrows). |
随着生活方式的改变和生活水平的提高,心血管疾病已严重威胁着人类健康和生命,尤其是心肌梗死被人类视为“健康第一杀手”。在研究心血管疾病发展过程中观察心脏形态结构、心功能以及室壁运动异常的改变,对于探索疾病发展、治疗及预后具有极其重要意义[11]。而高分辨率小动物超声仪以无创、快速、高效及高分辨率等优势,已成为应用最为广泛的评价小动物心肌梗死后心脏形态结构及功能改变的手段之一。
国内外文献对心功能的评价多集中于心脏形态结构和收缩功能的研究(以M型获得基本参数为代表),而结合心脏舒张功能与局部室壁运动指数来综合评价心脏结构和心功能报道极少见。因此,在该研究中,我们应用超声常规技术和EKVTM技术评价了小鼠心肌梗死后舒张功能改变和节段性室壁运动异常。结果提示,超声常规技术分析可明确心梗后心室形态结构与心功能是否改变,常规技术分析可确定心梗发生位置,心功能减弱程度;EKVTM分析可明确心肌梗死后是否出现室壁运动减弱,节段性分析则可最终确定发生室壁运动异常的具体部位,并对心肌异常运动的严重程度进行量化。
临床流行病学研究表明:在普通人群中左室舒张功能不全发生率为27.3%[12];在国内心力衰竭住院患者中约33.3%仅见左室舒张功能不全,而收缩功能无异常[13];在国外文献报道其发病率为56% [14],高于国内,此类患者与收缩功能降低心力衰竭的治疗差异较大,与若以心室收缩功能异常治疗常有害无益[15]。因此,及时准确地检测左室舒张功能有无异常对临床治疗及预后评估有极其重要意义。而二尖瓣血流脉冲多普勒频谱(PWD)是目前基础科研评价左室舒张功能异常的常用手段,但临床研究发现:二尖瓣血流脉冲多普勒频谱不能单纯反应心室的舒张特性,常表现“假性正常化”,而二尖瓣环组织多普勒频谱(TDI)能区别“假性正常化”,能更早期诊断左室舒张功能下降[16-17]。此外,Nagueh等[18]报道,二尖瓣口血流速度E和二尖瓣环运动速度E'比值,与左室舒张压有极强的相关性,是评价心室舒张功能的有效指标。因此,采用二尖瓣口PWD与二尖瓣环TDI结合,可以更准确全面地评价心室舒张功能,为临床诊断提供可靠价值。本研究显示,心梗模型与假手术组比较,IVRT明显延长,E'显著下降,E/E'比值显著上升,与文献报道一致,表明小鼠心梗后心室舒张功能下降。此外,Tei指数是综合评价心脏收缩与舒张功能的重要指标[19-20]。研究发现随着心肌梗死的发生,Tei与LVEF呈负相关,且相关性良好[21]。通过Tei指数不仅可以评价心肌梗死后的心脏的整体功能变化情况,根据其计算公式Tei指数=(ICT+IRT)/ET还可以了解心功能障碍的时相,从而更加准确深入地分析心肌梗死早期的心功能变化情况[22]。本研究显示,心梗模型组小鼠Tei指数较假手术组显著升高,LVEF显著下降,进一步表明小鼠心梗后心功能减退。
局部室壁运动异常是心肌缺血的早期特征性改变,也是超声心动图诊断心肌梗死的基础,对临床心肌梗死及时发现、准确诊断以及治疗和预后具有重大意义[23-24]。早在1935年Tennt [25]研究证实,阻断冠状动脉血流数秒后立即出现供血区室壁运动异常;结扎冠状动脉后,超声心动图在5~10次心搏内检测到室壁运动异常,且早于心电图ST段-T波改变。传统的2D或M型超声技术对局部室壁运动异常评价还有所欠缺,无法精准定位和定性,主观依赖性强[26],而EKVTM超声技术可以将小鼠心脏等高速运动的“慢动作”回放、解剖M型、TDI及左室功能自动测量等,其中TDI联合解剖M型心动图能够弥补传统超声心动图的不足,能够更全面、快速、准确地评价局部室壁运动异常情况以及较准确判定室壁运动异常节段的解剖位置[27-29]。本研究采用EKVTM超声心动图测定局部室壁运动指数,结果显示心梗小鼠心脏的不同部位(基底部、中部、近心尖部及心尖部)评分均表现室壁运动显著降低,其判断的敏感度、特异度与文献报道相似[30]。
综上所述,本研究通过2D、M-mode、多普勒以及EKVTM等超声技术,从不同角度观察心脏形态结构和心功能变化,将各指标有机结合,能够更全面敏感地评价小鼠心梗后节段性室壁运动异常和整体心功能的改变,准确评估心肌梗死程度,为临床心肌梗死的诊断、治疗及预后评估提供重要参考价值。
| [1] | Writing Group Members, Mozaffarian D, Benjamin EJ, et al. Executive summary: heart disease and stroke statistics--2016 update: a report from the American heart association[J]. Circulation, 2016, 133(4): 447-54. DOI: 10.1161/CIR.0000000000000366. |
| [2] | Edlinger C, Schreiber C, Wernly B, et al. Stem cell therapy for myocardial infarction 2001-2013 revisited[J]. Stem Cell Rev, 2015, 11(5): 743-51. DOI: 10.1007/s12015-015-9602-z. |
| [3] | Zaman S, Kovoor P. Sudden cardiac death early after myocardial infarction: pathogenesis, risk stratification, and primary prevention[J]. Circulation, 2014, 129(23): 2426-35. DOI: 10.1161/CIRCULATIONAHA.113.007497. |
| [4] | Khan AR, Binabdulhak AA, Alastal Y, et al. Cardioprotective role of ischemic postconditioning in acute myocardial infarction: a systematic review and meta-analysis[J]. Am Heart J, 2014, 168(4): 512-521.e4. DOI: 10.1016/j.ahj.2014.06.021. |
| [5] | 罗莲, 汪汉, 蔡琳. 左室舒张功能不全性心力衰竭的最新进展[J]. 心血管病学进展, 2015, 17(4): 442-6. |
| [6] | Zaragoza C, Gomez-Guerrero C, Luis Martin-Ventura J, et al. Animal models of cardiovascular diseases[J]. J Biomed Biotechnol, 2011(1): 131. |
| [7] | 王鑫, 宋佳格, 穆成吉, 等. 冠状动脉结扎法制作大鼠心梗模型研究进展[J]. 广州医药, 2016, 47(6): 93-5, 96. |
| [8] | 李峰杰, 李贻奎. 心肌梗死动物模型研究进展[J]. 中国药理学通报, 2013, 29(1): 5-10. |
| [9] | 刘建, 范慧敏, 汪进益, 等. 小鼠心梗模型的建立与无创评价[J]. 中国实验动物学报, 2010, 18(3): 196-8. |
| [10] | Kandalam V, Basu R, Abraham T, et al. TIMP2 deficiency accelerates adverse post-myocardial infarction remodeling because of enhanced MT1-MMP activity despite lack of MMP2 activation[J]. Circ Res, 2010, 106(4): 796-808. DOI: 10.1161/CIRCRESAHA.109.209189. |
| [11] | 赵静, 曾智, 颜亮, 等. 小动物超声仪与临床用超声仪评价小鼠心脏重构的对比分析[J]. 南方医科大学学报, 2011, 31(3): 443-7. |
| [12] | Kloch-Badelek M, Kuznetsova T, Sakiewicz W, et al. Prevalence of left ventricular diastolic dysfunction in European populations based on cross-validated diagnostic thresholds[J]. Cardiovasc Ultrasound, 2012, 10(1): 18. DOI: 10.1186/1476-7120-10-18. |
| [13] | 胡晓贞, 董耀荣. 舒张性心力衰竭的研究进展[J]. 中西医结合心脑血管病杂志, 2014, 12(5): 606-7. |
| [14] | Bytyçi I, Haliti E, Berisha G, et al. Left ventricular longitudinal systolic dysfunction is associated with right atrial dyssynchrony in heart failure with preserved ejection fraction[J]. Revista Portuguesa de Cardiologia, 2016, 35(4): 207-14. DOI: 10.1016/j.repc.2015.11.011. |
| [15] | 宾利沙. 彩色多普勒超声心动图评价冠心病左室舒张功能的临床价值[J]. 中华现代影像学杂志, 2011, 9(30): 105-6. |
| [16] | 汪晶晶, 陈韵岱, 王晶, 等. 双脉冲多普勒超声心动图技术测量TE-e'评估冠心病患者左心室舒张功能[J]. 南方医科大学学报, 2014, 94(3): 349-53. |
| [17] | 王晶明, 闫自强, 白新艳, 等. 组织多普勒显像评价冠心病患者左心室舒张功能的价值[J]. 中华超声影像学杂志, 2008, 17(9): 820-1. |
| [18] | Nagueh SF, Middleton KJ, Kopelen HA, et al. Doppler tissue imaging: a noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures[J]. J Am Coll Cardiol, 1997, 30(6): 1527-33. DOI: 10.1016/S0735-1097(97)00344-6. |
| [19] | Goroshi M, Chand D. Myocardial performance index (Tei index): a simple tool to identify cardiac dysfunction in patients with diabetes mellitus[J]. Indian Heart J, 2016, 68(1): 83-7. DOI: 10.1016/j.ihj.2015.06.022. |
| [20] | Mahajan A, Henry A, Meriki N, et al. The (Pulsed-Wave) doppler fetal myocardial performance index: technical challenges, clinical applications and future research[J]. Fetal Diagn Ther, 2015, 38(1): 1-13. DOI: 10.1159/000363181. |
| [21] | 潘永寿, 庾红玉, 阮坚, 等. 实时三维超声心动图联合Tei指数评价心力衰竭患者心功能的研究[J]. 广西医学, 2014, 43(5): 602-4. |
| [22] | 胡珍, 陈景瑞, 魏静, 等. 冠状动脉结扎制备大鼠心肌梗死模型及评价实验研究[J]. 天津中医药, 2016, 33(2): 90-5. DOI: 10.11656/j.issn.1672-1519.2016.02.08. |
| [23] | Wild S, Roglic G, Green A, et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030[J]. Diabetes Care, 2004, 27(5): 1047-53. DOI: 10.2337/diacare.27.5.1047. |
| [24] | 孙月, 杨道玲, 王禹雪. 超声心动图常规及新技术评价兔心肌梗死模型[J]. 中国超声医学杂志, 2016, 32(7): 648-51. |
| [25] | Tennt RJ. The effects of occhission on myocardial contraction[J]. Am J Physiol, 1935(112): 351. |
| [26] | Peteiro J, Monserrat L, Fabregas R, et al. Comparison of twodimensional echocardiography and pulsed Doppler tissue imaging during dobutamine-atropine stress testing to detect coronary artery disease[J]. Echocardiography, 2001, 18(4): 275-84. DOI: 10.1046/j.1540-8175.2001.00275.x. |
| [27] | 陈薇, 林萃灵, 段玲. 解剖M型超声心动图在冠心病节段性室壁运动异常检测中的应用[J]. 齐齐哈尔医学院学报, 2016, 37(23): 2901-2. |
| [28] | 张荣利, 朱天刚. 超声技术在心血管疾病诊治及研究中的应用[J]. 现代仪器, 2008, 14(5): 6-10. |
| [29] | 王军里, 付良轩. 解剖M型超声心动图和组织多普勒对冠心病室壁运动异常的诊断价值[J]. 现代中西医结合杂志, 2013, 22(6): 648-9. |
| [30] | 李昊, 张幼怡, 沈蔷, 等. 超声二维斑点追踪技术评价小鼠心肌梗死后节段性室壁运动异常[J]. 中国分子心脏病学杂志, 2015(3): 1354-8. |
 2017, Vol. 37
2017, Vol. 37

