血小板减少是血液肿瘤患者大剂量放化疗后最主要的治疗副作用之一,目前临床治疗手段主要是输注血小板和使用促血小板药物。尽管输注血小板会减少出血风险,但反复输注导致输注无效、价格昂贵、血制品紧张等因素限制其临床应用。在促血小板药物中,临床应用最为广泛的是血小板生成素(TPO)及其受体c-Mpl类似剂,包括重组人促血小板生成素(rhTPO)、c-Mpl激动剂艾曲波帕[1]和罗米司汀[2]。现有研究认为此类药物治疗血小板减少的主要机制是通过促进造血干细胞(HSC)向巨核细胞(MK)分化,促进巨核细胞成熟以及释放血小板[3-6]。然而TPO及c-Mpl已被证实在除了造血干细胞及巨核系统以外的多种细胞中表达,其中包括中枢神经系统、心脏、血管内皮细胞[7-10]。这些发现提示TPO除了可直接作用于造血细胞外,还可能通过作用于非造血细胞对其发挥保护作用。
MK的形成不仅依赖于HSC向巨核系分化,同时还依赖良好的造血微环境-龛[11],其完整性可促进化疗后骨髓各系的重建[12-14]。骨髓内皮祖细胞(BM-EPC)是骨髓微环境的重要组成部分,对于支持MK造血具有重要意义[15-16],同时骨髓来源的内皮祖细胞(EPC)有助于内皮组织的修复和新生血管的形成[17-18]。研究表明,大剂量化疗后致BM-EPC受损,是大剂量化疗后血小板重建不良的独立危险因素[19]。然而,目前从修复BM-EPC的角度来促进巨核细胞造血的研究甚少。但本课题组前期研究发现,TPO不仅作用于造血细胞,对内皮细胞也有保护作用[20]。基于此,本研究提出TPO/c-Mpl不仅可以直接刺激巨核细胞,是否还可以通过修复BM-EPC从而恢复其对巨核细胞的造血支持作用。本研究采用首次化疗缓解的血液肿瘤患者骨髓体外培养BM-EPC,观察TPO对BM-EPC的数量和功能的影响以及对MK的造血支持作用,为进一步揭示TPO促巨核系造血机制以及临床有效应用TPO类药物提供重要的理论基础。
1 材料和方法 1.1 仪器与试剂EBM-2-MV-SingleQuots培养基(Loza);MATRIGEL基质胶购、Fluorescein isothiocyanate- labeled Ulex Europaeus Agglutinin-I(FITC-UEA-I)及明胶(Sigma);鼠抗人表面抗体CD34、CD133、CD309(Becton Dickinson Biosciences);Dil-Acetylated Low Density Lipoprotein (DiI-Ac-LDL)(广州弈元有限公司);胎牛血清(Life Technologies);TPO(沈阳三生生物制药有限公司);胰蛋白酶及淋巴细胞分离液(上海英潍捷基贸易有限公司);CCK-8试剂盒(上海东仁化学科技有限公司);Transwell小室(滤膜膜直径6.5 mm,绿膜孔径8.0 μm)(Corning);倒置荧光显微镜(德国莱卡仪器股份有限公司);AIRTECHVS-1300L-U超净工作台(上海整新电子设备厂);5% CO2恒温培养箱(香港Heal Force HF100型);离心机(湖南湘仪实验室仪器开发有限公司);ACS CaliburTM流式细胞仪(Becton Dickinson)。
1.2 骨髓的选取选取2019年1月1日~8月31日在南方医科大学南方医院血液科23例血液系统恶性肿瘤患者化疗后30 d的骨髓作为实验标本,其中急性髓系白血病AML患者12例,急性淋巴细胞白血病ALL患者11例;女性10例,男性13例,年龄16~58岁,中位年龄45岁。同时获得10例健康供者捐赠的骨髓作为健康对照组,包含5名男性和5名女性,年龄18~45岁(中位年龄32岁)。患者和健康供者骨髓标本的获取均通过南方医科大学南方医院医学伦理委员会批准,并取得患者及健康供者知情同意。
1.3 BM-EPC的提取及培养利用差速贴壁分离法培养BM-EPC。先用1%的明胶对24孔培养板包被1 h备用;从满足条件的骨髓标本中用淋巴细胞分离液分离出单个核细胞,用含有10%胎牛血清,1%双抗配制的EBM-2完全培养基进行重悬,以1×106/孔单个核细胞,500 μL/孔体积种于已被明胶包被的24孔培养板中放入37 ℃、5% CO2孵箱培养。48 h后收集孔板中培养基中未贴壁的细胞离心(800 r/min,5 min)后,弃上清再用上述EBM-2完全培养基重悬,以每孔500 μL种于1%明胶包被的24孔板中继续培养。
1.4 原代BM-EPC流式鉴定取培养7 d后的BM-EPC,废弃24孔板中的旧培养液,用PBS清洗2~3次,每空加入胰酶作用约1 min后显微镜下观察细胞漂浮或皱缩,用EBM-2完全培养液终止消化,轻轻吹打直至细胞全部脱落,离心收集。分别用鼠抗人表面抗体CD34、CD133、CD309标记,避光作用约30 min,加入PBS离心洗涤1~2遍后流式细胞仪检测分析。
1.5 BM-EPC增殖实验取培养7 d后的BM-EPC,废弃24孔板中的旧培养液,用磷酸盐缓冲液(PBS)清洗2~3次,每孔加入胰酶,然后将细胞放至37 ℃、5% CO2条件下的培养箱孵育1 min,在镜下观察。当细胞皱缩间隙变大或皱缩时,用EBM-2完全培养液终止消化,轻轻吹打直至细胞全部脱落,离心收集细胞,调整细胞密度为2×104/mL接种于96孔板,以TPO 0、50、100和200 μg/L浓度分别预孵育24 h后(同浓度之间至少种3个孔),将上清全部更换为EBM-2完全培养液,每孔加入10 μL CCK-8反应2 h,后用酶标仪测450 nm处的吸光度A450 nm,A值越大,细胞活力率越高,则细胞数增殖越多。细胞活力(%)=[A(实验组)- A(空白)]/[A(对照组)-A(空白)]×100%。实验重复3次,计算各组细胞活力均值,细胞活力率最高组的TPO浓度确定为实验组。
1.6 DiI-Ac-LDL吞噬以及FITC-UEA-I结合实验取培养7 d后的BM-EPC,废弃24孔板中的旧培养液,用PBS清洗2~3次,加入浓度为10 mg/mL DiI-AcLDL放至37 ℃、5% CO2条件下的培养箱避光孵育,4 h后用4%多聚甲醛固定10 min,再用PBS洗涤1~2次后加入浓度为10 mg/mL FITC-UEA-I室温避光作用1 h。在荧光显微镜下随机取3个视野计数双染阳性BM-EPC数量。
1.7 BM-EPC迁移实验细胞迁移实验利用Transwell小室。用胰酶消化培养7 d的BM-EPC,收集离心后以4×104细胞/孔种入Transwell小室的上室中,下室加入500 μL EBM-2完全培养基,放至37 ℃、5% CO2条件下的培养箱孵育24 h,用4%多聚甲醛固定20 min,随后用吉姆萨染色剂作用1 min,清水缓慢冲洗后镜下随机选取3个视野进行细胞计数。
1.8 BM-EPC成管实验先将96孔板及100 μL枪头预冷,每孔加入50 μL Matrigel基质胶后37 ℃孵箱放置30 min备用。取培养7 d后的BM-EPC,PBS洗涤2~3次,用胰酶消化BMEPC,离心后用EBM-2完全培养基重悬,以2×104细胞/孔种入含有Matrigel基质胶的96孔板中,12 h后显微镜下随机选取3个视野计算成管长度。
1.9 BM-EPC与巨核细胞共培养Meg-1细胞株用含10%胎牛血清的1640完全培养液种于培养瓶中,在37 ℃、5% CO2条件下培养,在显微镜下见Meg-1细胞状态为圆且透亮时为可进行实验的Meg-01。用EBM-2完全培养基重悬5×105细胞备用。取培养7 d后的BM-EPC,废弃旧培养液,以500 μL/空含Meg-1的培养液加入其中与BM-EPC直接接触共培养,48 h后利用吸取细胞离心收集,PBS洗涤1~2次,用鼠抗人表面抗体CD41标记巨核细胞,作用约30 min后,加入PBS离心洗涤1~2遍后流式细胞仪分析。各不同实验间的标本均非来自同一患者或健康供者。
1.10 统计分析利用软件SPSS 22.0对实验数据进行处理,实验数据用均数±标准差表示,两样本比较采用配对t检验,进行单因素方差分析(one-way ANOVA),P<0.05表示差异有统计学意义。
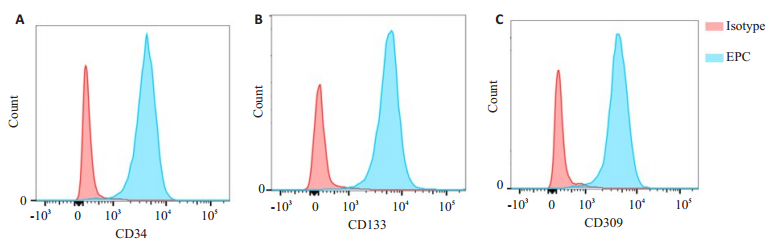
2 结果 2.1 原代BM-EPC鉴定通过获得满足实验要求的患者骨髓样本,提取单个核细胞后采取差速贴壁分离法培养BM-EPC。利用BM-EPC表面特异性抗原对所培养细胞进行鉴定,实验显示,对于所培养的细胞表面表达CD34, CD309及CD133的细胞率占80%以上,流式细胞鉴定实验表明所培养的细胞为BM-EPC(图 1)。
|
图 1 BM-EPC的免疫表型 Fig.1 Immunophenotyping of the BM-EPCs. A: High expression of CD34 in the BM-EPCs; B: High expression of CD133 in the BM-EPCs; C: High expression of CD309 in the BM-EPCs. |
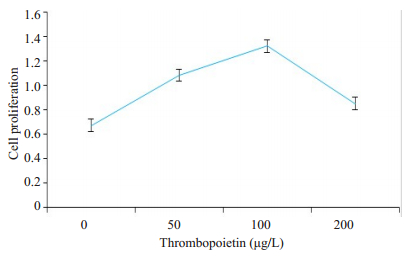
随着TPO浓度的增高,BM-EPC增殖率逐渐增高,TPO浓度为100 μg/L时为细胞增殖高峰,再随着TPO浓度的增高,细胞增殖率逐渐下降(图 2)。故选取TPO 100 μg/L作为实验组,无TPO为对照组,不加TPO的健康人为健康对照组。
|
图 2 TPO对BM-EPC的促增殖作用 Fig.2 Effect of thrombopoietin on BM-EPC proliferation. The assay showed that thrombopoietin enhanced the proliferation of the BM-EPCs and the optimal concentration was 100 μg/L (n=3). |
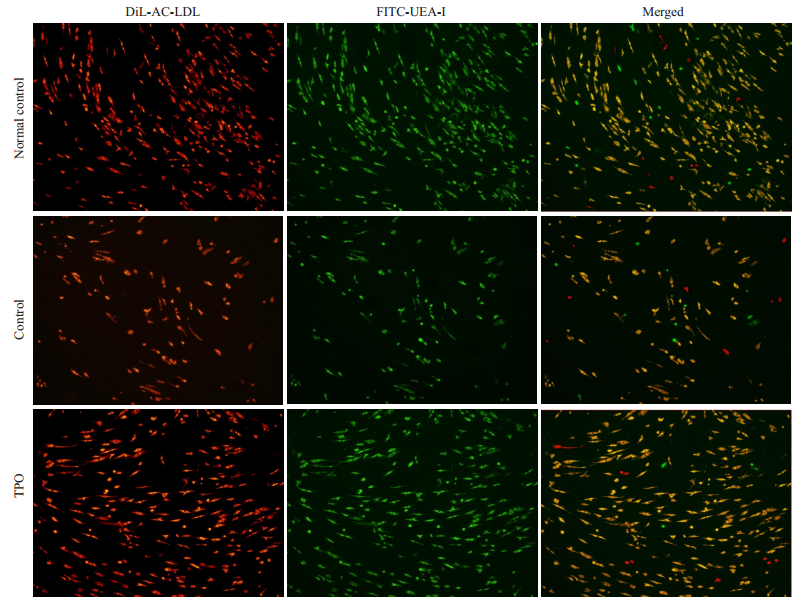
DiI-AcLDL吞噬及FITC-UEA-I结合实验是内皮细胞的特异性荧光表达,在两种荧光均表达的则为BMEPC。实验结果显示,具有DiI-AcLDL吞噬和FITCUEA-I结合能力的BM-EPC在实验组的细胞数量较对照组明显增多(图 3),来源不同病种的BM-EPCs数量之间无明显差异。
|
图 3 TPO增加BM-EPC细胞数量 Fig.3 Thrombopoietin (TPO) treatment increases the number of the BM-EPCs. Immunomicroscopic images of the BM-EPCs cultured for 7 days in healthy control (normal), TPO-free (control) and TPO-treated (TPO) groups. Typical BM-EPCs were characterized by double positive staining (merged in yellow) with DiI-Ac-LDL (red) and FITC-UEA-I (green) (Original magnification, ×10). |
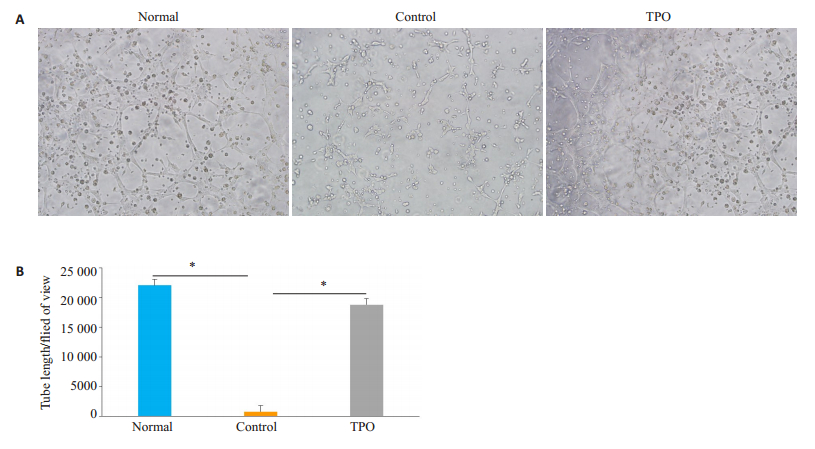
通过在显微镜下观察各组BM-EPC的成管长度,显示实验组成管长度明显长于对照组(P<0.05),而实验组与健康人BM-EPC成管长度差异无统计学意义(图 4)。
|
图 4 TPO对BM-EPC成管功能的影响 Fig.4 Effect of thrombopoietin (TPO) on tube formation ability of the BM-EPCs. A: Images of tube formation of the BM-EPCs cultured at day 7 from normal, control and TPO-treated group (×10); B: Quantification of tube-formation length of the BMEPCs from normal, control and TPO-treated groups (×10). *P < 0.05. |
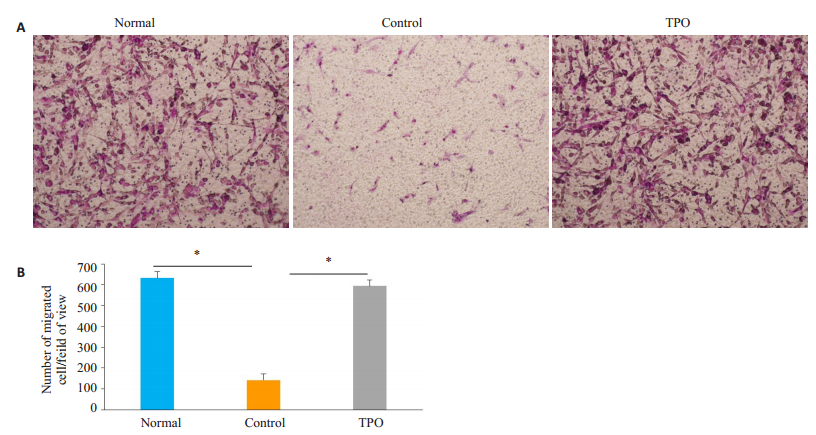
BM-EPC的迁移实验利用吉姆萨染色剂对迁移细胞进行染色后在显微镜下可以观察到,实验组BM-EPC迁移数量多于未对照组BM-EPC的细胞迁移数量,差异具有统计学意义(P<0.05),而实验组与健康人BM-EPC迁移数量在显微镜下观察差异无统计学意义(P<0.05,图 5)。
|
图 5 TPO对BM-EPC迁移功能的影响 Fig.5 Effect of thrombopoietin (TPO) on migration ability of the BM-EPCs. A: Transwell migration of BM-EPCs cultured for 7 days in normal, control and TPO-treated groups (×10); B: Quantification of migrated BM-EPCs per field of view in normal, control and TPO-treated groups (×10). *P < 0.05. |
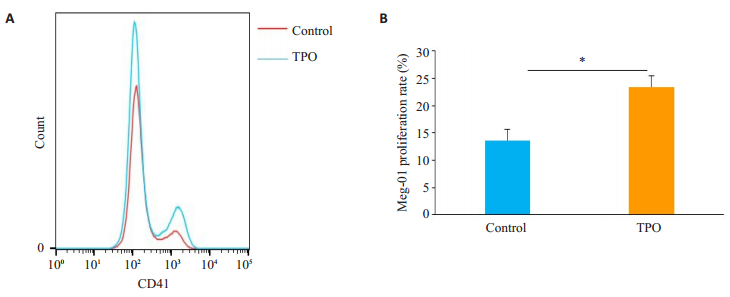
BM-EPC与Meg-01直接接触共培养后,通过流式细胞仪检测实验组与对照组两组Meg-01的细胞数,结果显示实验组Meg-01细胞数较对照组高,差异具有统计学意义(P<0.05,图 6)。
|
图 6 TPO修复BM-EPC的巨核细胞造血支持作用 Fig.6 Thrombopoietin (TPO) enhances megakaryopoiesis-supporting effect of the BM-EPCs. A: Comparison of CD41 + expression between control and TPO-treated groups; B: Proliferation rate of the megakaryocytes in control and TPO-treated groups. *P < 0.05. |
本研究结果表明,大剂量化疗后BM-EPC增殖能力、成管能力以及迁移能力受损,而TPO可以修复BMEPC功能以及促进MK细胞增殖。因本实验标本量较少,对所选取标本的患者原发病之间有无差异未进一步行分层研究。患者原发病、化疗方案以及有无并发症等因素对实验结果有无影响,需扩大样本量进行更深层次的分层研究。
BM-EPC是骨髓微环境的重要组成成分,功能良好的BM-EPC对于MK造血具有重要意义。有研究通过对骨髓移植后小鼠直接输注BM-EPC可以加速诱导移植后各系功能重建,促进HSC增殖和修复骨髓内皮细胞[20-22],然而,因BM-EPC在血液循环中数量过少限制其临床应用。本实验证明TPO不仅可促进BM-EPC增殖,还可以通过对BM-EPC修复从而恢复对MK的造血支持作用。因此,大剂量化疗后巨核造血的恢复不仅依赖于HSC,同时依赖于骨髓造血微环境的完整性。有研究表明BM-EPC促进MK造血的机制可能是通过与HSC之间的直接接触,另一方面可能是通过分泌VEGF、SDF-1等细胞因子促进HSC向MK分化[23]。但目前没有研究利用TPO增加BM-EPC数量来促进巨核系造血。本实验证明了TPO可显著增加BM-EPC数量,增加与MK细胞直接接触促进其增殖进一步丰富了TPO促进巨核造血的作用机制,为临床有效及合理应用TPO类制剂提供重要的理论基础。然而,TPO修复后的BM-EPC是否可通过增加释放促MK造血因子以促进MK增殖?本课题组后续将进行探讨。
机体的止血过程依赖于血管收缩、血小板血栓形成和血液凝固。其中血管结构和功能的异常都会使得止血过程发生紊乱[24]。内皮细胞是血管结构的一部分,在止血过程中发挥着重要作用,它可以通过释放血管调节因子对血管通透性进行调节,减少血管内物质的渗出[25],还可以分泌von Willebrand因子(vWF)黏附蛋白参与血小板的黏附和活化[26]。BM-EPC在刺激因子作用下可分化成成熟内皮细胞,具有成管和迁移特性,对于新生血管的形成和血管的修复具有重要意义[15]。尽管目前研究认为TPO类制剂可通过增加血小板数量来减少出血风险[27],但利用TPO修复BM-EPC成管和迁移功能,从而促进化疗后血窦血管形成和修复,减少出血风险的研究甚少。本研究结果提示TPO有修复BM-EPC功能的作用,这可能是临床使用TPO类制剂,例如重组人血小板生成素以[28]及TPO受体激动剂[29]减少出血症状的机制之一;同时也解释了一部分血小板减少患者在使用此类药物后即使血小板计数上升不明显,其出血状态也得以明显改善的原因。然而,TPO修复BM-EPC功能的具体信号通路,仍有待进一步研究。
综上所述,大剂量化疗后BM-EPC受损,TPO可以增加BM-EPC数量和修复其功能,本研究为指导血小板减少症患者合理用药提供理论依据。
| [1] |
Maroun MC, Ososki R, Andersen JC, et al. Eltrombopag as steroid sparing therapy for immune thrombocytopenic Purpura in systemic lupus erythematosus[J]. Lupus, 2015, 24(7): 746-50. DOI:10.1177/0961203314559632 |
| [2] |
Mitchell WB, Bussel JB. Thrombopoietin receptor agonists: a critical review[J]. Semin Hematol, 2015, 52(1): 46-52. |
| [3] |
Sheridan WP, Kuter DJ. Mechanism of action and clinical trials of Mpl ligand[J]. Curr Opin Hematol, 1997, 4(5): 312-6. DOI:10.1097/00062752-199704050-00003 |
| [4] |
Kuter DJ, Beeler DL, Rosenberg RD. The purification of megapoietin: a physiological regulator of megakaryocyte growth and platelet production[J]. Proc Natl Acad Sci USA, 1994, 91(23): 11104-8. DOI:10.1073/pnas.91.23.11104 |
| [5] |
Kuter DJ. The biology of thrombopoietin and thrombopoietin receptor agonists[J]. Int J Hematol, 2013, 98(1): 10-23. DOI:10.1007/s12185-013-1382-0 |
| [6] |
Kaushansky K. Thrombopoietin and its receptor in normal and neoplastic hematopoiesis[J]. Thromb J, 2016, 14(Suppl 1): 40-9. |
| [7] |
肖彬, 叶洁瑜, 徐月, 等. 血小板生成素信号通路的分子机制及对多种细胞的作用[J]. 中国实验血液学杂志, 2013, 21(1): 254-7. |
| [8] |
Baker JE, Su JD, Hsu A, et al. Human thrombopoietin reduces myocardial infarct size, apoptosis, and stunning following ischaemia/ reperfusion in rats[J]. Cardiovasc Res, 2008, 77(1): 44-53. |
| [9] |
Kanayasu-Toyoda T, Ishii-Watabe A, Suzuki T, et al. A new role of thrombopoietin enhancing ex vivo expansion of endothelial precursor cells derived from AC133-positive cells[J]. J Biol Chem, 2007, 282(46): 33507-14. DOI:10.1074/jbc.M703919200 |
| [10] |
Li B, Dai W. Thrombopoietin and neurotrophins share a common domain[J]. Blood, 1995, 86(4): 1643-4. DOI:10.1182/blood.V86.4.1643.bloodjournal8641643 |
| [11] |
Kiel MJ, Morrison SJ. Uncertainty in the niches that maintain haematopoietic stem cells[J]. Nat Rev Immunol, 2008, 8(4): 290-301. DOI:10.1038/nri2279 |
| [12] |
Yan Z, Zeng L, Li Z, et al. Bone marrow-derived endothelial progenitor cells promote hematopoietic reconstitution after hematopoietic stem cell transplantation[J]. Transplant Proc, 2013, 45(1): 427-33. |
| [13] |
Chute JP, Muramoto GG, Salter AB, et al. Transplantation of vascular endothelial cells mediates the hematopoietic recovery and survival of lethally irradiated mice[J]. Blood, 2007, 109(6): 2365-72. DOI:10.1182/blood-2006-05-022640 |
| [14] |
Kong Y, Shi MM, Zhang YY, et al. N-acetyl-L-cysteine improves bone marrow endothelial progenitor cells in prolonged isolated thrombocytopenia patients post allogeneic hematopoietic stem cell transplantation[J]. Am J Hematol, 2018, 93(7): 931-42. DOI:10.1002/ajh.25056 |
| [15] |
Ding L, Saunders TL, Enikolopov G, et al. Endothelial and perivascular cells maintain haematopoietic stem cells[J]. Nature, 2012, 481(7382): 457-62. DOI:10.1038/nature10783 |
| [16] |
Rafii S, Mohle R, Shapiro F, et al. Regulation of hematopoiesis by microvascular endothelium[J]. Leuk Lymphoma, 1997, 27(56): 375-86. |
| [17] |
Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997, 275(5302): 964-7. DOI:10.1126/science.275.5302.964 |
| [18] |
Iwami Y, Masuda H, Asahara T. Endothelial progenitor cells: past, state of the art, and future[J]. J Cell Mol Med, 2004, 8(4): 488-97. |
| [19] |
Kong Y, Chang YJ, Wang YZ, et al. Association of an impaired bone marrow microenvironment with secondary poor graft function after allogeneic hematopoietic stem cell transplantation[J]. Biol Blood Marrow Transplant, 2013, 19(10): 1465-73. DOI:10.1016/j.bbmt.2013.07.014 |
| [20] |
王君妍, 叶洁瑜, 梁恩瑜, 等. 血小板生成素通过PI3K/AKT通路防止CoCl2诱导内皮细胞凋亡[J]. 中国实验血液学杂志, 2018, 26(2): 528-34. |
| [21] |
Zeng LY, Chen C, Song GL, et al. Infusion of endothelial progenitor cells accelerates hematopoietic and immune reconstitution, and ameliorates the graft-versus-host disease after hematopoietic stem cell transplantation[J]. Cell Biochem Biophys, 2012, 64(3): 213-22. DOI:10.1007/s12013-012-9387-5 |
| [22] |
Salter AB, Meadows SK, Muramoto GG, et al. Endothelial progenitor cell infusion induces hematopoietic stem cell reconstitution in vivo[J]. Blood, 2009, 113(9): 2104-7. DOI:10.1182/blood-2008-06-162941 |
| [23] |
Rafii S, Shapiro F, Pettengell R, et al. Human bone marrow microvascular endothelial cells support long-term proliferation and differentiation of myeloid and megakaryocytic progenitors[J]. Blood, 1995, 86(9): 3353-63. DOI:10.1182/blood.V86.9.3353.bloodjournal8693353 |
| [24] |
贺蓉, 贺石林. 生理性止血机制[J]. 血栓与止血学, 1994, 15(3): 136-7. |
| [25] |
Roumenina LT, Rayes J, Frimat M, et al. Endothelial cells: source, barrier, and target of defensive mediators[J]. Immunol Rev, 2016, 274(1): 307-29. DOI:10.1111/imr.12479 |
| [26] |
Randi AM, Smith KE, Castaman G. Von Willebrand factor regulation of blood vessel formation[J]. Blood, 2018, 132(2): 132-40. DOI:10.1182/blood-2018-01-769018 |
| [27] |
Chou FS, Mulloy JC. The thrombopoietin/MPL pathway in hematopoiesis and leukemogenesis[J]. J Cell Biochem, 2011, 112(6): 1491-8. DOI:10.1002/jcb.23089 |
| [28] |
Li Y, Huang Q, Wang C, et al. Efficacy and safety of high-dose dexamethasone combined with rhTPO for newly diagnosed adults with severe immune thrombocytopenia[J]. Chin J Hematol, 2016, 37(2): 134-7. |
| [29] |
Wong RSM, Saleh MN, Khelif A, et al. Safety and efficacy of longterm treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study[J]. Blood, 2018, 131(6): 709-17. DOI:10.1182/blood-2017-12-823252 |
 2020, Vol. 40
2020, Vol. 40

