2. 安徽省多糖药物工程技术研究中心,安徽 芜湖 241002;
3. 中国科学院昆明植物研究所,云南 昆明 650201
2. Anhui Provincial Engineering Research Center for Polysaccharide Drugs, Wuhu 241002, China;
3. Kunming Institute of Botany, Chinese Academy of Science, Kunming 650201, China
糖尿病是一种需要长期服药的慢性代谢性疾病,到目前为止仍没有根治方法,患者只能长期靠药物对血糖进行控制[1]。菌类中很多真菌为药食同源,相比磺酰脲类、双胍类等化学药具有毒性低的特点,也是目前天然产物创制的主要来源[2]。从作用温和、毒副作用小的真菌提取物中依据不同的靶点筛选,继而发现治疗II型糖尿病的活性成分成为国内外学者的研究热点[3]。特别是菌类子实体中的多糖成分,因为其高效低毒,已广泛被用于功能食品和保健品[4]。通过前期文献调研发现很多多孔菌科真菌(如桦褐孔菌[5-7]、桑黄[8-9]、灰树花[10-12]、茯苓[13-14]等)中的多糖成分已被报道具有良好的降糖作用。降血糖作用作为多孔菌科真菌一个典型的生物特性值得关注。
东方栓孔菌[Trametes orientalis(Yasuda)Imazeki]为多孔菌科真菌,生长于阔叶树枯立木及腐木上,药用可用于肺结核、支气管炎、抗肿瘤及风湿类病症[15],已分离出的脂溶性小分子化合物多为麦角甾醇类物质[16-17],该类物质在菌类化学成分中较为普遍,无显著的降糖作用。其多糖化学成分及药理作用研究较少,有报道其纯化后的多糖具有抗氧化、抗肿瘤和免疫调节作用[18-19],但其降血糖作用未有报道。本研究以东方栓孔菌子实体为原料,水提醇沉法制备粗多糖,通过柱层析分段纯化,对各多糖组分抗氧化、降血糖及降血脂作用进行评价,探讨可能的作用机制,指导东方栓孔菌降血糖多糖活性成分的研究,为扩大降血糖药物来源,深入研究和开发东方栓孔菌提供理论依据。
1 材料和方法 1.1 实验主要材料及仪器DEAE纤维素(金穗);Sephadex G-100(宝曼,分子量分级范围4000-150000);半透膜(生工);氯仿、正丁醇、葡萄糖、苯酚、硫酸(分析纯,国药);超纯水(自制);Dextran T系列标准品(右旋糖酐D2,D3,D4,D5,D6,D7,D8,中国药品生物制品检定所提供);消渴丸(白云山中一药业);复方丹参片(白云山和记黄埔),单糖标准品(中国药品生物制品检定所提供)。
UV-2450紫外可见分光光度计(岛津);METTLER TOLEDOXS105电子天平(梅特勒-托利多);Agilent 1200 HPLC系统;全自动生化分析仪(贝克曼库尔特AU480);血糖测试仪(三诺)。
东方栓孔菌购于深圳悦云商贸有限公司,为该公司2016年9月收集于吉林长白山地区农户,经皖南医学院包淑云博士鉴定为东方栓孔菌,样品(TO01)保存于皖南医学院药学院。
1.2 隐孔菌多糖的提取方法采用水提醇沉法提取隐孔菌多糖。取阴干的隐孔菌子实体,打粉,过40目筛,经低温烘干,称取干燥后的隐孔菌粗粉2 kg,放入5 L圆底烧杯中,加入蒸馏水8 L,在70 ℃水浴条件下浸提3次,每次3 h,合并提取液,回收至1/10体积,冷却至室温,加入95%的乙醇至乙醇分数为65%,进行醇沉,加入后有紊状飘浮物出现,捞出,无水乙醇清洗。其余母液静置24 h后过滤,沉淀用无水乙醇反复冲洗,合并两次所得提取物,为隐孔菌粗多糖。
1.3 隐孔菌多糖的纯化方法参照文献[20]方法,对隐孔菌多糖进行纯化。
Sevage法除蛋白:将粗多糖用蒸馏水加热溶解,与Sevage试剂(氯仿,正丁醇体积比4: 1)按4: 1比例混合,强烈震荡30 min,用3000 r/min离心15 min,直至分层后弃去中间的蛋白质层和下层的Sevage溶液,上层多糖溶液继续加入Sevage试剂重复6次,直至不再出现蛋白层为止。合并多次的粗多糖溶液,放冰箱备用。
DEAE纤维素离子交换柱分级纯化:将DEAE纤维素装入规格为3 cm×80 cm的层析柱中,用蒸馏水冲洗多次,过夜平衡。用去离子水将脱蛋白粗多糖溶解,以粗多糖浓度为10 mg/mL上样20 mL,分别用去离子水和0.5 mol NaCl进行洗脱,以洗脱速度1 mL/min冲洗,用紫外监测,收集合并多糖含量较高及信号波动不大部分,最后得到水洗脱部分(Water-DEAE)和盐洗脱部分(Salt-DEAE)。盐冲洗部分用去离子水透析至无盐检出。
Sephadex G-100葡聚糖凝胶纯化:称取Sephadex G-100葡聚糖凝胶,用蒸馏水浸泡24 h,使其充分溶胀,倾去上层飘浮物,其余部分湿法装入2 cm×50 cm层析柱中,后用蒸馏水平衡2个柱体积。将Water-DEAE和Salt-DEAE(去盐)用去离子水溶解分别上样,上样浓度为5 mg/mL,上样10 mL,用蒸馏水洗脱,以0.2 mL/min洗脱速度冲洗,分管收集(10 mL/管),根据紫外监测信号进行合并,水-DEAE部分通过洗脱得到2个部分(TOPW-1和TOPW-2),盐-DEAE部分通过洗脱得到2个部分(TOPS-1、TOPS-2)。其中TOPW-1和TOPS-1紫外信号较为恒定。
1.4 多糖含量的测定方法参照文献报道的苯酚-硫酸法进行测定[21]。利用多糖在浓硫酸的作用下水解成单糖,后脱水生成糖的衍生物,继而与苯酚生成橙黄色化合物,通过比色法监测该橙黄色化合物吸收值来反映多糖的含量。
1.5 抗氧化活性测定方法参考文献方法[22]测定样品对ABTS+·的清除率。先将各柱层析收集段配制成500 μg/mL,后配制成质量浓度分别为50、100、200、300、400、500 μg/mL的待测液2 mL,然后加入2mL预先已经混合好的ABTS反应试剂,混合均匀,室温下反应5~6 min,在波长734 nm处测定各组分样品的吸光度值(A1)。用无水乙醇2 mL代替ABTS反应剂,步骤同上,于波长734 nm处测得各组分样品本身吸光度值(A2)。以2 mL无水乙醇与2 mL ABTS反应剂充分混合,重复同上步骤,测其在734 nm波长处的吸光度值。以同等体积蒸馏水作为参比液调零。每个分析样品重复3次,取平均值。按照下式计算清除率:
| $ {\rm{ABT}}{{\rm{S}}^ + } \times {\rm{清除率 }}\left( \% \right) = [1 - ({A_1} - {A_2})/{A_0}] \times 100\% $ |
参考文献[23]方法并加以改进。
标准品溶液配制:取标准相对分子质量分别为4600、7100、10 000、21 400、41 100、84 400、133 800 Da的右旋糖酐标准品各10 mg,用1 mL流动相溶解,过0.22 μm滤膜过滤,取滤液50 µL进样,记录谱图,绘制标准多糖分子量-洗脱体积标准曲线。
供试品溶液配制:选取紫外监测较为恒定的TOPW-1和TOPS-1,用水配制成8 mg/mL,同样方法进样,根据标准曲线计算分子量。
色谱条件:流动相为0.1 mol/L NaCl;色谱柱为Shodex Ohpak SB-804HQ凝胶色谱柱;流速为0.5 mL/min;柱温和示差检测器温度均设为35 ℃;进样量为50 μL。
1.7 多糖组分成分测定方法参考文献[23]方法并加以改进。
样品制备:取样品2 mg,于5 mL的COD管中,加2 mol/L三氟乙酸1 mL,110 ℃水解4 h,蒸干,用甲醇洗涤,蒸干,加1 mL水溶解,取50 μL水解液与50 μL 0.6 mol/L的NaOH溶液,再加50 μL 0.5 mol/L的PMP(1-苯基-3-甲基-5-吡唑啉酮)甲醇溶液,混匀,与70 ℃烘箱中反应30 min,取反应液20 μL进样。
色谱条件:流动相为0.1 mol/L醋酸盐缓冲液-乙腈;色谱柱为Agilent C18(150 mm×4.6 mm×5 μm);流速为1 mL/min;柱温为30 ℃;检测波长为250 nm。
1.8 体外降血糖活性测定方法 1.8.1 DPP4抑制剂活性测定实验参照文献[24]方法,设全酶组、阳性对照组、空白组及样品组,每组设3个重复孔。在孔中依次加入Assay Buffer、DPP4酶、样品和底物。全酶组中用溶剂代替样品,空白组中分别用Assay buffer代替DPP4酶和用溶剂代替样品。阳性对照组使用1 μmol/L的西他列汀(sitagliptin)。所有加样结束后,在37 ℃恒温30 min,在激发光波长350~360 nm,发射光波长450~465 nm处读取荧光值,按下式计算抑制率。
| $ \begin{array}{l} {\rm{抑制率 }}\left( \% \right) = \\ \frac{{{\rm{全酶组真实荧光值 }} - {\rm{样品组真实荧光值 }}}}{{{\rm{全酶组真实荧光值 }}}} \times {\rm{ }}100\% \end{array} $ |
参考文献[25]方法,将3T3-L1细胞诱导分化成脂肪细胞并将细胞接种到96孔板中。用低糖培养基将细胞清洗1次,后加入含不同药物的200 μL低糖培养基。对照组分别用DMSO、100 nmol/L的胰岛素及小檗碱孵育,待测样品组用终浓度为25 μg/mL的样品孵育,每个样品设3个重复孔。孵育24 h后吸取10 μL细胞培养基,用葡萄糖氧化酶-过氧化物酶法测定培养液中葡萄糖的浓度。同时,在剩余培养基中加20 μL MTS,37 ℃孵育2 h,测定在492 nm处吸光值,判断样品对脂肪细胞是否有毒性。结果根据以下公式计算:
| $ \begin{array}{l} \;\;\;{\rm{葡萄糖浓度(mmol/L) = (样品吸光度/标准品吸光}}\\ {\rm{度) \times 校准品浓度}}\\ \;\;\;{\rm{葡萄糖消耗率 }}\left( {\rm{\% }} \right){\rm{ = [(初始葡萄糖浓度 - 实验孔葡}}\\ {\rm{萄糖浓度)/初始葡萄糖浓度}}]{\rm{ \times 100\% }} \end{array} $ |
参考文献[26]方法,将待测样品与猪胰脂肪酶溶液混合后注入96孔中,每个浓度均设3个重复孔,于37 ℃培育15 min,后加入p-NPB混合均匀,再于37 ℃培育15 min,以400 nm为检测波长,以630 nm为参考波长,用酶标仪测定各样品A值。实验同时设置空白对照组和Orlistat阳性对照组。按下列公式计算抑制率:
| $ {\rm{PPL}}{\rm{活性抑制率}}\left( {\rm{\% }} \right){\rm{ = }}\left( {{\rm{1 - }}{{A}_{{\rm{样品}}}}{\rm{/}}{{A}_{{\rm{实验对照孔}}}}} \right){\rm{ \times 100\% }} $ |
参考文献[27]方法,用0.1 mol/L、pH 4.2的柠檬酸钠缓冲液新鲜配制STZ溶液。小鼠在禁食16 h后,腹腔注射,于7 d后检测血糖,随机血糖值高于11 mmol/L为造模成功。实验动物随机分成6组,每组8只,包括正常组(给予蒸馏水),模型组(给予蒸馏水),模型+多糖高、中、低剂量组(分别给予多糖0.1,0.2,0.4 g/kg)和模型+消渴丸(5丸/kg)组。灌胃给药,每天给药1次,连续给药2周。末次给药后,禁食12 h,经尾静脉取血测定空腹血糖值。采用SPSS统计进行处理,采用两组间均数比较t检验。
1.10 降血脂动物模型实验设计参考文献[27]方法,高脂饮料喂养6周后禁食12 h,随机测定2只小鼠血脂含量用来确定造模成功。实验分组同上,用模型+复方丹参(0.5 g/kg)作为阳性对照组。灌胃给药,每天1次。连续2周,最后一次给药后禁食12 h,经腹腔静脉取血,分离血清样本,经全自动生化仪测定TC、TG、LDL-C和HDL-C含量。采用SPSS统计进行处理,采用两组间均数比较t检验。
1.11 统计学处理方法采用SPSS 21.0进行统计处理,计量资料以均数±标准差表示,两组间均数比较采用独立样本t检验,P<0.05表示两组间差异有统计学意义。
2 结果 2.1 东方栓孔菌各层析段多糖含量及对ABTS清除能力水提醇沉粗多糖含量只有14%,经DEAE柱层析后分成水洗段和盐洗段,多糖含量上升到42%和46%,两个洗脱部分再分别再经过凝胶细分,前馏分TOPW-1和TOPS-1为紫外检测信号较一致的部分,均有较高的多糖含量,达到74%和85%。随着柱层析的不断深入,多糖含量有了明显的提升。将最后柱层析分离得到的各纯化段配制成浓度500 μg/mL的溶液,对其ABTS清除能力进行了测定。结果显示,盐洗脱部分不论多糖还是非多糖组分均有较高的清除能力,而水洗脱部分多糖含量高的组分清除能力较含量低的组分弱(表 1)。
| 表 1 东方栓孔菌各层析段含量及ABTS清除能力 Tab.1 Polysaccharide contents and ABTS scavenging ability in each column chromatography section |
对多糖含量较高且紫外信号较为一致的TOPW-1(a)和TOPS-1(b),通过凝胶色谱法进行相对分子质量测定,根据系列相对分子质量右旋糖苷标准品的液相色谱图,所绘制的方程为log Mw=-0.6513V+10.3390,R2=0.9970。进而计算出样品的相对分子质量分布的大致区间。TOPS-1组分数均相对分子质量Mn均为7835 Da,重均相对分子质量Mw均为108 000 Da,分布宽D为13.782,D值较大,提示为非均一多糖,不同多糖组分相对分子质量差异较大。TOPW-1组分数均相对分子质量Mn均为11 170 Da,重均相对分子质量Mw均为19 650 Da,分布宽D为1.759,提示其为均一多糖。对TOPW-1进行单糖组成测定,经衍生化后与标准单糖谱图进行对比(图 1),除保留时间为22 min左右的峰无标准单糖对照外,推断TOPW-1是由D-甘露糖、D-葡萄糖、D-半乳糖及D-岩藻糖以物质的量比1:0.28:2.95:0.63组成的多糖。
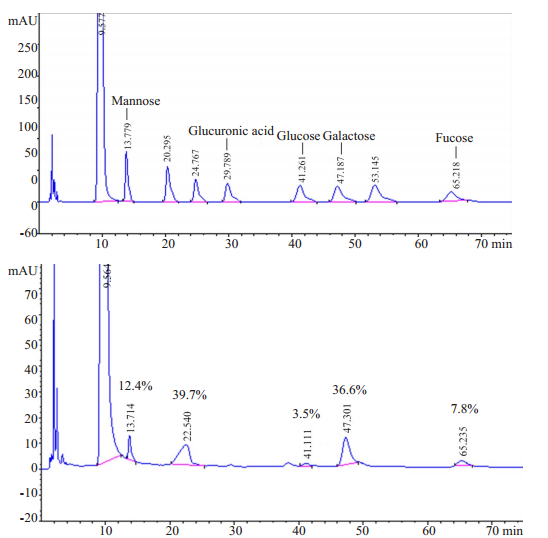
|
图 1 标准单糖和TOPW-1衍生物HPLC图谱 Fig.1 HPLC chromatograms of the derivatives of monosaccharides and TOPW-1. |
(1)DPP4抑制活性测定:TOPW-1和TOPS-1在25 μg/mL浓度下对DPP4抑制率分别为(1.18±4.08)%和(2.76±1.32)%,其而阳性对照西他列汀在1 µmol/L时抑制率为(99.44±0.03)%。(2)促脂肪细胞摄取葡萄糖活性:TOPS-1在25 μg/mL浓度下作用24 h后,具有弱的促进脂肪细胞摄取葡萄糖的活性,与空白组DMSO对照相比有统计学差异(P<0.05);而TOPW-1与空白DMSO溶剂对照组促进能力相似,无促进脂肪细胞摄取葡萄糖活性(表 2)。(3)胰脂肪酶抑制活性:TOPW-1在500 μg/mL浓度下对胰脂肪酶的抑制率为(7.239±1.12)%,而阳性对照物奥利司他在0.0025 μg/mL的浓度下抑制率达到了(89.294±0.52)%。TOPS-1在300 μg/mL浓度下其抑制率为负值,抑制率为(53.928±0.73)%。
| 表 2 东方栓孔菌多糖的葡萄糖消耗率 Tab.2 Glucose consumption rate of Trametes orientalis polysaccharides |
对TOPW-1和TOPS-1的体外抗氧化和降血糖实验数值显示,TOPS-1表现出明显的抗氧化、一定的促脂肪细胞摄取葡萄糖和促脂肪酶的活性,而TOPW-1作用不明显。对TOPS-1进一步用动物实验来评价其是否具有降血糖作用。通过STZ建造高血糖模型,模型组小鼠的血糖水平2周后平均值是正常组4倍多(P<0.01)。与模型组相比,TOPS-1中剂量组可以极显著降低血糖水平(P<0.01),低剂量组和高剂量组与模型组比较,其数值虽较模型组低,但无统计学意义(P>0.05),且高剂量组在一定程度上死亡率增高。与阳性对照消渴丸组比较而言,TOPS-1中剂量组降糖效果不如消渴丸组,但安全性相对稍高(表 3)。
| 表 3 TOPS-1对小鼠血糖的影响 Tab.3 Effects of different doses of TOPS-1 on plasma glucose in rats (Mean±SD, mmol/L) |
喂养高脂饲料后小鼠血清中TC,TG,LDL-C与正常组比较均有明显升高,HDL-C明显降低,且均具有极显著性差异(P<0.01,表 4)。
| 表 4 TOPS-1对小鼠血脂的影响 Tab.4 Effects of different doses of TOPS-1 on serum lipid levels in rats (Mean±SD, mmol/L) |
给药过程中,给药组均无小鼠死亡。与模型组比较,TOPS-1中剂量组能够极显著降低TC和LDL-C含量(P<0.01),3个剂量组均能够极显著降低TG的含量(P<0.01),但对于HDL-C含量的变化无明显影响。
3 讨论东方栓孔菌多糖的纯化仅有一篇文献报道[19],且不够全面,不能全面反映不同性质多糖的生物活性。本研究利用水及0.5 M盐水冲洗,将其中多糖组成按电荷性质分成两大类,能够较为全面地考查不同性质多糖的生物活性,为产品进一步开发提供理论依据。
抗氧化作用通常与降血糖、降血脂、免疫调节等多种生物活性相关。自由基抗氧化酶在胰岛β细胞内表达相对较低,造成胰岛素对活性氧(ROS)和活性氮(RNS)等自由基敏感。一旦自由基过量,则可破坏细胞大分子,引起氧化应激,导致胰岛β细胞结构及功能受损,引起胰岛素分泌不足[28]。样品对氧自由基的清除能力可以间接反映对胰岛β细胞的保护程度。同时,抗氧化作用对于减轻脂质过氧化,降低血脂水平也有着重要作用,对糖尿病并发症的发生发展有一定的预防作用[29]。通过测定ABTS清除率评价其抗氧化活性,水洗脱多糖部分和盐洗脱多糖部分有明显差异。水洗脱部分TOPW-1多糖含量高,但清除率反而不及多糖含量低的TOPW-2,说明水洗脱部分除了多糖还有另外一些有更强抗氧化作用的水溶性成分。盐水洗脱部分中多糖含量高和多糖含量低的组分均有较强的清除率,均高于水洗脱部分,推测盐水洗脱部分的多糖结构中可能含有某些还原性较强的基团。
体外降血糖活性测定采用了3种方法。二肽基肽酶(DPP4)是降血糖研究的一个重要靶点。它能分解体内的蛋白质,其中一种被DPP4分解的蛋白质叫做胰高血糖素样肽-1(GLP-1),GLP-1可以通过可以刺激胰岛素、抑制升糖素等方式来降低血糖[30]。数据显示两种多糖组分并不能抑制DPP4,说明两种多糖并不是通过刺激胰岛素分泌产生作用。糖尿病患者在糖代谢的紊乱的同时常伴随血脂代谢异常,血浆自由脂肪酸水平升高,以有毒的神经酰胺、长链脂酰辅酶A及神经鞘脂类形式堆积于胰腺和动脉等处,会降低组织对胰岛素的敏感性,引起胰岛素抵抗[31]。通过研究多糖促3T3-L1脂肪细胞摄取葡萄糖活性,显示TOPS-1与空白对照有差异,有弱的改善胰岛素抵抗,提高胰岛素敏感性的作用,而TOPW-1没有活性。另一个测定靶点为胰腺脂肪酶,它是体内脂肪消化的主要酶。临床上常通过测定胰脂肪酶的表达来诊断胰腺炎,胰腺损伤通常与炎症相联系,抑制胰脂肪酶活性能缓解炎症引起的释放延迟等2型糖尿病症状[32]。TOPW-1仅具有非常弱的胰脂肪酶抑制活性,对降低脂肪的吸收作用很弱,而TOPS-1对胰脂肪酶有激活作用(抑制率为负值),对于胰腺炎症引发的糖尿病的治疗是不利的,但它可能会加速体内脂肪分解利用,对糖尿病并发的脂质代谢紊乱有调节作用。
衡量体外抗氧化和降血糖测定结果,我们认为TOPW-1作用不强,而TOPS-1有进一步研究的必要。进一步的动物实验可以看出,TOPS-1能够显著降低TC,TG和LDL-C的含量,能够降低体内血脂水平。TOPS-1剂量浓度与降血糖效果并不呈现正比关系,低浓度组达不到起效的显著剂量,高浓度组可能因为溶液黏度太大,不易吸收,其降糖作用不如中剂量组。同时,高浓度组(0.4 g/kg)东方栓孔菌多糖能够造成糖尿病小鼠死亡率相对较高,原因可能与激活胰脂肪酶,加重炎症有一定的关系。3个剂量组中,中浓度(0.2 g/kg)能极显著地降低血糖水平,但比阳性对照消渴丸组降糖效果稍弱。两组均未能使血糖值恢复到正常水平,也没有直接研究表明其有治愈作用。
综上所述,TOPS-1在0.2 g/kg的剂量下,具有显著降低血糖和调节血脂的作用,推测其作用机制与清除胰岛β细胞内氧自由基、保护胰岛β细胞免受氧化应激损伤的作用、降低糖尿病小鼠肝脏脂质过氧化物的生成和增加胰岛素敏感性有关,能够有效降低糖尿病患者血糖和调节脂类代谢紊乱。
本研究明确了东方栓孔菌中盐水洗脱的多糖具有一定降血糖和调节血脂的作用,能够为东方栓孔菌的应用开发和机制的研究提供一定的理论基础。但是TOPS-1由于分离度的原因未能最终纯化为单一多糖,对于其化学特征还不能准确地阐明。同时,降血糖的机制非常复杂,利用现有的体外降血糖测定方法评价和推测了其中的部分作用机制,但对于更为精细的机制还需要进一步研究确定。
| [1] |
王洪霞, 胡晓灵. 糖尿病中医证型研究近况[J]. 中医文献杂志, 2008, 26(3): 47-9. DOI:10.3969/j.issn.1006-4737.2008.03.018 |
| [2] |
陈广耀. 抗糖尿病中药开发前景展望[J]. 中国新药杂志, 2000, 9(7): 448. DOI:10.3321/j.issn:1003-3734.2000.07.005 |
| [3] |
Butler MS. Natural products to drugs: natural product-derived compounds in clinical trials[J]. Nat Prod Rep, 2005, 25(3): 475-516. |
| [4] |
Giavasis I. Bioactive fungal polysaccharides as potential functional ingredients in food and nutraceuticals[J]. Curr Opin Biotechnol, 2014, 26: 162-73. DOI:10.1016/j.copbio.2014.01.010 |
| [5] |
Mizuno T, Zhuang C. Antitumor and hypoglycemic activities of polysacsaccharides from the sclerotia and mycelia of Inonotus obliquus[J]. J Ethnopharmacol, 2005, 101(3): 120-5. |
| [6] |
Chen HX, Lu XM, Qu ZS, et al. Glycosidase inhibitory activity and antioxidant properties of a polysaccharide from the mushroom Inonotus obliquus[J]. J Food Biochem, 2010, 34: 178-91. DOI:10.1111/j.1745-4514.2009.00322.x |
| [7] |
Wang J, Hu WJ, Li LZ, et al. Antidiabetic activities of polysaccharides separated from Inonotus obliquus via the modulation of oxidative stress in mice with streptozotocin-induced diabetes[J]. PLoS One, 2017, 12(6): e0180476. DOI:10.1371/journal.pone.0180476 |
| [8] |
Suabjakyong P, Nishimura K, Toida T, et al. Structural characterization and immunomodulatory effects of polysaccharides from Phellinus linteus and Phellinus igniarius on the IL-6/IL-10 cytokine balance of the mouse macrophage cell lines (RAW264.7)[J]. Food Funct, 2015, 6(8): 2834-44. DOI:10.1039/C5FO00491H |
| [9] |
Kim GY, Kim SH, Hwang SY, et al. Oral administration of proteoglycan isolated from Phellinus linteus in the prevention and treatment of collagen-induced arthritis in mice[J]. Biol Pharm Bull, 2003, 26(6): 823-31. |
| [10] |
Lei H, Wang Q, Guo SZ, et al. The protective effect of MT-α-glucan against streptozotocin (STZ)-induced NIT-1 pancreatic β-cell damage[J]. Carbohyd Polym, 2013, 92: 1211-7. DOI:10.1016/j.carbpol.2012.10.037 |
| [11] |
Lei H, Guo SZ, Han JC, et al. Hypoglycemic and hypolipidemic activities of MT-α-glucan and its effect on immune function of diabetic mice[J]. Carbohydr Polym, 2012, 89(1): 245-50. DOI:10.1016/j.carbpol.2012.03.003 |
| [12] |
Xiao C, Wu QP, Xie YZ, et al. Hypoglycemic effects of Grifola frondosa (Maitake) polysaccharides F2 and F3 through improvement of insulin resistance in diabetic rats[J]. Food Funct, 2015, 6(11): 3567-75. DOI:10.1039/C5FO00497G |
| [13] |
中国药科大学. 中药辞海[M]. 北京: 中国医药科技出版社, 1996: 1272-8.
|
| [14] |
郑彩云. 茯苓多糖抗糖尿病作用的实验研究[J]. 中国医疗前沿, 2010, 5(14): 12-3. |
| [15] |
赵继鼎.中国科学院中国孢子植物志编辑委员会. 中国真菌志-第三卷-多孔菌科[M]. 北京: 科学出版社, 1998: 372.
|
| [16] |
Chen HL, Chiang HC. Constituents of Fruit Bodies of Tramete orientalis[J]. Journal of the Chinese Chemical Society, 1995, 42: 97-100. DOI:10.1002/jccs.199500017 |
| [17] |
谭大聪, 周凌云, 樊海霞, 等. 东方栓菌化学成分研究[J]. 中药材, 2019, 42(2): 327-30. |
| [18] |
Zheng Y, Li Y, Wang WD. Optimization of ultrasonic-assisted extraction and in vitro antioxidant activities of polysaccharides from Trametes orientalis[J]. Carbohydr Polym, 2014, 111: 315-23. DOI:10.1016/j.carbpol.2014.04.034 |
| [19] |
Zheng Y, Wang WD, Li Y. Antitumor and immunomodulatory activity of polysaccharide isolated from Trametes orientalis[J]. Carbohydr Polym, 2015, 131: 248-54. DOI:10.1016/j.carbpol.2015.05.074 |
| [20] |
董亚茹, 王瑶, 赵立艳, 等. 金针菇多糖分离纯化及多糖铁复合物的制备[J]. 食品科技, 2017, 42(1): 208-14. |
| [21] |
周吴萍, 杜文佳. 灵芝多糖提取工艺的优化[J]. 湖北农业科学, 2013, 52(15): 3632-4. DOI:10.3969/j.issn.0439-8114.2013.15.046 |
| [22] |
韦玉兰, 苏上贵, 黄燕军, 等. 金樱子多糖抗氧化作用的实验研究[J]. 广西中医药, 2015, 38(3): 61-4. |
| [23] |
刘小攀, 田春莲, 肖卓炳, 等. 忽地笑多糖分子量及单糖组成研究[J]. 天然产物研究与开发, 2017, 29(10): 1648-53, 1682. |
| [24] |
Wang Y, Wu XL, Cheng YY, et al. A fluorescent switchable AIE probe for selective imaging of dipeptidyl peptidase-4 in vitro and in vivo and its application in screening DPP-4 inhibitors[J]. Chem Commun (Camb), 2016, 52(17): 3478-81. DOI:10.1039/C5CC08921B |
| [25] |
Nishide M, Yoshikawa Y, Yoshikawa EU, et al. Insulinomimetic Zn (Ⅱ) complexes as evaluated by both glucose-uptake activity and inhibition of free fatty acids release in isolated rat adipocytes[J]. Chem Pharm Bull, 2008, 56(8): 1181-3. DOI:10.1248/cpb.56.1181 |
| [26] |
李小第, 姜会敏, 霍雅玉, 等.刺玫果果肉石油醚层化学成分及胰脂酶和α-糖苷酶抑制活性研究[J]. 2015, 27 (6) : 1011-5. http://www.cnki.com.cn/Article/CJFDTOTAL-TRCW201506014.htm
|
| [27] |
陈峰, 谭银丰, 任守忠, 等. 罗勒水提物及其多糖在大鼠体内降血糖和降脂作用的研究[J]. 海南医学院学报, 2011(11): 1441-4. |
| [28] |
Wu JJ, Shi SS, Wang HJ, et al. Mechanisms underlying the effect of polysaccharides in the treatment of type 2 diabetes: a review[J]. Carbohydr Polym, 2016, 144: 474-94. DOI:10.1016/j.carbpol.2016.02.040 |
| [29] |
刘亚萍, 张泽生, 李雨蒙, 等. 灵芝多糖降血糖机制的研究进展[J]. 食品研究与开发, 2018, 39(2): 215-8. DOI:10.3969/j.issn.1005-6521.2018.02.039 |
| [30] |
李恒臻, 庄立晖, 刘哲, 等. 靶向DPP4与2型糖尿病相关药物分子的对接研究[J]. 临床医学进展, 2017, 7(1): 16-22. |
| [31] |
Johnson AMF, Olefsky JM. The origins and drivers of insulin resistance[J]. Cell, 2013, 152(4): 673-84. DOI:10.1016/j.cell.2013.01.041 |
| [32] |
孙慧, 王丹阳, 王翠翠, 等. 淀粉酶、脂肪酶联检对提高急性胰腺炎诊断的价值分析[J]. 中国民康医学, 2014, 14: 78-9. |
 2020, Vol. 40
2020, Vol. 40

