近年来,全球乳腺癌发病率以每年增加0.3%的趋势上升,而乳腺癌的死亡率呈下降趋势,主要得益于乳腺癌的早期诊断和新的治疗方法的不断应用[1]。在中国女性中,乳腺癌新发病例占所有新发恶性肿瘤的15%,居首位,乳腺癌的发病率和死亡率均呈不断上升趋势[2]。因此,深入研究乳腺癌的发病机制,寻找能提高乳腺癌早期诊断的肿瘤标志物至关重要。前期我们通过TCGA数据库筛选出在乳腺癌组织中的差异表达基因超氧化物歧化酶2(SOD2)。文献报道SOD2在乳腺癌[3]、肺癌[4]、皮肤癌[5]及涎腺腺样囊性癌[6]中发挥抑癌作用,然而近期的研究表明,在卵巢癌[7]、宫颈癌[8]、乳腺癌[9]及食道癌[10]中,SOD2发挥促癌作用,可能有助于肿瘤的进展和扩散,但这些研究均局限于细胞层面,没有大样本的临床数据报道。SOD2在肿瘤发生发展中的作用的相互矛盾使其成为肿瘤生物学领域争论的焦点。本研究通过挖掘TCGA数据库,应用生物信息学方法分析SOD2在乳腺癌中的表达、临床相关性及生存预后相关性并在临床样本中加以验证。使用GSEA富集分析挖掘SOD2可能参与的信号通路,揭示其在乳腺癌发生发展中的分子机制。
1 资料和方法 1.1 资料 1.1.1 临床样本从宁夏医科大学总医院生物样本组织库中提取2018年1月~2019年12月收集的原发性乳腺癌组织60例和相对应的癌旁组织60例为研究对象,60例患者均为女性,平均年龄48岁。所有患者均经术后病理诊断确诊为原发性乳腺癌,术前未行化疗、放射治疗或内分泌治疗。癌组织和癌旁组织均取自同一确诊乳腺癌患者,留取的乳腺癌组织和癌旁组织(距肿瘤组织边缘大于5 cm)均在离体30 min内放入液氮保存,收取标本时均告知患者留取标本将用于科研研究并签署知情同意书。
1.1.2 主要试剂SOD2一抗、二抗、RNA提取试剂盒、RNA反转录试剂盒和Real time PCR Taqman试剂均由国内试剂公司代购(中杉金桥)。SOD2引物由上海吉凯公司设计并合成。
1.2 方法 1.2.1人乳腺癌基因芯片表达数据及临床数据的收集和处理人乳腺癌患者的RNA-Seq数据集和相应的临床资料来自TCGA(https://gdc.nci.nih.gov)[11]。在创建数据集的过程中,从TCGA数据门户网站下载了总共1066例乳腺癌组织样本和112例正常样本的原始RNA测序读数和相应的临床信息,所有样本的RNA表达水平均已在R统计环境(R3.6.0)中使用BioConductor软件包进行处理和归一化,根据样本ID匹配SOD2 mRNA表达数据矩阵和临床信息文件。
1.2.2SOD2基因在人乳腺癌中的表达差异和临床相关性分析采用R 3.6.0软件对TCGA下载的数据进行处理,使用limma包对芯片数据做差异分析,计算SOD2在乳腺癌组织和乳腺正常组织、乳腺癌组织和与其相匹配的癌旁组织中的差异表达及临床相关性,使用beeswarm包做图。
1.2.3乳腺癌组织SOD2基因表达水平与乳腺癌预后的相关性分析使用Kaplan-Meier Plotter数据库(https://kmplot.com/analysis),对基因芯片中215223_s_at探针数据进行生存和预后分析。按SOD2在乳腺癌组织芯片中的表达均值进行分组,高于均值为高表达组,低于均值为低表达组。分别分析SOD2差异表达与乳腺癌患者总生存期(OS)、无复发生存(DMFS)、无远处转移生存(RFS)和后进展生存期(PPS)的相关性。
1.2.4基因集富集分析使用KEGG的基因集进行基因富集分析(GSEA)评估SOD2可能参与的信号通路,揭示其在乳腺癌发生发展中的分子机制[12]。根据SOD2表达中位数将基因表达数据分为高、低两组,每次分析进行1000次基因集排列。在整个过程中,SOD2的表达水平被认为是一个表型,根据标准化富集分数(NES)、标准化显著性水平(NOM p-val)和矫正多重假设检验(FDR q-val)对每种表型的富集途径进行分类,NES绝对值≥1.0,NOM p-val≤0.05,FDR q-val≤0.25确认为有意义的基因集合。
1.2.5PPI网络构建和信号通路关键基因筛选通过在线分析网站STRING(https://string-db.org/)得到已筛选有意义信号通路中差异表达基因(DEGs)的蛋白互作网络,以TSV格式导出,将所得源文件导入Cytoscape进行可视化分析,用插件cytoHubba进行Hub基因分析,筛选出潜在的关键基因。
1.2.6SOD2与筛选出的信号通路关键基因的相关性分析通过在线分析网站CANCERTOOL(http://web.bioinformatics.cicbiogune.es/CANCERTOOL)分析SOD2与JAK-STAT信号通路关键基因IL10和STAT4的相关性[13]。绘制的值对应于指定数据集中每个患者的两个基因(X轴和Y轴)的log2归一化基因表达值。黑线表示线性回归,灰色区域表示置信区间的界限,Cor和p分别表示Pearson's相关系数和统计显著性。
1.2.7 免疫组化临床样本采用免疫组织化学PV9000两步法,所有组织标本常规用10%甲醛固定,石蜡包埋,制成3 μm切片,按试剂盒说明书操作。选定一抗工作浓度为1:200。阳性结果判定:请两位病理学专家双盲法观察切片,采用半定量积分法判断结果:①按染色强度计分:无色为0分,淡黄色为1分,棕黄为2分,黄褐色为3分;②按阳性染色细胞百分率计分:阳性细胞数<10%为0分,10%~25%为1分,>25%~50%为2分,>50%~ 75%为3分,>75%为4分。将①×②的结果分为以下等级:0~3分为阴性(-),≥4分为阳性(+)。对照实验:以PBS代替一抗做空白对照,用已知阳性切片作阳性对照。若两位专家结果相差3分则重新判定。
1.2.8 RT-qPCR检测SOD2的表达按照RNA提取试剂盒说明书中步骤提取临床样本组织总RNA,按RNA反转录试剂盒逆转录合成cDNA,以cDNA为模板,按照Real time PCR试剂盒说明书配制反应体系,反应以U6为内参照,ABI-7300实时荧光定量仪上进行PCR扩增。反应条件为:95 ℃预变性3 min,95 ℃变性12 s,62 ℃退火40 s,共40个循环。实验结果采用2-ΔΔCt法进行表达量相对定量分析。SOD2引物(上游):5'GCCTC CCTGACCTGCCTTAC3',SOD2引物(下游):5'GTGA TTGATATGGCCCCCG3';U6(上游):5'CCCTAAGGC CAACCGTGAA3',U6(下游):5'CCAGAGGCATACAG GGACAAC3'。
1.3 统计分析所有统计分析和绘图均使用R(v.3.6.0)。用Wilcoxon秩和检验和Wilcoxon符号秩和检验分析SOD2在非配对样本和配对样本中的表达。采用Kruskal-Wallis检验和Wilcoxon符号秩和检验分析SOD2表达与临床病理特征的关系,使用Kaplan-Meier法做生存分析,以P<0.05为差异有统计学意义。两基因相关性使用Pearson's相关性分析,P<0.05并且|Cor|≥0.2为差异有统计学意义。临床样本资料采用Prism 8(GraphPad)和SPSS 26.0统计软件进行分析,计数资料应用R×C列联表的χ2检验对统计结果进行检验分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 SOD2在乳腺癌和乳腺正常组织中的差异表达分析基于TCGA数据分析结果显示SOD2基因在乳腺癌组织中的表达显著低于其在正常乳腺组织中的表达(P<0.001,图 1A)。乳腺癌组织与其相匹配的癌旁组织中的表达分析也验证了SOD2在乳腺癌组织中的表达显著低于其在癌旁组织中(P<0.001,图 1B)。
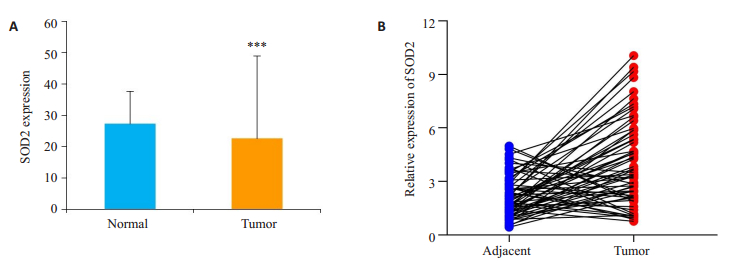
|
图 1 TCGA数据库中SOD2基因的差异表达 Fig.1 Expression levels of SOD2 in breast cancer tissues from TCGA database. A: Expression of SOD2 in breast cancer tissues and normal breast tissues; B: Expression of SOD2 in paired breast cancer and adjacent tissues. ***P < 0.001 vs normal. |
然而在我们的临床样本的检测中,我们发现SOD2 mRNA在乳腺癌中的相对表达水平明显高于其在癌旁组织的相对表达(P<0.001,图 2D)。
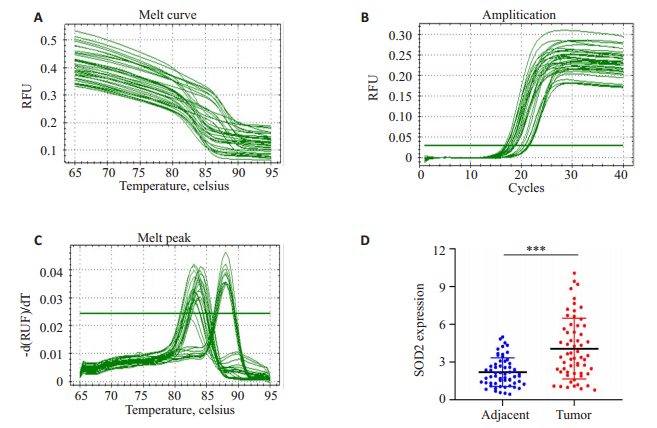
|
图 2 SOD2在乳腺癌组织及癌旁组织中mRNA的相对表达 Fig.2 Relative expression of SOD2 in breast cancer tissues and adjacent tissues by RT-qPCR. The amplification (A), melt curve(B), and melt peak (C) of RT-qPCR; (D) Scatter plot show the different relative expression of SOD2 in breast cancer tissues and adjacent tissues. Values are presented as Mean±SD (***P < 0.001). |
进一步的免疫组化结果显示,SOD2蛋白在乳腺癌中呈现高表达,而在癌旁组织中呈现低表达或表达缺失(P<0.001,表 1,图 3)。
| 表 1 SOD2在乳腺癌组织和癌旁组织中的蛋白表达情况 Tab.1 Expression of SOD2 protein in breast cancer and adjacent tissues (n=60) |
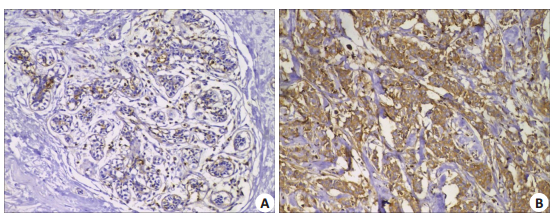
|
图 3 SOD2在乳腺癌组织及癌旁组织中蛋白水平的差异表达 Fig.3 Differential expression of SOD2 protein in breast cancer tissues (A) and adjacent tissues (B) (Original magnification:×200). |
基于TCGA数据库的数据分析结果显示SOD2的表达与乳腺癌TNM分期显著相关,Ⅲ、Ⅳ期患者中的表达明显低于Ⅰ、Ⅱ期(P<0.05,图 4A);与腋窝淋巴结有无转移显著相关,在有腋窝淋巴结转移的患者中其表达明显低于无腋窝淋巴结转移者(P<0.001,图 4B);而与T分期和有无远处转移无显著相关性(P>0.05,图 4C、D)。
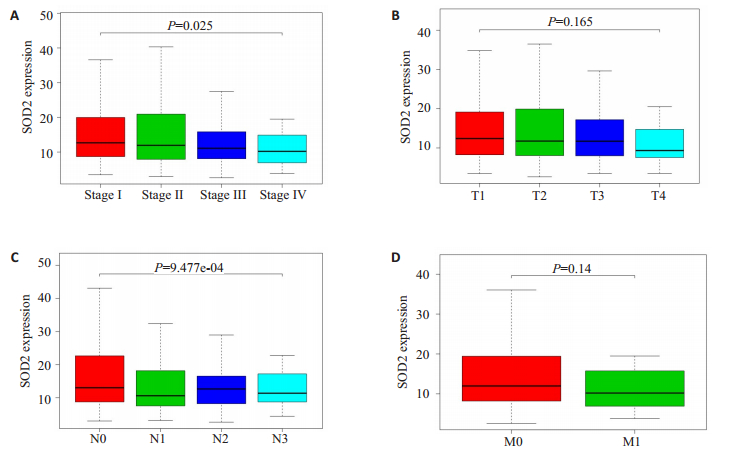
|
图 4 SOD2的表达与临床病理特征间的相关性分析 Fig.4 Association between SOD2 expression and the clinicopathologic characteristics of the patients. A: TNM stage; B: N stage; C: M stage; D: T stage. |
通过对我们收集的60例乳腺癌组织临床样本SOD2相对mRNA表达做临床相关性分析,60例样本平均的相对表达为4.05,因此,设定高于4.05的为高表达,低于4.05为低表达。临床相关性分析结果显示:SOD2的表达与腋窝淋巴结有无转移、雌激素受体(ER)表达及雄激素受体(AR)表达有显著性差异,P<0.05。而与组织学类型、组织学分级、TNM分期、HER-2表达及Ki-67增殖无显著相关性(表 2)。
| 表 2 SOD2的表达与乳腺癌临床病理特征的关系 Tab.2 Relationship between SOD2 expression and clinicopathological features of breast cancer patients |
结果显示SOD2的高表达为乳腺癌一不良预后因素,在无复发生存、无远处转移生存和后进展生存期的分析中,SOD2高表达者的DMFS、RFS和PPS均显著低于SOD2低表达者(P<0.05)。尽管在总生存的分析中未得到统计学差异(P=0.052),但SOD2高表达者OS低于低表达者的趋势存在(图 5)。
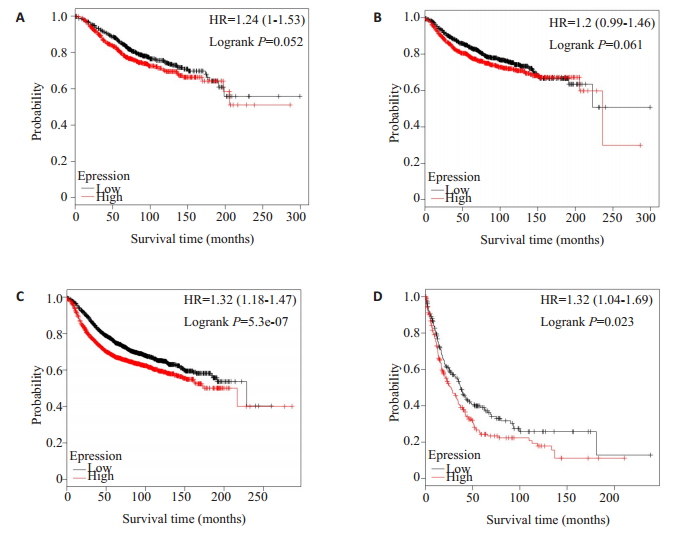
|
图 5 通过Kaplan-Meier Plotter数据库分析SOD2的表达与乳腺癌患者预后的关系 Fig.5 Analysis of Kaplan-Meier Plotter database for the relationship between SOD2 expression level and prognosis of patients with breast cancer. A: Overall survival; B: Distant metastasis-free survival; C: Recurrencefree survival; D: Post-progressive survival. |
GSEA富集分析共有21个信号通路和生物过程在SOD2和乳腺癌之间具有不同程度的富集,FDR q-val<0.05。其中与肿瘤相关的信号通路和生物过程有:细胞因子-细胞因子受体相互作用、Jak Stat信号通路、凋亡、P53信号通路、自然杀伤细胞介导的细胞毒性和趋化因子信号通路等(图 6)。
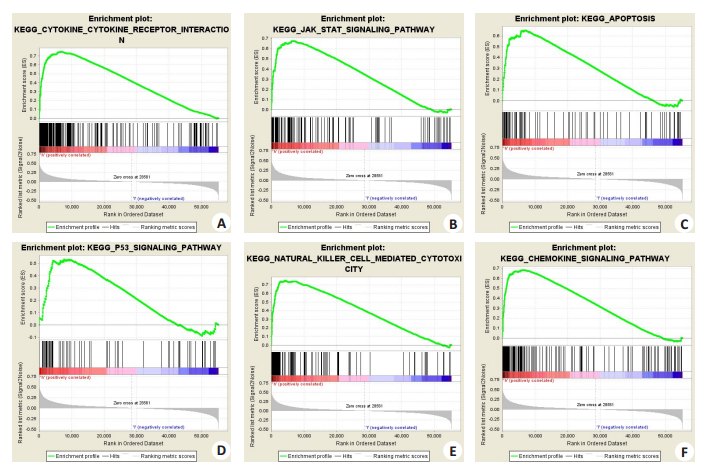
|
图 6 GSEA信号通路富集分析 Fig.6 Enrichment plots from the gene set enrichment analysis. A: Cytokine Cytokine receptor interaction; B: Jak Stat signaling pathway; C: Apoptosis; D: P53 signaling pathway; E: Natural killer cell mediated cytotoxicity; F: Chemokine signaling pathway. BRCA: Breast cancer; ES: Enrichment score; NES: Normalized ES; NOM P-val, normalized P-value. |
GSEA富集分析SOD2在JAK-STAT信号通路中发挥重要的生物学作用(图 7A),通过cytoscape软件构建SOD2在JAK-STAT信号通路中关键基因的蛋白互作网络,其中IL10和STAT4与SOD2最具有相关性,为筛选出的Hub基因(图 7B),进一步对筛选出的IL10和STAT4与SOD2做相关性分析,二者均与SOD2呈正相关性,相关系数分别为0.35和0.38,P<0.001(图 7C、D)。
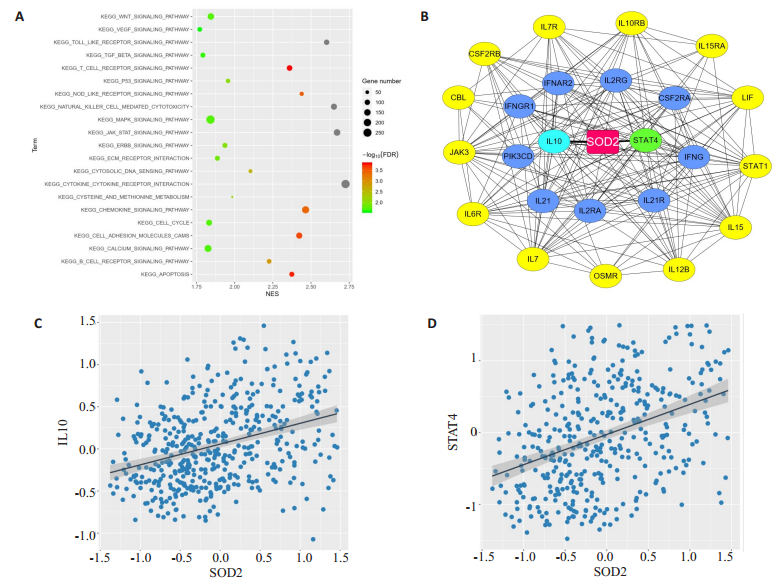
|
图 7 SOD2在JAK-STAT信号通路中蛋白互作网络 Fig.7 Protein-protein interaction network of target genes in JAK-STAT signaling pathway. A: Bubble diagram of KEGG enrichment analysis; B: PPI network of Hub genes; C: Pearson's correlation analysis between SOD2 and IL10 in BRCA data sets from TCGA; D: Pearson's correlation analysis between SOD2 and STAT4 in BRCA data sets from TCGA. |
SOD2在肿瘤进展过程中的作用已有数十年的研究并引起争议[14],SOD2作为肿瘤抑制因子或启动子的功能与其作为线粒体氧化剂调节剂的功能紧密相关[15],由于其在主要的细胞代谢中心清除有害的氧自由基而发挥细胞保护功能,因此传统上认为SOD2是一种肿瘤抑制因子[16-17]。Miar等[18]的研究报道,SOD2在前列腺癌、结肠癌及肺癌肿瘤中的表达比它们的正常组织相对应的降低,并且过表达SOD2在这几种肿瘤的裸鼠异种移植研究中显著延缓了肿瘤细胞的生长。SOD2表达的减少或丢失被认为是通过增加ROS介导的DNA损伤来影响细胞周期进程[19],以上研究提示SOD2表达缺失可能是肿瘤起始的一种表型。本研究利用从TCGA获得的高通量RNA测序数据,对SOD2在乳腺癌中的预后价值进行生物信息学分析。SOD2在乳腺癌肿瘤组织中的表达明显低于其在正常乳腺组织中的表达,在配对癌与癌旁组织的分析中得到了一致的结果,在SOD2与乳腺癌患者临床病理特征相关性分析中发现SOD2的表达与TNM分期和腋窝淋巴结转移状态呈显著负相关,提示SOD2的低表达与乳腺癌晚期临床病理特征(临床分期晚期和腋窝淋巴结转移)有关。
然而,有些研究报道在肿瘤的转移过程中,SOD2的表达会升高,比如在转移性肿瘤病变和高度侵袭性肿瘤系中SOD2高表达[5, 20-21]。研究表明,抗氧化酶表达的升高是肿瘤进展过程中必需的生存适应性,这使肿瘤细胞能够应对增加的细胞核细胞外氧化还原应激,SOD2的表达同样通过其作为氧自由基清除剂的典型作用为肿瘤细胞线粒体提供了保护[22]。Kaplan-Meier Plotter数据库包含了54 675个基因的10461个癌症样本的生存数据[23],其中包括3955个乳腺癌样本,可以进行乳腺癌有关基因的临床预后相关数据的分析。我们通过Kaplan-Meier Plotter数据库进行生存曲线分析结果显示乳腺癌组织SOD2高表达患者的无复发生存、无远处转移生存和后进展生存均低于低表达者,差异有显著性,在总生存的分析中SOD2高表达者也是低于低表达者,但未得到统计学差异。生存分析的结果显示SOD2高表达预后较差,与其在乳腺癌中的表达和临床相关性相矛盾。为了验证生存分析与SOD2表达的关系,我们收集了60例乳腺癌组织样本和与之相匹配的癌旁组织样本,通过qRT-PCR法检测SOD2 mRNA的相对表达,通过免疫组化检测SOD2蛋白水平的表达,所得出的结果比较一致,即SOD2无论mRNA水平还是蛋白水平,其在乳腺癌中的表达明显高于其在癌旁组织中的表达,与TCGA分析所得结果相反,但与生存分析的结果相一致。Kamara等[24]报道与原发肿瘤相比,人乳腺癌转移瘤中SOD2的表达升高,SOD2的表达与肿瘤的组织学分级有关,并参与癌细胞对凋亡的抵抗。他们认为SOD2在肿瘤的发生、发展过程中发挥双重调控作用,即早期肿瘤形成中作为肿瘤抑制因子和在转移进展中作为肿瘤促进剂的作用,细胞因子和转录因子在SOD2的调节中起主导作用。这可以解释TCGA数据库数据分析结果与我们临床样本数据分析的不一致性,可能其在东西方人群样本中存在差异。生存预后分析高表达患者预后较差又显示其为一促癌基因,正是其具有双重调控作用的体现。
为了进一步研究SOD2在乳腺癌中的功能及调控机制,我们利用TCGA数据进行了KEGG的基因集进行基因富集分析,富集分析发现,在乳腺癌中共有21个信号通路和功能在SOD2的高表达表型中有显著意义的富集,其中与肿瘤有关的有:细胞因子-细胞因子受体相互作用、JAK/STAT信号通路、凋亡、P53信号通路、自然杀伤细胞介导的细胞毒性和趋化因子信号通路等。Janus激酶/信号转导与转录激活子(JAK/STAT)信号通路是众多细胞因子信号转导的共同途径,广泛参与细胞增殖、分化、凋亡以及炎症等过程[25]。JAK/STAT通路的激活促进各种疾病的发生和发展,针对JAK/STAT信号通路的靶向治疗是目前的热点[26]。我们通过String在线网站针对筛选出的JAK/STAT信号通路中与SOD2相关的基因进行蛋白互作PPI网络构建,使用Cytoscape软件再次筛选出与SOD2具有直接互作关系的关键基因IL10和STAT4。通过CANCERTOOL在线网站,我们对SOD2/IL10及SOD2/STAT4的相关性进行了分析,分析结果显示SOD2与IL10及STAT4的皮尔逊相关系数均大于0.2,P值均小于0.01,二者呈正相关。IL-10,是一种人类细胞因子合成抑制因子,由178个氨基酸组成,以同源二聚体的形式发挥作用,在多种类型细胞中具有免疫抑制或者免疫刺激功能。IL10在肿瘤发生发展中发挥的作用至今仍存在较大的争议,一些研究表明IL10对肿瘤的生长和促进有积极的作用[27-28],但也有研究发现,IL10对肿瘤患者长期生存所必需的血管生成和转移有根除和抑制作用[29]。Ouyang等[30]提出IL10通过两种主要生物学活性对肿瘤发挥作用,一方面促进CD8T+细胞的增殖和活化,增强抗肿瘤能力,另一方面抑制促炎细胞因子的产生,从而抑制炎症引起的肿瘤生长。
综上所述,我们通过挖掘TCGA数据库,应用生物信息学技术推测SOD2可能作为潜在的诊断乳腺癌和预测其预后的肿瘤标记物,其内在的调控机制可能是通过调控IL10介导JAK-STAT信号通路影响乳腺癌细胞的增殖、侵袭和转移,尚需要进行一系列的实验来验证我们的预测结果,为乳腺癌的早期诊断和疗效评估提供新的靶点。
| [1] |
De Santis CE, Ma J, Gaudet MM, et al. Breast cancer statistics, 2019[J]. CA: A Cancer J Clin, 2019, 69(6): 438-51. DOI:10.3322/caac.21583 |
| [2] |
Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA: A Cancer J Clin, 2016, 66(2): 115-32. DOI:10.3322/caac.21338 |
| [3] |
Wang SY, Beeghly-Fadiel A, Cai QY, et al. Gene expression in triple-negative breast cancer in relation to survival[J]. Breast Cancer Res Treat, 2018, 171(1): 199-207. |
| [4] |
Li YJ, Fu JQ, Yuan X, et al. Simvastatin inhibits the proliferation of A549 lung cancer cells through oxidative stress and up-regulation of SOD2[J]. Pharmazie, 2014, 69(8): 610-4. |
| [5] |
Dhar SK, Tangpong J, Chaiswing L, et al. Manganese superoxide dismutase is a p53-regulated gene that switches cancers between early and advanced stages[J]. Cancer Res, 2011, 71(21): 6684-95. DOI:10.1158/0008-5472.CAN-11-1233 |
| [6] |
Chang BY, Yang H, Jiao Y, et al. SOD2 deregulation enhances migration, invasion and has poor prognosis in salivary adenoid cystic carcinoma[J]. Sci Rep, 2016, 6: 25918. DOI:10.1038/srep25918 |
| [7] |
Cui YJ, She KE, Tian DF, et al. miR-146a inhibits proliferation and enhances chemosensitivity in epithelial ovarian cancer via reduction of SOD2[J]. Oncol Res, 2016, 23(6): 275-82. |
| [8] |
Rabelo-Santos SH, Termini L, Boccardo E, et al. Strong SOD2 expression and HPV-16/18 positivity are independent events in cervical cancer[J]. Oncotarget, 2018, 9(31): 21630-40. DOI:10.18632/oncotarget.24850 |
| [9] |
He C, Danes JM, Hart PC, et al. SOD2 acetylation on lysine 68 promotes stem cell reprogramming in breast cancer[J]. Proc Nati Acad Sci USA, 2019, 116(47): 23534-41. DOI:10.1073/pnas.1902308116 |
| [10] |
Zuo J, Zhao M, Liu BW, et al. TNF-α-mediated upregulation of SOD-2 contributes to cell proliferation and cisplatin resistance in esophageal squamous cell carcinoma[J]. Oncol Rep, 2019, 42(4): 1497-506. |
| [11] |
Wang ZN, Jensen MA, Zenklusen JC. A practical guide to the cancer genome atlas (TCGA)[J]. Methods Mol Biol, 2016, 1418: 111-41. |
| [12] |
Subramanian A, Kuehn H, Gould J, et al. GSEA-P: a desktop application for Gene Set Enrichment Analysis[J]. Bioinformatics, 2007, 23(23): 3251-3. DOI:10.1093/bioinformatics/btm369 |
| [13] |
Cortazar AR, Torrano V, Martín-Martín N, et al. CANCERTOOL: a visualization and representation interface to exploit cancer datasets[J]. Cancer Res, 2018, 78(21): 6320-8. DOI:10.1158/0008-5472.CAN-18-1669 |
| [14] |
Kim YS, Gupta Vallur P, Phaëton R, et al. Insights into the dichotomous regulation of SOD2 in cancer[J]. Antioxidants (Basel), 2017, 6(4): E86. DOI:10.3390/antiox6040086 |
| [15] |
Huang Y, He T, Domann FE. Decreased expression of manganese superoxide dismutase in transformed cells is associated with increased cytosine methylation of the SOD2 gene[J]. DNA Cell Biol, 1999, 18(8): 643-52. DOI:10.1089/104454999315051 |
| [16] |
Murphy MP. How mitochondria produce reactive oxygen species[J]. Biochem J, 2009, 417(1): 1-13. |
| [17] |
Bravard A, Sabatier L, Hoffschir F, et al. SOD2: a new type of tumor-suppressor gene?[J]. Int J Cancer, 1992, 51(3): 476-80. |
| [18] |
Miar A, Hevia D, Muñoz-Cimadevilla H, et al. Manganese superoxide dismutase (SOD2/MnSOD)/catalase and SOD2/GPx1 ratios as biomarkers for tumor progression and metastasis in prostate, colon, and lung cancer[J]. Free Radic Biol Med, 2015, 85: 45-55. DOI:10.1016/j.freeradbiomed.2015.04.001 |
| [19] |
Sarsour EH, Kalen AL, Goswami PC. Manganese superoxide dismutase regulates a redox cycle within the cell cycle[J]. Antioxid Redox Signal, 2014, 20(10): 1618-27. DOI:10.1089/ars.2013.5303 |
| [20] |
Hempel N, Ye HQ, Abessi B, et al. Altered redox status accompanies progression to metastatic human bladder cancer[J]. Free Radic Biol Med, 2009, 46(1): 42-50. DOI:10.1016/j.freeradbiomed.2008.09.020 |
| [21] |
Hempel N, Carrico PM, Melendez JA. Manganese superoxide dismutase (Sod2) and redox-control of signaling events that drive metastasis[J]. Anticancer Agents Med Chem, 2011, 11(2): 191-201. DOI:10.2174/187152011795255911 |
| [22] |
Buchheit CL, Weigel KJ, Schafer ZT. Cancer cell survival during detachment from the ECM: multiple barriers to tumour progression[J]. Nat Rev Cancer, 2014, 14(9): 632-41. DOI:10.1038/nrc3789 |
| [23] |
李利, 张婷婷, 陈玉华, 等. 转录因子SOX12在肺腺癌中的表达及其与临床预后的关系[J]. 南方医科大学学报, 2019, 39(2): 186-91. |
| [24] |
Kamarajugadda S, Cai Q, Chen H, et al. Manganese superoxide dismutase promotes anoikis resistance and tumor metastasis[J]. Cell Death Dis, 2013, 4: e504. DOI:10.1038/cddis.2013.20 |
| [25] |
Trivedi S, Starz-Gaiano M. Drosophila Jak/STAT Signaling: Regulation and relevance in human cancer and metastasis[J]. Int J Mol Sci, 2018, 19(12): 4056. DOI:10.3390/ijms19124056 |
| [26] |
Hosford SR, Miller TW. Clinical potential of novel therapeutic targets in breast cancer: CDK4/6, SRC, JAK/STAT, PARP, HDAC, and PI3K/AKT/mTOR pathways[J]. Pharmgenomics Pers Med, 2014, 7: 203-15. |
| [27] |
Chen L, Shi YT, Zhu XJ, et al. IL-10 secreted by cancer-associated macrophages regulates proliferation and invasion in gastric cancer cells via c-Met/STAT3 signaling[J]. Oncol Rep, 2019, 42(2): 595-604. |
| [28] |
Bhattacharjee HK, Bansal VK, Nepal B, et al. Is Interleukin 10 (IL10) Expression in Breast Cancer a Marker of Poor Prognosis?[J]. Indian J Surg Oncol, 2016, 7(3): 320-25. DOI:10.1007/s13193-016-0512-6 |
| [29] |
Gulubova M, Aleksandrova E, Vlaykova T. Promoter polymorphisms in TGFB1 and IL10 genes influence tumor dendritic cells infiltration, development and prognosis of colorectal cancer[J]. J Gene Med, 2018, 20(2/3): e3005. DOI:10.1002/jgm.3005 |
| [30] |
Ouyang W, Rutz S, Crellin NK, et al. Regulation and functions of the IL-10 family of cytokines in inflammation and disease[J]. Annu Rev Immunol, 2011, 29: 71-109. DOI:10.1146/annurev-immunol-031210-101312 |
 2020, Vol. 40
2020, Vol. 40

