在我国,口腔癌是人类癌症疾病中最高发的肿瘤之一,舌癌又作为口腔癌中恶性程度最高的癌症性疾病之一[1-2]。近几十年来,舌癌的治疗大多运用手术、放疗等手段,但术后复发率高且毒副作用大[3-4]。所以寻找适合的药物治疗舌癌已成为科研界密切关注的问题。
和厚朴酚(HNK)是在中药厚朴中提取出的双酚类成分,其生物学活性和药理作用包括抗肿瘤、抗氧化、消炎等[5-7]。已有研究表明和厚朴酚可抑制结肠癌、鼻咽癌等癌细胞的生长,且曲莉等研究发现HNK可通过Pi3k/ Akt信号通路影响肿瘤细胞的增殖、侵袭和转移,但具体作用机制尚不明确[8-9]。目前尚未有人在舌癌细胞中研究和厚朴酚所起的作用,因此,本文将研究HNK体外对人舌鳞癌CAL-27细胞的影响及作用机制。
1 材料和方法 1.1 材料细胞:人舌鳞癌CAL-27细胞系购自中国科学院上海细胞库。
药品与试剂:HNK,纯度:>98%(批号:JZ15031502,南京景竹生物科技有限公司);噻唑蓝试剂盒(碧云天)。
仪器:酶标仪(Bio TeK);倒置荧光显微镜(Olympus);蛋白印迹系统(Bio-RAD)。
1.2 细胞培养人舌鳞癌CAL-27细胞用含10%血清、100 kU/L-1青霉素及100 μg/mL链霉素DMEM培养基,并放在含5% CO2、37 ℃的恒温箱内培养,待细胞长至皿底85%左右时进行常规传代或后续细胞实验。
1.3 分组与处置将CAL-27细胞分成4组:对照组细胞不加和厚朴酚。实验组细胞分别加入低、中、高浓度(20、40、60μmol/L)的HNK处理。
HNK配置方法:先用二甲基亚砜(DMSO)溶解至100 mmol/L,再用无血清培养基稀释到20、40、60 μmol/L。
1.3.1 MTT法检测细胞增殖抑制率细胞分组及处理同1.3,约5000/孔的浓度的CAL-27细胞接种至96孔板,贴壁后加入和厚朴酚培养液,24 h后加入10 μL MTT溶液且继续培养4 h,吸掉培养液并加入150 μL的DMSO,检测酶标仪490 nm处的吸光度值(A490 nm)。
生长抑制率(%)=(A对照组-A实验组)/A对照组×100%。
1.3.2 划痕实验观察细胞迁移能力细胞分组及处理同1.3,约5×105/孔的浓度的CAL-27细胞接种至6孔板,细胞均匀长满后用200 μL枪头进行均匀划痕,磷酸盐缓冲液(PBS)洗去划落的细胞,加入HNK培养液,24 h后用显微镜观察并拍照记录。
1.3.3 Hoechst33342染色法观察细胞凋亡形态细胞分组及处理同1.3,约1×105/孔的浓度的CAL-27细胞接种至6孔板,贴壁后加入HNK培养液,24 h后吸掉培养液,用PBS清洗3次后加入Hoechst33342染色剂且继续孵育30 min,吸掉液体后再用PBS清洗3次,荧光显微镜观察并记录。
1.3.4 流式细胞术检测细胞凋亡细胞分组及处理同1.3,约1×105/孔的浓度的CAL-27细胞接种至6孔板,贴壁后加入HNK培养液,24 h后用不含乙二胺四乙酸(EDTA)胰酶消化细胞,离心并用流式缓冲液吹散细胞,再加入5 μL Annexin V-FITC和10 μL PI后避光室温处理15 min,流式细胞仪检测并记录。
1.3.5 免疫印迹法检测相关蛋白表达细胞分组及处理同1.3,约3×106/皿的浓度的CAL-27细胞接种至大皿(直径为10 cm),经HNK处理24 h后,用细胞刮刀收集各组细胞并提取总蛋白,定量、制样及制胶后进行电泳、转膜及封闭,孵育一抗和二抗后用化学发光试剂(ECL)显影并记录。
1.4 统计学处理SPSS21.0软件进行统计学分析,用均数±标准差表示,两组间比较使用t检验,多组间比较用使单因素方差分析,P < 0.05为差异有统计学意义。
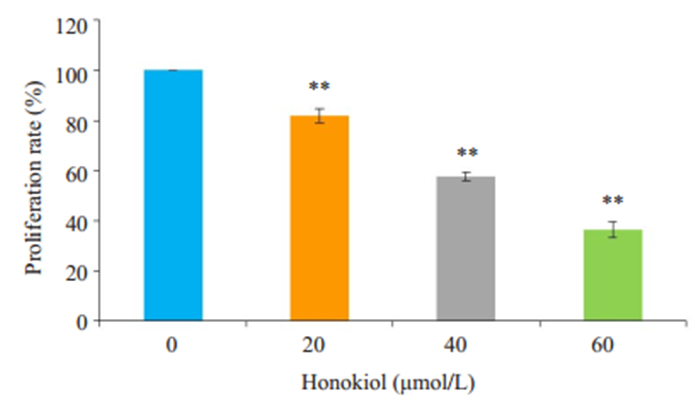
2 结果 2.1 HNK对CAL-27细胞的增殖抑制作用与对照组相比,经不同浓度HNK处理CAL-27细胞24 h后,细胞增殖能力均明显受到抑制,且随HNK浓度增加受到抑制的效果更加显著(P < 0.01,图 1)。
|
图 1 HNK对CAL-27细胞增殖的抑制作用 Fig.1 Inhibitory effect of HNK on proliferation of CAL-27 cells. **P < 0.01 vs the control group |
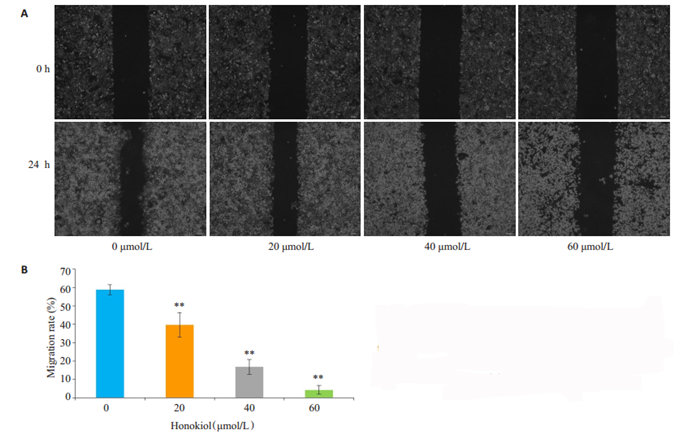
经统一划痕和不同剂量的HNK处理24 h后,分析两个时间点下细胞的迁移面积。与对照组相比,实验组的细胞划痕愈合能力明显减弱,划痕面积愈合百分比明显减少,迁移能力明显下降,且随着HNK浓度增加抑制细胞迁移的作用更加明显(图 2A、B,P < 0.01)。
|
图 2 HNK作用CAL-27细胞24 h后对迁移能力的影响 Fig.2 Migration ability of CAL-27 cells after 24 h of treatment with HNK using a scratch test (Original magnification: × 40) (A) and Statistical analysis of cell migration rate(B). **P < 0.01 vs the control group |
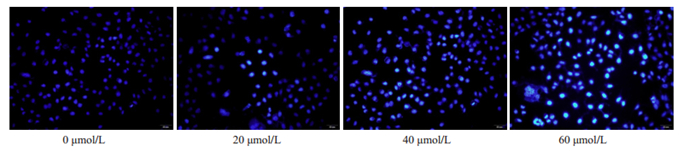
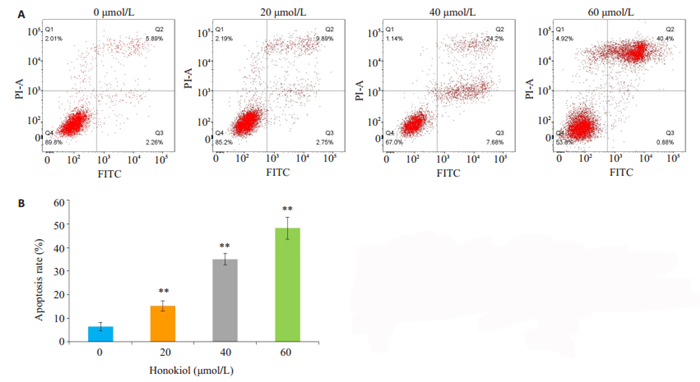
经Hoechst33342染料染色后,用荧光显微镜观察对照组细胞形态规则且胞核呈暗蓝光;经低、中、高3个剂量的HNK处理24 h后,数目减少、核固缩且胞核呈亮蓝光。与对照组比较随HNK浓度增加CAL-27细胞凋亡率显著增加(图 3、4A、4B,P < 0.01)。
|
图 3 荧光显微镜观察HNK作用CAL-27细胞24 h后细胞形态学影响 Fig.3 Effect of HNK on nuclear morphology of CAL-27 cells observed with fluorescence microscopy (×200) |
|
图 4 HNK对CAL-27细胞凋亡率的影响 Fig.4 Effect of the HNK on apoptosis rate of CAL-27 cells using flow cytometry to detected cell apoptosis (A) and Statistical analysis of cell apoptosis rate(B). **P < 0.01 vs the control group |
与对照组比较经不同浓度HNK处理24 h后,p-Pi3k、p-Akt蛋白表达量明显减少(P < 0.05),且Akt蛋白表达量基本不变(图 5A、B,P>0.05)。
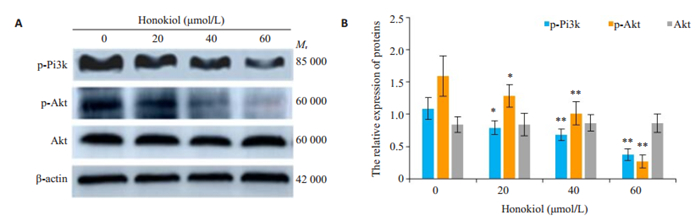
|
图 5 CAL-27细胞p-Pi3k、p-Akt、Akt蛋白的表达 Fig.5 Expression of p-Pi3k, p-Akt, Akt proteins of CAL-27 cells by Western blot (A) and statistical analysis of p-Pi3k, p-Akt and Akt protein expressions in CAL-27 cells. β-actin was used as a blank control (B). **P < 0.05 and P > 0.05 vs the control group |
与对照组比较经不同浓度HNK处理24 h后,p-Fak蛋白表达量明显下降(P < 0.01),而Fak蛋白表达量无明显变化(图 6A、B,P>0.05)。
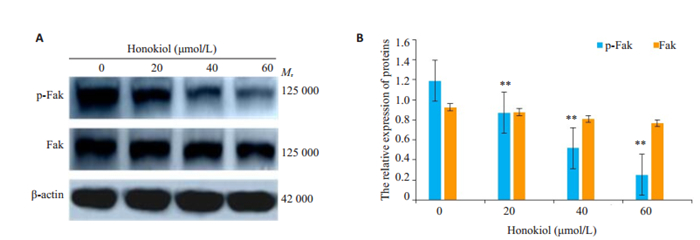
|
图 6 HNK对CAL-27细胞p-Fak、Fak蛋白的表达的影响 Fig.6 Expression of p-Fak、Fak proteins of CAL-27 cells by Western blot (A) and statistical analysis (B). β-actin was used as a blank control. **P < 0.01 vs the control group |
与对照组比较经不同浓度和厚朴酚处理24 h后,MMP2和MMP9蛋白表达量明显下降(图 7A、B,P < 0.05)。
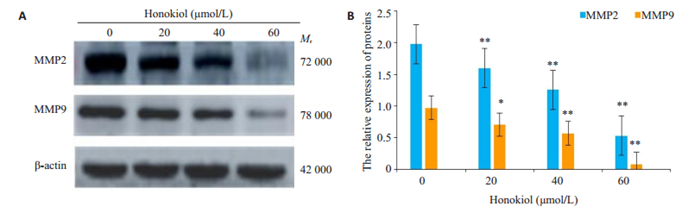
|
图 7 CAL-27细胞MMP2、MMP9蛋白的表达 Fig.7 Expression of MMP2、MMP9 proteins of CAL-27 cells by Western blot (A) and statistical analysis (B). β-actin was used as a blank control. *P < 0.05, **P < 0.01 vs the control group |
与对照组比较经不同浓度和厚朴酚处理24 h后,Bcl-2蛋白表达量明显降低而Bax和Cleaved-Caspase-3蛋白表达量明显升高(图 8A、B,P < 0.01),呈一定的浓度依赖性。
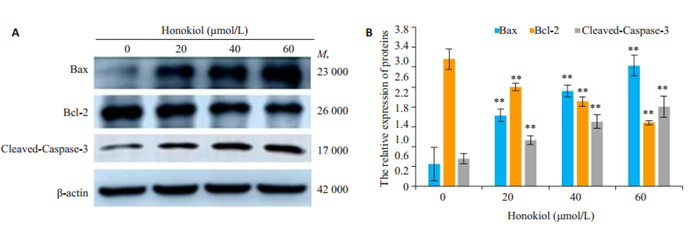
|
图 8 CAL-27细胞Bax、Bcl-2、Cleaved-Caspase-3蛋白的表达 Fig.8 Expression of Bax、Bcl-2、Cleaved-Caspase-3 proteins of CAL-27 cells by Western blot (A) and statistical analysis (B). β-actin was used as a blank control. **P < 0.01 vs the control group |
舌鳞状细胞癌是口腔癌中的一种顽固且浸润性强的癌症,它的发病率逐渐增加且更加年轻化[10-12],常规的手术治疗可发生远处转移[13]。但近年来,中药单体成分在抗肿瘤领域中的研究逐渐上升,和厚朴酚价格低廉且功效好[14-15]。并且有研究表明,HNK有多种药理作用,并能起到抑制肺癌、卵巢癌等多种肿瘤细胞的作用[16-17],但是否能起到抑制舌癌CAL-27细胞生长的作用尚不清楚。
本实验用MTT法观察HNK对人舌鳞癌CAL-27细胞的影响,检测结果发现,HNK能明显抑制舌癌CAL-27细胞体外增殖,且随HNK浓度增加而抑制作用增强,提示HNK有明显的抗舌癌细胞作用。进而采用划痕实验观察了舌癌细胞的迁移情况,随着HNK浓度的上升迁移能力明显下降。又用Hoechst33342染色法和流式细胞术检测CAL-27细胞凋亡情况的结果发现,在倒置荧光显微镜下观察到对照组细胞形态正常,细胞核完整,染色质均匀;实验组细胞形态不规则,核膜消失,染色质皱缩,胞核碎裂呈亮蓝色,且随着HNK浓度的增加细胞核越来越亮,与HNK在神经胶质瘤细胞中所起到效果相同[18]。
Pi3k/Akt信号通路在细胞增殖过程中起正调控作用[19]。在骨肉瘤细胞中,HNK可激活Bax、Cleaved-Caspase-3和PARP的蛋白表达并抑制Bcl-2的蛋白表达来抑制骨肉瘤细胞生长[20]。另有研究表明,抑制Pi3k/Akt通路也可抑制肿瘤细胞增殖并诱导其凋亡[21]。因此,我们采用Western blot蛋白印迹法检测了Pi3k/ Akt通路及凋亡相关蛋白在舌癌细胞中的表达情况,Cleaved-Caspase-3细胞凋亡中扮演重要角色,其活化后可使线粒体外膜通透性增加,从而导致细胞程序性死亡[22-24]。经HNK处理24 h后CAL-27细胞中p-Pi3k、p-Akt、Bcl-2蛋白表达量减少且Bax和Cleaved-Caspase-3蛋白表达量增加,且与HNK呈一定的浓度依赖关系,与上述文献的结果一致,进一步证明了HNK的抗舌癌细胞作用。
局部粘着斑激酶Fak是一种与细胞生长及迁移密切相关的蛋白酪氨酸激酶,大量研究表明Fak在多种肿瘤细胞中存在高表达的现象,因此抑制Fak的活化可能成为治疗肿瘤细胞潜在的新靶点[25-28]。Pi3k/Akt通路在肿瘤细胞迁移过程中也起到重要的调控作用,其下游的MMP2和MMP9也是细胞迁移过程中具有重要作用的蛋白酶,可以被上述通路激活从而增强肿瘤细胞的迁移作用[29-31]。因此我们同样采用Western blot蛋白印迹法检测了经HNK处理24 h后CAL-27细胞中迁移相关蛋白Fak、MMP2和MMP9表达情况,结果显示随着HNK浓度的增加p-Fak蛋白表达量显著下降而Fak蛋白表达量基本不变,MMP2和MMP9蛋白表达量明显减少,这与其它已报道文献中抑制肿瘤迁移现象结果相同[32-34]。
综上所述,HNK抑制舌癌CAL-27细胞体外增殖、迁移和诱导CAL-27细胞凋亡可能是通过调控Bcl-2、Bax、Cleaved-Caspase-3和p-Fak的蛋白表达量来实现的。本研究为临床开发中药治疗舌癌提供了实验依据。后续将进行体内试验研究,并探讨HNK抑制舌癌细胞的具体分子机制。
| [1] |
朱红, 寿卫东, 周扬, 等. 1267例南京及周边地区口腔恶性肿瘤统计分析[J]. 口腔医学, 2015, 35(12): 1064-8. |
| [2] |
Zhang J. Effect of adriamycin combined with metformin on biological function of human tongue cancer SSC-15 cells[J]. Oncol Lett, 2019, 17(6): 5674-80. |
| [3] |
Nur SZ, Bernard KBL, Zheng WW, et al. Effects of palbociclib on oral squamous cell carinoma and the role of PIK3CA in conferring resistance[J]. Cancer Biol Med, 2019, 16(02): 264-75. DOI:10.20892/j.issn.2095-3941.2018.0257 |
| [4] |
孙小雅, 严汉兴, 贺莎, 等. 舌癌多种治疗方式的临床疗效比较[J]. 中南医学科学杂志, 2018, 46(1): 16-9. |
| [5] |
Gaurav K, Satish R, Dharmalingam S, et al. Honokiol induces cytotoxic and cytostatic effects in malignant melanoma cancer cells[J]. Am J Surg, 2012, 204(6): 868-73. DOI:10.1016/j.amjsurg.2012.09.001 |
| [6] |
Rauf A, Patel S, Imran M, et al. Honokiol: An anticancer lignan[J]. Biomed Pharmcother, 2018, 107(11): 555-62. |
| [7] |
Sarrica A, Kirika N, Romeo M, et al. Safety and Toxicology of Magnolol and Honokiol[J]. Planta Med, 2018, 84(16): 1151-64. DOI:10.1055/a-0642-1966 |
| [8] |
Liu RX, Ren WY, Ma Y, et al. BMP7 mediates the anticancer effect of honokiol by up regulating p53 in HCT116 cells[J]. Int J Oncol, 2017, 51(3): 907-17. DOI:10.3892/ijo.2017.4078 |
| [9] |
曲莉, 张蕊. 和厚朴酚对鼻咽癌细胞株的增殖、迁移与侵袭能力的影响及机制[J]. 临床耳鼻咽喉头颈外科杂志, 2017, 31(2): 88-90. |
| [10] |
Zhang H, Liu J, Fu X, et al. Identi fi cation of Key Genes and Pathways in Tongue Squamous Cell Carcinoma Using Bioinformatics Analysis[J]. Med Sci Monit, 2017, 14(23): 5924-32. |
| [11] |
Jeon JH, Kim MG, Park JY, et al. Analysis of the outcome of young age tongue squamous cell carcinoma[J]. Maxillofac Plast Reconstr Surg, 2017, 39(1): 41-7. |
| [12] |
史毅, 吴伟忠, 霍安. 补骨脂乙素对Tca8113细胞迁移及侵袭的抑制作用及其机制[J]. 中国药理学通报, 2015, 31(12): 1741-5. DOI:10.3969/j.issn.1001-1978.2015.12.022 |
| [13] |
董文杰, 孙越, 张思扬. 早期舌癌复发的相关因素及预防措施[J]. 实用癌症杂志, 2015, 30(11): 1729-31. DOI:10.3969/j.issn.1001-5930.2015.11.044 |
| [14] |
Yan Z, Lai Z, Lin J. Anticancer Properties of Traditional Chinese Medicine[J]. Comb Chen High T Scr, 2017, 20(5): 423-9. |
| [15] |
Pan J, Lee Y, Wang Y, et al. Honokiol targets mitochondria to halt cancer progression and metastasis[J]. Mol Nutr Food Res, 2016, 60(6): 1383-95. DOI:10.1002/mnfr.201501007 |
| [16] |
Lee JS, Sul JY, Park JB, et al. Honokiol induces apoptosis and suppresses migration and invasion of ovarian carcinoma cells via AMPK/mTOR signaling pathway[J]. Int J Mol Med, 2019, 43(5): 1969-78. |
| [17] |
Cen M, Yao Y, Cui L, et al. Honokiol induces apoptosis of lung squamous cell carcinoma by targeting FGF2-FGFR1 autocrine loop[J]. Cancer Med, 2018, 7(12): 6205-18. DOI:10.1002/cam4.1846 |
| [18] |
Guo YB, Bao XJ, Xu SB, et al. Honokiol induces cell cycle arrest and apoptosis via p53 activation in H4 human neuroglioma cells[J]. Int J Clin Exp Med, 2015, 8(5): 7168-75. |
| [19] |
黄锐, 陈琦. PI3K/Akt信号转导通路对肿瘤的影响[J]. 医学理论与实践, 2016, 29(19): 3324-7. |
| [20] |
Yang J, Zou Y, Jiang D. Honokiol suppresses proliferation and induces apoptosis via regulation of the miR-21/PTEN/PI3K/AKT signaling pathway in human osteosarcoma cells[J]. Int J Mol Med, 2018, 41(4): 1845-54. |
| [21] |
Zhu X, Song X, Xie K, et al. Osthole induces apoptosis and suppresses proliferation via the PI3K/Akt pathway in intrahepatic cholangiocarcinomal[J]. Int J Mol Med, 2017, 40(4): 1143-51. DOI:10.3892/ijmm.2017.3113 |
| [22] |
吴柯, 薛莱, 韩萍. 和厚朴酚对人结肠癌细胞及Wnt信号通路的影响及调控作用[J]. 检验医学与临床, 2019, 16(12): 1643-5. DOI:10.3969/j.issn.1672-9455.2019.12.004 |
| [23] |
Kalkavan H, Green D R. MOMP, cell suicide as a BCL-2 family business[J]. Cell Death Differ, 2018, 25(1): 46-55. DOI:10.1038/cdd.2017.179 |
| [24] |
Ren L, Cao Q X, Zhai F R, et al. Asiatic acid exerts anticancerpotential in human ovarian cancer cells via suppression of PI3K/Akt/mTOR signalling[J]. Pharm Biol, 2016, 54(11): 2377-82. DOI:10.3109/13880209.2016.1156709 |
| [25] |
Zheng D, Duan H, Wang S, et al. FAK regulates epithelial-mesenchymal transition in adenomyosis[J]. Mol Med Rep, 2018, 18(6): 5461-72. |
| [26] |
Iqbal J, Abbasi BA, Ahmad R, et al. Ursolic acid a promising candidate in the therapeutics of breast cancer: Current status and future implications[J]. Biomed Pharmacother, 2018, 108: 752-6. DOI:10.1016/j.biopha.2018.09.096 |
| [27] |
Anandani C, Metgud R, Ramesh G, et al. Awareness of general dental practitioners about oral screening and biopsy procedures in Udaipur, India[J]. Oral Health Prev Dent, 2015, 13(6): 523-30. |
| [28] |
刘宁宁, 冯蓓, 段伟, 等. RNA干扰黏着斑激酶表达对宫颈癌细胞增殖、侵袭、迁移能力、细胞凋亡及Caspase-3相对表达量的影响[J]. 广西医学, 2019, 41(10): 1268-71. |
| [29] |
Chai R, Fu H, Zheng Z, et al. Resveratrol inhibits proliferation and migration through SIRT1 mediated post-translational modification of PI3K/AKT signaling in hepatocellular carcinoma cells[J]. Mol Med Rep, 2017, 16(6): 8037-44. DOI:10.3892/mmr.2017.7612 |
| [30] |
Zeng YF, Xiao YS, Liu Y, et al. Formin-like 3 regulates RhoC/FAK pathway and actin assembly to promote cell invasion in colorectal carcinoma[J]. World J Gastroenterol, 2018, 24(34): 3884-97. DOI:10.3748/wjg.v24.i34.3884 |
| [31] |
Wen X, Wang N, Zhang F, et al. Overexpression of SCARA5 inhibits tumor proliferation and invasion in osteosarcoma via suppression of the FAK signaling pathway[J]. Mol Med Rep, 2016, 13(3): 2885-91. DOI:10.3892/mmr.2016.4857 |
| [32] |
Allen K, Farah C. Screening and referral of oral mucosal pathology: a check-up of Australian dentists[J]. Aust Dent, 2015, 60(1): 52-8. DOI:10.1111/adj.12261 |
| [33] |
Wang EM, Fan QL, Yue Y, et al. Ursolic Acid Attenuates High Glucose-Mediated Mesangial Cell Injury by Inhibiting the Phosphatidylinositol 3-Kinase/Akt/Mammalian Target of Rapamycin (PI3K/Akt/mTOR) Signaling Pathway[J]. Med Sci Monit, 2018, 24: 846-54. DOI:10.12659/MSM.907814 |
| [34] |
Song XL, Ju RJ, Xiao Y, et al. Application of multifunctional targeting epirubicin liposomes in the treatment of non-small-cell lung cancer[J]. Int J Nanomedicine, 2017, 12: 7433-51. DOI:10.2147/IJN.S141787 |
 2020, Vol. 40
2020, Vol. 40

