2. 儿童发育疾病研究教育部重点实验室//国家儿童健康与疾病临床医学 研究中心//儿童发育重大疾病国家国际科技合作基地//儿科学重庆市重点实验室,重庆 400014
2. Ministry of Education Key Laboratory of Child Development and Disorders/National Clinical Research Center for Child Health and Disorders/China International Science and Technology Cooperation Base of Child Development and Critical Disorders/Chongqing Key Laboratory of Pediatrics, Chongqing 400014, China
邻苯二甲酸二丁酯(DBP)是一类广泛使用的增塑剂,被广泛应用于食品包装、医疗器械等各种塑料制品中,是一类重要的全球性有机污染物[1]。一旦进入生态系统中,将随饮水、食物摄入、和空气吸入等途径进入人体。其中婴幼儿和儿童的暴露途径更为多样化[2],包括母乳喂养、婴儿护理产品和塑料玩具的广泛使用等。研究表明,DBP具有雌激素效应,是一种环境内分泌干扰物[1]。婴幼儿处于发育的关键期,DBP对婴幼儿的污染风险不容忽视。大量研究表明DBP具有胚胎发育、生殖毒性以及内分泌干扰效应[3-4]。而近年来DBP对未成熟脑的神经毒性也受到越来越多的重视。DBP神经毒的机制研究非常广泛,本研究有别于传统的围绕DBP的拟雌激素特性的作用,针对新生儿中枢神经系统发育过程中的最先出现的部位和细胞,探索DBP神经毒性的关键环节。本课题组前期[2, 5]通过动物实验模型已经发现DBP围生期染毒后可引起子代大鼠认知功能障碍、脑电节律慢化、海马神经细胞凋亡等神经毒性,且可导致子代大鼠海马神经细胞ERβ、BDNF表达降低,推测DBP可能通过雌激素信号通路导致了海马神经细胞结构和功能损害,从而导致子代大鼠认知功能障碍。为进一步探索DBP神经毒性的可能分子机制,本研究通过体外培养原代大鼠海马神经元,模拟系统性调控的体内模型,深入研究DBP对原代培养的海马细胞结构和功能的损伤,并探索DBP是否通过GABA参与的ERs-BDNF-NPY雌激素信号通路发挥其神经毒性作用,为有效规避DBP的神经毒性提供重要的实验基础。
1 材料和方法 1.1 实验材料 1.1.1 实验动物实验采用无特定病原体级孕18 d SD大鼠,实验所用SD大鼠均购自重庆医科大学实验动物中心,许可证号:SCXK(渝)2017-0012,置于SPF级动物实验室饲养。12 h光亮/黑暗条件。在动物饲养和实验过程中,符合作者所在单位实验动物伦理委员会所制定的伦理学标准。
1.1.2 主要试剂DBP(Sigma- Aldrich,纯度99.0%),DMEM/F12培养基(Hyclone SH30023.01B),Neurobasal培养基(Gibco),B27培养基添加剂(Gibco),L-谷氨酰胺(Sigma),澳洲胎牛血清(Life),EDTA-胰蛋白酶(Gibco),小鼠抗大鼠NF200Millipore,Cell Counting Kit 8(日本同仁CK04)。ERβ兔多克隆抗体(Abcam),BDNF兔多克隆抗体(Abcam),NPY兔多克隆抗体(Abcam),PVDF膜(Millipore),BCA法蛋白定量试剂盒(Thermo scientific),超敏ECL化学发光试剂盒(BioRad)。细胞外液:NaCl 140(mmol/L),KCl 5(mmol/L),CaCl2 1.8(mmol/L),MgCl2·6H2O 1(mmol/L),HEPES 10(mmol/L),D-Glucose 10(mmol/L)。电极内液:KCl 130(mmol/L),MgCl22(mmol/L),HEPES 10(mmol/L),EGTA10(mmol/L),ATPNa2 5(mmol/L)。
1.2 方法 1.2.1 胎鼠海马神经元的体外分离培养及鉴定(1)将爬片放于六孔板内,生物安全柜中紫外灯照射30 min后,用多聚赖氨酸包被后在生物安全柜中风干。孕18 d SD大鼠,通过腹腔内注射10%水合氯醛进行麻醉,解剖取出胎鼠,在冰水混合物中洗涤1次,将胎鼠断头快速取出脑组织并将其放入含有预冷的DMEM/F12的玻璃培养皿中,剥出海马组织,剥离脑膜和血管,加入0.5% EDTA-胰酶消化10 min后加入血清停止消化,细胞筛网过滤,800 r/min、4 ℃下离心10 min。离心后,弃去上清液,加入4 mL种植培养基,重悬,并将20 μL重悬液吸入细胞计数板,通过Count Star细胞计数器计数后接种在含有细胞爬片的六孔板中,接种密度为(5~10)×105/孔,放置于37 ℃、5% CO2孵箱。4 h后全量换液。神经元生长培养基以后每3.5 d量换液1次。将细胞培养至第10天以进行免疫荧光鉴定。(2)免疫荧光鉴定胎鼠海马原代神经元:取培养至10 d的正常神经元细胞爬片,用神经元神经丝蛋白(NF)200抗体结合山羊抗兔CY3行免疫荧光鉴定。
1.2.2 药物浓度筛选海马神经元原代培养4 d后将海马神经元暴露在含有终浓度为0(对照)、0.1、1、10 g/L DBP的培养基中,置入含有5% CO2的37 ℃恒温培养箱中培养96 h,光镜下观察神经元的形态,选取合适的浓度以备后续研究,染毒选取24、48、96 h 3个时间点,探索DBP对神经元成熟的毒性作用。
1.2.3 DBP染毒后海马神经元轴突变化海马神经元原代培养至第4天时,将DBP染毒96 h组和同时间点正常对照组,用NF200抗体进行免疫荧光检测神经元轴突,NIS-viewer软件进行轴突长度测量。
1.2.4 透射电子显微镜观察海马神经元超微结构海马神经元原代培养至第4天时,将DBP染毒96 h组和同时间点正常对照组,去除培养基,收集细胞于离心管中,加入戊二醛固定,染色,透射电镜观察神经元超微结构。
1.2.5 膜片钳技术记录海马神经元动作电位海马神经元原代培养至第4天时,将DBP染毒96 h组和同时间点正常对照组,去除培养基,置于细胞外液中,采用Muticlamp-700B膜片钳系统进行全细胞模式动作电位记录。用pCLAMP10.3软件分析动作电位发放频率。
1.2.6 CCK-8检测海马神经元的活性在包被过的96孔板中接种100 μL的单细胞悬液,4 h后培养基全量换为无血清培养基,每3 d无血清培养基半量换液,在培养箱中培养细胞至第4天时向培养板中加入DBP,分别于染毒后24、48、96 h后,向每孔加入10 μL CCK-8溶液,在培养箱中培养4 h,用酶标仪测定在波长450 nm的吸光度A450 nm。
1.2.7 Western blot测定海马神经元BDNF,NPY,ERβ表达用全蛋白提取试剂盒提取两组各时间点细胞蛋白,BCA法测定细胞蛋白浓度后行蛋白免疫印迹实验测定BDNF,NPY,ERβ蛋白表达水平,用ImageJ软件分析2组各时间点BDNF,NPY,ERβ级内参的灰度值,BDNF,NPY,ERβ水平分别用BDNF/β-actin,NPY/β-actin,ERβ /β-actin的比值表示。
1.2.8 高效液相色谱串联质谱检测神经递质GABA的释放取两组各时间点细胞样本,加入预冷的甲醇/乙腈/水,超声离心。采用Agilent 1290 Ifinity LC超高液相色谱系统进行分离,采用5500QTRAP质谱仪在负离子模式下进行质谱分析,采用Mulitiquant软件提取色谱峰面积及保留时间,进行神经递质GABA的测定。
1.3 统计学方法数据采用SPSS 17.0统计软件进行统计分析,数据以均数±标准差表示,两组比较采用LSD-t检验,多组间采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 原代培养胎鼠海马神经元的鉴定图 1A为神经元光镜图片,可见神经元之间的突起形成网状,胞体呈锥形和纺锤形,图 1B为神经元免疫荧光图片,在荧光显微镜下神经元被标记为红色,所有细胞核通过DAPI染色显示呈蓝色。在显微镜下90%以上的细胞是NF200阳性,以此证明培养的细胞是神经元。
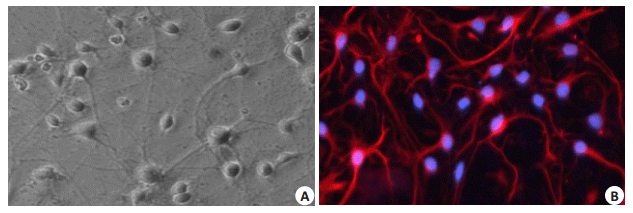
|
图 1 培养10 d海马神经元照片 Fig.1 Optical microscopy and immunofluorescence (red) images of the primary cultured hippocampal neurons (Original magnification: ×200). A: Under the light microscope (NF200-red fluorescence, DAPI-blue fluorescence); B: Under the fluorescence microscope. |
因海马神经元原代培养至4 d时生长迅速、增快,第8天时,细胞间形成致密的神经纤维网络,细胞发育成熟,故选取DBP染毒96 h,观察其形态及功能的改变,选取24、48、96 h 3个时间点探索DBP致其毒性的可能机制。
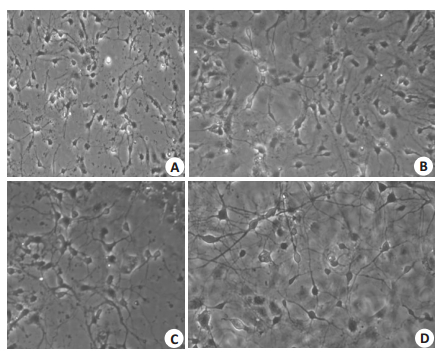
|
图 2 光镜下不同浓度DBP染毒96 h后各组神经元形态变化 Fig.2 Morphological changes of the neurons under optical microscope after DBP exposure for 96 h (×100). A: 10 g/L DBP group; B: 1 g/L DBP group; C: 0.1 g/L DBP group; D: Control group. |
海马神经元原代培养4 d后将海马神经元暴露在含有终浓度为0.0(对照)、0.1、1、10 g/L DBP的培养基中,染毒96 h后光镜下可以看出10 g/L组细胞出现大量死亡,可见细胞碎片,1 g/L组细胞胞体透亮度减低,轴突纤细、轴突间网络连接稀疏,0.1 g/L组细胞形态未发生明显改变与对照组基本相同。10 g/L组光镜下虽形态改变明显,但细胞大量死亡不利于后续机制的研究,而1 g/L组细胞死亡较少,且与正常对照组相比可见较明显的异常形态改变,故选取1 g/L组作为实验组进行后续毒性作用及毒性机制的研究。
2.3 神经元形态变化 2.3.1 免疫荧光检测神经元轴突长度DBP染毒处理神经元96 h组较正常对照组神经元轴突长度变短,两组间有显著差异(P < 0.01,图 3、表 1)。
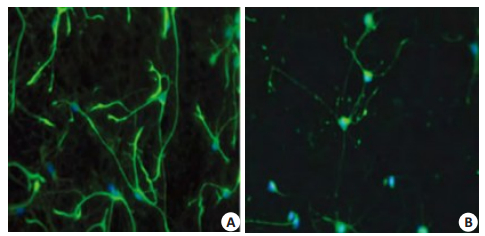
|
图 3 免疫荧光检测各自神经元轴突长度 Fig.3 Immunofluorescence detection of axonal length of the neurons in each group (×200). NF200: Green fluorescence; DAPI: Blue fluorescence. A: Normal control group; B: DBP exposure group. |
| 表 1 两组神经元轴突长度 Tab.1 Axonal length of neurons in the control and DBP-exposed groups (Mean±SD) |
正常组神经元核呈圆形,胞浆内线粒体粗面内质网核糖体等结构清晰(图 4A、C);DBP染毒组细胞核呈圆形,染色有聚集,细胞质内广泛空泡形成(图 4B、D),说明DBP可对神经元的超微结构产生损伤。
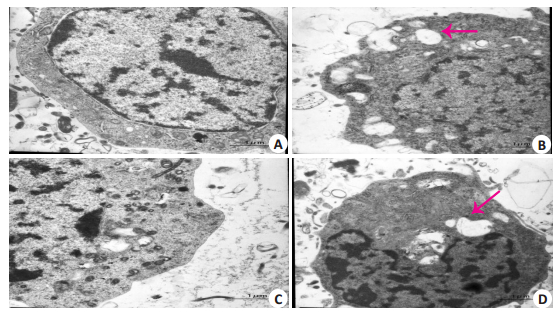
|
图 4 透射电子显微镜下两组神经元超微结构变化 Fig.4 Ultrastructural changes of the control and DBP-exposed neurons observed by TEM (× 12 000). A: Control group; B: DBP exposure group; C: Control group; D: DBP exposure group. Scale bar=1.0 μm. |
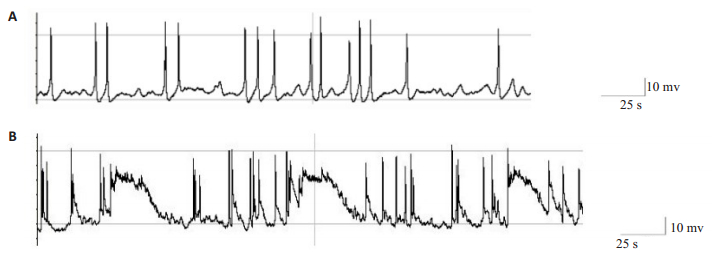
应用膜片钳技术记录神经元不同处理下动作电位频率情况,每组记录6个海马神经元细胞,图 5显示神经元的记录结果。于海马神经元原代培养至第4天时给药96 h后神经元放电频率4.35±0.95 Hz明显高于正常对照组神经元动作电位频率1.23±2.55 Hz(P < 0.01)。
|
图 5 膜片钳记录两组神经元动作电位结果 Fig.5 Action potential (AP) of the neurons recorded by patch- clamp electrophysiology. A: Some AP records of neurons in the normal control group; B: Some AP records of neurons in the DBP exposure group. |
原代海马神经元于培养至第4天时,给予DBP染毒24、48、96 h后,与同时间点正常对照组相比细胞活性均有所减低,具有统计学差异(表 2)。
| 表 2 DBP作用不同时间后海马神经元的细胞活力 Tab.2 Cell viability of neurons after exposure to DBP for different durations (Mean±SD) |
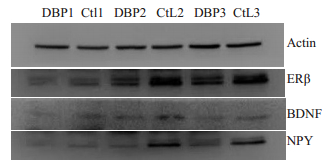
两组各时间点BDNF、NPY、ERβ蛋白结果:DBP染毒24、48、96 h ERβ蛋白表达显著低于对照组(P < 0.05),DBP染毒48、96 h后BDNF蛋白表达显著低于对照组(P < 0.05),DBP染毒48、96 h NPY蛋白表达显著低于对照组(P < 0.05,表 3)。
| 表 3 DBP作用不同时间后对海马神经元DBNF、NPY、ERβ蛋白表达的影响 Tab.3 Absorbance for expressions of BDNF, NPY and ERβ proteins in the hippocampal neurons after DBP exposure for different time (Mean±SD, n=6) |
由表 4可以看出DBP染毒24 h及48 h后神经递质GABA释放有所减低,但尚无统计学差异(P>0.05),染毒96 h后GABA的释放较对照组明显降低,且具有统计学差异(P < 0.05)。
| 表 4 DBP作用不同时间后海马神经元神经递质GABA表达量 Tab.4 GABA release from the hippocampal neurons after DBP exposure for different time (Mean±SD) |
|
图 6 DBP作用不同时间后对海马神经元BDNF、NPY、ERβ蛋白的表达 Fig.6 Expressions of BDNF, NPY and ERβ proteins in the hippocampal neurons after DBP exposure for different time. Ctl1: 24 h Control group; DBP1: DBP exposure for 24 h group; Ctl2: 48 h Control group; DBP2: DBP exposure for 48 h group; Ctl3: 96 h Control group; DBP3: DBP exposure for 96 h group. |
DBP作为一种常见的邻苯二甲酸酯类增塑剂,具有胚胎发育、生殖毒性以及内分泌干扰效应,对人类和动物产生重要危害。近年来大量研究证实[4-6]DBP污染还对发育期神经系统具有毒性作用,引起认知行为异常。课题组前期研究[5]采用DBP对大鼠孕期及哺乳期灌胃染毒,建立围生期DBP暴露体内模型,发现DBP可对子鼠的认知及脑功能产生损害,但其机制尚未明确。目前认为可能与内分泌干扰作用[7]、氧化应激损伤[8]、海马区神经细胞凋亡、突触结构与功能异常有关[9]。
神经元细胞体外培养[10-12]是研究神经元生长发育、形态功能的重要模型,在研究神经病学发病机制、神经生物学、药物应用等领域有广泛作用。海马是大脑边缘系统的重要组成部分,参与个体学习、记忆及情绪反应等多种功能,因此,海马神经元在高级神经功能中发挥着重要作用。本研究采用体外培养原代大鼠海马神经元作为研究模型,进一步深入研究DBP的神经毒性,并探索DBP的神经毒性机制,以期能为有效规避DBP的神经毒性提供重要的实验基础。
大量国外文献报道[13-15],孕18 d胎鼠的神经系统还未完全分化成熟,拥有大量神经干细胞,离体取材损伤小,较新生鼠海马神经元存活率高且阳性率更高,更利于DBP体外染毒模型的建立。因此,本研究选取孕18 d胎鼠的海马神经细胞体外培养作为研究模型。
本研究于海马神经元原代培养4 d后将海马神经元暴露在含有终浓度为0(对照)、0.1、1、10 g/L DBP的培养基中,染毒96 h后光镜下可以看出10 g/L组细胞出现大量死亡,可见大量细胞碎片,1 g/L组细胞突起连接减少,可见稀疏的神经网络,0.1 g/L组细胞形态未发生明显改变与对照组基本相同。因考虑到10 g/L组光镜下细胞大量死亡不利于后期毒性机制的研究,故选取1 g/L组作为实验组进行下一步毒性作用的探索。神经元的生长包括4个期[16-17],在4~8 d时生长迅速、增快,8 d后神经元已基本生长成熟处于平台期,故本研究于神经元培养至第4天给予DBP,选取染毒24、48、96 h 3个时间点,探索DBP对神经元发育的毒性作用。
本研究通过免疫荧光、透射电镜观察DBP对原代培养神经细胞结构的影响,并采用膜片钳观察DBP对神经细胞电活动的影响,以及通过cck-8检测DBP染毒后海马神经细胞活力的改变,从而探讨DBP对神经细胞功能的影响。
免疫荧光检测可以看出DBP染毒后可导致海马神经元突起网络稀疏,轴突长度变短。这可能是DBP作用于海马神经元,引起了海马神经元的病理性凋亡,从而导致细胞间突起连接减少,进而影响整个神经纤维网络。透射电镜下,染色有聚集,胞浆内出现空泡,可见DBP可对神经元的超微结构也造成损伤,Tanida的研究[9]及我们的前期研究均表明DBP灌胃染毒可以对海马各区神经细胞造成损害,诱导与学习记忆有关的功能障碍。结合本研究结果。我们认为DBP对海马神经元轴突及超微结构的损伤可能是DBP影响学习记忆及认知功能的结构基础。
DBP导致海马神经元轴突及超微结构的损害,是否进而导致神经元功能的损伤?神经细胞电活动及神经细胞活性是评估神经细胞功能的重要指标。因此本研究进一步通过膜片钳检查神经细胞电活动及cck-8检测神经细胞活性探讨DBP对海马神经功能的影响。因神经元原代培养至第8天时,细胞才发育趋于成熟,兴奋性才稳定,故本研究只对DBP染毒96 h组进行动作电位的测定。本研究通过膜片钳全细胞动作电位记录发现,DBP染毒后海马神经细胞放电频率较正常对照组增加。有研究发现[18-20]伤害性刺激可使大鼠脑区放电频率增加,这可能是因为神经元存在兴奋/抑制平衡,此类神经元始终接受GABA能神经元的调控,处于一种紧张性抑制之中[21],在伤害性刺激作用时,兴奋性突触传递效能增强,抑制性突触传递效能减弱。这在神经元的生理和病理过程中起着非常重要的作用[22-23]。本研究中DBP染毒组海马神经细胞放电频率增加,我们推测这是海马神经细胞对毒物刺激的损伤性反应。同样,DBP染毒后海马神经细胞还出现了去极化漂移,表明DBP染毒后神经细胞出现了异常放电,进一步表明DBP暴露可致海马神经元功能受损。
DBP对神经元造成损伤的另外一个途径是改变神经元的活性,进而造成神经元的损伤或病理学凋亡。有研究表明DBP可能通过内分泌干扰作用、氧化应激损伤[7]、神经递质系统紊乱等产生神经毒作用,本研究通过CCK-8试剂盒检测DBP作用不同时间后原代培养海马神经元的吸光度,结果显示两组各时间点染毒组细胞活性均较对照组降低,并且随着染毒时间的增加,活性降低更明显。课题组前期研究表明DBP可导致海马神经各区细胞出现线粒体空泡化,CCK-8试剂盒的检测原理[24-25]与细胞线粒体中的脱氢酶有关,所以进一步推测DBP对海马神经元的线粒体结构造成了损伤,导致海马神经元内的线粒体数目减少,细胞线粒体中的脱氢酶也减少,从而使其活性降低,推测神经元形态及功能的改变是DBP影响学习记忆及认知功能的病理生理基础。
DBP导致了海马神经元的结构和功能损伤,但其分子机制尚不明确。DBP是一种环境雌激素,可干扰脑内雌激素信号相关通道。已知雌激素具有脑保护作用,其受体与学习记忆密切相关。雌激素与ERβ结合后,可激活位于BDNF基因上的雌激素反应元件,增强BDNF基因的表达,进而又诱导NPY表达增加[26-27]。这提示脑内可能存在ERs-BDNF-NPY的级联反应。BNDF和NPY是具有广泛的神经营养及保护作用的物质,参与海马神经元的存活、突触形成等,对情绪、学习记忆等有明显的调控作用[28-29]。γ-氨基丁酸(GABA)是哺乳动物神经系统内主要的抑制性神经递质,许多研究证实,GABA参与了认知和学习记忆等生理活动[30-32],在神经系统的发育过程中GABA可影响神经元的迁移、增殖与分化[33],并且传统研究认为雌激素受体主要表达在GABAergic中间神经元,因此本研究从GABA参与的ERs-BDNF-NPY雌激素信号通路入手,进一步探讨DBP的神经毒性作用机制。
本课题组前期体内实验研究发现DBP围生期染毒后的21 d大鼠的ER-β表达与正常对照组比明显降低,提示DBP下调了幼年大鼠海马ER-β的表达,这与王亚民等[34]研究中发现双酚A围生期暴露抑制了ER-β的表达的结果一致。我们也发现DBP围生期染毒后,幼年大鼠海马的BDNF表达较正常对照组明显降低,提示DBP下调了海马BDNF的表达。故我们推测DBP围生期暴露主要通过降低血清睾酮水平,最终降低脑内源性雌激素合成,并抑制海马ER-β的表达,从而降低雌激素效应,继而下调了BDNF的表达,促进海马神经细胞的凋亡及抑制突触可塑性,导致学习记忆功能的下降,因此,我们推测DBP极有可能通过雌激素受体基因型途径和\或非基因型途径而发挥其毒性作用。
本研究发现DBP染毒24 h后对ERβ、BDNF、NPY蛋白的表达较对照组降低,但不具有统计学差异,这可能是因为DBP暴露时间较短,尚未对海马神经元蛋白水平的表达产生明显的影响。而染毒48 h组和96 h组蛋白水平表达较同时间点正常对照组下降,与课题组前期体内实验结果是一致的。但是Li等[35]研究发现高剂量的DBP暴露可增加雄性仔鼠海马区芳香化酶及早基因BDNF的表达,推测可能与BDNF的表达受到多种途径的调控,而这些调控作用的大小可能具有时间(仔鼠的天龄)特异性,并且体内体外DBP暴露浓度目前尚无明确的对应关系,实际上人群不可能暴露在如此高剂量的DBP,相反低剂量的DBP暴露的影响更具有现实意义,所以高浓度的DBP是否也会导致体外培养的原代海马神经元BDNF表达增加尚有待进一步的研究。我们还检测了3个时间点神经递质GABA的释放,发现DBP染毒24、48 h组GABA的释放较对照组无明显的降低,仅96 h组下降明显。表明DBP长时间染毒导致了神经递质GABA释放的减少。结合前期研究我们进一步推测,雌激素受体与NPY是共存于GABAergics神经细胞,在DBP染毒后,ERβ表达下降,雌激素信号减弱导致BDNF表达下降,低浓度的BDNF减弱了神经细胞兴奋反应及降低了NPY的表达,后续NPY的降低反馈作用于GABAergic中间神经元,致使其释放神经递质GABA减少以求增强兴奋反应,这也进一步解释了我们前期体外研究发现的DBP暴露后细胞活性降低,但是其兴奋性反而会增加。我们还发现DBP染毒24 h时ERβ、BDNF、NPY蛋白表达较对照组无明显的降低,推测可能是因为DBP染毒时间较短,此雌激素信号通路仍可保持生理平衡,这也是此时GABA释放较对照组无明显差异的原因,但是随着染毒时间的增加,生理平衡随即被打破,导致GABA参与的ERs-BDNF-NPY雌激素信号通路的破坏。
综上所述,本研究表明DBP导致了原代培养的海马神经细胞结构和功能的损伤,其神经毒性机制可能与GABA参与的ERs-BDNF-NPY雌激素信号通路受阻有关,这将有助于探索干预措施的深入研究。
| [1] |
Fan GT, Xie JC, Yoshino H, et al. Environmental conditions in homes with healthy and unhealthy schoolchildren in Beijing, China[J]. Build Environ, 2017, 112(8): 270-84. |
| [2] |
Li X, Jiang L, Cheng L, et al. Dibutyl phthalate-induced neurotoxicity in the brain of immature and mature rat offspring[J]. Brain Dev, 2014, 36(8): 653-60. DOI:10.1016/j.braindev.2013.09.002 |
| [3] |
Percy Z, Xu Y, Sucharew H, et al. Gestational exposure to phthalates and gender-related play behaviors in 8-year-old children: an observational study[J]. Environ Health, 2016, 15(1): 87. DOI:10.1186/s12940-016-0171-7 |
| [4] |
Kim JI, Hong YC, Shin CH, et al. The effects of maternal and children phthalate exposure on the neurocognitive function of 6-year-old children[J]. Environ Res, 2017, 156(7): 519-25. |
| [5] |
Li XJ, Jiang L, Chen L, et al. Neurotoxicity of dibutyl phthalate in brain development following perinatal exposure: a study in rats[J]. Environ Toxicol Pharmacol, 2013, 36(2): 392-402. DOI:10.1016/j.etap.2013.05.001 |
| [6] |
Jurewicz JK, Polanska W. Exposure to widespread environmental toxicants and children's cognitive development and behavioral problems[J]. Med Environ Health, 2013, 26(2): 185-204. |
| [7] |
Yan B, Guo J, Liu X, et al. Oxidative stress mediates dibutyl phthalateinduced anxiety-like behavior in Kunming mice[J]. Environ Toxicol Pharmacol, 2016, 45(7): 45-51. |
| [8] |
Fan X, Warner M, Gustafsson JA. Estrogen receptor beta expression in the embryonic brain regulates development of calretininimmunoreactive GABAergic interneurons[J]. Proc Natl Acad Sci USA, 2006, 103(51): 19338-43. DOI:10.1073/pnas.0609663103 |
| [9] |
Tanida T, Warita K, Ishihara K, et al. Fetal and neonatal exposure to three typical environmental chemicals with different mechanisms of action: mixed exposure to phenol, phthalate, and dioxin cancels the effects of sole exposure on mouse midbrain dopaminergic nuclei[J]. Toxicol Lett, 2009, 189(1): 40-7. |
| [10] |
Christian KM, Song H, Ming GL. Functions and dysfunctions of adult hippocampal neurogenesis[J]. Annu Rev Neurosci, 2014, 37(5): 243-62. |
| [11] |
Dragos, Cīrneci, Radu, et al. Learning tasks as a possible treatment for DNA lesions induced by oxidative stress in hippocampal neurons[J]. Neural Regeneration Res, 2013, 8(32): 3063-70. |
| [12] |
Fasick V, Spengler RN, Samankan S, et al. The hippocampus and TNF: Common links between chronic pain and depression[J]. Neurosci Biobehav Rev, 2015, 53(1): 139-59. |
| [13] |
Facci L, Skaper SD. Culture of rodent cortical, hippocampal, and striatal neurons[J]. Methods Mol Biol, 2018, 1727(10): 39-47. |
| [14] |
Kaech S, Banker G. Culturing hippocampal neurons[J]. Nat Protoc, 2006, 1(5): 2406-15. DOI:10.1038/nprot.2006.356 |
| [15] |
Viesselmann C, Ballweg J, Lumbard D, et al. Nucleofection and primary culture of embryonic mouse hippocampal and cortical neurons[J]. J Vis Exp, 2011, 24(47): 2373-82. |
| [16] |
Korkotian E, Botalova A, Odegova T, et al. Complex effects of aqueous extract of Melampyrum pratense and of its flavonoids on activity of primary cultured hippocampal neurons[J]. J Ethnopharmacol, 2015, 163(3): 220-8. |
| [17] |
Vergara-Castaneda V. Prolactin mediates neuroprotection against excitotoxicity in primary cell cultures of hippocampal neurons via its receptor[J]. Brain Res, 2016(5): 193-9. |
| [18] |
Accorsi-Mendonça D, Almado CE, Bonagamba LG, et al. Enhanced firing in NTS induced by Short-Term sustained hypoxia is modulated by Glia-Neuron interaction[J]. J Neurosci, 2015, 35(17): 6903-17. DOI:10.1523/JNEUROSCI.4598-14.2015 |
| [19] |
Sonekatsu M, Taniguchi W, Yamanaka M, et al. Interferon-gamma potentiates NMDA receptor signaling in spinal dorsal Horn neurons via microglia-neuron interaction[J]. Mol Pain, 2016, 12(4): 174-8. |
| [20] |
Takeda M, Nasu M, Kanazawa T, et al. Activation of GABA(B) receptors potentiates inward rectifying Potassium currents in satellite glial cells from rat trigeminal ganglia: in vivo patch-clamp analysis[J]. Neuroscience, 2015, 288(3): 51-8. |
| [21] |
Weiner JL, Valenzuela CF. Ethanol modulation of GABAergic transmission: the view from the slice[J]. Pharmacol Ther, 2006, 111(3): 533-54. DOI:10.1016/j.pharmthera.2005.11.002 |
| [22] |
Cullinan WE, Ziegler DR, Herman JP. Functional role of local GABAergic influences on the HPA axis[J]. Brain Struct Funct, 2008, 213(1/2): 63-72. |
| [23] |
Jacob TC, Moss SJ, Jurd R. GABA(A) receptor trafficking and its role in the dynamic modulation of neuronal inhibition[J]. Nat Rev Neurosci, 2008, 9(5): 331-43. DOI:10.1038/nrn2370 |
| [24] |
Kwakowsky A, Milne MR, Waldvogel HJ, et al. Effect of estradiol on neurotrophin receptors in basal forebrain cholinergic neurons: relevance for alzheimer's disease[J]. Int J Mol Sci, 2016, 17(12): 2122-6. DOI:10.3390/ijms17122122 |
| [25] |
Yan M, Zhu P, Liu HM, et al. Ethanol induced mitochondria injury and permeability transition pore opening: role of mitochondria in alcoholic liver disease[J]. World J Gastroenterol, 2007, 13(16): 2352-6. DOI:10.3748/wjg.v13.i16.2352 |
| [26] |
Malva JO, Xapelli S, Baptista S, et al. Multifaces of neuropeptide Y in the brain--neuroprotection, neurogenesis and neuroinflammation[J]. Neuropeptides, 2012, 46(6): 299-308. DOI:10.1016/j.npep.2012.09.001 |
| [27] |
Velíšková J, Iacobas D, Iacobas S, et al. Oestradiol regulates neuropeptide Y release and gene coupling with the GABAergic and glutamatergic synapses in the adult female rat dentate gyrus[J]. J Neuroendocrinol, 2015, 27(12): 911-20. DOI:10.1111/jne.12332 |
| [28] |
Andero R, Choi DC, Ressler KJ. BDNF-TrkB receptor regulation of distributed adult neural plasticity, memory formation, and psychiatric disorders[J]. Prog Mol Biol Transl Sci, 2014, 122(6): 169-92. |
| [29] |
Rangani RJ, Upadhya MA, Nakhate KT, et al. Nicotine evoked improvement in learning and memory is mediated through NPY Y1 receptors in rat model of Alzheimer's disease[J]. Peptides, 2012, 33(2): 317-28. |
| [30] |
Berlau DJ, Mcgaugh JL. Enhancement of extinction memory consolidation: the role of the noradrenergic and GABAergic systems within the basolateral amygdala[J]. Neurobiol Learn Mem, 2006, 86(2): 123-32. |
| [31] |
Farr SA, Uezu K, Creonte TA, et al. Modulation of memory processing in the cingulate cortex of mice[J]. Pharmacol Biochem Behav, 2000, 65(3): 363-8. DOI:10.1016/S0091-3057(99)00226-9 |
| [32] |
Shahidi S, Iraj S, et al. The role of GABAergic transmission in the dentate gyrus on acquisition, consolidation and retrieval of an inhibitory avoidance learning and memory task in the rat[J]. Brain Res, 2008(4): 87-93. |
| [33] |
Pelkey KA, Chittajallu R, Craig MT, et al. Hippocampal gabaergic inhibitory interneurons[J]. Physiol Rev, 2017, 97(4): 1619-747. DOI:10.1152/physrev.00007.2017 |
| [34] |
王亚民, 徐晓虹, 张婧, 等. 围产期母体染毒双酚A对雄性子代脑内雌激素β受体和芳香酶表达的影响[J]. 生物物理学报, 2009(6): 423-9. DOI:10.3321/j.issn:1000-6737.2009.06.005 |
| [35] |
Li Y, Zhuang M, Li T, et al. Neurobehavioral toxicity study of dibutyl phthalate on rats following in utero and lactational exposure[J]. J Appl Toxicol, 2009, 29(7): 603-11. DOI:10.1002/jat.1447 |
 2020, Vol. 40
2020, Vol. 40

