2. 中山大学孙逸仙纪念医院生物样本库,广东 广州 510120;
3. 南方医科大学 药学院,广东 广州 510515;
4. 南方医科大学珠江医院泌尿外科,广东 广州 510028
2. Department of Biobank, Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou 510120, China;
3. College of Pharmacy, Southern Medical University, Guangzhou 510515, China;
4. Department of Urology, Zhujiang Hospital, Southern Medical University, Guangzhou 510028, China
肾脏为人体重要的排泄器官,肾间质纤维化(RIF)是所有慢性肾病中最常见的病理表现,为所有慢性肾脏疾病的最后阶段,最终不可避免地导致肾功能衰竭和死亡[1]。RIF的主要生物学事件是细胞外基质合成增加和大量积聚,其常由肾小管上皮细胞向间充质细胞转分化(EMT)所致[2]。在RIF进程中EMT的发生、发展受到TGF-β/Smad[3]、P38MAPK[4-5]和wnt4/β-catenin[6-7]等多种细胞内信号转导通路的调控。KIF3A是驱动蛋白(KIF)2家族的一个重要成员,可调节细胞内运输,介导微管运动。有报道称在肾胚胎发育过程中,肾间充质干细胞中缺乏KIF3A导致肾单位数量减少[8],而肾小管上皮细胞中缺乏KIF3A则导致肾囊肿形成并进展至肾衰竭[9-12]。然而KIF3A是否参与RIF及EMT未见报道。故本研究构建单侧输尿管梗阻小鼠模型(UUO小鼠)[13],以及利用TGF-β1诱导肾小管细胞系NRK-52E转分化,在体内和体外研究KIF3A在肾纤维化发生前后的表达变化,并初步探讨KIF3A在EMT和RIF中的可能作用及机制。
1 材料和方法 1.1 细胞NRK-52E为本实验室保存,培养于含10%胎牛血清的DMEM培养基中,细胞消化用0.25%胰蛋白酶-0.02% EDTA工作液处理。
1.2 动物3月龄SPF级C57BL/6J小鼠24只,体质量20~24 g,购于南方医科大学实验动物中心,实验动物使用许可证号为SYXK粤2006-0015。
1.3 主要药品TGF-β1、苏木素和伊红染液(Sigma- Aldrich);α-SMA抗体、KIF3A抗体、辣根过氧化物酶(HRP)标记的山羊抗兔、山羊抗鼠(Alclonal);GAPDH抗体(锐抗);E-cadherin抗体(Cell Signaling Technology);荧光相对定量PCR引物为擎科生物公司合成;mRNA反转录和Q-PCR试剂盒(Takara);天狼星红染色试剂盒(雷根生物);Masson染色试剂盒(南京建成)。
1.4 造模方法动物适应饲养1周后,随机分为假手术组(Sham组)、单侧输尿管梗阻手术组(UUO组),每组18只,假手术组仅剥离左侧输尿管,模型组剥离左侧输尿管后结扎2个位点。以1%戊巴比妥钠按8 mL/kg剂量麻醉小鼠,俯卧固定后在小鼠背部左侧切开约1~2 cm的切口,沿着肾脏下行找到左侧输尿管,UUO组在输尿管结扎两个位点,Sham组仅剥离输尿管,随后缝合伤口。于术后第7、14和21天分别处死每组6只小鼠,取手术侧肾脏进行后续实验。
1.5 荧光相对定量PCR检测先用Trizol法提取总RNA,随后用RT-PCR试剂盒进行逆转录,将提取的mRNA逆转录为cDNA后,进行荧光相对定量PCR检测,引物序列见表 1。
| 表 1 引物序列 Tab.1 Sequences of the primers |
使用SDS裂解液裂解组织,提取蛋白后,用Western blot检测蛋白表达,以GAPDH为内参。样品经将SDS-聚丙烯酰胺凝胶上电泳后转移到硝酸纤维素膜(NC膜)上,用5%脱脂奶粉室温封闭1 h,取出用TBST漂洗干净即可进行一抗孵育;一抗于室温孵育2~4 h,取出用TBST振荡洗膜3次,每次5 min;二抗于室温孵育1 h,TBST振荡洗膜3次,每次10 min。膜稍沥干后加入化学发光试剂孵育1 min,稍沥干后利用曝光机进行曝光,图片扫描后用Image J分析软件分析每个目的条带灰度值,用目的蛋白灰度值与内参(GAPDH)灰度值的比值代表目的蛋白的相对表达含量[14]。
1.7 肾脏组织切片染色选取4 μm肾脏组织切片,常规脱蜡水化后进行苏木精-伊红(HE)染色和天狼星红(Sirius Red, SR)染色;选取3 μm肾脏组织切片,常规脱蜡水化后进行马松(Masson)三色法染色。中性树胶封片后,在奥林巴斯显微镜(BX51)观察拍照,并分析每组小鼠肾小管间质的损伤和胶原沉积的阳性面积。
1.8 肾脏组织切片免疫组织化学染色选取3 μm肾脏组织切片,常规脱蜡水化后置于0.01 mol/L的枸盐酸缓冲液中高压修复3 min,1 h后打开高压锅,自然冷却至室温,用PBS冲洗后灭活内源性过氧化物酶,加入即用型山羊血清室温封闭1 h后,分别加兔抗鼠KIF3A抗体(1:100),室温孵育2 h后,PBS洗3遍,后加二抗(1:200)室温孵育1 h,PBS洗3遍后再用DBA显色,苏木素复染核2 min,最后用中性树胶封片,在奥林巴斯显微镜(BX51)观察拍照。用Image J软件对各组切片进行评分,软件根据阳性面积和染色强度评分,得分有4个等级,分别为4/3/2/1,高阳性为4分,阳性为3分,低阳性为2分,阴性为1分[15]。
1.9 肾脏组织切片染色半定量参考金瑞日等[16]的半定量方法,将masson染色和SR染色切片进行半定量分析,即在400倍镜下每张切片随机采集10个不重叠视野,将呈现为蓝色的纤维区域(masson染色)或红色的纤维区域(SR染色)视作阳性目标,以阳性面积与整个视野总面积的比值作为阳性纤维化面积率,取其平均值作为每例切片的阳性纤维化面积率。
1.10 TGF-β1诱导NRK-52E细胞纤维化选择指数生长期的细胞传代至12孔板,待细胞生长到密度约30%,将含10%胎牛血清的DMEM培养基换为无血清DMEM培养基,饥饿24 h,实验组加10 μg/L的TGF-β1溶液,对照组加PBS溶液,在5%血清的培养基中诱导48 h后,提取蛋白待分析。
1.11 统计学处理实验数据均用SPSS 19.0统计软件处理,用平均值±标准差表示。两组间均值比较采用两独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 肾脏组织切片染色结果HE染色可见:Sham组肾脏切片未见病理变化,肾小管完整无萎缩脱落等现象;UUO手术后7 d,肾小管萎缩,小管细胞脱落,小管管腔扩张,间质有炎症细胞浸润,随着梗阻时间的增多,以上病理症状加重。天狼星红(SR)染色和马松(Masson)三色法染色可见:假手术组肾脏小管基底膜完整,间质纤维胶原沉积不明显;UUO手术后7 d,肾小管基底膜断裂,间质胶原沉积增多,随着梗阻时间增多,基质成分增多,纤维化形成。将Masson染色和SR染色切片进行半定量分析,结果显示,随着梗阻时间延长,肾脏间质纤维化显著增多(图 1)。
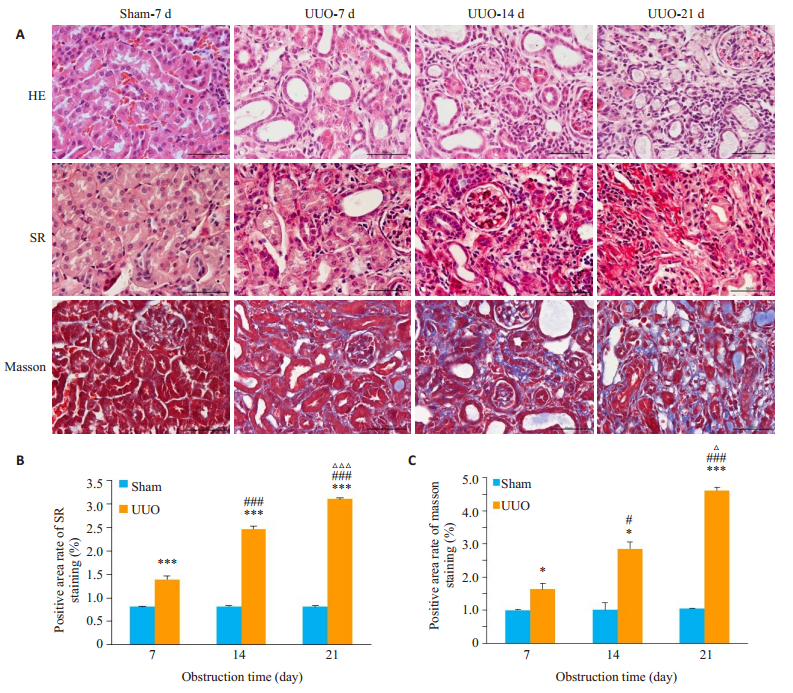
|
图 1 各组小鼠肾间质胶原沉积的检测 Fig.1 HE, SR and Masson staining of mouse kidney tissue showing increased renal fibrosis with the increase of the obstruction time. A: Scale bar=50 μm; B: Positive area rate of SR staining; C: Positive area rate of masson staining (Mean±SD, n=6). *P < 0.05, ***P < 0.0001 vs Sham at the same time point; #P < 0.05, ###P < 0.0001 vs UUO-7D; P < 0.05, P < 0.0001 vs UUO-14D. |
RT-PCR结果显示,与Sham组相比,UUO组术后7 d KIF3A mRNA的表达显著增高(1.00±0.03 vs 3.22± 0.87,P=0.011),21 d达到高峰(1.00±0.03 vs 4.80±0.14,P=0.0001,图 2A)。免疫组织化学染色及其评分结果显示,Sham组小鼠肾脏KIF3A蛋白主要表达于肾小管上皮细胞,UUO术后,随梗阻时间延长,肾小管上皮细胞的表达逐步增加,21 d最显著,且同时观察到在间质的显著表达(图 2B、C)。
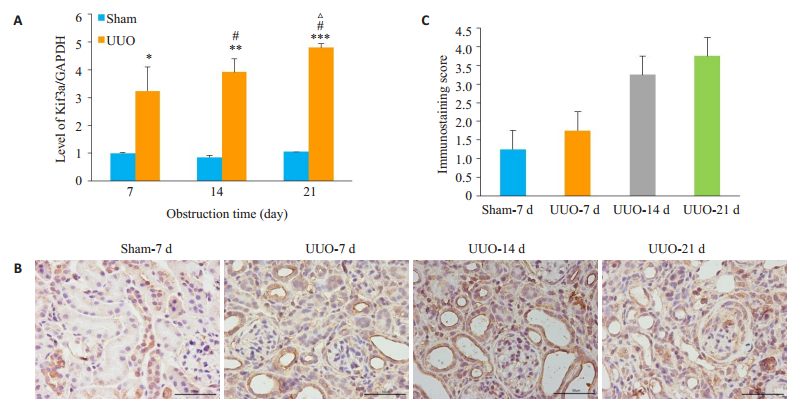
|
图 2 各组小鼠不同时间点KIF3A的表达及分布 Fig.2 Expression of KIF3A at different time points. A: Expression of KIF3A mRNA (Mean±SD, n=6). *P < 0.05, **P < 0.001, ***P < 0.0001 vs Sham at the same time point; #P < 0.05 vs UUO- 7D; ΔP < 0.05 vs UUO-14D; B: Expression and localization of KIF3A protein. Scale bar=50 μm; C: Score of immunochemistry. |
Western blot分析KIF3A及转分化标志相关蛋白α-SMA和E-cadherin蛋白的表达,以GAPDH为内参照。与Sham组相比,UUO组术后7 d KIF3A蛋白的表达开始增加,于21 d达到高峰;同时,术后7 d α-SMA蛋白的表达增多,其变化趋势与KIF3A蛋白一致,而E-cadherin蛋白表达变化趋势与KIF3A蛋白相反(图 3)。
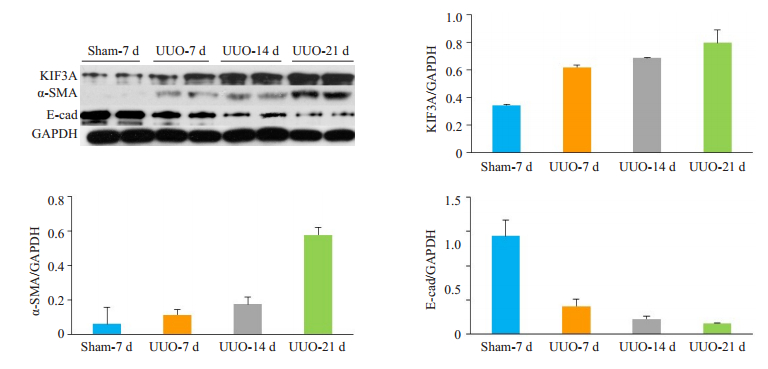
|
图 3 各组小鼠不同时间点肾组织KIF3A、E-cad和α-SMA蛋白的表达 Fig.3 Expression of KIF3A, E-cad and α-SMA proteins at different time points. |
Western blot检测到TGF-β1组较对照组转分化标志物α-SMA蛋白的表达显著增多(P < 0.001),E-cadherin蛋白表达减少(P < 0.0001),同时KIF3A的表达增多P < 0.001),Wnt4/β-catenin信号通路中Wnt4和β-catenin蛋白的表达增多(P < 0.0001,图 4)。
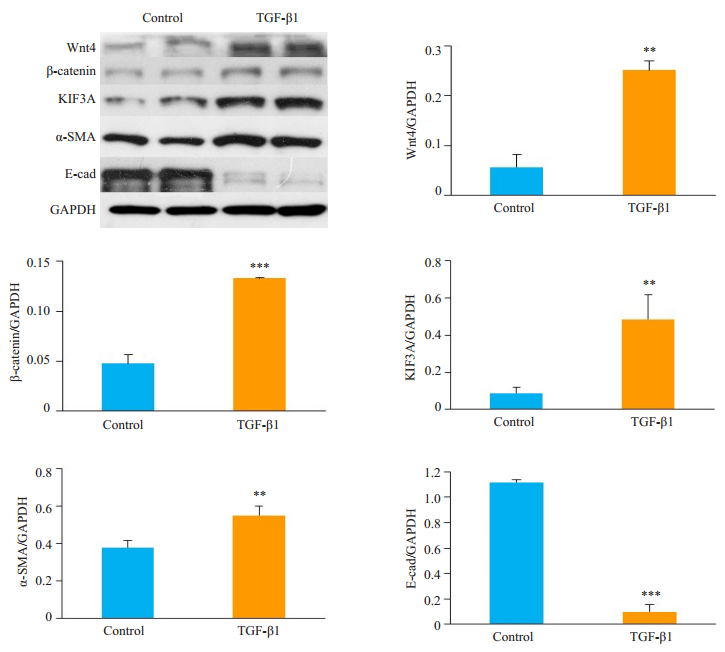
|
图 4 TGF-β1诱导NRK-52E细胞转分化后相关蛋白的表达 Fig.4 Changes in protein expressions in NRK-52E cells after TGF-β1-induced transdifferentiation (Mean ± SD, n=4). *P < 0.05, **P < 0.001, ***P < 0.0001 vs Control group. |
肾间质纤维化(RIF)是所有慢性肾脏疾病发生发展的最后阶段[17]。RIF发生时上皮细胞-间充质转化(EMT)激活,基质蛋白合成增多而基质降解受到抑制,小管间质可见胶原和纤维连接蛋白的堆积[18-19]。本研究构建了单侧输尿管梗阻所致的RIF模型,UUO手术后7 d,小管间质增宽,胶原沉积增加,纤维形成,且随着梗阻时间延长至14、21 d时,纤维化程度逐步加重。本研究首次发现,RIF模型中,KIF3A在肾小管上皮和间质表达增多,提示KIF3A可能参与了RIF的发生。
KIF3A是异三聚体驱动蛋白2的亚基,属于N-驱动蛋白,微管正端导向的马达蛋白。异三聚体驱动蛋白2由KIF3A、KIF3B两个亚基和运载蛋白KAP3组成[20]。有研究报道KIF3A在细胞增殖和迁移中发挥着重要的作用,在上皮细胞过度表达可促使细胞转分化[21]。本研究发现UUO手术后,小鼠肾脏KIF3A的表达增加,E-cadherin蛋白下降,α-SMA蛋白表达增高,体外利用TGF-β诱导肾小管细胞系NRK-52E转分化时也发现KIF3A蛋白的表达增加,E-cadherin蛋白下降,α-SMA蛋白表达增高。α-SMA是成纤维细胞的标记物,其为ECM的主要来源[22]。因此我们推测,KIF3A可能参与EMT,进而加重RIF。
研究报道KIF3A参与wnt/β-catenin信号通路的调节,后者在细胞的增殖和凋亡发挥重要的作用[23]。以往多项研究表明,wnt/β-catenin信号通路为肾纤维化疾病发生发展中的经典信号通路[24],对于正确的肾单位发育至关重要,并且在受损的肾小管上皮细胞中被重新激活,特别是在损伤后重新填充小管的增殖的管状祖细胞中[25]。而RIF的主要原因为上皮细胞-间充质转化(EMT)激活,后者被多项研究证明[26-28]能被wnt/β-catenin信号通路所激活。具体作用机制为:Wnt信号通路能通过抑制糖原合成酶激酶3β介导的磷酸化作用和细胞质中β-catenin蛋白降解作用等来诱发EMT的发生[29]。细胞内较大浓度的β-catenin蛋白会转移进入核内,作为转录因子亚单位诱导大量基因的表达,后者的表达产物中有大部分是诱导EMT转换发生的转录因子。本研究中,利用TGF-β1诱导NRK-52E细胞转分化后,KIF3A蛋白的表达增多,同时wnt4和β-catenin蛋白的表达增多,因此,我们推测:KIF3A是否可通过激活wnt/β-catenin信号通路从而诱发上皮细胞-间充质转化,从而加重RIF?还需要进一步的实验证实。
综上所述,本文通过构建单侧输尿管梗阻的UUO和体外诱导肾小管细胞系NRK52-E纤维化,首次发现在纤维化发生时,KIF3A的表达显著增加。且伴随着转分化相关蛋白α-SMA蛋白的表达显著增多,E-cadherin蛋白表达减少。同时wnt/β-catenin信号通路被激活。我们推测,KIF3A有可能通过激活wnt/β-catenin信号通路,参与EMT及RIF。然而,这些只是初步的实验现象,深入的作用及其机制还需要进一步的实验研究。
| [1] |
马秋波, 包宇实. 慢性肾脏病肾间质纤维化免疫机制研究进展[J]. 中华实用诊断与治疗杂志, 2018, 32(1): 101-4. |
| [2] |
Huang Y, Zhang Z, Huang Y, et al. Induction of inactive TGF-β1 monomer formation by Hydrogen sulfide contributes to its suppressive effects on Ang II- and TGF-β1-induced EMT in renal tubular epithelial cells[J]. Biochem Biophys Res Commun, 2018, 501(2): 534-40. DOI:10.1016/j.bbrc.2018.05.032 |
| [3] |
Chen J, Li D. Telbivudine attenuates UUO-induced renal fibrosis via TGF-β/Smad and NF-κB signaling[J]. Int Immunopharmacol, 2018, 55: 1-8. DOI:10.1016/j.intimp.2017.11.043 |
| [4] |
Farris AB, Colvin RB. Renal interstitial fibrosis: mechanisms and evaluation[J]. Curr Opin Nephrol Hypertens, 2012, 21(3): 289-300. DOI:10.1097/MNH.0b013e3283521cfa |
| [5] |
Zhou X, Bai C, Sun X, et al. Puerarin attenuates renal fibrosis by reducing oxidative stress induced-epithelial cell apoptosis via MAPK signal pathways in vivo and in vitro[J]. Ren Fail, 2017, 39(1): 423-31. DOI:10.1080/0886022X.2017.1305409 |
| [6] |
Zuo Y, Liu Y. New insights into the role and mechanism of Wnt/β-catenin signalling in kidney fibrosis[J]. Nephrology (Carlton), 2018, 23(Suppl 4): 38-43. |
| [7] |
Guo Y, Li Z, Ding R, et al. Parathyroid hormone induces epithelial-to-mesenchymal transition via the Wnt/β-catenin signaling pathway in human renal proximal tubular cells[J]. Int J Clin Exp Pathol, 2014, 7(9): 5978-87. |
| [8] |
Chi L, Galtseva A, Chen L, et al. Kif3a controls murine nephron number via GLI3 repressor, cell survival, and gene expression in a lineage-specific manner[J]. PLoS One, 2013, 8(6): e65448. DOI:10.1371/journal.pone.0065448 |
| [9] |
Guinot A, Lehmann H, Wild PJ, et al. Combined deletion of Vhl, Trp53 and Kif3a causes cystic and neoplastic renal lesions[J]. J Pathol, 2016, 239(3): 365-73. DOI:10.1002/path.4736 |
| [10] |
Lehmann H, Vicari D, Wild PJ, et al. Combined deletion of Vhl and Kif3a accelerates renal cyst formation[J]. J Am Soc Nephrol, 2015, 26(11): 2778-88. DOI:10.1681/ASN.2014090875 |
| [11] |
Lin F, Hiesberger T, Cordes K, et al. Kidney-specific inactivation of the KIF3A subunit of kinesin-II inhibits renal ciliogenesis and produces polycystic kidney disease[J]. Proc Natl Acad Sci USA, 2003, 100(9): 5286-91. DOI:10.1073/pnas.0836980100 |
| [12] |
Liu Z, Rebowe RE, Wang Z, et al. KIF3a promotes proliferation and invasion via Wnt signaling in advanced prostate cancer[J]. Mol Cancer Res, 2014, 12(4): 491-503. DOI:10.1158/1541-7786.MCR-13-0418 |
| [13] |
马园园, 刘成海, 陶艳艳. 肾纤维化动物模型特点与研究进展[J]. 中国实验动物学报, 2018, 26(3): 398-403. DOI:10.3969/j.issn.1005-4847.2018.03.020 |
| [14] |
何凤, 喻陆, 童俊容, 等. 整合素连接激酶在梗阻性肾病肾小管上皮细胞转分化中的作用及尿激酶对其表达调节的研究[J]. 南方医科大学学报, 2009, 29(5): 909-13. |
| [15] |
Varghese F, Bukhari AB, Malhotra R, et al. IHC profiler: an open source plugin for the quantitative evaluation and automated scoring of immunohistochemistry images of human tissue samples[J]. PLoS One, 2014, 9(5): e96801. DOI:10.1371/journal.pone.0096801 |
| [16] |
金瑞日, 鲍晓荣. 活性维生素D3对大鼠肾小管间质纤维化的影响及其机制研究[J]. 中国临床医学, 2015, 21(6): 722-6. |
| [17] |
Allison SJ. Fibrosis: targeting EMT to reverse renal fibrosis[J]. Nat Rev Nephrol, 2015, 11(10): 565. DOI:10.1038/nrneph.2015.133 |
| [18] |
Carew RM, Wang B, Kantharidis P. The role of EMT in renal fibrosis[J]. Cell Tissue Res, 2012, 347(1): 103-16. DOI:10.1007/s00441-011-1227-1 |
| [19] |
Xue R, Li Y, Li X, et al. miR-185 affected the EMT, cell viability, and proliferation via DNMT1/MEG3 pathway in TGF-β1-induced renal fibrosis[J]. Cell Biol Int, 2019, 43(10): 1152-62. DOI:10.1002/cbin.11046 |
| [20] |
Yamazaki H, Nakata T, Okada Y, et al. Cloning and characterization of KAP3: a novel kinesin superfamily-associated protein of KIF3A/ 3B[J]. Proc Natl Acad Sci USA, 1996, 93(16): 8443-8. DOI:10.1073/pnas.93.16.8443 |
| [21] |
Boehlke C, Kotsis F, Buchholz B, et al. Kif3a guides microtubular dynamics, migration and lumen formation of MDCK cells[J]. PLoS One, 2013, 8(5): e62165. DOI:10.1371/journal.pone.0062165 |
| [22] |
Shin JM, Um JY, Lee SA, et al. Effect of MeCP2 on TGF-β1-induced Extracellular Matrix Production in Nasal Polyp-derived Fibroblasts[J]. Am J Rhinol Allergy, 2018, 32(4): 228-35. DOI:10.1177/1945892418770291 |
| [23] |
Xu M, Wang G, Zhou H, et al. TGF-β1-miR-200a-PTEN induces epithelial-mesenchymal transition and fibrosis of pancreatic stellate cells[J]. Mol Cell Biochem, 2017, 431(1/2): 161-8. |
| [24] |
刘燚, 崔志明, 张金龙, 等. 驱动蛋白KIF3A的研究与进展[J]. 中国组织工程研究, 2016, 20(37): 5617-24. DOI:10.3969/j.issn.2095-4344.2016.37.021 |
| [25] |
Gewin LS. Renal tubule repair: is Wnt/-Catenin a friend or foe[J]. Genes (Basel), 2018, 9(2): pii: E58. DOI:10.3390/genes9020058 |
| [26] |
Kawakami T, Ren S, Duffield JS. Wnt signalling in kidney diseases: dual roles in renal injury and repair[J]. J Pathol, 2013, 229(2): 221-31. DOI:10.1002/path.4121 |
| [27] |
Gao S, Hu J, Wu X, et al. PMA treated THP-1-derived-IL-6 promotes EMT of SW48 through STAT3/ERK-dependent activation of Wnt/β-catenin signaling pathway[J]. Biomed Pharmacother, 2018, 108: 618-24. DOI:10.1016/j.biopha.2018.09.067 |
| [28] |
Hua K, Li Y, Zhou H, et al. Haemophilus parasuis infection disrupts adherens junctions and initializes EMT dependent on canonical Wnt/β-Catenin signaling pathway[J]. Front Cell Infect Microbiol, 2018, 8: 324. DOI:10.3389/fcimb.2018.00324 |
| [29] |
Wei CY, Zhu MX, Yang YW, et al. Downregulation of RNF128 activates Wnt/β-catenin signaling to induce cellular EMT and stemness via CD44 and CTTN ubiquitination in melanoma[J]. J Hematol Oncol, 2019, 12(1): 21. |
 2020, Vol. 40
2020, Vol. 40

