2. 南方医科大学 基础医学院,广东 广州 510515;
3. 南方医科大学 实验动物中心,广东 广州 510515;
4. 南方医科大学 南方医科大学珠江医院检验医学部,广东 广州 510280
2. School of Basic Medical Science, Southern Medical University, Guangzhou 510515, China;
3. Department of Laboratory Animal Center, Southern Medical University, Guangzhou 510515, China;
4. Department of Laboratory Medicine, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China
牙齿几乎存在于所有的脊椎动物中,从胚胎早期预定成牙部位到形成完整的牙齿,是一个连续、长期、极其复杂的生物学过程。骨、牙本质、牙骨质是一类组成成分非常相似的矿化结缔组织,且有非常相似的发育机制。而且牙齿作为一个相对独立的整体也较容易展开发育过程的系列研究。因此,牙齿的发育及矿化已成为来源于上皮组织的器官发育与进化及其骨组织发育研究的最佳模型,成为了近年来研究的热点[1]。然而,目前针对人类牙齿发育过程及相关遗传性疾病的研究主要依赖于以小鼠作为动物模型来展开。但是,小鼠为单牙列动物,其牙齿与人的牙齿发育有较大差异,因此在用小鼠作为模型研究人的牙齿发育尤其是相关遗传性疾病时,人类一些相关的表型特征并不能完全在小鼠牙齿上呈现[2]。
然而,研究发现猪的牙齿与人的牙齿非常相似,猪与人一样也为双牙列,拥有人类的所有牙齿类型,同样有乳牙和恒牙两副牙列[1, 3],尤其是小型猪的成功繁育,以及针对小型猪牙齿发育模式研究的越来越多,使之成为研究人类牙齿发育及相关疾病的理想模型[3-5]。但是,小型猪品系较多,不同品系之间遗传背景以及牙齿结构存在一定差异[6-8]。我国地域广泛,逐渐形成了一些稳定的小型猪品系,目前主要有巴马小型猪、五指山小型猪、西藏小型猪、贵州小型猪等。国内学者主要针对巴马小型猪进行了牙齿相关研究[8-9],而目前尚未有西藏小型猪牙齿研究方面的报道。
西藏小型猪产于我国青藏高原,是世界分布海拔最高的猪种,也是我国目前已知小型猪品种中体重最轻的品种之一。本研究首次系统对西藏小型猪的乳牙从解剖结构、牙齿釉质及牙本质超微结构、釉质及牙本质矿化密度以及牙胚和牙髓组织病理结构进行分析研究。研究结果将为西藏小型猪作为牙体疾病研究模型提供较为完善的参考数据,为进一步利用该模型展开牙齿发育尤其是牙齿相关遗传性疾病的分子发病机理研究奠定基础。
1 材料和方法 1.1 实验动物健康西藏小型猪(2~8月龄)上下颌骨6对(由南方医科大学动物中心馈赠),-20 ℃保存。小型猪由南方医科大学动物中心常规饲料饲养,实验动物符合南方医科大学实验动物伦理委员会的规定。
1.2 牙齿X线拍摄牙片采用Toshiba DG-073B-DC X线球管,XMIND DC(Acteon, France)牙片机进行拍摄,投照条件:70 kV,8 MA,0.25~0.32 S。上下颌骨X线片采用Siemens Axiom FX平板DR机进行拍摄,非晶硅平板探测器,像素143 μm。投照条件:70 kV,15 MAs。
1.3 牙齿Micro-CT扫描及密度计算西藏小型猪牙齿采用Micro CT80(SCANCO MEDICAL AG, Switzerland)高分辨率CT进行扫描,扫描参数为:55 kV,145 μA,8 w,分辨率为12 μm,投影旋转步长为0.50~360°。使用已知密度的[羟基磷灰石矿物[0.25g·cm-3和0.75g·cm-3(Bruker)]校准CT图像。使用ImageJ软件(http://imagej.nih.gov/ij/)测量样品及标准品灰度值,每颗牙齿选取十个CT断层切面,通过标准品的灰度值及对应密度计算出实验牙齿牙釉质和牙本质的平均矿物质密度。使用Mimics软件重建牙齿的3D模型。
1.4 牙齿扫描电镜观察使用低速硬组织切割机(Buehler, Lake Bluff)将所有拔出的牙齿切成切片。使用金刚砂纸(3M,Maplewood)抛光牙切片,超声荡洗60 min。浸入30%磷酸中蚀刻切片30 s,用蒸馏水冲洗5 min并在梯度升高的高浓度的乙醇溶液中真空脱水过夜。使用自动溅射涂布机(Agar Scientific, Elektron Technology)固定样品并用金喷涂。使用S-3400N电子扫描显微镜(Hitachi),使用20 kV的加速电压,能谱123eV(Bruker,Nano XFlash R Detector 5010)观察样品的表面形貌和微观结构分析微观结构。
1.5 牙胚及牙髓组织HE染色将西藏小型猪颌骨内未萌出的牙胚用骨凿及剪刀剥出,取出PBS反复冲洗,放入含有4%多聚甲醛溶液的1.5 mL EP管内固定。同时将小猪颌骨内牙冠已形成但牙根尚未发育完全的的乳牙剥离,用探针轻柔地将髓腔内牙髓取出,取出PBS反复冲洗,放入含有4%多聚甲醛溶液的1.5 mL EP管内固定。固定24 h,然后将固定好的牙胚及牙髓组织梯度酒精脱水,二甲苯溶液透明,组织块完成透明后置入恒温箱内石蜡溶液中,待其完全浸蜡后,把熔化的石蜡倒入组织模具内,然后把组织块按所需要研究的组织面向下埋入,将组织蜡块制备成5 µm的连续切片,然后进行脱蜡,再将组织切片放入苏木精中5 min,蒸馏水冲洗1min后用含1%的盐酸酒精分化10 s,蒸馏水冲洗20 min左右,伊红溶液中浸染5 min,蒸馏水冲洗。将组织切片按顺序放入不同酒精梯度(80%,90%,100%)中各浸泡两次每次2 min进行脱水。将切片依次放入二甲苯溶液进行透明,用滤纸吸去多余的二甲苯,晾干,用吸管吸取适量中性树胶滴加在组织切片上,加盖盖玻片,晾干后显微镜下观看染色结果。
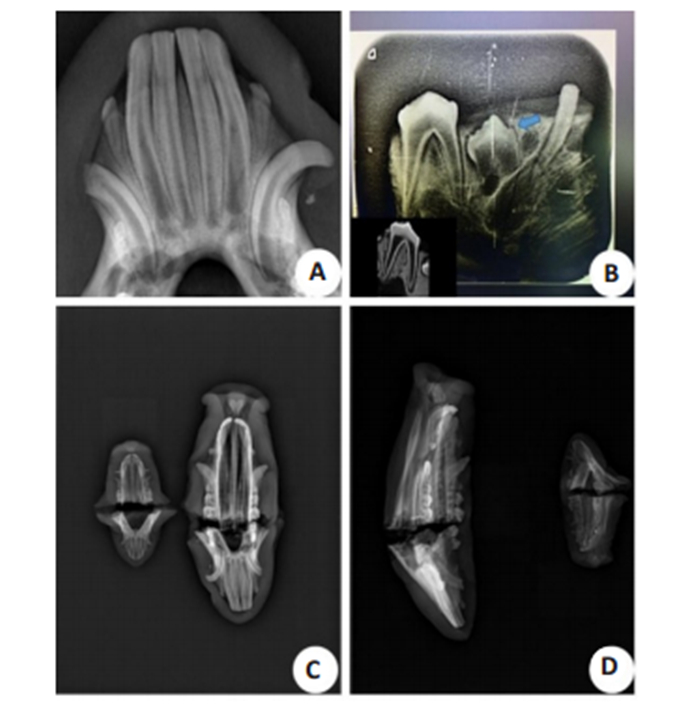
2 结果与分析 2.1 西藏小型猪乳牙X线表现从X线拍摄片可见西藏小型猪乳前牙根管口未闭合,第三乳切牙体积较小,乳尖牙朝口外弯曲生长(图 1A)。第一乳前磨牙(蓝色箭头所示)暂未萌出,牙根尚未完全形成,第二前磨牙牙冠釉质较薄,根管粗大,根尖孔已发育完全(图 1B)。上下颌正位片可清晰见到切牙牙冠牙根(图 1C),侧位片可清晰见到前磨牙图像(图 1D)。
|
图 1 西藏小型猪乳牙X线片 Fig.1 X-ray films of the deciduous teeth of Tibet minipigs. A: Deciduous anterior teeth; B: Deciduous canine and premolars; C, D: Jaw bone and deciduous teeth. |
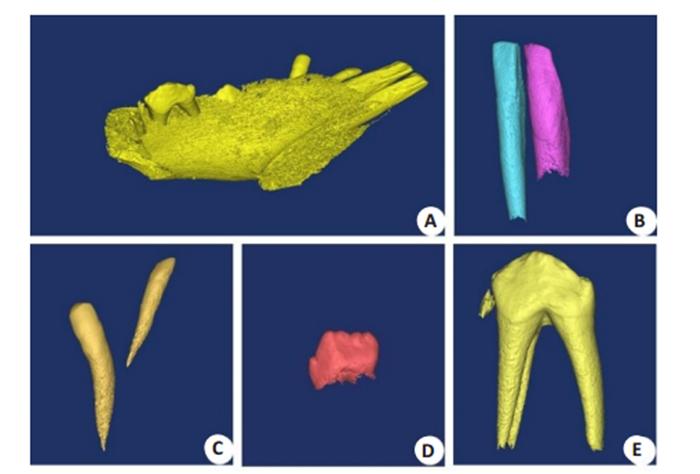
经Micro-CT对2月龄西藏小型猪乳牙完成扫描后,我们采用Mimics软件进行了三维重建,通过三维重建后可全方位观察看牙冠牙根形态,可见西藏小型猪乳切牙和乳尖牙呈单根牙(图 2B、C),乳前磨牙为三根牙(图 2E),此时的第一乳前磨牙牙冠已形成,牙根尚未形成。通过ImageJ软件测量标准品及西藏小型猪乳牙的灰度值,通过标准品密度值和灰度值计算出西藏小型猪乳牙的矿化密度值见表 1。
|
图 2 西藏小型猪乳牙Micro-CT三维重建图 Fig.2 Micro-CT-based 3D-reconstruction of the deciduous teeth of Tibet minipigs. A: Unilateral maxilla; B: First and second deciduous incisors; C: Third deciduous incisor and deciduous canine; D: First deciduous premolar; E: Second deciduous premolar. |
| 表 1 西藏小型猪乳牙牙齿密度 Tab.1 Density of the deciduous teeth of Tibet minipigs |
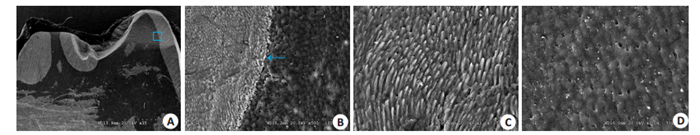
扫描电镜显示2月龄西藏小型猪乳牙牙齿具有与人类似的牙釉质和牙本质结构,牙釉质与牙本质之间具有明显的分界线,釉质密度相对较高,颜色较浅;牙本质密度相对较低,颜色较深(图 3A,B)。釉牙本质界较为平直,与人类釉牙本质界多呈扇形有着一定的区别(图 3B)。乳牙釉质横纹釉柱明显(图 3C),牙本质可见分布均匀的牙本质小孔(图 3D)。(图 3B~D为图A蓝色方框区域放大后图示)。
|
图 3 西藏小型猪乳牙扫描电镜结构图 Fig.3 SEM of the deciduous teeth of Tibet minipigs. A: Dental crown of the first deciduous premolar; B: Dental crown of the first deciduous molar; C: Enamel; D: Dentin. Blue box and arrow show the boundary between enamel and dentin. |
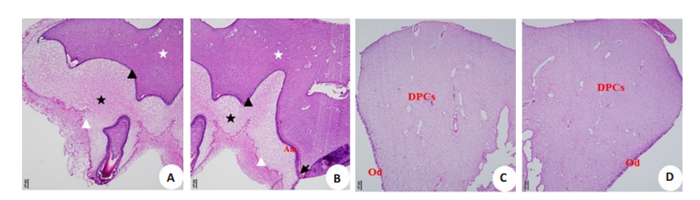
HE染色可见2月龄西藏小型猪第1磨牙牙胚正处于钟状期,成釉器最外层为外釉上皮,中间为星网状层,最里层为内釉上皮,下面为牙乳头, 部分地方已进入分泌期,成釉细胞形成,并分泌出釉质(图 4A、B)。2月龄西藏小型猪第一乳前磨牙牙冠已初步形成,牙髓腔形成,牙髓腔由成牙本质细胞、未分化的牙髓细胞和血管组成(图 4C、D)。
|
图 4 西藏小型猪牙胚及牙髓组织HE染色 Fig.4 HE staining of the tooth germ and pulp tissue of Tibet minipigs. A, B: HE staining of the tooth germ in the bell stage; C, D: HE staining of pulp tissue of the first molar of Tibet minipigs. oee: Outer enamel epithelium; iee: Inner enamel epithelium; sr: Stellate reticulum; Od: Odontoblasts; Am: Ameloblasts; DP: Dental papilla; E: Enamel; DPCs: Dental pulp cells. |
小型猪遗传背景稳定,体型小,部分生理器官及系统等与人类非常相似,是研究人类各脏器及相关疾病理想的动物模型。随着人类对疾病研究的深入,近年来,小型猪作为模式动物在国际及国内得到广泛应用,包括应用于心血管系统、内分泌系统、皮肤系统、骨骼系统研究以及器官移植等[10-13]。比如,本研究用的西藏小型猪模型,作为动物模型已在缺血性脑病、亨廷顿舞蹈症等疾病得到了良好应用[14-15]。在本研究中,我们针对西藏小型猪的牙齿进行了显微结构分析,拟为西藏小型猪作为牙齿相关疾病研究提供一个可靠的动物模型。我们研究发现西藏小型猪乳牙由12颗乳切牙,4颗乳尖牙,8颗乳前磨牙,8颗乳磨牙,共32颗乳牙组成,乳牙下面为未萌出的恒牙牙胚,与人类乳牙组成(8颗乳切牙,4颗乳尖牙,8颗乳磨牙,共20颗乳牙)及系统相似。牙齿组织结构分为牙冠和牙根,牙冠由外层的釉质和里层的牙本质和牙髓组成(图 1),其牙列特点与人类也非常相似,是研究牙齿发育及相关疾病机理的理想动物模型。
在我们的前期工作中,主要使用小鼠作为牙齿相关疾病研究模型。然而,我们在研究人牙本质发育不良1型致病基因Vps4b敲除小鼠时,发现小鼠牙齿并未像人类患者一样发生相应病理变化,推测原因可能与小鼠跟人体牙齿发病机理存在差异有关[16]。然而,已有研究证实利用小型猪构建牙髓炎模型,探讨根尖孔径对牙髓炎症发展及转归的影响,可发现小型猪根尖孔径较大时,根尖炎症范围更小,年轻未发育完全的较大根尖孔血运丰富,具有更强的抵抗炎症的能力,该结果与人类牙齿相似[17]。此外,研究证实6月龄以上的小型猪可作为牙周病理想模型,其乳牙和恒牙牙面可见大量菌斑、牙石,从而形成牙龈炎,进而发展为牙周炎[18]。进一步利用小型猪模型用于治疗牙周炎新型药物的研究发现,利用羧甲基壳聚糖锌多肽复合材料均匀涂于6月龄小型猪牙齿表面,可以有效抑制牙周致病菌和牙结石的形成,从而减轻牙周组织炎症[19]。此外,小型猪也已用于正畸治疗扩弓及保持期颊侧牙槽骨变化的情况及疗效研究[20]。由此证实,小型猪已逐渐成为了一种理想的口腔领域研究模式动物。在我们的研究中,我们发现西藏小型猪的乳牙牙胚由上皮来源的成釉细胞和间充质来源的牙乳头细胞以及成牙本质细胞组成(图 4),牙齿的形成由上皮与间充质来源细胞相互刺激、交互作用形成牙釉质及牙本质等牙体硬组织。该过程与人类牙齿形成过程一致,因此可利用西藏小型猪牙齿发育的过程用于人类牙齿发育及其相关疾病的研究。
与人牙齿发育相似,小型猪乳牙发育也具有较为严格的发育时间节点。小型猪第三乳切牙和乳尖牙在出生时就已萌出,其余所有乳牙在6~8个月内全部萌出。小型猪在出生3~5周后第一乳切牙和第一乳磨牙萌出;第二乳切牙、第二乳前磨牙以及第三乳前磨牙在出生后1~3个月内萌出;第一乳前磨牙萌出最晚,在出生后6~8个月内萌出[1]。在本研究中,X线拍摄片可见乳牙牙冠由釉质和牙本质组成,但釉质较薄(图 1),而人的乳牙釉质较猪的乳牙厚度稍厚,猪的乳牙牙髓腔较大,与人类乳牙一致。本研究发现猪的乳牙牙釉质及牙本质密度较人乳牙矿化密度稍低[21],结果与其他学者较一致[4]。扫描电镜发现,猪乳牙的牙釉质结构由密集的釉柱组成,牙本质中牙本质小孔分布较均匀,与人牙齿电镜扫描结果相似[21],但小型猪的釉牙本质界呈直线状,而人牙齿釉牙本质界呈贝壳状弧形,弧线凸向牙本质侧,两者之间存在一定的差异。研究还发现,2月龄西藏小型猪第一磨牙牙胚HE染色处于钟状期晚期即将进入分泌期,提示不需要取小型猪胚胎,在出生后仍可以获取早期的牙胚组织用于牙齿发育时空表达机制研究。第一乳前磨牙牙髓组织HE染色可见牙髓组织最外层为成牙本质细胞,成牙本质细胞里层可见未分化的牙髓细胞,提示其可作为牙齿再生的种子细胞,以及体外培养作为种子细胞进行牙齿相关研究。
总之,本研究发现西藏小型猪牙齿超微结构、牙齿矿化密度与人类牙齿非常接近,牙胚以及牙髓组织病理结构以与人类牙胚及牙髓组织病理结构基本一致,其可作为一个良好可靠的模型用于人类牙齿发育、再生及牙齿相关疾病的研究。
| [1] |
Nakashima M, Iohara K, Bottino M, et al. Animal models for stem cell-based pulp regeneration: Foundation for human clinical applications[J]. Tissue Eng Part B Rev, 2019, 25(2): 100-13. DOI:10.1089/ten.teb.2018.0194 |
| [2] |
Hu A, Lu T, Chen D, et al. Vps4b heterozygous mice do not develop tooth defects that replicate human dentin dysplasia Ⅰ[J]. BMC Genet, 2019, 20(1): 7. DOI:10.1186/s12863-018-0699-3 |
| [3] |
王福, 吴志芳, 李阳. 利用大型动物模型研究牙发育及再生的优劣[J]. 口腔医学研究, 2015, 31(6): 549-54. |
| [4] |
Wang S, Liu Y, Fang D, et al. The miniature pig: a useful large animal model for dental and orofacial research[J]. Oral Dis, 2007, 13(6): 530-7. DOI:10.1111/j.1601-0825.2006.01337.x |
| [5] |
Gao Z, Wang L, Wang F, et al. Expression of BMP2/4/7 during the odontogenesis of deciduous molars in miniature pig embryos[J]. J Mol Histol, 2018, 49(5): 545-53. DOI:10.1007/s10735-018-9792-1 |
| [6] |
Ide Y, Nakahara T, Nasu M, et al. Postnatal mandibular cheek tooth development in the miniature pig based on two-dimensional and three-dimensional X-ray analyses[J]. Anat Rec, 2013, 296(8): 1247-54. DOI:10.1002/ar.22725 |
| [7] |
李玉晶, 赵宝荣. 实验用小型猪牙颌系统解剖组织学特点[J]. 中华口腔医学杂志, 1993, 28(4): 234-6. |
| [8] |
Li Y, Gong Y, Wu X, et al. Quantitative proteomic analysis of deciduous molars during cap to bell transition in miniature pig[J]. J Proteomics, 2018, 172: 57-67. DOI:10.1016/j.jprot.2017.10.013 |
| [9] |
Wang F, Xiao J, Cong W, et al. Morphology and chronology of diphyodont dentition in miniature pigs, Sus Scrofa[J]. Oral Dis, 2014, 20(4): 367-79. DOI:10.1111/odi.12126 |
| [10] |
Song T, Wu T, Wei F, et al. Construction of a cDNA library for miniature pig mandibular deciduous molars[J]. BMC Dev Biol, 2014, 14(1): 16. DOI:10.1186/1471-213X-14-16 |
| [11] |
Tikhonov VN, Bobovich VE. Genetics and major applications of supersmall mini pigs in medicine and biotechnology[J]. Russian J Genet Appl Res, 2012, 2(1): 97-104. DOI:10.1134/S2079059712010145 |
| [12] |
Zhao Y, Xiang L, Liu Y, et al. Atherosclerosis induced by a highcholesterol and high-fat diet in the inbred strain of the wuzhishan miniature Pig[J]. AnimBiotechnol, 2017, 1-9. |
| [13] |
Li W, Chen X, Riley AM, et al. Long-term spironolactone treatment reduces coronary TRPC expression, vasoconstriction, and atherosclerosis in metabolic syndrome pigs[J]. Basic Res Cardiol, 2017, 112(5): 54. DOI:10.1007/s00395-017-0643-0 |
| [14] |
刘亚千, 赵玉琼, 王凯, 等. 巴马小型猪1型糖尿病模型的建立[J]. 实验动物科学, 2015, 32(4): 1-7. DOI:10.3969/j.issn.1006-6179.2015.04.001 |
| [15] |
刚蔷蔷, 郝鹏, 张嘉宁. 西藏小型猪缺氧缺血性脑病模型的建立及病理和影像学表现[J]. 南方医科大学学报, 2016, 36(5): 705-9. |
| [16] |
Baxa M, Hruska-Plochan M, Juhas S, et al. A transgenic minipig models of Huntington's disease[J]. J Huntington's Dis, 2013, 2(1): 47-68. |
| [17] |
樊闪, 刘晓勇, 汪育苗, 等. 根尖孔径大小对小型猪牙髓炎组织病理学影响[J]. 北京口腔医学, 2015, 23(5): 254-8. |
| [18] |
Jung S, Yang HY, Lee TH. Differential expression of immunologic proteins in gingiva after socket preservation in mini pigs[J]. J Appl Oral Sci, 2015, 23(2): 187-95. DOI:10.1590/1678-775720140311 |
| [19] |
刘学玉, 潘克清, 张丽, 等. 羧甲基壳聚糖锌多肽复合材料局部应用对巴马小型猪龈沟液中IL-1、TNF-α和PGE-2含量的影响[J]. 上海口腔医学, 2016, 25(2): 172-6. |
| [20] |
苏明, 欧阳嘉杰, 王晓林, 等. 小型猪胫骨垂直牵张成骨模型的建立[J]. 北京口腔医学, 2014, 22(6): 325-7. |
| [21] |
Lu T, Li M, Xu X, et al. Whole exome sequencing identifies an AMBN missense mutation causing severe autosomal-dominant amelogenesis imperfecta and dentin disorders[J]. Int J Oral Sci, 2018, 10(3): 26. DOI:10.1038/s41368-018-0027-9 |
 2019, Vol. 39
2019, Vol. 39

