2. 南方医科大学南方医院妇产科生殖医学中心,广东 广州 510515
2. Center for Reproductive Medicine, Department of Obstetrics and Gynecology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
畸精子症是指精子形态的异常,即精子的畸形率增高,而精子的形态异常往往影响精子与卵母细胞透明带的结合,致使受精率降低,严重降低男性生育能力,影响体外受精(IVF)结局[1]。虽然畸精子症的临床治疗包括药物和辅助生殖技术,但存在费用高、妊娠率低等问题。就其根本原因在于畸精子症的发生机制尚不清楚,难以从根本上解决此类患者的生育问题。据报道,全世界育龄夫妇不孕不育症的发病率在8%~15%,其中20% ~30%完全由男性因素造成的[2],且男性生育能力呈逐年下降趋势[3-4]。因此,寻找畸精子症发生的相关因素,对于揭示其发病机理,提高此类患者的生育能力极为重要。氧化应激可产生活性氧(ROS),一定水平的ROS对于维持男性生殖系统正常生理功能具有重要意义,而过高的ROS水平与精子的畸形率上升密切相关[5-8]。以往的研究主要关注ROS介导的脂质过氧化和DNA氧化损伤对精子畸形率及其IVF结局的影响[9-10],而蛋白质的氧化损伤往往被忽视。近年来,发现晚期氧化蛋白产物(AOPPs)不仅是体内蛋白质氧化的终末期产物,而且可作为内源性致病物质,诱导或加重氧化应激[11-12],是机体许多慢性疾病如肾病、心血管、内分泌等疾病发生的重要机制[13]。AOPPs可引起中性粒细胞及单核细胞呼吸爆发;刺激中性粒细胞合成IL-8;刺激单核细胞合成炎性细胞因子TNF- a;刺激血管内皮细胞产生ROS。AOPPs检测技术简单、快速、低廉,且在评价氧化应激的特异性、灵敏度等方面均优于目前常用的经典检测指标ROS、SOD等,故AOPPs被认为是一种新型的、可靠、实用性强的蛋白氧化应激指标[14]。研究发现无精子症组精浆中AOPPs浓度显著高于正常男性组[15]。但是,关于AOPPs对畸精子症严重程度及IVF结局的影响,目前尚未见报道。因此本研究旨在从蛋白氧化损伤角度,探讨精浆中AOPPs水平与畸精子症严重程度及IVF结局参数的关系。
1 资料和方法 1.1 研究对象采用两阶段横断面调查研究,选取了2018年10月~2019年3月在南方医科大学南方医院生殖医学中心接受不孕不育治疗的272对夫妇为研究对象。第1阶段实验旨在探索精浆AOPPs与精液参数的相关性,选取86对不孕不育夫妇的助孕前男方精浆标本,年龄26~50岁,34.8±5.5岁;第2阶段实验旨在进一步探究精浆AOPPs与体外受精结局参数的关系,选取186对不孕不育夫妇的取卵日男方精浆标本,年龄23~50岁,35.3±5.9岁。纳入标准:超促排卵方案:拮抗剂或降调节方案;获卵数≥5个;行IVF受精。排除标准:男性吸烟、癌症、泌尿生殖道和腺体感染。所有受试者纳入本研究前均获得知情同意。伦理审查由南方医院伦理委员会批准。
1.2 分组按照精子正常形态百分比将受试分为2组,1%~ 3%为A组(畸精子症组),≥4%为B组(正常精子形态组);畸精子症组又分为3个亚组,1%为a组(重度畸精子症),2%为b组(中度畸精子症),3%为c组(轻度畸精子症)。按照受精率中位数83%(71%,94%)分为两组,≤83%为Ⅰ组(低于中位数组),> 83%为Ⅱ组(高于中位数组)。
1.3 标本收集和处理所有受试对象禁欲3~7 d后以手淫法采集精液标本,置洁净、经消毒的一次性塑料容器内,室温下精液液化。在第1阶段实验中,按照WHO《人类精液检查与处理实验室手册》标准[16],对助孕前精液标本进行精液常规分析,测定精液体积、精子浓度,精子活力以及正常精子形态百分比等指标。精液分析后,将所有精浆样品以300 g离心15 min,置于15 mL锥形离心管中,取上清液储存在-80 ℃冰箱。在第2阶段实验中,将取卵日精液标本进行常规离心处理后,取上清液储存在-80 ℃冰箱。
1.4 AOPPs和ROS的测定AOPPs测定采用ELISA试剂盒(南京森贝伽生物科技有限公司)。本试剂盒应用双抗体夹心法测定标本中人AOPPs水平,用酶标仪测定吸光度(A450 nm),通过标准曲线计算样品中人AOPPs浓度。质控、测定曲线及操作均严格按照说明书进行。ROS测定采用化学荧光法测试盒(Sigma)。利用DCFH-DA(2, 7-dichlorofuorescin diacetate)作为细胞内活性氧检测探针,将激发波长设置为500 nm,发射波长设置为525 nm,荧光分光光度计(Perkin Elmer)进行荧光检测。具体操作均按照说明书进行。
1.5 观察指标年龄、体质量指数(BMI)、受精率、异常受精率及良好胚胎形成率。
1.6 统计学分析数据采用SPSS 22.0软件进行数据处理,计量资料以均数±标准差表示,两组间采用两样t检验,多组间采用单因素方差分析,组间两两比较采用LSD法。计数资料以(%)表示,组间比较采用卡方检验。相关性分析采用Pearson相关和偏相关分析,以P < 0.05表示差异具有统计学意义。
2 结果 2.1 精浆中AOPPs水平与精液参数的相关性分析第1阶段实验选取的86例男方精液标本,结果显示精浆中AOPPs与ROS水平呈正相关(r=0.277,P=0.01),与正常精子形态百分比呈显著负相关(r=-0.315,P= 0.003),而与年龄、BMI、禁欲天数、精液体积、精液PH、精子浓度、非前向精子运动百分率(NP)、前向精子运动精子百分率(PR)、精子活力、正常精子形态百分比等指标无显著相关性(P > 0.05)。精浆中ROS水平与正常精子形态百分比(r=-0.268,P=0.013)、精子活力(r=-0.269,P=0.012)及PR(r=-0.297,P=0.005)均呈负相关(表 1)。
| 表 1 精浆中AOPPs水平与精液参数的相关性分析 Tab.1 Correlation between the levels of seminal AOPPs and sperm parameters |
为进一步验证精浆AOPPs与精子形态的关系,我们按照精子正常形态百分比分为2组,1%~3%为A组(畸精子症组),≥4%为B组(正常精子形态组)。结果显示:与正常精子形态组相比,畸精子症组精子浓度(P= 0.003)、PR(P=0.000)及精子活力(P=0.000)均显著降低,精浆AOPPs(P=0.027)和ROS(P=0.047)水平均显著升高(表 2)。
| 表 2 不同精子形态组中患者的一般资料比较 Tab.2 Comparison of basic parameters in different sperm morphology groups |
为进一步探索精浆AOPPs与畸精子症严重程度的关系,我们按照精子正常形态百分比,将畸精子症组又分为3个亚组,1%为a组(重度畸精子症),2%为b组(中度畸精子症),3%为c组(轻度畸精子症)。单因素方差分析结果显示:3组精浆中AOPPs(F=3.635,P=0.033)水平存在显著性差异。两两比较结果显示:在重度畸精子症组,精浆AOPPs水平显著高于轻度(P=0.019)和中度畸精子症组(P=0.015,图 1A)。3组精浆中ROS水平虽无显著性差异,但随着畸精子症严重程度的增加,出现了升高的趋势(图 1B)。
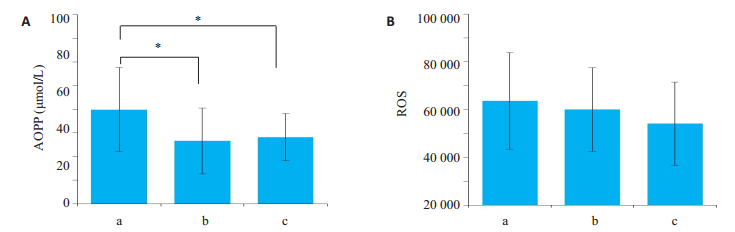
|
图 1 不同严重程度畸精子症组精浆中AOPPs和ROS水平的差异 Fig.1 Seminal levels of AOPPs (A) and ROS (B) in teratospermia groups with different severities (*P < 0.05). a: 1% of normal sperm; b: 2% of normal sperm; c: 3% of normal sperm |
为了研究精浆AOPPs对IVF结局的影响,在第2阶段实验中我们选取了186例接受IVF治疗的取卵日男方精液标本,按照受精率中位数83%(71%,94%)分为2组,≤83%为Ⅰ组(低于中位数组),> 83%为Ⅱ组(高于中位数组)。结果显示:与高于中位数组相比,低于中位数组取卵日精浆AOPPs(P=0.036)和ROS(P=0.049)水平显著升高,成熟卵母细胞率显著降低(P=0.000,表 3)。
| 表 3 不同受精率组中患者的一般资料比较 Tab.3 Comparison of basic parameters in different fertilization rate groups |
我们分析了186例取卵日男方精浆中AOPPs水平与IVF结局参数的相关性,结果显示取卵日精浆中AOPPs水平与受精率呈显著负相关(r=- 0.214,P= 0.003),与异常受精率(r=-0.096,P=0.190)及优质胚胎形成率(r=0.027,P=0.710)无相关性。此外,我们控制了成熟卵母细胞率这一变量对受精率的影响,采用偏相关分析结果显示取卵日精浆中AOPPs水平仍与受精率呈显著负相关(r=-0.228,P=0.002)。精浆中ROS水平与IVF结局参数的相关性与AOPPs结果一致(表 4)。
| 表 4 精浆中AOPPs水平与IVF结局参数的相关性分析 Tab.4 Relationship between seminal AOPPs level and IVF outcome parameters |
氧化应激是指机体内ROS的产生和清除处于失衡的一种状态[17]。生理剂量的ROS在调节细胞生长、信号传导及防御微生物侵袭等方面都有着重要作用。生理状态下,精子能够自发产生一定量的ROS,适量的ROS在调控与精子获能相关的酪氨酸磷酸化反应中扮演着重要的角色。然而,当精子内ROS水平远远超过抗氧化剂所能承受的最大限度,则会诱发一系列的氧化应激反应,导致脂质过氧化、蛋白质修饰和DNA损伤[18]。研究表明[19-21],精浆中异常升高的ROS水平与男性不育密切相关。
AOPPs不仅是氧化应激的产物,同时也是氧化应激的执行者,可进一步促进氧化应激的产生,形成氧化应激的恶性循环[11-12]。而过度的氧化应激可损害精子形成和精子代谢,增加精子畸形率,继而降低受精率,最终致男性不育[22-23]。然而AOPPs是否与畸精子症严重程度及其IVF受精率低下相关,尚不清楚。本研究结果显示,与正常精子形态的男性相比,在畸精子症尤其是重度畸精子症患者的精浆中AOPPs水平显著升高,同时相关分析发现AOPPs与正常精子形态百分比及其IVF受精率呈显著负相关关系。
在第1阶段助孕前精浆的研究中,通过对AOPPs水平与各项精液参数的相关性分析,我们发现了AOPPs与正常精子形态百分比存在负相关。继而根据正常精子形态百分比进行分组比较,结果发现与正常形态精子组比较,畸精子症组精浆AOPPs水平显著升高,尤其重度畸精子症组显著高于轻、中度组。提示精浆中AOPPs水平的异常升高,可能预示着男性发生重度畸精子症的风险增高。Kratz等[15]在前期研究中发现无精子症组和畸形精子症组的AOPPs水平高于正常对照组,无精子症患者的精浆中AOPPs水平高于畸形精子症组,该研究认为精浆中过高的AOPPs水平可能影响了精子的正常发育。这与我们的结果一致,我们的结果不仅发现畸形精子症组中的AOPPs高于正常形态组,且随着畸形程度的加重,精浆AOPPs水平也是逐渐升高。氧化应激造成精子结构和功能完整性的损害,是导致精子细胞功能障碍和男性不育的主要原因[23]。抗氧化剂对致畸精子具有保护作用,能提高精子活力和DNA完整性,这进一步证实了氧化应激反应对精子产生的重大影响[24]。本研究中,虽然不同程度畸精子症组精浆中ROS水平无显著性差异,但随着畸精子症严重程度的增加,ROS水平呈现了升高的趋势,同时精浆中ROS水平与正常精子形态百分比存在负相关,而AOPPs与ROS呈显著正相关。过量的ROS水平主要介导脂质、蛋白质和DNA的氧化损伤[18],而AOPPs作为蛋白质氧化损伤的产物,可引起ROS的蓄积。故我们推测,AOPPs作为内源性致病物,可诱导和加重机体内氧化应激反应,致使过量ROS产生,并进而对精子的形态和功能造成损伤。
既然精浆中AOPPs水平与畸精子症及其严重程度相关,而畸精子症影响IVF受精,因此在第2阶段取卵日精浆的研究中,我们进一步分析了AOPPs水平与IVF受精率的关系。根据受精率中位数进行分组比较,发现低于受精率中位数组精浆AOPPs水平显著升高,采用Pearson相关分析也发现AOPPs水平与IVF受精率负相关。考虑受精率与女方因素也存在一定的相关性,为了剔除女性相关因素的影响,我们也比较了不同受精率组中女方年龄、不孕类型、不孕原因、不孕年限及成熟卵母细胞率等指标,结果发现低受精率组成熟卵母细胞率显著降低,其余指标均无显著差异。因此,我们控制了成熟卵母细胞率这一变量后,AOPPs水平仍与受精率呈负相关。提示精浆中过高的AOPPs水平可能影响IVF受精率。虽然目前精浆中AOPPs与IVF结局的相关报道较少,但是过度的氧化应激对男性生殖损害的报道较多,如毒物暴露、化疗、电离辐射、衰老、肥胖、吸烟和酗酒等都会造成男性生殖系统过度的氧化应激反应,而其均会对男性生殖道、生殖细胞、性激素、子代的表观遗传等方面造成严重的负面影响[25]。多项研究表明过高的ROS可以与精子DNA反应,造成N-糖苷键断裂,使DNA脱碱基位点,影响分子结构稳定性,导致DNA单链断裂,最终损伤DNA[26-29]。ROS水平与精子异常形态发生率之间存在显著的正相关[23, 30-31]。精子DNA碎片指数与IVF受精率呈显著负相关[32-33]。而Hammadeh等[34]发现精浆中过高的ROS水平与IVF周期受精率降低有关。我们的结果中同样证实了ROS与受精率呈负相关。因此,我们推测精浆中过高的AOPPs水平,可能通过诱导或加重氧化应激,使ROS异常升高。而异常升高的ROS,一方面损伤精子DNA,使精子DNA链断裂[28];另一方面使精子膜发生脂质过氧化,破坏膜的流动性和完整性,增加畸形率[35-36],进而导致受精率下降,最终影响IVF结局。
综述所述,精浆中AOPPs水平与畸精子症及其严重程度相关,过高的AOPPs水平可能影响IVF受精率。提示精浆中AOPPs水平的异常升高可能预示着男性发生重度畸精子症及IVF受精率低下的风险增高。这为探索畸精子症发病机理和寻找干预措施提供新思路。同时有望通过补充抗氧化剂或NADPH氧化酶抑制剂减轻或降低精浆氧化应激水平[28],改善精液质量,增加受精率,提高此类患者生育能力和辅助生殖技术治疗效率。
| [1] |
Lemmens L, Kos S, Beijer C, et al. Predictive value of sperm morphology and progressively motile sperm count for pregnancy outcomes in intrauterine insemination[J]. Fertil Steril, 2016, 105(6): 1462-8. DOI:10.1016/j.fertnstert.2016.02.012 |
| [2] |
Agarwal A, Mulgund A, Hamada A, et al. A unique view on male infertility around the globe[J]. Reprod Biol Endocrinol, 2015, 13(5): 37. |
| [3] |
Merzenich H, Zeeb H, Blettner M. Decreasing sperm quality: a global problem?[J]. BMC Public Health, 2010, 10(1): 24. DOI:10.1186/1471-2458-10-24 |
| [4] |
Jorgensen N, Joensen UN, Jensen TK, et al. Human semen quality in the new millennium: a prospective cross-sectional populationbased study of 4867 men[J]. BMJ Open, 2012, 2(4): 35-6. |
| [5] |
Gavriliouk D, Aitken RJ. Damage to sperm DNA mediated by reactive Oxygen species: its impact on human reproduction and the health trajectory of offspring[J]. Adv Exp Med Biol, 2015, 868(10): 23-47. |
| [6] |
Opuwari CS, Henkel RR. An update on oxidative damage to spermatozoa and oocytes[J]. Biomed Res Int, 2016, 28(7): 9540142. |
| [7] |
Oumaima A, Tesnim A, Zohra H, et al. Investigation on the origin of sperm morphological defects: oxidative attacks, chromatin immaturity, and DNA fragmentation[J]. Environ Sci Pollut Res Int, 2018, 25(14, SI): 13775-86. DOI:10.1007/s11356-018-1417-4 |
| [8] |
Ko EY, Sabanegh J, Agarwal A. Male infertility testing: reactive Oxygen species and antioxidant capacity[J]. Fertil Steril, 2014, 102(6): 1518-27. DOI:10.1016/j.fertnstert.2014.10.020 |
| [9] |
Moazamian R, Polhemus A, Connaughton H, et al. Oxidative stress and human spermatozoa: diagnostic and functional significance of aldehydes generated as a result of lipid peroxidation[J]. Mol Hum Reprod, 2015, 21(6): 502-15. DOI:10.1093/molehr/gav014 |
| [10] |
Martin-Hidalgo D, Julia Bragado M, Batista AR, et al. Antioxidants and male fertility: from molecular studies to clinical evidence[J]. Antioxidants (Basel), 2019, 8(4): E89. DOI:10.3390/antiox8040089 |
| [11] |
Wu Q, Zhong ZM, Zhu SY, et al. Advanced oxidation protein products induce chondrocyte apoptosis via receptor for advanced glycation end products-mediated, redox-dependent intrinsic apoptosis pathway[J]. Apoptosis, 2016, 21(1): 36-50. DOI:10.1007/s10495-015-1191-4 |
| [12] |
Cao W, Xu J, Zhou ZM, et al. Advanced oxidation protein products activate intrarenal renin-angiotensin system via a CD36-mediated, redox-dependent pathway[J]. Antioxid Redox Signal, 2013, 18(1): 19-35. DOI:10.1089/ars.2012.4603 |
| [13] |
Piwowar A. Advanced oxidation protein products. Part Ⅰ. Mechanism of the formation, characteristics and property[J]. Pol Merkur Lekarski, 2010, 28(164): 166-9. |
| [14] |
Piwowar A. The advanced oxidation protein products as potential diagnostic and prognostic factor in diseases of the indicated participation of oxidative stress[J]. Postepy Hig Med Dosw, 2014, 68(5): 446-58. |
| [15] |
Kratz EM, Piwowar A. Melatonin, advanced oxidation protein products and total antioxidant capacity as seminal parameters of prooxidant-antioxidant balance and their connection with expression of metalloproteinases in context of male fertility[J]. J Physiol Pharmacol, 2017, 68(5): 659-68. |
| [16] |
Cooper TG, Noonan E, von Eckardstein S, et al. World Health Organization reference values for human semen characteristics[J]. Hum Reprod Update, 2010, 16(3): 231-45. DOI:10.1093/humupd/dmp048 |
| [17] |
Eva, Tvrdá, Anton, et al. Antioxidant efficiency of lycopene on oxidative stress-induced damage in bovine spermatozoa[J]. J Anim Sci Biotechnol, 2017, 7(1): 67-79. |
| [18] |
Aitken RJ, De Iuliis GN, Finnie JM, et al. Analysis of the relationships between oxidative stress, DNA damage and sperm vitality in a patient population: development of diagnostic criteria[J]. Hum Reprod, 2010, 25(10): 2415-26. DOI:10.1093/humrep/deq214 |
| [19] |
Kamkar N, Ramezanali F, Sabbaghian M. The relationship between sperm DNA fragmentation, free radicals and antioxidant capacity with idiopathic repeated pregnancy loss[J]. Reprod Biol, 2018, 18(4): 330-5. DOI:10.1016/j.repbio.2018.11.002 |
| [20] |
Darbandi M, Darbandi S, Agarwal A, et al. Reactive Oxygen species and malereproductive hormones[J]. Reprod Biol Endocrinol, 2018, 16(1): 87. DOI:10.1186/s12958-018-0406-2 |
| [21] |
Kumar N, Singh AK. Reactive Oxygen species in seminal plasma as a causeof male infertility[J]. Gynecol Obstet Hum Reprod, 2018, 47(10): 565-72. DOI:10.1016/j.jogoh.2018.06.008 |
| [22] |
Dorostghoal M, Kazeminejad SR, Shahbazian N, et al. Oxidative stress status and sperm DNA fragmentation in fertile and infertile men[J]. Andrologia, 2017, 49(10): 12762. DOI:10.1111/and.12762 |
| [23] |
Agarwal A, Tvrda E, Sharma R. Relationship amongst teratozoospermia, seminal oxidative stress and male infertility[J]. Reprod Biol Endocrinol, 2014, 27(12): 45. |
| [24] |
Fanaei H, Khayat S, Halvaei I, et al. Effects of ascorbic acid on sperm motility, viability, acrosome reaction and DNA integrity in teratozoospermic samples[J]. Iran J Reprod Med, 2014, 12(2): 103-10. |
| [25] |
Schieber M, Chandel NS. ROS function in redox signaling and oxidative stress[J]. Curr Biol, 2014, 24(10): R453-62. DOI:10.1016/j.cub.2014.03.034 |
| [26] |
Zandieh Z, Vatannejad A, Doosti M, et al. Comparing reactive oxygenspecies and DNA fragmentation in semen samples of unexplained infertile and healthy fertile men[J]. Ir J Med Sci, 2018, 187(3): 657-62. DOI:10.1007/s11845-017-1708-7 |
| [27] |
Houston BJ, Nixon B, King BV, et al. The effects of radiofrequency electromagnetic radiation on sperm function[J]. Reproduction, 2016, 152(6): R263-76. DOI:10.1530/REP-16-0126 |
| [28] |
Aktan G, Dogru-Abbasoglu S, Kucukgergin CA, et al. Mystery of idiopathic male infertility: is oxidative stress an actual risk[J]. Fertil Steril, 2013, 99(5): 1211-5. DOI:10.1016/j.fertnstert.2012.11.045 |
| [29] |
Luczaj W, Skrzydlewska E. DNA damage caused by lipid peroxidation products[J]. Cell Mol Biol Lett, 2003, 8(2): 391-413. |
| [30] |
Colagar AH, Marzony, Chaichi MJ. Zinc levels in seminal plasma are associated with sperm quality in fertile and infertile men[J]. Nutr Res, 2009, 29(2): 82-8. DOI:10.1016/j.nutres.2008.11.007 |
| [31] |
Keshtgar HF, Bahmanpour S, Azad F. In vitro effects of a tocopherol on teratozoospermic semen samples[J]. Andrologia, 2012, 44(Suppl 1): 721-7. |
| [32] |
Kishi K, Ogata H, Ogata S, et al. Frequency of sperm DNA fragmentation according to selection method: comparison and relevance of a microfluidic device and a swim-up procedure[J]. J Clin Diagn Res, 2015, 9(11): QC14-6. |
| [33] |
Simon L, Emery BR, Carrell DT. Review: diagnosis and impact of sperm DNA alterations in assisted reproduction[J]. Best Pract Res Clin Obstet Gynaecol, 2017, 44(12): 38-56. |
| [34] |
Hammadeh ME, Al Hasani S, Rosenbaum P, et al. Reactive oxygen species, total antioxidant concentration of seminal plasma and their effect on sperm parameters and outcome of IVF/ICSI patients[J]. Arch Gynecol Obstet, 2008, 277(6): 515-26. DOI:10.1007/s00404-007-0507-1 |
| [35] |
Hosen MB, Islam MR, Begum F, et al. Oxidative stress induced sperm DNA damage, a possible reason for male infertility[J]. Iran J Reprod Med, 2015, 13(9): 525-32. |
| [36] |
Evgeni E, Charalabopoulos K, Asimakopoulos B. Human sperm DNA fragmentation and its correlation with conventional semen parameters[J]. Reprod Infertil, 2014, 15(1): 2-14. |
| [37] |
Liang XJ, Duan N, Wang YE, et al. Advanced oxidation protein products induce endothelial-to-mesenchymal transition in human renal glomerular endothelial cells through induction of endoplasmic reticulum stress[J]. J Diabetes Complications, 2016, 30(4): 573-9. DOI:10.1016/j.jdiacomp.2016.01.009 |
 2019, Vol. 39
2019, Vol. 39

