2. 空军军医大学西京医院急诊科,陕西 西 安 710032
2. Department of Emergency Medicine, Xijing Hospital, Air Force Medical University, Xi'an 710032, China
失血性休克是严重创伤、骨折、消化道大出血等多种情况的主要致死因素[1]。表现为组织灌注减少, 无氧代谢导致代谢性酸中毒, 血管内皮细胞损伤, 全身炎症反应, 最终发生多器官功能衰竭[2]。缺氧是失血性休克最主要病理改变, 可影响DNA损伤修复和线粒体代谢[3]。线粒体和葡萄糖无氧代谢相关基因的改变可能是损伤持续加重的主要原因[4]。在失血性休克状态下保护血管内皮细胞线粒体功能对失血性休克的能量稳态至关重要。
临床上以控制出血、液体复苏、炎症管理等为主要治疗手段。强调个体化措施以改善微循环、稳定内环境, 并监测相应指标以调整治疗[5-7]。目前没有休克的临床靶向治疗, 仅有应用高迁移率族蛋白B1(HMGB1)抗体在缺血再灌注损伤中保护作用的动物实验研究[8]。明晰休克过程中重要转录因子才能尝试进行靶向干预治疗。休克过程中血管内皮细胞通过HIF家族转录因子[9]和microRNAs(miRNAs)感知和响应环境氧浓度, 并且高度协调代谢反应。我们发现[10], HIF-1α在休克早期减轻休克血管内皮线粒体损伤。miR-186可以与HIF-1α的mRNA靶向结合, 减少HIF-1α蛋白合成[11]。研究休克早期的miR-186及其靶基因HIF-1α的变化, 通过靶向抑制miR-186促进休克早期HIF-1α表达, 从而减轻血管内皮细胞线粒体损伤, 可以为指导休克早期救治提供新的思路和靶向治疗方法。
1 材料和方法 1.1 材料人脐静脉内皮细胞HUVECs由空军军医大学急诊科赠送。蛋白提取试剂盒、BCA蛋白检测试剂盒(北京四正柏生物公司); 兔抗人HIF-1α、β-actin单克隆抗体, 羊抗兔IgG二抗(CST); 细胞RNA微量提取试剂盒(上海生工生物技术公司); 聚丙烯酰胺凝胶电泳凝胶制备试剂盒(西安赫特生物公司); 转染试剂Lipofectamine2000(热默尔); Opti-MEM® I减血清培养基, RPMI 1640培养基, 胎牛血清(Gibco); SYBR Green荧光实时定量PCR试剂盒(TaKaRa); 引物合成由北京奥科生物工程公司完成; 厌氧培养箱(GeneScience)。Azure c400可见荧光Western blot成像系统(Azure Biosystems)。透射电镜由武汉赛维尔生物科技有限公司完成。
1.2 方法 1.2.1 细胞缺氧培养细胞培养:从液氮中取出HUVECs并复苏, 用含10%体积胎牛血清的RPMI 1640培养液培养, 培养条件为37 ℃、5%体积CO2:培养至对数生长期时进行下一步操作。缺氧组以厌氧培养箱培养, 培养条件为O2浓度 < 6%, 培养6 h, 对照组选取正常培养条件下的HUVECs细胞。实验重复3次取3次均值纳入统计。
1.2.2 miRNA-inhibit转染取对数期生长的细胞接种于6 cm平皿, 细胞生长至70%~80%的融合面积时, 使用Opti-MEM® I减血清培养基提取饥饿细胞1 h, miRNA-inhibit与LipofectamineTM 2000脂质体转染试剂按体积比1:1混合, miRNA-inhibit转染浓度为50 nmol/L。转染12 h后, 换为含10%体积胎牛血清的RPMI 1640培养基继续培养48 h后, 然后进行厌氧缺氧培养或者其他实验。干扰组转染miRNA-inhibit, 对照组转染对照inhibit, 实验重复3次取3次均值纳入统计。
1.2.3 实时定量PCR按照锐博生物的poly(A)加尾法将样本反转录成为miRNA。利用SYBR GREEN嵌合荧光原理进行miRNA荧光定量检测, 反应体系为:反转录产物1μL, 前引物0.5 μL联接引物0.5μL, SYBR GREEN 5 μL, 无RNA去离子水3μL。反应程序设置为:1.95 ℃, 持续2 min, 模板变性; 2.95 ℃, 20 s, 60 ℃ 15 s, 循环40次; 熔解曲线设置为:95~70 ℃, 0.5 ℃/次, 恒温时间设置为5 s。HIF-1α采取常规QPCR法检测, miRNA-186以miRNA-U6为内参, HIF-1α以β-anctin为内参, 实验数据用2-△△Ct公式进行相对定量分析, 实验重复3次取3次均值纳入统计, 统计数据以均数±标准差表示。miR-186前引物:CCCGATAAAGCTAG ATAACC; 后引物:CAGTGCGTGTCGTGGAGT。U6前引物:CTCGGCTTCGGCAGCACA; 后引物:AACG CTTCACGAATTTGCGT。HIF-1α前引物CTCAAAg TCggACAgCCTCA; 后引物:CCCTgCAgTAggTTTCTgCT。β-anctin前引物CTCCATCCTGGCCTCGCTGT; 后引物GCTGTCACCTTCACCGTTCC。
1.2.4 Western blot法检测蛋白表达收集细胞, 用预冷的PBS洗2遍, 加RAPA蛋白提取试剂后冰上裂解30 min, 15 000 r/min离心15 min(离心半径3 cm), 收集上清液, BCA试剂盒蛋白定量, 取总量为30 μg的各组样本, 用含10%丙烯酰胺的SDS-PAGE胶进行电泳, 湿转至PVDF膜上, 5%的BSA封闭60 min, 相应一抗4 ℃孵育过夜。洗膜后加二抗室温孵育60 min, 再次洗膜后ECL发光, Western blot成像系统全自动图像采集, 将图像进行定量分析。实验重复3次取3次均值纳入统计, 统计数据以均数±标准差表示。
1.2.5 线粒体膜电位检测缺氧诱导结束后吸除培养液, 用PBS溶液洗涤细胞2次, 加入1 mL JC-1(线粒体膜电位检测试剂JC-1, 化学名:C25H27Cl4N4.I)染色工作液, 充分混匀。在细胞培养箱中37 ℃孵育20 min。吸除上清, 加入JC-1染色缓冲液洗涤2次。吸除缓冲液, 加入2 mL细胞培养液, 荧光显微镜下观察并采集图像, 使用image j图像分析系统分别采集红、绿色荧光的参数, 计算线粒体膜电位(红色荧光/绿色荧光强度比值), 比值越高, 表示线粒体损伤越小。实验重复3次取3次均值纳入统计, 统计数据以均数±标准差表示。
1.2.6 透射电镜观察线粒体损伤处理后的细胞2000 r/min离心5 min, 将细胞离心成薄片后用细针挑离离心管壁, 固定液固定2 h。PBS清洗10遍, 使用丙酮逐级脱水后包埋, 显微镜下切片染色。透射电镜下观察细胞内线粒体结构。应用Flameng半定量分析法计分[12]:随机选择5个视野, 每个视野计数20个线粒体, 按0~4分级计分:0级(0分), 结构正常; Ⅰ级(1分), 基质颗粒丢失; Ⅱ级(2分), 线粒体肿胀, 基质透明; Ⅲ级(3分)线粒体嵴断裂, 基质凝固; Ⅳ级(4分), 线粒体内外膜溶解, 呈空泡状。将100个线粒体总分除以100, 为样本所得分数, 实验重复3次取3次均值纳入统计, 统计数据以均数±标准差表示。
1.2.7 统计学方法所得计量资料首先使用Shapiro- Wilk检验判断数据是否为正态分布, 其中转录组基因表达量、QPCR、WESTERN-BLOT、线粒体损伤分数为正态分布数据, 且方差齐性, 以均数±标准差表示, 所有数据应用Spss13.0统计软件进行分析。正常培养组和缺氧培养组HUVECs、miR-186干扰组与阴性对照组计量资料的比较采用两独立样本t检验, P < 0.05认为差异有统计学意义。
2 结果 2.1 HUVEC缺氧处理后miR-186表达情况缺氧处理6 h后收集HUVECs细胞, qPCR检测miR-186相对表达量, 缺氧组和对照组分别为:2.576± 0.667、1.051±0.182, n=3, 差异有统计学意义(t=3.817, P=0.0188)。缺氧处理后miR-186表达轻度升高(图 1)。

|
图 1 正常培养(对照组)与缺氧诱导(缺氧组)的HUVEC细胞, miR-186表达情况 Fig.1 Expression of miR-186 in normal and hypoxic HUVECs (*P=0.0188) |
干扰组和对照组转染相应miRNA-inhibit 48 h后, qPCR检测干扰组和对照miR-186的相对表达量分别为0.239 ± 0.036、1.035 ± 0.214, 差异有统计学意义(t= 6.350, P=0.0032)(图 2)。

|
图 2 对照组与干扰组的HUVEC细胞, miR-186表达情况 Fig.2 Expression of miR-186 in normal HUVECs and HUVECs with miR-186 interference (**P=0.0032) |
干扰组转染miR-186的miRNA-inhibit、对照组转染阴性对照miRNA-inhibit 48 h后, qPCR检测干扰组和对照组HIF-1α的mRNA相对表达量分别为3.239 ± 0.318、1.077±0.212, 差异有统计学意义(t=9.806, P= 0.0006)。蛋白免疫印迹法检测两组细胞HIF-1α蛋白的表达, 干扰组和对照组HIF-1α的蛋白相对灰度比分别为0.323±0.059、0.168±0.019, 差异有统计学意义(t= 4.315, P=0.0125)。干扰miR-186表达后, HIF-1α表达上升, 说明miR-186通过调控HIF-1α的mRNA, 抑制HIF-1α蛋白的表达(图 3)。

|
图 3 干扰miR-186促进HIF-1α表达 Fig.3 Interference of miR-186 enhances HIF-1α expression in hypoxic HUVECs. A: HIF-1α mRNA expression was significantly higher in HUVECs with miR-186 interference than in the control cells (***P= 0.001).B: Western blotting showing significantly increased expression of HIF- 1α protein in HUVECs with miR-186 interference (**P=0.00 125). β-actin was used as the internal reference protein |
粒体损伤的作用干扰组转染miR-186的miRNA-inhibit、对照组转染阴性对照miRNA-inhibit 48 h后, 缺氧处理6 h后, JC-1法荧光显微镜检测干扰组和对照组线粒体膜电位分别为(87.1±3.1)%、(54.5±4.5)%, 差异有统计学意义(t=5.91, P=0.004)(图 4)。干扰miR-186表达后, 缺氧状态下线粒体损伤加重, HIF-1α参与休克状态下血管内皮细胞能量代谢, 保护线粒体功能。

|
图 4 荧光显微镜下(1:2000), JC-1染色法检测线粒体膜电位图 Fig.4 Fluorescence microscopy showing the mitochondrial membrane potential map of HUVECs with miR-186 and the control cells as detected by JC-1 staining. Red indicates good mitochondrial function and green indicates mitochondrial function damage. The mitochondrial membrane potential was significantly reduced in the interference group as compared with the control group after hypoxia treatment (**P=0.004) |
干扰组转染miR-186的miRNA-inhibit、对照组转染阴性对照miRNA-inhibit 48 h后, 缺氧处理6 h后收集HUVECs细胞, 制备电镜切片并观察线粒体损伤。对照组投射电镜显示线粒体肿胀, 嵴移向周围, 变短及数量减少, 基质内多个局灶性空泡, 基质物质丢失。干扰组线粒体损伤减轻, 干扰组Flameng半定量分析法计分2.783±0.11, 对照组为3.120±0.14, 差异有统计学意义(t=3.310, P=0.0297)(图 5)。
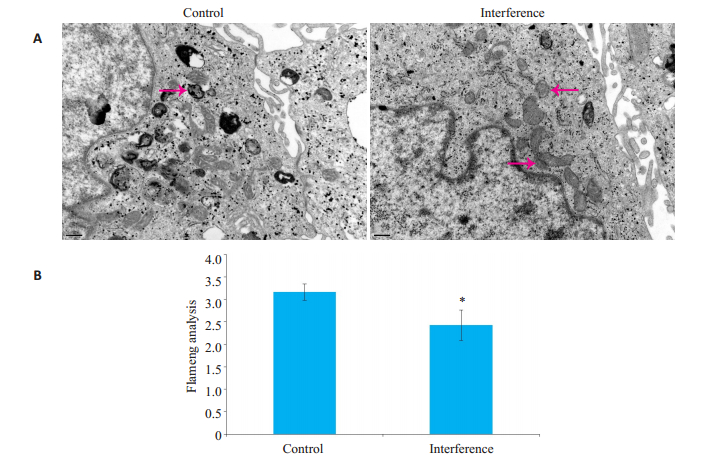
|
图 5 干扰miR-186减轻线粒体损伤 Fig.5 Interference of miR-186 alleviates mitochondrial damage in HUVECs with hypoxic exposure. A: Mitochondrial structure of the cells under electron microscope (arrows indicate the mitochondria); B: Comparison of Flameng scores between the interference group and control group (*P=0.0297) |
失血性休克导致细胞凋亡, 器官损伤和死亡, 以致全身缺氧, 代谢紊乱和全身炎症反应[13]。目前临床对于休克的救治局限于液体复苏和纠正并发症方面, 遵循"抢救生命第一, 保护功能第二, 先重后轻, 先急后缓"的原则。临床上采取的基本治疗措施主要包括控制出血、保持呼吸道通畅、限制性液体复苏、合理止痛以及其他对症治疗, 同时注意损伤控制复苏策略(低压复苏和延迟性液体复苏), 预防创伤凝血病等内容[5-7, 14]。阻断或逆转休克进程的靶向治疗是一个新的研究方向, 有研究发现磷酸肌醇-3-激酶抑制靶向治疗, 可以延长患者对出血的耐受性, 并延长受伤患者的"黄金时段"[15]。靶向治疗需要明显休克进程中的关键机制和重要调控因素, 然而创伤失血性休克是一种十分复杂的生理现象, 导致许多分子途径的失调, 其中线粒体功能保护对休克后的能量稳态至关重要[16-18]。在动物模型中休克后线粒体和葡萄糖氧化相关的许多基因发生改变[19], 很多miRNA和转录因子参与其中。其中miR-34a、miR-122、miR- 155、miR/223、miR-370已有相关报道[20]。HIF-1α是目前研究最深入, 调控最广泛和突出的是转录因子[21]。在缺氧状态下, HIF-1α调控下游众多基因的转录表达, 从而调控多种生理病理过程[22]。同时在缺氧状态下, 多种microRNA也可以参与调控HIF-1α[23]。miR-186是参与HIF-1α转录调控的关键因素, 在肿瘤细胞缺氧耐受中, miR-186可以与低氧诱导因子HIF-1α的mRNA靶向结合, 从而减少HIF-1α蛋白合成。此外miR-186在肿瘤细胞增殖, 体内肿瘤形成, 细胞周期调控等方面均有明确作用[24]。目前已经广泛开展长链非编码RNA调控miR-186/HIF-1α轴, 参与多项疾病进程的研究[11], hsa_circ_0010729靶向miR-186/HIF-1α轴对血管内皮细胞增殖和凋亡的关键调节[25], 长链非编码PVT1可直接与胃癌细胞中的miR-186相互作用, 这导致HIF-1α表达下游的抑制[26]。也有关于miR-186模拟物调控肿瘤进展的研究[27]。但是其在休克中的表达与作用尚无相关研究。
我们通过对休克小鼠的转录组测序发现休克组与对照组相比, 共有3762条差异基因, 其中明显差异的基因有25条。将此25条基因进行GO富集, 发现HIF-1α参与8个主要的GO功能, 且主要在调控血管功能中发挥作用。我们发现HIF-1α通过靶向调控GLUT1的表达, 提高外周血葡萄糖向血管内皮细胞转运, 参与失血性休克早期对血管内皮细胞线粒体功能的保护[10]。休克过程中HIF-1α高表达后是血管内皮细胞代谢状态发生改变, 提高葡萄糖转运, 减轻线粒体损伤。同时缺氧相关miRNA表达, 抑制HIF-1α转录, 加重细胞损伤。干预这一调控和反馈机制或能靶向治疗休克。我们通过给予HUVEC缺氧模拟失血性休克早期血管内皮细胞环境, 发现缺氧培养后miR-186表达轻度升(t=3.817, P=0.0188), 提示miR-186表达的上调可能是机体应对休克的措施, 可能与细胞内ROS和线粒体超氧化物的产生, p53减少和EGFR激活, 控制与线粒体能量代谢相关的基因和涉及miR-7, miR-9, miR-34a, miR-186, miR-381, miR-584-的miRNA调节网络活化有关[28]。通过转染miR-186的miRNA-inhibit, 我们发现干预miR-186, 可以促进HIF-1α表达(t=9.806, P=0.0006), 结果与Tan H[11], 在肿瘤中的研究以及Lin L[29]慢阻肺中发现miRNA-186可能影响HIF-1α依赖性肺结构维持程序的研究一致。为了验证干扰miR-186对血管内皮细胞损伤的作用, 我们在电镜下观察不同组之间线粒体结构, 干扰miR-186明显减轻线粒体损伤(t=3.310, P= 0.0297), 可能与干扰miR-186表达后减轻其对HIF-1α的转录调控, 促进HIF-1α蛋白表达, 改善葡萄糖向线粒体转运和供能有关。随着miRNA特异性antagomir寡核苷酸技术的成熟, 干预miRNA成为了一种方便快捷的疾病靶向治疗的热点[30]。本研究结果只是在细胞层面的发现, 需要建立动物模型进行进一步靶向干预miR-186的研究, 毕竟miR-186参与JAK-STAT、PTENPI3K等多条通路的调控, 需要进一步深入的探讨其在休克中的调控网络与组织细胞的关系。
综上, 本研究从血管内皮细胞线粒体功能变化方面入手, 研究miR-186在其中所起的重要作用, 靶向调控失血性休克后miR-186的表达可能对失血性休克的救治起到一定的作用。
| [1] |
张为, 赵晓东. 创伤失血性休克中的液体复苏[J]. 中华急诊医学杂志, 2019, 28(2): 144-7. |
| [2] |
许硕贵. 创伤失血性休克中的损伤控制[J]. 中华急诊医学杂志, 2018, 27(10): 1076-80. DOI:10.3760/cma.j.issn.1671-0282.2018.10.002 |
| [3] |
栾樱译, 姚咏明. 创伤失血性休克诊治中的病理生理机制[J]. 中华急诊医学杂志, 2018, 27(11): 1189-91. DOI:10.3760/cma.j.issn.1671-0282.2018.11.001 |
| [4] |
Wada H, Kito K, Caskey LS, et al. Cleavage of the C-terminus of NEDD8 by UCH-L3[J]. Biochem Biophys Res Commun, 1998, 251(3): 688-92. DOI:10.1006/bbrc.1998.9532 |
| [5] |
刘双庆, 赵晓东. 创伤失血性休克诊治中国急诊专家共识[J]. 临床急诊杂志, 2017, 27(12): 881-9. |
| [6] |
刘国辉. 创伤失血性休克液体复苏策略[J]. 中华急诊医学杂志, 2018, 27(5): 473-5. DOI:10.3760/cma.j.issn.1671-0282.2018.05.003 |
| [7] |
张连阳, 李阳. 创伤失血性休克进展[J]. 临床急诊杂志, 2018, 19(3): 145-8. |
| [8] |
Deng M, Scott MJ, Fan J, et al. Location is the key to function: HMGB1 in sepsis and trauma-induced inflammation[J]. J Leukoc Biol, 2019, 106(1): 161-9. |
| [9] |
Maria D, Abd J, Stannard G, et al. Hypoxia-inducible factor 1 signalling, metabolism and its therapeutic potential in cardiovascular disease[J]. BBA-Molecular Basis Dis, 2019, 1865(4): 831-43. DOI:10.1016/j.bbadis.2018.09.024 |
| [10] |
陈实, 范金柱, 谢建刚. 缺氧诱导因子-1α改善缺氧血管内皮细胞线粒体损伤的实验研究[J]. 中华创伤骨科杂志, 2019, 3(21): 19-24. |
| [11] |
Tan H, Zhao L. lncRNA nuclear-enriched abundant transcript 1 promotes cell proliferation and invasion by targeting miR-186-5p/ HIF-1α in osteosarcoma[J]. J Cell Biochem, 2019, 120(4): 6502-14. DOI:10.1002/jcb.27941 |
| [12] |
Flameng W, Borgers M, Daenen W, et al. Ultrastructural and cytochemical correlates of myocardial protection by cardiac hypothermia in man[J]. J Thorac Cardiovasc Surg, 1980, 79(3): 413-24. |
| [13] |
Baker RG, Hayden MS, Ghosh S. NF-kappaB, inflammation, and metabolic disease[J]. Cell Metab, 2011, 13: 11-22. DOI:10.1016/j.cmet.2010.12.008 |
| [14] |
冯筑生, 范颖楠, 李俊杰, 等. 低压复苏治疗创伤失血性休克的系统评价[J]. 中华急诊医学杂志, 2016, 25(5): 605-9. DOI:10.3760/cma.j.issn.1671-0282.2016.05.013 |
| [15] |
Black GE, Sokol KK, Shawhan RR, et al. Inducing metabolic suppression in severe hemorrhagic shock: Pilot study results from the Biochronicity Project[J]. J Trauma Acute Care Surg, 2016, 81(6): 1003-11. DOI:10.1097/TA.0000000000001235 |
| [16] |
黄丽, 胡宪文, 张慕春, 等. 线粒体通透性转换孔在七氟醚后处理减轻失血性休克复苏大鼠脑损伤中的作用[J]. 中华麻醉学杂志, 2018, 38(4): 413-6. DOI:10.3760/cma.j.issn.0254-1416.2018.04.008 |
| [17] |
岳云雪, 焦桂青, 张春晖, 等. 线粒体保护剂对失血性休克的干预作用与机制[J]. 中国老年学杂志, 2017, 37(19): 4939-42. DOI:10.3969/j.issn.1005-9202.2017.19.111 |
| [18] |
王齐, 赵自刚, 牛春雨. 线粒体Sirt3活化在重症失血性休克发展进程中的作用[J]. 中国急救医学, 2018(11): 1005-8. DOI:10.3969/j.issn.1002-1949.2018.11.017 |
| [19] |
Ravenna L, Salvatori L, Russo M. HIF3α:the little we know[J]. FEBS J, 2016, 283(6): 993-1003. DOI:10.1111/febs.13572 |
| [20] |
Yang W, Chen J, Meng Y, et al. Novel targets for treating Ischemia- Reperfusion injury in the liver[J]. Int J Mol Sci, 2018, 19(5): E1302. DOI:10.3390/ijms19051302 |
| [21] |
Bertozzi D, Iurlaro R, Sordet O, et al. Characterization of novel antisense HIF-1α transcripts in human cancers[J]. Cell Cycle, 2011, 10(18): 3189-97. DOI:10.4161/cc.10.18.17183 |
| [22] |
Adamovich Y, Ladeuix B, Golik M, et al. Rhythmic Oxygen levels reset circadian clocks through HIF1α[J]. Cell Metab, 2017, 25(1): 93-101. DOI:10.1016/j.cmet.2016.09.014 |
| [23] |
Liu L, Wang Y, Bai R, et al. MiR-186 inhibited aerobic glycolysis in gastric cancer via HIF-1α regulation[J]. Oncogenesis, 2016(5): e224. |
| [24] |
Liao GQ, Liu XP, Wu DH, et al. MORC2 promotes cell growth and metastasis in human cholangiocarcinoma and is negatively regulated by miR-186-5p[J]. Aging, 2019, 11(11): 3639-49. DOI:10.18632/aging.102003 |
| [25] |
Dang RY, Liu FL, Li Y. Circular RNA hsa_circ_0010729 regulates vascular endothelial cell proliferation and apoptosis by targeting the miR-186/HIF-1α axis[J]. Biochem Biophys Res Commun, 2017, 490(2): 104-10. DOI:10.1016/j.bbrc.2017.05.164 |
| [26] |
Huang T, Liu HW, Chen JQ, et al. The long noncoding RNA PVT1 functions as a competing endogenous RNA by sponging miR-186 in gastric cancer[J]. Biomedi Pharmacoth, 2017, 88: 302-8. DOI:10.1016/j.biopha.2017.01.049 |
| [27] |
Terzuoli E, Donnini S, Finetti F, et al. Linking microsomal prostaglandin E Synthase-1/PGE-2 pathway with miR-15a and -186 expression: Novel mechanism of VEGF modulation in prostate cancer[J]. Oncotarget, 2016, 7(28): 44350-64. |
| [28] |
Khachigian LM. The yin and yang of YY1 in tumor growth and suppression[J]. Int J of Cancer, 2018, 143(3): 460-5. DOI:10.1002/ijc.31255 |
| [29] |
Lin L, Sun J, Wu D, et al. MicroRNA-186 is associated with hypoxia-inducible factor-1α expression in chronic obstructive pulmonary disease[J]. Mol Genet Genomic Med, 2019, 7(3): e531. DOI:10.1002/mgg3.531 |
| [30] |
Mei D, Tan WSD, Wong WSF. Pharmacological strategies to regain steroid sensitivity in severe asthma and COPD[J]. Curr Opin Pharmacol, 2019, 46(46): 73-81. |
 2019, Vol. 39
2019, Vol. 39

