2. 广东省人民医院广东省医学科学院科教处,广东 广州 510080;
3. 湖南省郴州市第一人民医院危重病医学科,湖南 郴州 423000
2. Department of Science and Education, Guangdong Provincial People's Hospital/Guangdong Academy of Medical Sciences, Guangzhou 510080, China;
3. Department of Critical Care Medicine, Chenzhou First People's Hospital, Chenzhou 423000, China
吸入性麻醉药广泛应用于临床麻醉中。研究表明,吸入麻醉药物的使用可以引起术后患者认知功能损害及记忆功能障碍[1],常用吸入麻醉药当中,以异氟烷引起的较为明显[2-3]。术后认知功能障碍会损害患者的学习能力、记忆力和空间辨别能力以及延迟长住院时间等,对于术后认知功能障碍,我们该如何认识、预防并加以治疗目前尚无定论[4]。研究表明,海马神经元线粒体形态、功能改变及细胞凋亡在异氟烷介导的术后认知功能障碍中扮演着重要作用[5-6]。乌司他丁具有明显的抗炎、抗细胞凋亡作用[7],其作用主要是通过抑制炎症反应,降低线粒膜高渗透性从而抑制线粒体依赖细胞凋亡信号途径有关[8];使用乌司他丁预防及治疗可以降低术后认知功能障碍(POCD)的发生率,可能与抑制炎症引起的神经细胞通透性增加导致的突出连接障碍有关[9]。已有研究考虑乌司他丁可能通过抑制应激反应及炎症反应起到降低围术期患者POCD的发生率,主要通过检测外周血中炎症因子、神经生化指标以及观察术后POCD发生率做出推断[10-11],但对于其是否对异氟烷引起的海马神经元凋亡的影响及可能的机制尚不明确[9],本研究旨在探讨乌司他丁预处理对异氟烷急性暴露后大鼠海马神经元凋亡的影响及可能机制。
1 方法和材料 1.1 试剂乌司他丁(广州天普);细胞色素C细胞凋亡试剂盒;TUNEL细胞凋亡检测试剂盒(Biovision);JC-1线粒体膜电位试剂盒(Invitrogen);Percoll液(美国通用电气公司);caspase-3抗体(Abcam);H2DCFDA荧光探针;各种酶及培养基(Sigma)。
1.2 分组与模型选择体质量180~220 g的SD雄性大鼠36只(由广东省动物实验中心提供),动物实验取得医院伦理委员会批准,数字表法随机等分为对照组、异氟烷暴露(Iso)组及乌司他丁(UTI)组。3%戊巴比妥钠30 mg/kg腹腔注射麻醉后,将异氟烷组和乌司他丁组大鼠暴露于特制容器中并通以30%氧气作为载体的0.75%异氟烷6 h [12],对照组暴露于30%氧气中,乌司他丁组大鼠在异氟烷暴露前10 min,根据参考文献[7]给予乌司他丁50000 U/kg预处理。
1.3 方法 1.3.1 TUNEL法检测海马细胞凋亡分离大鼠海马组织,切片,根据说明书步骤,以Hoechst标记细胞核,FITC标记TUNEL阳性(凋亡)细胞。
1.3.2 分离海马细胞参考文献[6],分离海马组织并剪碎,加入0.25%胰酶及适当高糖DMEM/F12,胰酶的终浓度约为0.1%。37 ℃细胞箱内的消化25 min,轻吹打后终止消化。60% percoll浓度梯度离心(3000 r/min,15 min),取percoll液面和培养液之间的絮状物,即为海马神经元,纯度达90%以上。
1.3.3 线粒体膜电位(△ψm)检测参照Salvioli S法[13],采用JC-1检测细胞线粒体跨膜电位(△ψm)的变化,JC-1终浓度为5 μmol/L,染色。37 ℃水浴振荡孵育15 min后,用PBS洗涤神经元细胞3次,PBS重悬后用流式细胞仪检测,计数低△ψm细胞(JC-1单体发射的绿色荧光)的细胞百分数(%)以评估线粒体去极化的神经元含量。
1.3.4 细胞色素C释放量的测定参照细胞色素C细胞凋亡试剂盒步骤,提取各组海马神经元包浆蛋白(除线粒体),BCA法蛋白浓度测定,各组蛋白上样量为100 μg,电泳后转PVDF膜,细胞色素C一抗4 ℃孵育过夜,二抗室温孵育2 h,ECL化学发光法,凝胶成像仪曝光成像。
1.3.5 Caspase-3活性检测充分裂解海马组织,参照以上Western blot法检测cleaved caspase-3表达。
1.3.6 细胞内活性氧(ROS)检测参照文献[14],将分离好的海马神经元加入10 μmol/L的H2DCFDA混匀,37 ℃孵育30 min,激光共聚焦显微镜观察,流式细胞仪进行荧光定量检测。
1.4 统计学处理数据以均数±标准差表示,应用SPSS 20.0统计软件进行分析。组间比较使用单因素方差分析和LSD多重比较法,P < 0.05为差异有统计学意义。
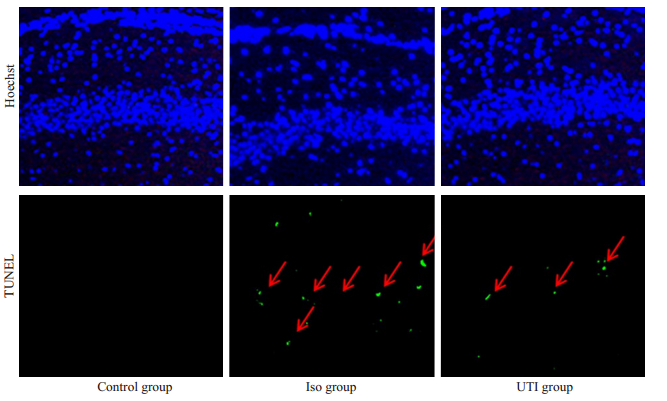
2 结果 2.1 乌司他丁抑制异氟烷介导的海马神经元凋亡TUNEL染色结果显示:与对照组比较,异氟烷暴露后,异氟烷组海马神经元凋亡细胞(21.7±3.5个/视野)显著增加(P < 0.05),乌司他丁组(10.4±2.8个/视野)凋亡细胞比异氟烷组显著降低(P < 0.05,图 1、表 1)。
|
图 1 乌司他丁对海马神经元凋亡的影响 Fig.1 Effect of ulinastatin on apoptosis of the hippocampal neurons (Original magnification: ×200). |
| 表 1 乌司他丁对海马神经元凋亡、线粒体膜电位(△ψm)、线粒体依赖细胞凋亡和神经元细胞内ROS的影响 Tab.1 Effect of ulinastatin on neuronal apoptosis, mitochondrial transmembrane potential (△ψm), mitochondrialdependent neuron apoptosis and cellular ROS level in the hippocampus (Mean±SD, n=12) |
JC-1荧光探针检测结果显示:异氟烷组中低△ψm海马神经元比例为(23.2±5.6)%,较之对照组显著增加(P < 0.05);乌司他丁组中低△ψm海马神经元比例为(14.2±3.2)%,比异氟烷组显著降低(P < 0.05,表 1)。
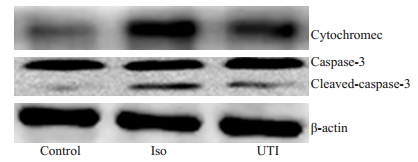
2.3 乌司他丁抑制异氟烷介导的线粒体依赖细胞凋亡Western blot结果显示:与对照组比较,异氟烷组神经元细胞色素C释放增加(P < 0.05),caspase-3活性(cleaved caspase-3)增加(P < 0.05);乌司他丁组细胞色素C释放及caspase-3活性均较异氟烷显著降低(P < 0.05,图 2、表 1)。
|
图 2 乌司他丁对线粒体依赖细胞凋亡的影响 Fig.2 Western blotting of mitochondrion-dependent apoptosisrelated proteins in the hippocampus of rats in the 3 groups. |
H2DCFDA探针结果显示:异氟烷组中细胞内ROS水平为对照组的(203.5±17.1)%,与对照组差异具有显著意义(P < 0.05);乌司他丁组中细胞内ROS水平为对照组的(115.8±13.8)%,较异氟烷组显著降低(P < 0.05,图 3、表 1)。

|
图 3 乌司他丁对细胞内ROS的影响 Fig.3 Effect of ulinastatin on intracellular ROS in the hippocampus of rats in the 3 groups (×100) |
术后认知功能障碍是手术、麻醉等多因素引起的中枢神经系统并发症。目前研究表明,吸入麻醉药可以引起术后认知功能障碍,临床表现为记忆力减退、注意力不集中和空间认知功能障碍等,有些甚至影响日常生活与工作[15-18]。异氟烷在临床麻醉维持中广泛应用,有研究报道,异氟烷麻醉对术后认知功能减退影响明显[13-14, 19-22]。
异氟醚引起术后认知功能障碍的机制并不明确,关于海马依赖性认知功能损害的研究有炎症反应机制和细胞凋亡机制[23-26],但麻醉药物引起的认知功能障碍该如何预防与治疗,尚在探索之中[17, 27]。最近研究表明,异氟烷致神经元内钙稳态失衡,最终触发线粒体途径细胞凋亡,从而参与异氟烷介导的认知功能障碍[3, 6, 28]。Zhang等[29]研究发现异氟醚也可以通过增加大鼠线粒体膜通透性,增加海马区活性氧以及激活caspase-3等损坏学习和记忆[29]。Wu [30]则报道了以线粒体为靶点进行抗神经毒性治疗可以降低异氟醚诱导的老年大鼠认知功能障碍。
乌司他丁,尿胰蛋白酶抑制剂,目前广泛应用于临床。相关研究表明,乌司他丁通过其抗炎作用对急性肺损伤、急性呼吸窘迫综合征、多器官功能衰竭以及脑缺血再灌注损伤等有保护作用[31-32, 9]。目前关于其对POCD的影响尚不明确,可能与抑制炎症因子的释放有关[33]。乌司他丁是否可以通过大脑海马线粒体途径影响异氟醚导致海马神经元凋亡的情况,我们用乌司他丁对异氟烷暴露的大鼠进行预处理,通过TUNEL染色发现,乌司他丁可以显著抑制异氟烷介导的海马神经元凋亡,细胞凋亡分为外源性凋亡和内源性凋亡,内源性凋亡途径即线粒体依赖途径。由于线粒体凋亡途径在异氟烷介导的海马神经元凋亡中发挥重要作用[29, 34],我们通过急性分离提纯海马神经元,检测其线粒体途径凋亡信号,以探讨相关机制。
线粒体损伤是线粒体途径凋亡信号激活的标志。线粒体膜电位是维护线粒体内外物质平衡,保持线粒体功能正常活动所必需的。在细胞凋亡早期,线粒体膜通透性转变孔开放,膜通透性升高,线粒体膜电位下降[35]。而通透性转变孔的开放使得线粒体内细胞色素C及H+等小分子物质“漏出”,H+等的丢失的结果则是线粒体膜电位崩溃,细胞色素C等的释放。通过JC-1荧光探针检测,发现异氟烷暴露以后,海马神经元线粒体膜电位下降,细胞色素C释放至胞质,而乌司他丁预处理则可显著抑制上述改变。线粒体膜间隙的细胞色素C等促凋亡因子自线粒体的释放后触发caspase级联,通过裂解方式激活caspase-9,进而激活下游caspase 3,6,7等,最终导致细胞死亡[36-37],在本研究中,我们通过检测发现,异氟烷暴露可以显著引起海马神经元中cleaved caspase-3表达增加,而乌司他丁预处理则抑制异氟烷介导的cleaved caspase-3表达增加。通过上述结果,我们可以认为异氟烷可以诱导海马神经元线粒体途径凋亡,而乌司他丁则抑制这种改变。
活性氧(ROS)参与线粒体凋亡信号的调节[38-39],过量ROS引发细胞凋亡的机制可能涉及两方面原因,一方面过量ROS造成细胞广泛性氧化损伤,尤其是对细胞内关键靶点如细胞膜、线粒体膜、DNA等造成结构和功能性的氧化损害,激发细胞启动凋亡程序,另一方面,过量的R0S本身作为信号分子,参与、调控凋亡信号的启动和转导。通过H2DCFDA探针检测我们发现,异氟烷组海马神经元中ROS水平明显增加,而乌司他丁预处理组中神经元ROS水平显著下降。以上结果提示乌司他丁可能通过抑制ROS产生参与线粒体途径凋亡的调节。
综上所述,异氟烷可以介导海马神经元线粒体损伤及细胞凋亡,而乌司他丁可以显著改善异氟烷介导的海马神经元线粒体途径的凋亡。另外研究表明,溶酶体损伤参与线粒体损伤的调节[35],即“溶酶体-线粒体损伤轴”,作为一种有效的溶酶体保护剂,乌司他丁是否可以通过保护溶酶体从而参与线粒体凋亡信号的调节,将是我们下一步研究的内容。
| [1] |
Zou YQ, Li XB, Yang ZX, et al. Impact of inhalational anesthetics on postoperative cognitive function Study protocol of a systematic review and meta-analysis[J]. Medicine (Baltimore), 2018, 97(1): e9316. DOI:10.1097/MD.0000000000009316 |
| [2] |
Stratmann G, Sall JW, May LD, et al. Beyond anesthetic properties: the effects of isoflurane on brain cell death, neurogenesis, and LongTerm neurocognitive function[J]. Anesth Analg, 2010, 110(2): 431-7. DOI:10.1213/ane.0b013e3181af8015 |
| [3] |
Liao ZX, Cao DX, Han XE, et al. Both JNK and P38 MAPK pathways participate in the protection by dexmedetomidine against isoflurane- induced neuroapoptosis in the hippocampus of neonatal rats[J]. Brain Res Bull, 2014, 107: 69-78. DOI:10.1016/j.brainresbull.2014.07.001 |
| [4] |
Needham MJ, Webb CE, Bryden DC. Postoperative cognitive dysfunction and dementia: what we need to know and do[J]. Br J Anaesth, 2017, 119(1): I115-25. DOI:10.1093/bja/aex136 |
| [5] |
Li YJ, Zeng MT, Chen WQ, et al. Dexmedetomidine reduces isoflurane-induced neuroapoptosis partly by preserving PI3K/Akt pathway in the hippocampus of neonatal rats[J]. PLoS One, 2014, 9(4): e93639. DOI:10.1371/journal.pone.0093639 |
| [6] |
李世勇.线粒体动力学异常在异氟烷致发育期大鼠神经元毒性中作用及机制研究[D].武汉: 华中科技大学, 2013.
|
| [7] |
Cho YS, Shin MS, Ko IG, et al. Ulinastatin inhibits cerebral ischemiainduced apoptosis in the hippocampus of gerbils[J]. Mol Med Rep, 2015, 12(2): 1796-802. DOI:10.3892/mmr.2015.3612 |
| [8] |
Li G, Li T, Li Y, et al. Ulinastatin inhibits oxidant-induced endothelial hyperpermeability and apoptotic signaling[J]. Int J Clin Exp Pathol, 2014, 7(11): 7342-50. |
| [9] |
Lv ZT, Huang JM, Zhang JM, et al. Effect of ulinastatin in the treatment of postperative cognitive dysfunction: review of current literature[J]. Biomed Res Int, 2016, 2571080. |
| [10] |
Zhang M, Zhang YH, Fu HQ, et al. Ulinastatin May significantly improve postoperative cognitive function of elderly patients undergoing spinal surgery by reducing the translocation of lipopolysaccharide and systemic inflammation[J]. Front Pharmacol, 2018, 9: 1007. DOI:10.3389/fphar.2018.01007 |
| [11] |
Ren KW, Shen N, Tang JL, et al. Effects of ulinastatin on inflammatory response and cognitive function after hip arthroplasty for the elderly patients with femoral neck fracture[J]. Eur Rev Med Pharmacol Sci, 2018, 22(4): 1126-32. |
| [12] |
Jin H, Wang M, Wang J, et al. Paeonol attenuates isoflurans anesthesia-induced hippocampal neurotoxicity via modulation of JNK/ERK/P38MAPK pathway and regulates histone acetylation in neonatal rat[J]. J Matern Fetal Neonatal Med, 2018, 29: 1-11. |
| [13] |
陈云燕, 王兴民, 宋瑞, 等. 重症失血性休克大鼠血小板线粒体变化及虎杖苷的干预作用[J]. 中华创伤杂志, 2013, 29(9): 882-8. DOI:10.3760/cma.j.issn.1001-8050.2013.09.023 |
| [14] |
李涛, 李金河, 李浩波, 等. 高渗氯化钠羟乙基淀粉溶液对蛛网膜下腔出血后脑血管痉挛的影响及机制研究[J]. 中华危重病急救医学, 2014, 26(8): 589-93. DOI:10.3760/cma.j.issn.2095-4352.2014.08.014 |
| [15] |
Tsai TL, Sands LP, Leung JM. An update on postoperative cognitive dysfunction[J]. AdvAnesth, 2010, 28(1): 269-84. |
| [16] |
Bilotta F, Qeva E, Matot I. Anesthesia and cognitive disorders: a systematic review of the clinical evidence[J]. Expert Rev Neurother, 2016, 16(11): 1311-20. DOI:10.1080/14737175.2016.1203256 |
| [17] |
Chi YL, Li ZS, Lin CS, et al. Evaluation of the postoperative cognitive dysfunction in elderly patients with general anesthesia[J]. EurRevMedPharmacolSci, 2017, 21(6): 1346-54. |
| [18] |
Li X, Wei K, Hu R, et al. Upregulation of Cdh1 attenuates IsofluraneInduced neuronal apoptosis and Long-Term cognitive impairments indevelopingrats[J]. FrontCellNeurosci, 2017, 11: 368. |
| [19] |
王强.异氟烷致新生大鼠认知功能障碍与海马P38MAPK通路的关系及其机制研究[D].上海: 第二军医大学, 2011.
|
| [20] |
施庆余, 罗爱林, 李世勇. 异氟烷对发育期大鼠海马IL-1β mRNA, IL- 6mRNA和TNF-αmRNA表达的影响[J]. 中华麻醉学杂志, 2010, 30(3): 324-6. DOI:10.3760/cma.j.issn.0254-1416.2010.03.022 |
| [21] |
赵洪伟, 陆冠宇, 徐志鹏, 等. 异氟烷对老年大鼠学习、记忆能力及海马nNOS表达的影响[J]. 天津医科大学学报, 2010, 16(2): 191-4. DOI:10.3969/j.issn.1006-8147.2010.02.003 |
| [22] |
Hongliang, L iu, Tijun, et al. Isoflurane-induced neuronal apoptosis in developing hippocampal neurons[J]. Neural Regeneration Research, 2013, 8(9): 825-32. |
| [23] |
Cui RS, Wang K, Wang ZL. Sevoflurane anesthesia alters cognitive function by activating inflammation and cell death in rats[J]. Exp TherMed, 2018, 15(5): 4127-30. |
| [24] |
Ni C, Li ZQ, Qian M, et al. Isoflurane induced cognitive impairment in aged rats through hippocampal calcineurin/NFAT signaling[J]. BiochemBiophysResCommun, 2015, 460(4): 889-95. |
| [25] |
Li XM, Zhou MT, Wang XM, et al. Resveratrol pretreatment attenuates the isoflurane-induced cognitive impairment through its anti-inflammation and-apoptosis actions in aged mice[J]. J MolecularNeuroscience, 2014, 52(2): 286-93. |
| [26] |
Jiang S, Miao B, ChenY. Prolonged duration of isoflurane anesthesia impairs spatial recognition memory through the activation of JNK1/ 2inthehippocampusofmice[J]. Neuroreport, 2017, 28(7): 386-90. DOI:10.1097/WNR.0000000000000760 |
| [27] |
Liang B, Fang J. Postnatal isoflurane exposure induces cognitive impairment and abnormal histone acetylation of glutamatergic systems in the hippocampus of adolescent rats[J]. Journal of MolecularNeuroscience, 2016, 60(1): 11-20. |
| [28] |
Kinoshita M, Tsutsumi YM, Fukuta K, et al. Isoflurane-induced postconditioning via mitochondrial calcium-activated Potassium channels[J]. JMedInvest, 2016, 63(1/2): 80-4. |
| [29] |
Zhang Y, Xu Z, Wang H, et al. Anesthetics isoflurane and desflurane differently affect mitochondrial function, learning, and memory[J]. AnnNeurol, 2012, 71(5): 687-98. |
| [30] |
Wu J, Li H, Sun X, et al. A Mitochondrion-Targeted antioxidant ameliorates Isoflurane-Induced cognitive deficits in aging mice[J]. PLoSOne, 2015, 10(9): e0138256. DOI:10.1371/journal.pone.0138256 |
| [31] |
Sun R, Li Y, Chen W, et al. Total ginsenosides synergize with ulinastatin against septic acute lung injury and acute respiratory distresssyndrome[J]. IntJClinExpPathol, 2015, 8(6): 7385-90. |
| [32] |
Li Y, Zhao L, Fu H, et al. Ulinastatin suppresses lipopolysaccharide induced neuro-inflammation through the downregulation of nuclear factor-κB in SD rat hippocampal astrocyte[J]. Biochem Biophys Res Commun, 2015, 458(4): 763-70. DOI:10.1016/j.bbrc.2015.01.155 |
| [33] |
Jiang XM, Hu JH, Wang LL, et al. Effects of ulinastatin on global ischemia via brain pro-inflammation signal[J]. Transl Neurosci, 2016, 7(1): 158-63. |
| [34] |
Li J, Zhu XQ, Yang SZ, et al. Lidocaine attenuates cognitive impairment after isoflurane anesthesia by reducing mitochondrial damage[J]. NeurochemRes, 2019, 44(7): 1703-14. |
| [35] |
Wang X, Song R, Chen Y, et al. Polydatin-- a new mitochondria Protector for acute severe hemorrhagic shock treatment[J]. Expert OpinInvestigDrugs, 2013, 22(2): 169-79. |
| [36] |
Li T, Liu YT, Li GC, et al. Polydatin attenuates ipopolysaccharideinduced acute lung injury in rats[J]. Int J Clin Exp Pathol, 2014, 7(12): 8401-10. |
| [37] |
Lakhani SA, Masud A, Kuida K, et al. Caspases 3 and 7: key mediators of mitochondrial events of apoptosis[J]. Science, 2006, 311(5762): 847-51. DOI:10.1126/science.1115035 |
| [38] |
Sinha K, Das J, Pal PB, et al. Oxidative stress: the mitochondriadependent and mitochondria-independent pathways of apoptosis[J]. ArchToxicol, 2013, 87(7): 1157-80. |
| [39] |
Mates JM, Segura JA, Alonso FJ, et al. Oxidative stress in apoptosis andcancer:anupdate[J]. ArchToxicol, 2012, 86(11): 1649-65. |
 2019, Vol. 39
2019, Vol. 39

