癌症的治疗中,化疗一直以来都是内科治疗的主要手段,通常采用多药物联合化疗。但是由于化疗药物不能特异性的识别肿瘤细胞,所以化疗不仅可以杀死肿瘤细胞,还可以破坏身体其他正常组织细胞。引起诸多副作用[1-6],其中以造血功能损伤最为严重,因而伴有明显的贫血、出血、感染等症状[7],严重者危及生命。目前针对造血功能损伤主要是通过药物辅助治疗[8]来改善患者的病情,然而,这些药物治疗对于部分患者来说存在着诸多副作用,有时甚至无效,且费用昂贵[9-10]。所以我们需要一种更安全、有效、经济的治疗方法来改善化疗后的不良反应,这样就可以提高癌症化疗的安全性,为癌症治疗打下良好的基础。
低强度脉冲超声(LIPUS)作为一种新兴物理疗法,90年代就已获得美国食品药品监督管理局批准。LIPUS已被证实具有促进成骨细胞、成纤维细胞、软骨细胞等细胞的增殖、分化和分泌细胞因子等作用[11-14]。本课题组的前期研究表明LIPUS能促进骨髓间充质干细胞、骨髓有核细胞的增殖[15-16],同时也证明了LIPUS可以治疗环磷酰胺化疗所致的白细胞减少症、提高阿糖胞苷化疗后白细胞计数[17-18]。但前期研究仅证实LIPUS对单一药物化疗所引起的白细胞减少症有效,由于临床均为多药物联合化疗后引起造血功能损伤,因此本研究在前期研究基础之上新采用临床常用化疗方案阿霉素、环磷酰胺联合作用诱发SD大鼠造血损伤[19],进一步探究LIPUS能否改善阿霉素和环磷酰胺联合化疗后大鼠造血功能损伤,并尝试阐述物理方法LIPUS对造血功能损伤的改善机制,为今后化疗所致造血功能损伤的治疗提供新方法。
1 材料和方法 1.1 材料 1.1.1 实验动物健康6~8周龄SD大鼠,80只,体质量180±20 g,均来自于重庆医科大学实验动物中心[生产许可证号:SCXK(渝)2018-0003]。所有实验动物均在相同标准的实验环境[温度:(23±0.5)℃,湿度:(45± 5)%,12 h明暗周期]下饲养一周。本研究符合重庆医科大学实验动物伦理委员会所制定的伦理学标准。
1.1.2 主要实验试剂与检测仪器阿霉素、环磷酰胺(阿拉丁);一次性真空采血管(永康医药);大鼠骨髓单个核细胞分离试剂盒(灏洋华科生物);ELISA试剂盒(西唐生物);低强度脉冲超声治疗仪(海扶医疗);SM2000R型石蜡切片机(Leica);Olympus-BX51型光学显微镜(OLYMPUS);CFX实时定量PCR仪(Bio-Rad);XT- 2000i型全自动五分类血液分析仪(SYSMEX);CytoFLEX流式细胞仪(Beckman Coulter)。
1.2 方法 1.2.1 阿霉素联合环磷酰胺化疗目前国内外化疗的动物模型主要是使用单一药物如环磷酰胺[20-21]、阿糖胞苷[18]、阿霉素[22]等造成小鼠出现化疗副反应,但单一用药缺点明显与临床用药理念不符。故本研究参照单一用药模型构建方法[20-22]和临床一线化疗方案[23],采用阿霉素联合环磷酰胺化疗诱导化疗模型。
1.2.2 实验分组及治疗依据医学统计学所列样本估算公式及附表[24]得到每个时间点样本量应≥4只,为了使实验结果更加准确,本实验每个时间点取6只。将80只大鼠根据性别和体质量进行随机分层分组,对照组和LIPUS组各40只。首先用生理盐水分别溶解阿霉素和环磷酰胺,LIPUS组:按照阿霉素(2 mg/kg)+环磷酰胺(20 mg/kg)的剂量先后腹腔注射,连续给药4 d,LIPUS辐照采用本课题组前期已筛选参数(强度:0.2 W/cm2,频率:0.6 MHz)进行辐照,辐照前进行辐照区域脱毛消毒,并将超声耦合剂涂于辐照区域皮肤,将超声治疗头紧贴大鼠右腿股骨干皮肤,辐照频率20 min/d,连续辐照7 d,辐照过程治疗头位置不可移动。对照组:用药剂量及用药方式与LIPUS组相同,对照组大鼠与LIPUS辐照组操作相同,但不接通电源。
1.2.3 指标的采集与检测 1.2.3.1 一般情况实验过程中观察并记录大鼠的精神状态、皮肤毛发色泽、腹泻情况、运动情况以及重量变化和死亡时间等情况。
1.2.3.2 血常规检测于给药第0、4、7、9、11、14、18天(n=6),将大鼠麻醉后,剃除心前区毛发酒精棉球消毒,取注射器于左侧胸骨下倾斜30°进针抽取心脏血0.5 mL快速注入一次性真空采血管(含EDTA)中,上下颠倒采血管混匀抗凝,2 h之内将采好的血液送至重庆医科大学宠物医院进行血常规检测。
1.2.3.3 实时荧光定量PCR检测骨髓造血相关因子表达采用Trizol试剂从骨髓中提取和纯化总RNA,按照逆转录试剂盒说明书的操作步骤,逆转录为cDNA。接着应用SYBR Green进行实时定量PCR反应。反应结束后,Bio-Rad Prime PCR软件分析荧光信号数据,计算各反应管的Ct值,以β-actin作为内参并与对侧比较,采用2-△△Ct法进行定量。所需引物用Primer3.0在线软件设计,由上海生工生物工程股份有限公司合成(表 1)。
| 表 1 引物序列 Tab.1 Primer sequences |
分别于给药第0、4、11天(n=6)将大鼠颈椎脱臼处死,剃除右后肢毛发消毒皮肤后解剖剥离右侧股骨,于4%多聚甲醛溶液中固定骨组织,经过脱水、脱钙、石蜡包埋、切片、染色。光学显微镜下观察骨髓细胞的形态结构和造血组织,每个组织观察10个(×40倍)视野。
1.2.3.5 ELISA检测IL-3和GM-CSF以1000 r/min离心10分钟从骨髓中分离骨髓上清。根据试剂盒的说明,使用ELISA试剂盒检测骨髓上清IL-3和GMCSF。通过95%的置信区间计算IL-3和GM-CSF的正常值上下限。
1.2.3.6 骨髓细胞凋亡检测用2 mL注射器将骨髓冲出,收集悬液到离心管中,反复吹打成单细胞悬液,悬液经70 μm无菌筛网过滤,离心弃上清,用样本稀释液重悬细胞浓度至2×108/mL~1×109/ mL的单细胞悬液,取部分样本采用流式细胞仪进行骨髓细胞凋亡检测。细胞总凋亡率=早期凋亡率(UR)+晚期凋亡率(LR)。
1.3 统计学分析采用SPSS 25.0软件对数据进行统计分析。各项数据均采用均数±标准差表示,采用单因素方差分析比较多样本均数,其中两两比较采用LSD-t法。P<0.05认为差异有统计学意义。
2 结果 2.1 血常规变化如图 1所示,化疗4 d后白细胞急剧下降,第11天白细胞上升显著(P<0.05),并且第11、14、18天与对照组相比升高明显(P<0.05);LIPUS组仅在第11、14天红细胞高于对照组,但差异不明显(P>0.05);LIPUS组和对照组血小板在给药后第7天下降至一个低水平,而后出现了明显的上升但并无差异,直到第18天,两组相比才有差异(P<0.05)。
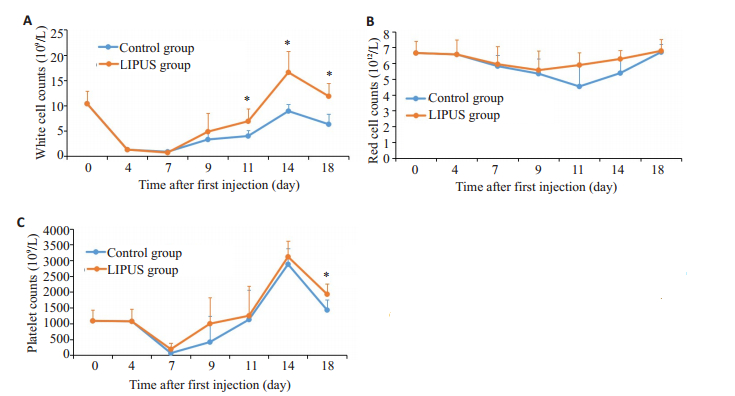
|
图 1 LIPUS组和对照组血常规变化 Fig.1 Blood routine changes in LIPUS group and control group. A: White cell counts; B: Red blood cell counts; C: Platelet counts. *P<0.05 vs Control group |
如图 2所示,比较骨髓ICAM-1(细胞间黏附分子-1)、VCAM-1(血管细胞黏附分子-1)、SCF(干细胞因子)的mRNA水平。ICAM-1:LIPUS组和对照组与化疗后相比均有明显增高(P=0.000,P=0.045),LIPUS组与对照组相比差异极为显著(P=0.001);VCAM-1:LIPUS组和对照组与化疗后相比均有明显增高(P=0.000,P=0.003),LIPUS组与对照组相比差异显著(P=0.000);SCF:LIPUS组和对照组与化疗后相比均有明显增高(P=0.000,P= 0.011),但两组间差异无统计学意义(P=0.058)。
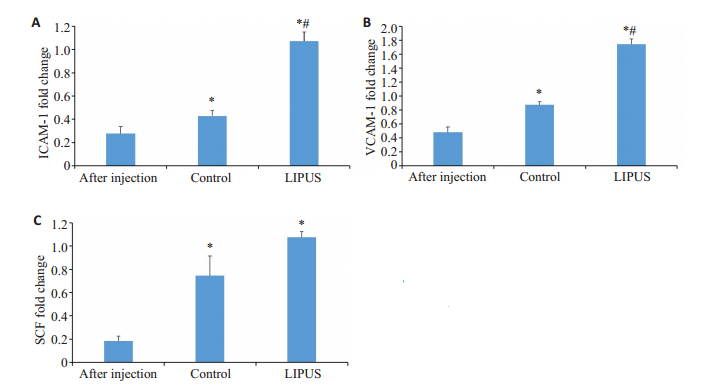
|
图 2 大鼠骨髓造血调控因子 Fig.2 Hematopoietic regulatory factor in rat bone marrow. A: ICAM-1; B: VCAM-1; C: SCF. *P<0.05 vs After injection. #P<0.05 vs Control group |
如图 3所示,比较各组骨髓组织病理组织切片,可见正常大鼠骨髓造血组织丰富,结构完整(图 3A)。给药后,骨髓增生降低,巨核细胞减少或消失,脂肪细胞增加,造血组织减少(图 3B)。给药后第7天,对照组造血组织细胞虽增加,但仍未恢复正常(图 3C);LIPUS组与对照组相比造血组织丰富,且已恢复至正常水平(图 3D)。
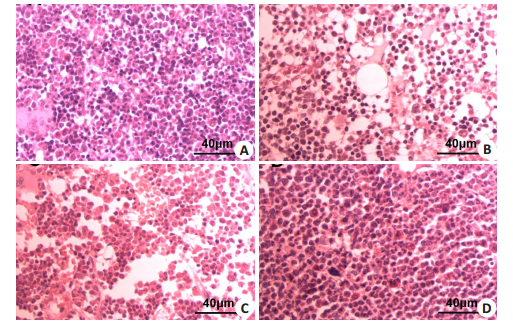
|
图 3 大鼠骨髓组织病理切片 Fig.3 Cross sections of bone marrow of the rat (HE staining, Original magnification: × 400). A: bone marrow of normal rats; B: Bone marrow of a rat 4 days after chemotherapy; C: Bone marrow of a rat after 7 days of pseudoirradiation with LIPU; D: Bone marrow of a rat after 7 days of LIPUS irradiation |
随后采用Image J图像分析软件对已拍摄的骨髓组织病理切片(n=10)进行量化统计分析镜下造血组织面积百分比(图 4),由图可见对照组第4天造血组织面积下降有统计学意义(P<0.05)且第0天、第4天与第11天均有统计学意义(P<0.05),提示造血组织部分恢复;LIPUS组第4天造血组织下降明显(P<0.05),第11天与第4天相比存在显著差异(P<0.05),第0天与第11天相比无明显差异(P>0.05)。LIPUS组与对照组对比,第11天两组间存在显著差异(P<0.05)。
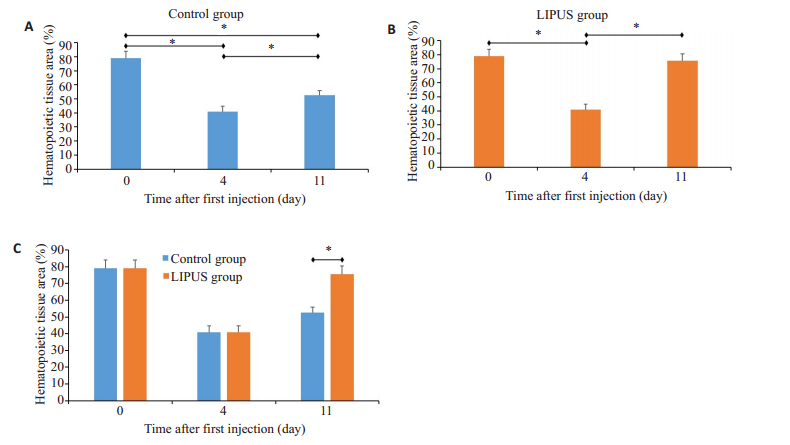
|
图 4 大鼠造血组织面积 Fig.4 Changes in hematopoietic tissue area in the bone marrow of the rats. A: Changes in the control group; B: Changes in the LIPUS group; C: Comparison between LIPUS group and the control group. *P<0.05 |
|
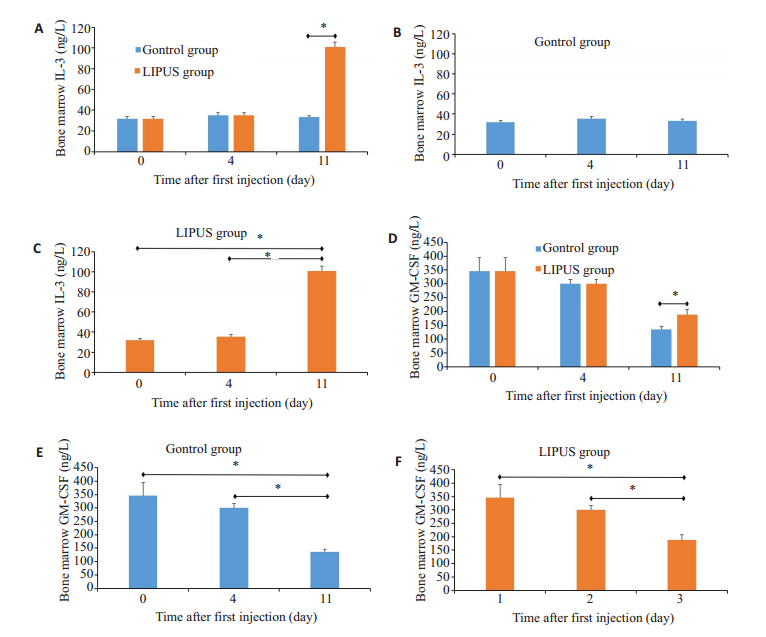
图 5 大鼠骨髓上清造血因子 Fig.5 Levels of IL-3 and GM-CSF in the bone marrow supernatant detected by ELISA on days 0, 4, and 11. A: Comparison of IL-3 levels between LIPU group and control group; B: Changes in IL-3 level in the control group; C: Changes in IL-3 level in LIPUS group; D: Comparison of GM-CSF level between LIPU group and control group; E: Changes in GM-CSF in the control group; F: Changes in GM-CSF level in LIPUS group. *P<0.05 |
|
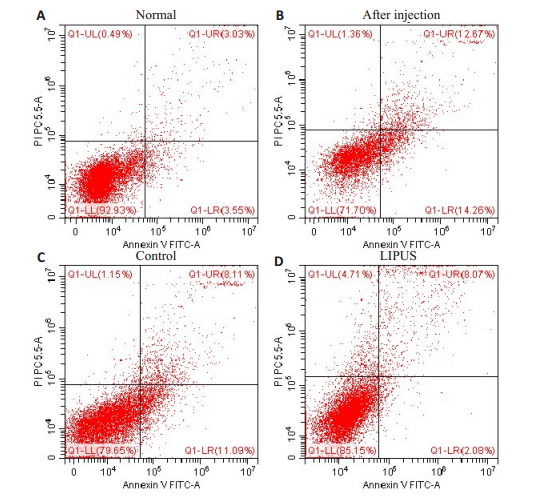
图 6 骨髓细胞凋亡 Fig.6 Bone marrow cell apoptosis in the two groups. A: Cell apoptosis in normal rat bone marrow; B: Apoptosis of rat bone marrow cells after 4 days of chemotherapy; C: Apoptosis of rat bone marrow cells after 7 days of pseudo-irradiation; D: Apoptosis of rat bone marrow cells after 7 days of LIPUS irradiation |
在第0,4和11天比较大鼠骨髓上清IL-3和GMCSF的表达。IL-3:对照组未见明显变化,而LIPUS在第11天升高显著与对照组相比有统计学意义(P<0.05);GM-CSF:给药后,对照组和LIPUS组含量开始下降,至第11天LIPUS组高于对照组(P<0.05)。
2.5 骨髓细胞凋亡采用Annexin V-FITC/PI双染法流式细胞术检测细胞凋亡,其凋亡结果显示:LIPUS组与对照组相比骨髓细胞凋亡率显著减少(P<0.05)。总凋亡率分别为(6.56 ± 0.52)%、(27.81 ± 4.56)%、(18.51 ± 4.07)%、(10.11±1.37)%。
3 讨论近年来,全球癌症新增病例和死亡病例呈逐年上升趋势[25]。目前为止恶性肿瘤尚且没有经济、快速、有效的解决办法,化疗仍是中晚期恶性肿瘤的主要治疗手段。阿霉素和环磷酰胺广泛应用于临床治疗,但杀伤肿瘤细胞的同时杀伤自身细胞,尤其是新生细胞,主要表现为造血细胞减少、白细胞计数和血小板计数降低,这将导致机体免疫下降,易感性增高,出血倾向等副反应,个别甚至可能危及生命。因此,寻找缓解化疗后血细胞减少、免疫下降的快速、有效、经济的治疗手段已经迫在眉睫。
联合化疗优点众多,主要是由于联合化疗可以去除耐药因素,从而减少了癌细胞产生耐药的可能性。但目前造血损伤模型仍然主要是采用单药诱导,缺点明显且与临床治疗方案不符,所以本实验综合动物实验和临床方案[19-23]采用阿霉素联合环磷酰胺的方案进行化疗。
近年来,LIPUS已被广泛应用到关节软骨再生[26]、软组织修复[27]、抗感染和梗塞[28]、神经再生[29]和血管溶栓[30]等领域。Akiyama [31]也曾做过低频超声与高频超声对颅骨穿透性的研究,与高频超声相比,虽然低频超声穿过骨质的能量有所衰减,但其穿透性优于高频超声,能更有效的发挥作用。同时,LIPUS为低强度脉冲发射,能有效避免因强度高、连续辐照所带来的发热、皮肤损伤等副作用,具有经济便捷、安全有效等优点。
研究结果显示,LIPUS具有改善造血、提高免疫的作用。通过对血常规分析发现,LIPUS能促进化疗后白细胞恢复,能缓解红细胞下降,表明LIPUS能修正化疗后白细胞、红细胞降低。通过对骨髓SCF、ICAM-1、VCAM-1等造血相关因子分子的检测,发现其中LIPUS组SCF虽高于对照组,但差异不显著,这并不能说明LIPUS对SCF无影响,Zhao等[32]就曾发现SCF促进造血和血管发生是一个缓慢的过程,SCF的升高需要一段时间,所以可能由于SCF升高所需的时间比ICAM-1、VCAM-1要多,而在本实验中未能观测到SCF明显升高,我们下一步也将对SCF展开更加深入的研究;LIPUS组与对照组相比能显著的提升ICAM-1、VCAM-1的水平;而ICAM-1和VCAM-1已经被证实可参与造血干/祖细胞的动员、归巢、增殖和分化等[33],VCAM-1能在骨髓基质细胞上表达,因此参与早期血液祖细胞的归巢[34],ICAM-1能通过磷酸化激活特异性激酶,导致转录因子激活和细胞因子产生增加,细胞膜蛋白表达增加,活性氧物质产生和细胞增殖[35-36],这表明LIPUS可以通过提升ICAM-1和VCAM-1的水平来改善造血。LIPUS组和对照组相比,造血组织的增加尤为显著,在LIPUS治疗后造血组织已经到达正常水平,表明LIPUS能够促进造血组织的恢复。IL-3和GM-CSF作为造血生长因子在造血过程中起协同作用,IL-3可刺激多能干细胞和多种祖细胞的增殖与分化,GM-CSF对髓系干细胞到成熟粒细胞的增殖与分化过程均有刺激作用,而在LIPUS治疗后两者均出现增高,表明LIPUS可促进造血因子的分泌从而达到促进造血的目的。化疗在治疗肿瘤时通过外源性途径加快细胞凋亡[37],而在经过LIPUS辐照后骨髓细胞凋亡减少。同时,LIPUS辐照处皮肤、精神状态、饮食以及活动度均未见异常,表明LIPUS无明显不良反应。
综上所述,采用阿霉素+环磷酰胺(2 mg/kg+20 mg/ kg)能诱发较长时间的造血损伤,符合临床用药思路和实验要求。LIPUS可通过纠正血细胞下降、增加造血组织来改善造血,可能是因为其能提升ICAM-1、VCAM-1水平和IL-3、GM-CSF所致。
| [1] |
Javarappa KK, Tsallos D, Heckman CA. A multiplexed screening assay to evaluate chemotherapy-induced myelosuppression using healthy peripheral blood and bone marrow[J]. Slas Discovery, 2018, 23(7, SI): 687-96. |
| [2] |
Staff NP, Grisold A, Grisold W, et al. Chemotherapy-induced peripheral neuropathy: A current review[J]. Ann Neurol, 2017, 81(6): 772-81. DOI:10.1002/ana.v81.6 |
| [3] |
Yoshimura A, Noro R, Miyanaga A, et al. Combination chemotherapy of alternating etoposide and carboplatin with weekly administration of irinotecan and cisplatin in extensive-stage smallcell lung cancer[J]. Anticancer Res, 2012, 32(10): 4473-8. |
| [4] |
Varricchi G, Marone G, Mercurio V, et al. Immune checkpoint inhibitors and cardiac toxicity: an emerging issue[J]. Curr Med Chem, 2018, 25(11): 1327-39. DOI:10.2174/0929867324666170407125017 |
| [5] |
Glass CK, Mitchell RN. Winning the battle, but losing the war: mechanisms and morphology of cancer-therapy-associated cardiovascular toxicity[J]. Cardiovasc Pathol, 2017, 30: 55-63. DOI:10.1016/j.carpath.2017.06.009 |
| [6] |
胡红, 王利. 抗肿瘤药物所致不良反应调查与分析[J]. 中医临床研究, 2017, 9(35): 51-3. DOI:10.3969/j.issn.1674-7860.2017.35.024 |
| [7] |
Barreto JN, Mccullough KB, Ice LL, et al. Antineoplastic agents and the associated myelosuppressive effects: a review[J]. J Pharm Pract, 2014, 27(5): 440-6. DOI:10.1177/0897190014546108 |
| [8] |
Lalami Y, Klastersky J. Impact of chemotherapy-induced neutropenia (CIN) and febrile neutropenia (FN) on cancer treatment outcomes: An overview about well-established and recently emerging clinical data[J]. Crit Rev Oncol Hematol, 2017, 120: 163-79. DOI:10.1016/j.critrevonc.2017.11.005 |
| [9] |
Chen W, Rizzieri D, Drago S. Safety of growth factor administration for leukapheresis in those with WBC counts greater than 60000/μL[J]. J Clin Apher, 2015, 30(1): 28-31. DOI:10.1002/jca.v30.1 |
| [10] |
Chen SH, Yang SH, Chu SC, et al. The role of donor characteristics and post-granulocyte colony-stimulating factor white blood cell counts in predicting the adverse events and yields of stem cell mobilization[J]. Int J Hematol, 2011, 93(5): 652-9. DOI:10.1007/s12185-011-0844-5 |
| [11] |
Uddin SM, Qin YX. Enhancement of osteogenic differentiation and proliferation in human mesenchymal stem cells by a modified low intensity ultrasound stimulation under simulated microgravity[J]. PLoS One, 2013, 8(9): e73914. DOI:10.1371/journal.pone.0073914 |
| [12] |
Jia L, Chen J, Wang Y, et al. Focused low-intensity pulsed ultrasound affects extracellular matrix degradation via decreasing chondrocyte apoptosis and inflammatory mediators in a surgically induced osteoarthritic rabbit model[J]. Ultrasound Med Biol, 2016, 42(1): 208-19. DOI:10.1016/j.ultrasmedbio.2015.08.010 |
| [13] |
Fung CH, Cheung WH, Pounder NM, et al. Osteocytes exposed to far field of therapeutic ultrasound promotes osteogenic cellular activities in pre-osteoblasts through soluble factors[J]. Ultrasonics, 2014, 54(5): 1358-65. DOI:10.1016/j.ultras.2014.02.003 |
| [14] |
杜登悝, 陈世荣, 易刚, 等. 低强度脉冲超声促进人骨性关节炎软骨细胞合成细胞外基质[J]. 细胞与分子免疫学杂志, 2016, 32(11): 1536-40. |
| [15] |
于海生.低强度脉冲超声促进骨髓来源细胞增殖的研究[D].[重庆]: 重庆医科大学, 2012.
|
| [16] |
于海生, 陈文直, 王嫣, 等. 低强度脉冲超声对体外培养的骨髓间充质干细胞增殖效应的研究[J]. 中国医科大学学报, 2011, 11: 971-4. |
| [17] |
Liu B, Luo Y, Luo D, et al. Treatment effect of low intensity pulsed ultrasound on leukopenia induced by cyclophosphamide in rabbits[J]. Am J Transl Res, 2017, 9(7): 3315-25. |
| [18] |
张愉, 何瑞欣, 周微尘, 等. 低强度脉冲超声对阿糖胞苷所致新西兰兔白细胞、血小板减少的影响[J]. 重庆医科大学学报, 2015, 12: 1503-9. |
| [19] |
Singh JC, Mamtani A, Barrio A, et al. Pathologic complete response with neoadjuvant doxorubicin and cyclophosphamide followed by paclitaxel with trastuzumab and pertuzumab in patients with HER2- Positive early stage breast cancer: a single center experience[J]. Oncologist, 2017, 22(2): 139-43. DOI:10.1634/theoncologist.2016-0268 |
| [20] |
Que L, He L, Yu CS, et al. Activation of Nrf2-ARE signaling mitigates cyclophosphamide-induced myelosuppression[J]. Toxicol Lett, 2016, 262: 17-26. DOI:10.1016/j.toxlet.2016.09.003 |
| [21] |
于冬冬, 牛云云, 路玫, 等. 针灸对CTX小鼠骨髓细胞DNA修复基因XRCC1和ADPRT的调控作用[J]. 中国中医基础医学杂志, 2018(9): 1270-2. |
| [22] |
凌兰兴, 吴桂甫, 杨小叶, 等. 针刺对阿霉素所致大鼠骨髓抑制的保护作用[J]. 中国医药指南, 2013, 12: 467-8. |
| [23] |
赵静, 张晓彤, 胡克, 等. 紫杉醇联合卡铂三周方案同步胸部放疗治疗不宜手术的局部晚期非小细胞肺癌疗效和安全性研究:一项来自单中心的回顾性研究[J]. 中国肺癌杂志, 2016, 19(11): 731-7. DOI:10.3779/j.issn.1009-3419.2016.11.03 |
| [24] |
颜虹. 医学统计学[M]. 北京: 人民卫生出版社, 2010.
|
| [25] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [26] |
Jia XL, Chen WZ, Zhou K, et al. Effects of low-intensity pulsed ultrasound in repairing injured articular cartilage[J]. Chin J Traumatol, 2005, 8(3): 175-8. |
| [27] |
Lu HB, Liu FF, Chen HB, et al. The effect of low-intensity pulsed ultrasound on bone-tendon junction healing: Initiating after inflammation stage[J]. J Orthop Res, 2016, 34(10): 1697-706. DOI:10.1002/jor.v34.10 |
| [28] |
Yang PF, Li D, Zhang SM, et al. Efficacy of ultrasound in the treatment of osteoarthritis of the knee[J]. Orthop Surg, 2011, 3(3): 181-7. DOI:10.1111/os4.2011.3.issue-3 |
| [29] |
Mourad PD, Lazar DA, Curra FP, et al. Ultrasound accelerates functional recovery after peripheral nerve damage[J]. Neurosurgery, 2001, 48(5): 1136-40. |
| [30] |
Nesser HJ, Karia DH, Tkalec W, et al. Therapeutic ultrasound in cardiology[J]. Herz, 2002, 27(3): 269-78. DOI:10.1007/s00059-002-2362-y |
| [31] |
Akiyama M, Ishibashi T, Yamada T, et al. Low-frequency ultrasound penetrates the cranium and enhances thrombolysis in vitro[J]. Neurosurgery, 1998, 43(4): 828-32. DOI:10.1097/00006123-199810000-00062 |
| [32] |
Zhao LR, Singhal S, Duan WM, et al. Brain repair by hematopoietic growth factors in a rat model of stroke[J]. Stroke, 2007, 38(9): 2584-91. DOI:10.1161/STROKEAHA.106.476457 |
| [33] |
王改琴, 吴宏. VCAM-1、ICAM-1与造血干细胞的动员、归巢及作用机制[J]. 国际检验医学杂志, 2007, 28(12): 1114-6. DOI:10.3969/j.issn.1673-4130.2007.12.022 |
| [34] |
Schlesinger M, Bendas G. Vascular cell adhesion molecule-1(VCAM-1)--an increasing insight into its role in tumorigenicity and metastasis[J]. Int J Cancer, 2015, 136(11): 2504-14. DOI:10.1002/ijc.v136.11 |
| [35] |
Sarecka-Hujar B, Zak I, Krauze J. Interactions between rs5498 polymorphism in the ICAM1 gene and traditional risk factors influence susceptibility to coronary artery disease[J]. Clin Exp Med, 2009, 9(2): 117-24. DOI:10.1007/s10238-008-0022-0 |
| [36] |
Hubbard AK, Rothlein R. Intercellular adhesion molecule-1(ICAM- 1) expression and cell signaling cascades[J]. Free Radical Bio Med, 2000, 28(9): 1379-86. DOI:10.1016/S0891-5849(00)00223-9 |
| [37] |
Goldar S, Khaniani MS, Derakhshan SM, et al. Molecular mechanisms of apoptosis and roles in cancer development and treatment[J]. Asian Pac J Cancer Prev, 2015, 16(6): 2129-44. DOI:10.7314/APJCP.2015.16.6.2129 |
 2019, Vol. 39
2019, Vol. 39

