非小细胞肺癌在肺癌中约占80%,发病率逐年上升[1],多数患者在确诊时已处于肺癌晚期,且伴有局部或远隔脏器转移,因此非小细胞肺癌的首选治疗方式仍为化疗[2-3]。肿瘤转移是导致肿瘤患者死亡的主要原因[4-5],而SRC酪氨酸激酶与肿瘤细胞的生长、转移、细胞信号传导、血管的新生密切相关,已被公认为是重要的抗肿瘤作用靶点[6-8]。肿瘤细胞的转移受多种因素影响,为肿瘤治疗的研究热点[14-16]。有研究表明,SRC激酶的活化状态与缝隙连接蛋白(Cx)的表达相关,SRC激酶可以通过磷酸化Cx43,调控细胞缝隙连接功能[9-11]。抑制SRC激酶可以抑制肺癌细胞的增殖[12],其抑制剂PP2可以抑制癌细胞的迁移侵袭[13]。但PP2能否影响肺癌细胞A549侵袭转移能力及其相关机制尚未可知。因此,本研究重点观察SRC激酶抑制剂PP2对肺癌细胞A549侵袭转移能力的影响,并进一步探讨其机制,为临床化疗中靶向抑制肿瘤转移提供治疗新方向。
1 材料和方法 1.1 细胞和试剂肺癌细胞株A549蚌埠医学院药理实验室冻存。SRC激酶抑制剂PP2(Sigma),噻唑蓝(MTT)(Sigma),二甲基亚砜(Sigma),胰酶(Sigma);RPMI培养基(Gibco);胎牛血清(四季青公司);Cx43过表达质粒(mCx43)、SiRNA由上海吉玛基因设计合成;Cx43抗体,MMP-2抗体(Sigma),GAPDH单克隆抗体(Proteintech),Goat Anti-Mouse IgG(Proteintech),Goat Anti-Rabbit IgG抗体(Proteintech),蛋白Marker(Thermo)。
1.2 方法 1.2.1 细胞培养肺癌细胞A549培养于含10%胎牛血清、100 U/mL青霉素及100 mg/L链霉素的RPMI培养基内,置于5% CO2、37 ℃及饱和湿度的细胞培养箱中传代培养,传代时使用0.25%的胰酶细胞消化液处理,传代比例约为1:2。
1.2.2 MTT法检测PP2对肺癌细胞的增殖抑制作用取生长状态良好的A549肺癌细胞,计数后按照5×104/mL的密度接种至96孔板,每孔加入细胞悬液200 µL,于培养箱内培养24 h,加入不同浓度药物PP2 [终浓度依次为1、4、8、16、32 µmol/L,每组设置6个平行复孔,并设置阴性对照组(不加药,含有正常状态的细胞)],药物分别处理24、36、48 h后,每孔内加入20 µL、浓度为5 g/L的MTT,培养箱中继续培养4 h后,弃上清液,每孔加入二甲基亚砜(DMSO)200 µL,继续于37 ℃培养箱中放置30 min使DMSO与细胞内物质充分接触反应后测定A490nm,并计算细胞存活率。
1.2.3 贴壁细胞转染取生长状态良好的肺癌细胞A549,计数后按照4~5×105/mL的密度接种于六孔板内,每孔加入细胞悬液2 mL,置于培养箱中继续培养,使细胞24 h内融合度达到70%~90%;SiRNA(或过表达质粒)和Lipofectamin2000各5 µL,分别与50 µL无血清Opti-MEM混合,轻柔混匀,室温放置5 min,将稀释好的SiRNA(或过表达质粒)和Lipofectamin2000试剂混合,轻柔混匀,室温放置20 min,以便形成SiRNA(或过表达质粒)/Lipofectamin2000复合物,孔板内细胞用PBS清洗2次后加入无血清RPMI培养基,再将形成的复合物加入到含细胞和培养基的培养孔板中,来回轻柔摇晃细胞培养板,细胞在5% CO2、37 ℃及饱和湿度的细胞培养箱中继续培养12 h后更换为含有10%胎牛血清的RPMI,继续培养至24 h,进行转染后其他操作。
1.2.4 Western blot检测细胞内Cx43、MMP-2蛋白表达SRC激酶抑制剂PP2(终浓度依次为0、1、2、4、8、16 µmol/L)、过表达质粒和SiRNA,分别作用于细胞24 h后,消化并收集细胞,加入裂解液于冰上裂解30 min,后在四度离心机12 000 r/min离心30 min,收集上清液,BCA蛋白定量法(参照试剂盒说明书操作)测各组蛋白浓度,用细胞裂解液将各组蛋白稀释至相同浓度,与一定量5×上样缓冲液4:1混合,100 ℃煮沸5 min使蛋白变性。经SDS-PAGE电泳(10%分离胶)分离后电转印至PVDF膜上。5%脱脂牛奶室温封闭2 h;Cx43一抗(1:2000稀释,使用一抗稀释液稀释)4 ℃孵育过夜;取出用TPBS洗涤3次,10 min/次;Goat Anti-Mouse IgG(1:5000稀释,使用TPBS稀释)室温孵育2 h;TPBS洗涤3次,10 min/次,ECL发光试剂盒显影曝光。BioRad凝胶成像系统采集图像。以GAPDH为内参对照,蛋白表达强度以Cx43、MMP-2蛋白表达灰度值与GAPDH灰度值的比值表示。
1.2.5 划痕实验检测细胞体外转移能力取生长状态良好的肺癌细胞A549,酶解计数后按照5×105/mL接种至六孔板内,每孔加入细胞悬液2 mL;继续培养24 h,使细胞融合度达到90%以上,弃原孔板内上清液,使用PBS清洗2遍,用200 µL移液枪枪头在孔板内划竖向垂直于培养板的“一”字痕,用PBS清洗3遍,洗去上清液中不贴壁的细胞,不同孔内加入不同浓度的用不含血清的RPMI培养基配制的SRC激酶抑制剂PP2(药物浓度为0、1、2、4、8、16 µmol/L)2 mL,放入培养箱内继续培养,分别取药物作用0、12、24 h,置于倒置显微镜下拍照(100×),每孔拍6张照片,对比不同药物浓度、不同作用时间的细胞转移情况,采用ImageJ2x统计划痕愈合面积,使伤口愈合面积标准化,即实验处理组与对照组相比得到创伤愈合百分比,进行统计学分析。
1.2.6 Transwell实验检测细胞体外侵袭能力预先在上室平铺50 µL的Matrigel胶(基质胶与无血清培养基1:4混合),在37 ℃培养箱内聚合4 h;取对数生长期的细胞A549,胰酶消化为单个细胞后,用无血清培养基将其制成单细胞悬液,计数后,用无血清培养基把细胞以5×105/mL的密度分别与SRC激酶抑制剂PP2(0、1、2、4、8、16 µmol/L)混合,接种到包含8 µm微孔聚碳酸酯膜的Transwell小室内,小室内加入200 µL细胞悬液,下层24孔板的孔内加入含有10%胎牛血清的培养基700 µL,置于5% CO2、37 ℃及饱和湿度的细胞培养箱中培养24 h,取出小室,用PBS清洗小室,再用棉签拭去小室内的细胞,小室外的细胞使用甲醛固定15 min,结晶紫染色15 min,倒置显微镜下(200×)随机选择视野拍照,计算细胞数,进行统计学分析,实验重复3次。
1.3 统计学方法采用SPSS软件进行统计学处理,实验数据采取均数±标准差表示,组间比较采用t检验,P < 0.05为差异有统计学意义。图标绘制采用GraphPad Prism 5。
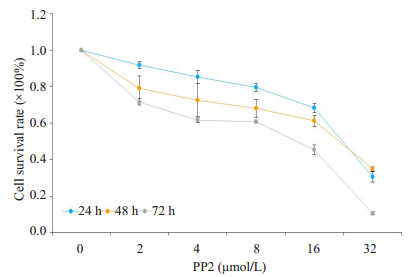
2 结果 2.1 PP2对A549细胞的增殖抑制作用MTT实验使用不同浓度PP2(0、2、4、8、16、32 µmol/L),分别处理A549细胞24、48、72 h,结果表明,随着PP2浓度的增加,细胞增殖能力明显降低,且在32 µmol/L的PP2处理细胞72 h后,细胞存活率仅为(11.43±0.4)%(图 1)。
|
图 1 PP2对A549细胞的增殖抑制作用 Fig.1 Inhibitory effect of PP2 on proliferation of A549 cells (n=4). |
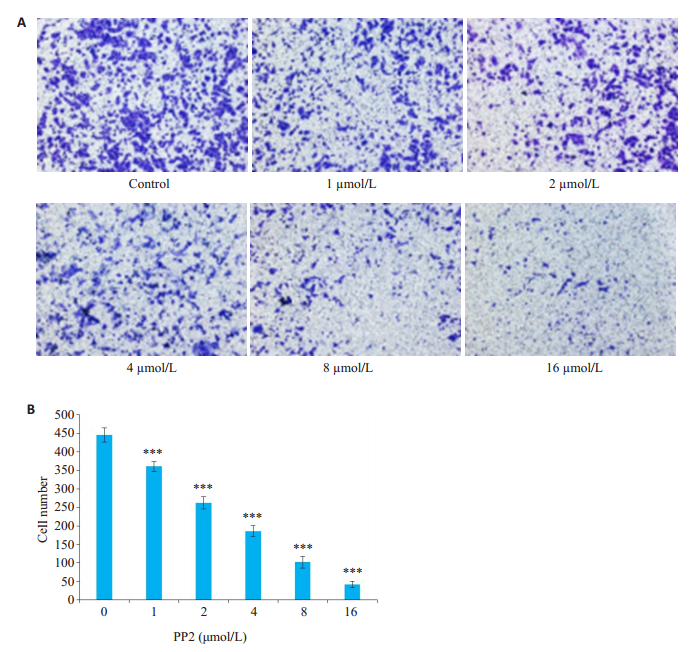
Transwell实验结果显示,使用SRC激酶抑制剂PP2处理细胞24 h,对照组穿膜细胞数为446±23(图 2),且分布密集。给药组(终浓度依次为1、2、4、8、16 µmol/L)细胞穿过微孔滤膜的数量较少且呈零星分散。给药组细胞穿过微孔滤膜的数量随着药物浓度的增大而减少,PP2从低浓度到高浓度,穿膜细胞数依次为361±16、262±20、186±18、102±19、42±10,呈浓度依赖性,差异有统计学意义(P < 0.0001)。
|
图 2 PP2抑制A549细胞的侵袭能力 Fig.2 Inhibitory effect of PP2 on the invasion of A549 cells. A: Changes in invasion capacity of A549 cells after PP2 treatment at different concentrations; B: Number of invading cells after the treatments. ***P < 0.0001 vs control (0 μmol/L) (n=3, original magnification: ×200). |
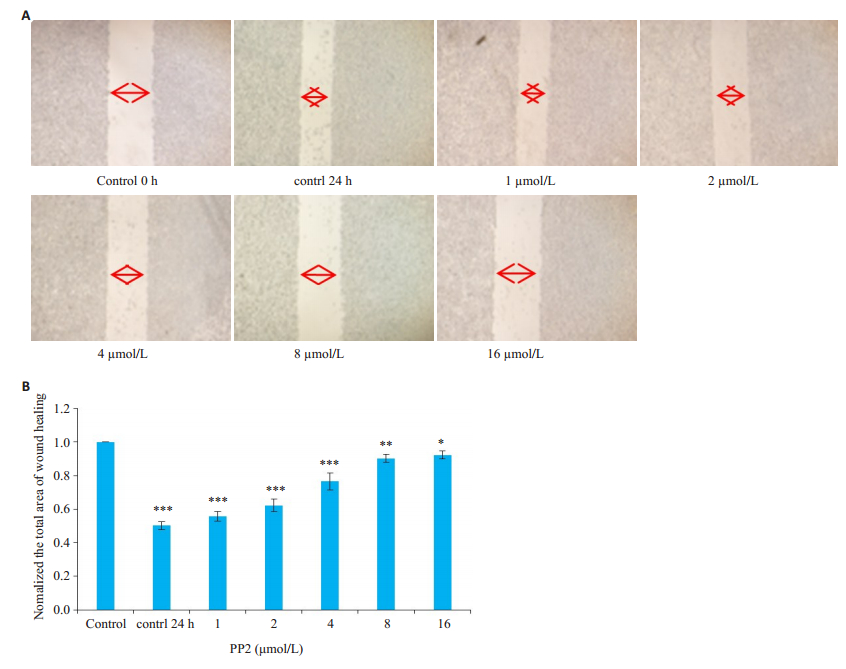
划痕实验结果显示,PP2处理细胞株24 h后,给药组细胞与对照组细胞相比转移能力变弱,不同给药组(终浓度依次为1、2、4、8、16 µmol/L)随着药物浓度的增大细胞转移能力减弱,呈浓度依赖性(图 3)。
|
图 3 PP2抑制A549细胞的转移能力 Fig.3 PP2 inhibits A549 cell metastasis. A: Wound healing assay of A549 cells treated with different concentrations of PP2; B: Normalized total area of wound healing. *P < 0.05, **P < 0.001, ***P < 0.0001 vs control (n=3, original magnification: ×100). |
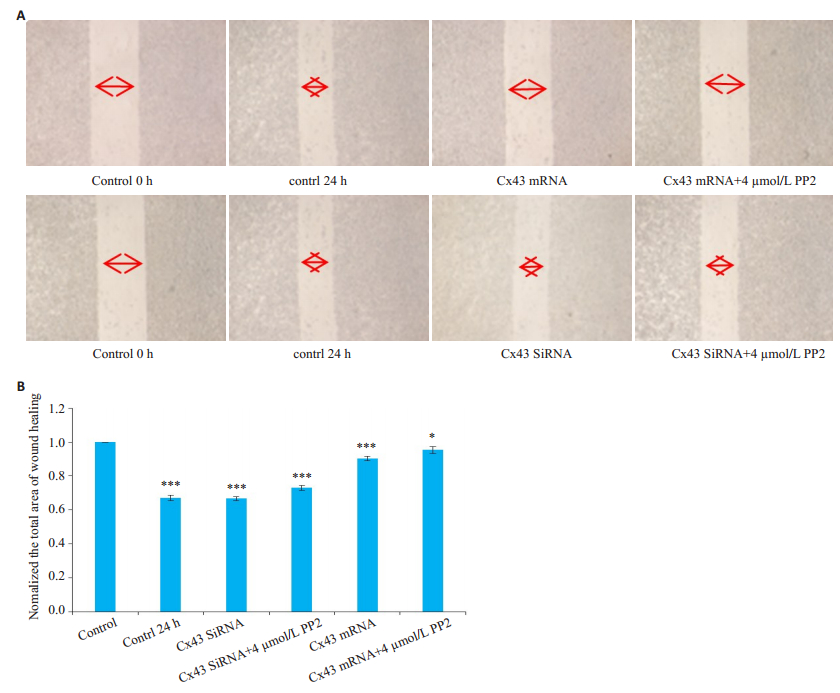
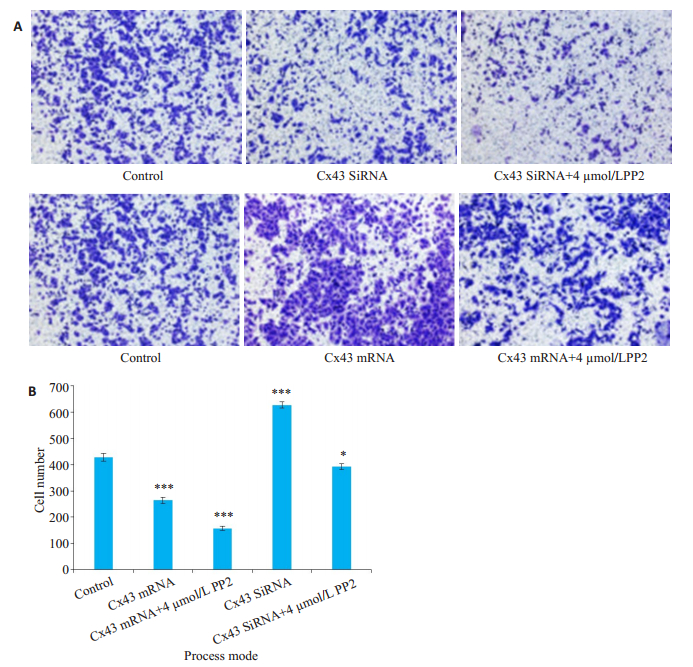
贴壁细胞使用小分子质粒转染,过表达或者沉默Cx43蛋白后,再进行划痕实验,实验结果显示,过表达质粒处理组比对照组转移能力减弱,过表达质粒处理组中,PP2(浓度4 µmol/L)处理组比只用过表达处理而联合未给药组的转移能力有所减弱;SiRNA沉默蛋白处理组比对照组转移能力增强,SiRNA沉默处理组中,PP2(浓度4 µmol/L)处理组比只用SiRNA沉默处理而未给药组的转移能力有所减弱(图 4)。
|
图 4 过表达质粒或SiRNA处理对A549细胞侵袭能力的作用 Fig.4 Effect of Cx43 overexpression and siRNAmediated Cx43 silencing on PP2-induced inhibition of A549 cell metastasis. A: Wound healing assay of A549 cells after Cx43 overexpression or silencing transfection; B: Normalized total area of wound healing. *P < 0.05, ***P < 0.0001 vs control (n=3, original magnification: ×100). |
贴壁细胞使用小分子质粒转染,过表达或者沉默Cx43蛋白后,再进行Transwell实验。实验结果显示,过表达质粒处理组穿膜细胞数比对照组减少(264±14 vs 428±18,图 5),过表达质粒处理组中,加PP2(浓度4 µmol/L)处理组穿膜细胞数比与只用过表达质粒处理而未联合给药组减少(157±10 vs 264±14)。SiRNA沉默蛋白处理组穿膜细胞数比与对照组增多(627±14 vs 428± 18),在SiRNA沉默处理组中,加PP2(浓度4 µmol/L)处理组与只用SiRNA沉默处理而未给药组相比,穿膜细胞数减少(392±13 vs 627±14,P < 0.05)。
|
图 5 过表达质粒或SiRNA处理对A549细胞侵袭能力的作用 Fig.5 Effect of Cx43 overexpression and silencing on PP2-induced inhibition of A549 cell invasion. A: Transwell assay of A549 cells treated with PP2 after Cx43 overexpression and silencing; B: Statistics of the relative cell number; *P < 0.05, ***P < 0.0001 vs control (n=3, original magnification: ×200). |
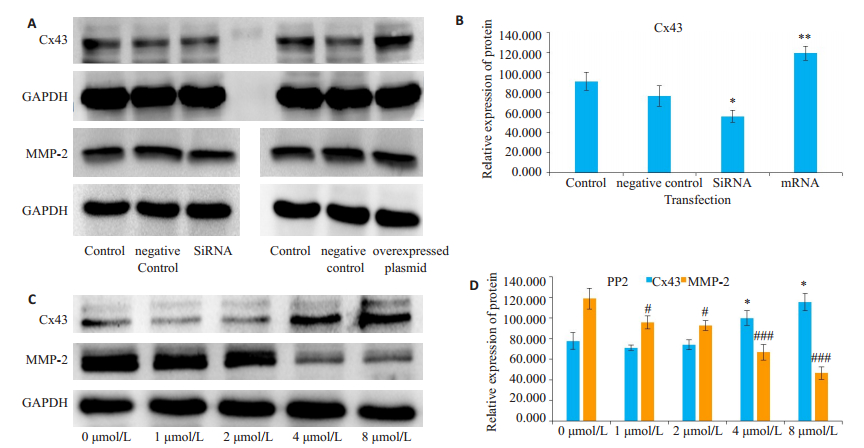
不同浓度PP2(0、1、2、4、8 µmol/L)分别处理细胞24 h后,采用Western blot检测Cx43、MMP-2蛋白表达的影响。结果显示,PP2可以增加细胞内Cx43蛋白的表达,抑制MMP-2的表达。小分子质粒处理后,过表达质粒处理细胞,Cx43蛋白的表达量增加;SiRNA处理,Cx43蛋白的表达量减少,而MMP-2蛋白的表达未受影响(图 6)。
|
图 6 PP2、过表达质粒、SiRNA处理A549细胞株之后细胞中Cx43、MMP-2和GAPDH的表达情况 Fig.6 Western blot for detecting expressions of Cx43, MMP-2 and GAPDH in A549 cells after PP2 treatment, Cx43 overexpression and Cx43 silencing. A: Protein expressions after Cx43 overexpression and silencing; B: Statistical results of the protein expressions after transfection; C: Protein expression after PP2 treatment; D: Statistical results of the protein expressions after PP2 treatment. *P < 0.05, **P < 0.01, #P < 0.05, ###P < 0.0001 vs control group (n=3). |
在肿瘤细胞中SRC激酶异常活化,从而促进肿瘤细胞的生长和转移,因此靶向SRC激酶的药物逐渐成为研究热点[17-18]。当外部信号转导入细胞时,SRC激酶可以迅速被激活并使下游信号转导分子被磷酸化,通过复杂的信号传导过程最终影响细胞的粘附和侵袭能力[19]。在乳腺癌、肺癌等多种肿瘤组织中,SRC激酶处于异常活化状态[20-21]。SRC激酶抑制剂PP2可有效抑制细胞SRC激酶的活性。本研究表明,1、2、4、8、16 µmol/L PP2作用于A549细胞后,显著降低细胞的体外增殖、侵袭和转移能力,且随着浓度的增加而增强。
缝隙连接是细胞间传递物质信号的重要通道,主要由连接蛋白Cx组成,肿瘤的发生发展与Cx的表达异常密切相关,Cx基因的突变及缺失,使缝隙连接通讯异常,因而机体对肿瘤细胞的监视和调控能力减弱,导致肿瘤过度克隆增长;相应Cx基因表达水平增高可以促进肿瘤缝隙连接的形成,增加细胞间信号的交流,阻碍肿瘤细胞的生长与转移[22-24]。Cx43已成为较公认的抑癌基因[25]。本研究前期实验证明,在肺癌细胞中主要表达Cx43,且Cx43可以不依赖于缝隙连接的形成而影响细胞的增殖能力[26-28]。也有研究表明,药物通过抑制SRC激酶的活化,可以增加Cx43的表达和缝隙连接功能,从而进一步说明SRC激酶的活化状态可能导致Cx43发生磷酸化[29]。本实验调控细胞Cx43的表达,进而观察对A549细胞侵袭转移能力的影响。结果显示,过表达Cx43后,A549细胞的侵袭转移能力明显降低;且进一步增强了PP2降低A549的侵袭转移能力;而沉默Cx43后,A549细胞的侵袭转移能力显著增强,但对PP2的影响不明显。以上实验结果表明,SRC激酶抑制剂PP2可以抑制肺癌A549细胞的侵袭转移能力;调控Cx43蛋白的表达,可以影响PP2对A549细胞侵袭转移能力的作用。也可以初步推断Cx43在A549细胞的侵袭转移过程中起到了非常重要的调控作用。
那么PP2对Cx43蛋白的表达是否有影响呢?实验结果显示,采用4 µmol/L和8 µmol/L的PP2作用于A549细胞后,缝隙连接蛋白Cx43的表达水平增高,基质金属蛋白酶MMP-2表达显著减少。基底膜成分的降解是肺癌细胞侵袭和转移的重要步骤,MMP-2是降解IV型胶原最主要的酶,在肿瘤的血管生成、肿瘤细胞的侵袭和转移灶的形成中起重要作用[30-32]。而本研究结果进一步表明,PP2可以抑制肺癌A549细胞的侵袭转移能力,该过程伴随Cx43蛋白的表达增多。但是否是通过抑制SRC激酶活性从而增加Cx43蛋白的表达仍需进一步研究。本研究下一步将通过动物实验验证PP2在体内对肺癌细胞A549的转移的抑制。
综上所述,本研究观察了SRC激酶抑制剂PP2对肺癌A549细胞的侵袭转移能力,并探讨了相关机制。初步探索了以Cx43为靶点的肺癌治疗新措施,为临床肺癌治疗提供了新思路。
| [1] |
Milroy MJ. Cancer statistics:global and National[M]. West-Berlin: Springer International Publishing, 2018.
|
| [2] |
任晓旭, 马锐. 广泛期小细胞肺癌内科治疗进展[J]. 现代肿瘤医学, 2019, 27(2): 359-62. DOI:10.3969/j.issn.1672-4992.2019.02.046 |
| [3] |
谢亚琳, 梁继珍, 苏宁. 吉非替尼与厄洛替尼在EGFR基因敏感突变晚期NSCLC患者一线治疗中的疗效比较[J]. 南方医科大学学报, 2015, 35(3): 446-9. |
| [4] |
Qun R, Chen Y, Yeh CR, et al. Recruited mast cells in the tumor microenvironment enhance bladder cancer metastasis via modulation of ER beta/CCL2/CCR2 EMT/MMP9 signals[J]. Oncotarget, 2016, 7(7): 7842-55. |
| [5] |
刘洋, 曹雪涛. 肿瘤转移前微环境的特征与作用[J]. 中国肿瘤生物治疗杂志, 2017, 24(10): 1148-50. |
| [6] |
李鸣赫. SRC样受体通过负调控ADAM12增加非小细胞肺癌放疗敏感性的机制研究[D].沈阳: 中国医科大学, 2018.
|
| [7] |
孙释然.非受体酪氨酸激酶Src在乳腺癌组织的表达及其与预后的关系[D].武汉: 华中科技大学, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D01074399
|
| [8] |
Dorenkamp M, Muller JP, Shanmuganathan KS, et al. Hyperglycaemia-induced methylglyoxal accumulation potentiates VEGF resistance of diabetic monocytes through the aberrant activation of tyrosine phosphatase SHP-2/SRC kinase signalling axis[J]. Sci Rep, 2018, 8(1): 14684-95. DOI:10.1038/s41598-018-33014-9 |
| [9] |
Paul L, Heather Y, Prangya S, et al. Structural changes in the carboxyl terminus of the gap junction protein connexin43 indicates signaling between binding domains for c-Src and zonula occludens-1[J]. J Biol Chem, 2004, 279(52): 54695-701. DOI:10.1074/jbc.M409552200 |
| [10] |
郑超, 董淑英, 童旭辉, 等. 丙戊酸钠对乳腺癌细胞缝隙连接功能的增强作用及其机制[J]. 南方医科大学学报, 2013, 33(1): 66-9. |
| [11] |
蒋国君.缝隙连接蛋白Cx43形成的GJIC对阿霉素体外抗乳腺癌作用的影响[D].蚌埠: 蚌埠医学院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10367-1012447960.htm
|
| [12] |
郑锐, 秦晓松, 矢野圣二, 等. 抑制Src酪氨酸激酶对非小细胞肺癌细胞增殖的影响[J]. 中华肿瘤防治杂志, 2006, 11(1): 826-30. |
| [13] |
Bartscht T, Seidl D, Hass R, et al. The Src family kinase inhibitors PP2 and PP1 effectively block TGF-beta1-induced cell migration and invasion in both established and primary carcinoma cells[J]. Onkologie, 2011, 34(6): 175-6. |
| [14] |
Bai ZT, Wu ZR, Xi LL, et al. Inhibition of invasion by N-transferuloyloctopamine via AKT, p38MAPK O crossMark and EMT related signals in hepatocellular carcinoma cells[J]. Bioorg Med Chem Lett, 2017, 27(4): 989-93. DOI:10.1016/j.bmcl.2016.12.073 |
| [15] |
周丹, 许鹏程, 张敏, 等. 色素上皮衍生因子通过调控上皮间质转化抑制乳腺癌细胞侵袭和转移[J]. 南方医科大学学报, 2018, 38(1): 1-7. |
| [16] |
Zhang Y, Zhang L. Knockdown of LASP2 inhibits the proliferation, migration, and invasion of cervical cancer cells[J]. J Cell Biochem, 2019, 32(5): 612-25. |
| [17] |
Kelber JA, Reno T, Kaushal SA, et al. KRas induces a Src/PEAK1/ErbB2 kinase amplification loop that drives metastatic growth and therapy resistance in pancreatic cancer[J]. Cancer Res, 2012, 72(10): 2554-64. DOI:10.1158/0008-5472.CAN-11-3552 |
| [18] |
Karachaliou N, Cardona AF, Bracht JW, et al. Integrin-linked kinase (ILK) and src homology 2 domain-containing phosphatase 2(SHP2): novel targets in EGFR-mutation positive non-small cell lung cancer (NSCLC)[J]. Ebiomedicine, 2019, 39(2): 207-14. |
| [19] |
Lin X, Zhang JM, Chen LQ, et al. Tyrosine phosphorylation of Rab7 by Src kinase[J]. Cell Signal, 2017, 35(1): 84-94. |
| [20] |
Nchez BS, Calcabrini A, Mez-Dom G, et al. Src kinases catalytic activity regulates proliferation, migration and invasiveness of MDAMB-231 breast cancer cells[J]. Cell Signal, 2012, 24(6): 702-15. |
| [21] |
Wu W, He L, Huang Y, et al. MicroRNA-510 plays oncogenic roles in non-small cell lung cancer by directly targeting SRC kinase signaling inhibitor 1[J]. Oncol Res, 2019, 27(5): 305-17. |
| [22] |
Notary AM, Westacott MJ, Hraha TH, et al. Decreases in gap junction coupling recovers Ca2+ and insulin secretion in neonatal diabetes mellitus, dependent on beta cell heterogeneity and noise[J]. PLoS Comput Biol, 2016, 12(9). |
| [23] |
Wang LJ, Liu WD, Zhang L, et al. Enhanced expression of Cx43 and gap junction communication in vascular smooth muscle cells of spontaneously hypertensive rats[J]. Mol Med Rep, 2016, 14(5): 4083-90. DOI:10.3892/mmr.2016.5783 |
| [24] |
Yamaguchi T, Yoneyama M, Ogita K. Calpain inhibitor alleviates permanent hearing loss induced by intense noise by preventing disruption of gap junction-mediated intercellular communication in the cochlear spiral ligament[J]. Eur J Pharmacol, 2017, 803(2): 187-94. |
| [25] |
Kazan JM, El-Saghir J, Saliba J, et al. Cx43 expression correlates with breast cancer metastasis in MDA-MB-231 cells in vitro, in a mouse xenograft model and in human breast cancer tissues[J]. Cancers (Basel), 2019, 11(4): 390-402. |
| [26] |
Jiang G, Dong S, Yu M, et al. Influence of gap junction intercellular communication composed of connexin 43 on the antineoplastic effect of adriamycin in breast cancer cells[J]. Oncol Lett, 2017, 13(2): 857-66. DOI:10.3892/ol.2016.5471 |
| [27] |
Wu D, Li B, Liu H, et al. In vitro inhibited effect of gap junction composed of Cx43 in the invasion and metastasis of testicular cancer resistanced to cisplatin[J]. Biomed Pharmacother, 2018, 98(7): 826-33. |
| [28] |
Yu ML, Zhang CL, Li L, et al. Cx43 reverses the resistance of A549 lung adenocarcinoma cells to cisplatin by inhibiting EMT[J]. Oncol Rep, 2014, 31(6): 2751-8. DOI:10.3892/or.2014.3163 |
| [29] |
Zheng L, Li HJ, Cannon A, et al. Phosphorylation of Cx43 residue Y313 by Src contributes to blocking the interaction with Drebrin and disassembling gap junctions[J]. J Mol Cell Cardiol, 2019, 126(1): 36-49. |
| [30] |
Samartzis EP, Fink D, Stucki MA. Doxycycline reduces MMP-2 activity and inhibits invasion of 12Z epithelial endometriotic cells as well as MMP-2 and-9 activity in primary endometriotic stromal cells in vitro[J]. Reprod Biol Endocrinol, 2019, 17(1): 38-50. |
| [31] |
Gong H, Zhou L, Khelfat L, et al. Rho- Associated protein kinase(ROCK) promotes proliferation and migration of PC-3 and DU145 prostate cancer cells by targeting LIM kinase 1 (LIMK1) and matrix metalloproteinase-2 (MMP-2)[J]. Med Sci Monit, 2019, 25(12): 3090-9. |
| [32] |
Hung CY, Lee CH, Chiou HL, et al. Praeruptorin-B inhibits 12-Otetradecanoylphorbol-13-acetate-induced cell invasion by targeting AKT/NF-kappaB via matrix metalloproteinase-2/-9 expression in human cervical cancer cells[J]. Cell Physiol Biochem, 2019, 52(6): 1255-66. DOI:10.33594/000000000 |
 2019, Vol. 39
2019, Vol. 39

