结核病是由结核分枝杆菌(MTB)引起的慢性传染病,全球有1/3人口感染MTB,感染者中5%~10%会发展为肺结核,再加上耐多药结核病的蔓延,疫情依然严峻,寻找有效的结核病诊治手段对结核病的防控具有重要的意义[1-3]。肺结核患者痰涂片抗酸染色及痰培养物中鉴定MTB是确诊结核病的主要依据[4],但其存在不可避免的缺点:涂片及培养其检出率低,菌量少时更难检测,培养周期比较长等[5]。近年开展的大幅度提高灵敏度的gene-xpert仍有其细菌学检测方法的局限性,需要有其他更加简便、快速、有效的方法提高结核病的诊治的高效性及敏感性[6]。近年来,寻找提高诊治方法的特异性生物标识的研究不断进行,抗体、免疫和炎症标记物、多种细胞因子和趋化因子的研究越来越多[7],但研究进展较慢,至今没有特异性强的生物标识物能辅助诊断活动性结核病[8]。因此,寻求有效的生物标识物已成为临床诊断结核病的迫切需求。
由于结合肺结核的抗结核感染的免疫是细胞免疫为主,因此可从代表细胞免疫的细胞因子中寻找生物标识物。细胞免疫是以I型辅助性T细胞(Thl细胞)介导多种细胞因参与的免疫[9],如IFN-γ在肺结核的辅助诊断中已经得到专家认可并广泛应用,但是IFN-γ释放试验不能区分潜伏感染与活动结核[10],并且无法对病情的严重程度进行判断。在活动性肺结核的疾病进展中,随着病灶范围增大、痰菌负荷量增大而病情严重程度不同,据病情不同需要个体化治疗方案才能提高肺结核的治愈率,因此寻找对肺结核的严重程度能起提示作用的指标亦非常重要。
近年来对于干扰素诱导蛋白10(IP-10)/CXCL-10的研究是新的热点问题,它是CXC家族趋化因子中的小分子细胞因子[11],IFN-γ可在多种细胞中诱导IP-10的表达,如成纤维细胞、巨噬细胞和单核细胞[12],通过结合趋化因子受体CXCR3而对T细胞和单核细胞有趋化作用[13]。淋巴细胞在结核免疫中地位重要,而IP-10在肺结核时能够通过趋化作用将活化的淋巴细胞募集到肺部组织,故与结核感染之间有着密切联系[14],相关研究认为IP-10比IFN-γ可能具有更高的敏感性[15],在活动性结核患者中可能有优势[16-17],并且在对免疫力低下或抑制的人群IP-10有望成为重要的免疫标记物[18-19]。有研究显示糖尿病合并活动性肺结核患者中血清IP-10水平明显增高[20],而有研究表明IP-10在观察疗效方面也具有某种程度上的优势[21-22]。
以上研究表明,无论对于免疫正常及低下肺结核患者,IP-10对于肺结核活动性的辅助诊断,甚至疗效判断方面都可能有意义,但因以往研究的样本量较少,需进一步扩大样本量研究,同时对作为病情严重程度判断的指标进行探索研究。故本研究拟采用前瞻性观察方法对2013年2月~2017年2月广州市胸科医院的193例结核病人血浆IP-10在活动性肺结核的辅助诊断的价值及其不同受累范围中的表达及意义进行了初步探索研究,以期发现IP-10的临床价值。
1 资料和方法 1.1 研究对象 1.1.1 分组结核组:选取广州市胸科医院2013年2月~ 2017年2月符合《肺结核诊断和治疗指南》诊断标准[23]的193例住院结核病患者,年龄42.60±22.50岁。对照组:采用同期招募的健康人84例做对照,年龄36.92± 12.13岁。
对于有完整影像学资料的165例肺结核病人,依据肺部病灶所占的范围按照表 1再进行分组。根据影像学划分整个肺部可分为6个肺野,根据病灶所占的范围进行分组,病灶占1~2个肺野分为A组;3~4个肺野归为B组,5~6个肺野归为C组。193例患者分组结果如下:A组60例,男45例,女15例,年龄15~87岁(36 ± 19岁);B组40例,男26例,女14例,年龄16~88岁(37 ±20岁);C组65例,男46例,女19例,年龄15~84岁(49 ± 22岁)。
| 表 1 IFN-γ和IP-10在结核组和健康对照组的比较 Tab.1 Comparison of IFN-γ and IP-10 between patients with pulmonary tuberculosis (TB) and the healthy control group (pg/mL, Mean±SD) |
按中华医学会结核病学分会2001年颁布的肺结核诊断和治疗指南标准[23],经临床确诊的活动性结核病患者(符合以下两条其中一条):(1)菌阳活动性肺结核诊断参考:两次痰标本涂片镜检抗酸杆菌阳性或分离培养分支杆菌阳性;胸部X线摄片显示肺结核征象;(2)菌阴活动性肺结核诊断标准:典型肺结核临床症状和胸部X线表现;诊断性抗结核治疗有效;临床上可排除其它非结核性肺部疾病;PPD(5IU)强阳性;血清抗结核抗体阳性;痰结核PCR+探针检测呈阳性;肺外组织病理证实结核病变;BALF检出MTB;支气管或肺部组织病理证实结核病变;具备前6条中3项或7、8条中任何一项可确诊。
1.1.2.2 肺结核排除标准入选前3月内曾使用免疫抑制剂或者激素类药物等影响免疫力的药物;丙型肝炎病毒、乙型肝炎病毒、HIV等病毒感染;其他慢性疾病如系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病;有糖尿病、心衰、肾炎等慢性病;结核病患者在入组前接受过抗结核治疗大于1周;痰菌阳性但菌种鉴定为非结核分枝杆菌的结核患者;怀孕。
1.1.2.3 对照组纳入标准为采用国际通用Mantoux法进行5单位1:2000 PPD皮试,反应结果为硬结平均直径0~9 mm;影像学检查未发现肺部阴影;无肺结核病史;近期无结核接触史的健康体检者。
1.1.2.4 对照组排除标准3月内曾使用激素、免疫抑制剂等影响免疫功能的药物;丙型肝炎病毒、乙型肝炎病毒、HIV等病毒感染;其他慢性疾病如系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病;有糖尿病、心衰、肾炎等慢性病;既往有肺结核病史;怀孕。
本研究已经由广州市胸科医院伦理委员会批准通过,并且所有研究对象均已签署知情同意书。
1.2 研究方法患者入院1周内完成性别、年龄、有无结核病史及治疗、痰菌指标;肺部影像学(协助判断病灶的范围)。纳入研究观察的结核病患者均为住院患者,对照组为门诊体检患者,取研究对象的晨起空腹静脉全血3 mL,淋巴细胞分离液的密度梯度离心法分离标本,吸出血浆层,保存于-80 ℃冰箱后同批测定。应用Luminex xMAP检测研究对象血浆中IFN-γ和IP-10细胞因子。
1.3 统计学方法所有数据采用SPSS21.0软件对数据进行处理,所有计量资料以均数±标准差表示,组间差异采用两独立样本t检验,多组比较采用单因素方差分析;以P < 0.05为差异有统计学意义;用Graphpad Prism 7绘制散点图。
2 结果 2.1 IP-10和IFN-γ的表达情况IP-10因子在结核组与对照组外周血中的表达水平差异有统计学意义(t = 3.948,P < 0.05),而IFN-γ在两组间的差异无统计学意义(P > 0.05,表 1,图 1)。
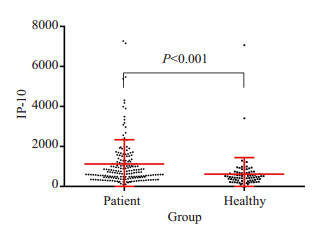
|
图 1 IP-10在结核组和健康对照组浓度散点图 Fig.1 Scatter plot of plasma IP-10 levels in TB group and healthy control group |
C组血浆IP-10比其他组明显随病灶增多而升高,各组差异具有统计学意义(P < 0.05,图 2),而IFN-γ在各组之间差异无统计学意义(P > 0.05,表 2)。
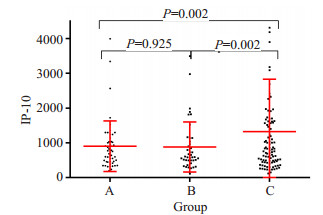
|
图 2 IP-10在不同受累范围的肺结核组的浓度散点图 Fig.2 Scatter plot of plasma IP-10 levels in TB patients with different affected lung fields |
| 表 2 IFN-γ和IP-10在不同受累范围的肺结核组的比较 Tab.2 Comparison of plasma IFN-γ and IP-10 levels among TB patients with different affected lung fields (pg/mL, Mean±SD) |
细胞免疫是结核病的主要保护性免疫反应,MTB感染机体后,T淋巴细胞和单核细胞向感染部位的聚集会形成肉芽肿[24],从而会发生一系列的炎症反应,而机体内各种细胞通过迁移、游走和黏附等多个步骤进行运输,其过程则需通过趋化因子的表达及其受体的激活来进行。本研究探讨的IP-10和IFN-γ是结核细胞免疫中具有代表性的细胞因子。Luster等[25]在活化的U937细胞株中证实IP-10的存在。趋化因子cxc受体3是IP-10的唯一受体,是由IFN-γ和/或脂多糖所诱导产生的一种细胞因子[26],IP-10与其受体结合后可发挥多种生物学功能。IP-10趋化淋巴细胞的能力强大,但对中性粒细胞活性无影响,IP-10与I型辅助性T细胞(Thl细胞)介导的炎症反应有密切关系,因此IP-10在活动性肺结核地位非常重要[27]。
相关研究提示,活化的IP-10可以促使初始的CD4 T细胞向Thl细胞分化,Thl细胞又可分泌IL-2和IFN-γ,而IFN-γ又可以促进细胞分泌IP-10,IP-10通过正反馈作用招募更多的Thl细胞在炎症部位聚集,最终加强Thl型炎症反应[28]。
上述研究表明,IP-10通过与其相应受体结合能使多种炎性细胞在炎症部位聚集、活化,从而释放出更多炎性因子,进一步介导炎症反应,在机体抗结核等过程中起非常重要的作用。从上述途径来看IP-10具有放大效应,对于结核感染敏感性高,其数据大小也是IFN-γ的数倍,故IP-10在活动性肺结核辅助诊断方面是一个有潜在价值的指标,本研究结果证实在判断肺结核活动方面IP-10比IFN-γ有价值。本研究提示活动结核患者血浆中IP-10的表达显著高于健康对照组,这与以往研究结果[29-30]相似,提示IP-10在结核患者中的高表达与结核病的活动有密切的关系。但在本研究中,IP-10在肺结核组与健康对照组有明显差异,而IFN-γ无显著差异,考虑与健康对照组有潜伏感染结核有关,尽管对照组无明确结核接触史,不排除不明情况下有结核接触史导致的感染。本研究中IP-10在活动性肺结核组明显升高提示其在判断病灶活动与否时具有优势,有可能成为辅助诊断活动性肺结核的新型生物标记物。另外,国外也有相似报道:有研究通过在33例活动性结核病、20例潜伏结核中检测血清中IP-10及其他相关细胞因子[31],IP-10诊断活动性肺结核的敏感度和特异度分别为93.9%和90.0%,提示IP-10可能是区别活动肺结核和潜伏结核的一个有研究价值的指标,但由于研究纳入的样本量偏小,需要进一步深入研究和验证。更有意义的是,本研究进一步分析不同病变范围时,发现病灶多的组IP-10显著升高,IFN-γ则无此变化,提示IP-10升高与病灶的增多相关,IP-10在判断病情方面具有一定意义,是简便、快速、客观的可以量化的生物标记物,可进一步开发作为疗效判断的一个指标以指导治疗。既往对病灶范围的判断主要依赖影像学,现仅通过血浆细胞因子的检测方便工作的开展,比如在其他抽血检查的基础上进行血浆细胞因子的检测,减少患者的创伤。另外,细胞因子的检测可以远程运输,而影像学检查需要患者本人,所以细胞因子检测具有很大优势。
在其他肺部疾病的研究也表明检测IP-10的应用价值,Lee等[32]研究提示IP-10水平在活动性肺结核组高于健康组、肺癌组、非结核分枝杆菌病组和其他肺部感染组,与国内相关研究一致[17]。此外,肺结核患者不但在血清中IP-10表达增高,其在尿液中的表达也有升高[33],由于尿液采集相对方便的优点将为肺结核诊治提供便捷的途径,此研究结果具有一定的临床应用价值,但需要进一步深入研究不同情况下IP-10的表达。
综上所述,本研究表明IP-10检测在活动性肺结核的辅助诊断及在肺结核病灶范围的病情判断中都有一定的参考价值,有望与其他常规检查、临床分析相结合来进一步提高其诊治效能,相信IP-10会成为一个有效辅助诊断及判断病情严重程度的指标。
| [1] |
Wallis RS, Kim P, Cole S, et al. Tuberculosis biomarkers discovery: developments, needs, and challenges[J]. Lancet Infect Dis, 2013, 13(4): 362-72. DOI:10.1016/S1473-3099(13)70034-3 |
| [2] |
World Health Organisation. G1obal tuberculosis report 2016[OL]. http://www.who.int/tb/publications/global_report/en/, 2016.
|
| [3] |
Ferreiro L, Sanjose E, Valdes L, et al. Tuberculous pleural effusions[J]. Arch Bronconeumol, 2014, 50(10): 435-43. DOI:10.1016/j.arbres.2013.07.006 |
| [4] |
Yew WW, Leung CC. Update in tuberculosis 2007[J]. Am J Respir Crit Care Med, 2008, 177(5): 479-85. DOI:10.1164/rccm.200710-1561UP |
| [5] |
Wallis RS, Pai M, Menzies D, et al. Tuberculosis 4 biomarkers and diagnostics for tuberculosis: progress, needs, and translation into practice[J]. Lancet, 2010, 375(9729): 1920-37. DOI:10.1016/S0140-6736(10)60359-5 |
| [6] |
Lawn SD, Mwaba P, Bates M, et al. Advances in tuberculosis diagnostics:the xpertw MTB/RIF assay and future prospects for a point-of-care test[J]. Lancet Infect Dis, 2013(13): 349-61. |
| [7] |
Mihret A, Bekele Y, Bobosha K, et al. Plasma cytokines and chemokines differentiate between active disease and non-active tuberculosis infection[J]. J Infect, 2013, 66(4): 357-65. DOI:10.1016/j.jinf.2012.11.005 |
| [8] |
Wallis RS, Kim P, Cole S, et al. Tuberculosis biomarkers discovery: developments, needs, and challenges[J]. Lancet Infect Dis, 2013, 13(4): 362-72. DOI:10.1016/S1473-3099(13)70034-3 |
| [9] |
Sakai S, Kauffman KD, Schenkel JM, et al. Cutting edge: control of mycobacterium tuberculosis infection by a subset of lung parenchyma-homing CD4 T cells[J]. J Immunol, 2014, 192(7): 2965-9. DOI:10.4049/jimmunol.1400019 |
| [10] |
Sester M, Sotgiu G, Lange C, et al. Interferon-gamma release assays for the diagnosis of active tuberculosis: a systematic review and meta-analysis[J]. Eur Respir J, 2011, 37(1): 100-11. DOI:10.1183/09031936.00114810 |
| [11] |
Liu L, Callahan MK, Huang D, et al. Chemokine receptor CXCR3: an unexpected enigma[J]. Curr Top Dev Biol, 2005, 68(2): 149-81. |
| [12] |
Narumi S, Hamilton TA. Inducible expression of murine IP-10 mRNA varies with the state of macrophage inflammatory activity[J]. J Immunol, 1991, 146(9): 3038-44. |
| [13] |
Weng Y, Siciliano SJ, Waldburger KE, et al. Binding and functional properties of recombinant, endogenous CXCR3 chemokine receptors[J]. J Biol Chem, 1998, 273(29): 18288-91. DOI:10.1074/jbc.273.29.18288 |
| [14] |
Ferrero E, Biswas P, Vettoretto K, et al. Macrophages exposed to mycobacterium tuberculosis release chemokines able to recruit selected leucocyte subpopulations: focus on gamma delta cells[J]. Immunology, 2003, 108(3): 365-74. DOI:10.1046/j.1365-2567.2003.01600.x |
| [15] |
Connell TG, Rangaka MX, Curtis N, et al. Quantiferon- TB gold: state of the art for the diagnosis of tuberculosis infection[J]. Expert Rev Mol Diagn, 2006, 6(8): 663-77. |
| [16] |
Supriya P, Chandrasekaran P, Das SD. Diagnostic utility of interferongamma- induced protein of 10 kDa (IP-10) in tuberculous pleurisy[J]. Diagn Microbiol Infect Dis, 2008, 62(2): 186-92. DOI:10.1016/j.diagmicrobio.2008.05.011 |
| [17] |
张迪, 孟存仁, 王家路. 血清γ-干扰素诱导蛋白10在活动性肺结核患者中的诊断价值[J]. 新疆医科大学学报, 2018, 41(9): 1095-8. DOI:10.3969/j.issn.1009-5551.2018.09.010 |
| [18] |
Pooran AH, Miller RF. Different screening strategies(single or dual) for the diagnosis of suspected latent tuberculosis a cost effectiveness analysis[J]. BMC Pulm Med, 2010, 10(7): 1471-82. |
| [19] |
Day CA, Lerumo L. Functional capacity of mycobacterium tuberculosis specific T cell responses inhuman isassociated with mycobacterial load[J]. J Immunol, 2011, 187(5): 2222-32. DOI:10.4049/jimmunol.1101122 |
| [20] |
何花, 曾益, 周玉皆. γ干扰素诱导蛋白10(IP-10)对糖尿病合并活动性肺结核的临床诊断价值[J]. 徐州医学院学报, 2014, 3(4): 224-6. |
| [21] |
Wergeland I, Pullar N, Assmus J, et al. IP-10 differentiates between active and 1atent tuberculosis irrespective of HIV status and declines during therapy[J]. Infect J, 2015, 70(4): 381-9. DOI:10.1016/j.jinf.2014.12.019 |
| [22] |
Tonby K, Ruhwald M, Kvale D, et al. IP-10 measured by dry plasma spots as biomarker for therapy responses in mycobacterium tuberculosis infection[J]. Sci Rep, 2015, 5(127): 9223-36. |
| [23] |
中华医学会结核病学分会. 肺结核诊断和治疗指南[J]. 中华结核和呼吸杂志, 2001, 24(2): 5-9. |
| [24] |
唐佩军, 吴妹英. 结核分枝杆菌感染免疫应答与免疫逃逸机制的研究进展[J]. 核病与肺部健康杂志, 2017, 6(2): 181-6. DOI:10.3969/j.issn.2095-3755.2017.02.022 |
| [25] |
Luster AD, Unkeless JC, Ravetch JV. Gamma-interferon transcriptionally regulates an early-response gene containing homology to platelet proteins[J]. Nature, 1985, 315(621): 672-6. |
| [26] |
郎杉. CXCL10/IP-10在脂多糖诱导大鼠急性呼吸窘迫综合征中作用机理的研究[D].北京: 中国人民解放军总医院; 解放军医学院, 2017.
|
| [27] |
陈秋悦, 陈效友. Y-干扰素诱导蛋白10在结核病诊断中的研究进展[J]. 中国防痨杂志, 2017, 39(11): 1233-6. DOI:10.3969/j.issn.1000-6621.2017.11.016 |
| [28] |
Campbell JD, Gangur V, Simon FE, et al. A1lergic hurnans are hyporesponsive to a CXCR3 1igand-mediated Thl hnmunitypromotmg loop[J]. Faseb J, 2004, 18(2): 329-31. DOI:10.1096/fj.02-0908fje |
| [29] |
Wang XJ, Jiang J, Cao ZH, et al. Diagnostic performance of multiplex cytokine and chemokine assay for tuberculosis[J]. Tuberculosis (Edinb), 2012, 92(6): 513-20. DOI:10.1016/j.tube.2012.06.005 |
| [30] |
杨倩婷, 邓国防, 尤信信, 等. IP-10在结核患者中的表达及在诊断中的应用[J]. 新发传染病电子杂志, 2017, 2(4): 198-201. DOI:10.3877/j.issn.2096-2738.2017.04.003 |
| [31] |
Jeong YH, Hur YG, Lee H, et al. Discrimination between active and latent tuberculosis microbiol[J]. J Clin Microbiol, 2015, 53(2): 504-10. DOI:10.1128/JCM.02758-14 |
| [32] |
Lee K, Chung W, Jung Y, et al. CXCR3 1igands as clinical markers for pulmonary tuberculosis[J]. Int J Tuberc Lung Dis, 2015, 19(2): 191-9. DOI:10.5588/ijtld.14.0525 |
| [33] |
Cannas A, Calvo L, Chiacchio T, et al. IP-10 detection in urine is associated with lung diseases[J]. BMC Infect Dis, 2010, 10(4): 333-45. |
 2019, Vol. 39
2019, Vol. 39

