2. 昆明医科大学第一附属医院 医学检验科,云南 昆明 650032;
3. 云南省检验医学重点实验室,云南 昆明 650032;
4. 云南省内设研究机构实验诊断研究所,云南 昆明 650032
2. Clinical Laboratory, First Affiliated Hospital of Kunming Medical University, Kunming 650032, China;
3. Yunnan Provincial Key Laboratory of Laboratory Medicine, Kunming 650032, China;
4. Yunnan Provincial Institute of Laboratory Diagnosis, Kunming 650032, China
子痫前期(PE)是妊娠期特有疾病,约影响全球5~ 8%的妊娠妇女,是引起孕妇和围产儿死亡的主要原因之一,除了娩出胎盘,目前尚无有效治疗手段[1]。PE发病机制未完全明确,普遍考虑为多因素共同作用的结果,如子宫螺旋动脉重铸障碍,胎盘源性生理物质分泌异常,母体全身炎症反应等[2-4]。
维生素D是人体内不可或缺的类固醇激素,它非经典作用方面的功能越来越受重视,对其抗癌作用以及免疫功能调节分子机制的研究已成为热点[5-6]。越来越多的证据表明维生素D缺乏可能与PE的发病有关[7-8]。MircoRNA-21(miR-21)是目前发现的在恶性肿瘤、心血管疾病、免疫性疾病等多种疾病中均高表达的microRNA(miRNA),被视作一种原癌基因[9-14]。许多报道表明PE患者存在miR-21表达的失调,不过,miR-21在PE患者体内是高表达还是低表达始终未能得到一致的结论[15-19]。研究表明维生素D可通过直接机制(维生素D反应元件VDRE)和间接机制(影响成熟miRNA发生)调节miRNA的表达[20],通过调节miRNA表达,维生素D参与了多种疾病的发生发展过程[21-24]。已有研究报道指出维生素D可促进绒毛外滋养细胞侵袭[25],但是,维生素D是否通过靶向miRNA影响PE细胞运动性及其具体机制尚未明确。本研究主要检测了胎盘滋养细胞系中,维生素D水平对miR-21表达情况的影响以及维生素D协同miR-21对滋养细胞迁移侵袭能力的影响,以期进一步探讨二者在PE发病机制中的作用并为PE治疗提供新思路。
1 材料和方法 1.1 细胞株及主要试剂人胎盘滋养细胞株HTR-8/SVneo(HTR)购自BioVector质粒载体菌种细胞基因保藏中心,RPMI 1640培养基、Opti-MEM培养液(Gibco),胎牛血清(BD)。1, 25二羟维生素D3[1, 25(OH)2D3](Sigma),miR-21 mimic、miR-21 inhibitor及其对应的miRNA阴性对照均由上海吉玛制药技术有限公司合成。转染试剂Lipofectamine2000(Invitrogen),RNA提取逆转录和实时荧光定量所用试剂(QIAGEN),miR-21引物和内参U6引物(吉码)。Transwell小室和BD基质胶(Corning),小鼠抗人GAPDH抗体、兔抗人MMP9抗体(Santa Cruz),兔抗人E-cadherin、Fibronectin抗体(Abcam)。
1.2 方法 1.2.1 细胞培养以及1, 25(OH)2D3的刺激和转染HTR细胞在含10%胎牛血清的RPMI 1640培养基中,37 ℃、5% CO2无菌培养箱中培养,每2~3 d传代1次,取对数期生长细胞进行实验。细胞融合度达80%左右后按转染试剂说明书进行转染;若需联合1, 25(OH)2D3刺激细胞,则在转染6h换培养基时加1, 25(OH)2D3。
1.2.2 RT-qPCR法检测miR-21表达情况1, 25(OH)2D3以无水乙醇配制成100 µmol/L的贮存液,-20 ℃避光保存。取对数期生长细胞,胰酶消化后制备成单细胞悬液,接种到6孔板,密度为2×105/孔。待细胞贴壁后,实验组加1, 25(OH)2D3, 工作浓度分别为0.1、1、10 nmol/L,并设空白对照组,培养箱中分别培养24、48、72 h,按试剂盒说明书提RNA,RT-qPCR实验检测miR-21表达情况。以U6作为参考,所用引物序列如下:
miR-21:F primer:ACGTTGTGTAGCTTATCAGACTG
R primer:AATGGTTGTTCTCCACACTCTC
U6:F primer:CAGCACATATACTAAAATTGGAACG
R primer:ACGAATTTGCGTGTCATCC
1.2.3 Transwell检测细胞迁移和侵袭能力取24孔板Transwell小室,上室中加入单独转染miR-21 mimic/ inhibitor或联合10 nmol的1, 25(OH)2D3处理的HTR细胞悬液(浓度为2.5×105/mL)200 μL,下室中加入含10%胎牛血清的RPMI 1640培养基600 μL,37 ℃培养箱继续培养24 h后,用棉签擦拭掉上室中未穿过膜的细胞,PBS冲洗小室3次,甲醇固定约20 min,0.1%结晶紫溶液中染色10 min后,倒置显微镜下随机选取5个视野,200倍光学显微镜下拍照计数每个视野内穿透小室微孔膜的细胞数,计算平均数,随后做统计学分析。细胞侵袭实验的Transwell小室上室提前加入100 μL按说明书稀释后的Matrigel胶,细胞接种数目为1×105/孔,培养时间为36~48 h,其余操作同迁移实验。
1.2.4 Western blotting检测EMT相关蛋白的表达水平取对数生长期细胞,经相应处理后,提取蛋白质,通过SDS-PAGE凝胶电泳分离,将蛋白转移到硝酸纤维膜上,4 ℃封闭过夜后加入一抗,4 ℃过夜后加入二抗,室温下孵育3 h。用化学发光试剂增强反应,以凝胶成像系统分析结果。
1.3 统计学处理采用GraphPad Prism7软件进行统计学分析,对两组数据比较采用t检验,实验数据以均数±标准差表示;对多组数据比较采用单因素方差分析,实验数据以95% CI表示。P < 0.05为差异具有统计学意义。
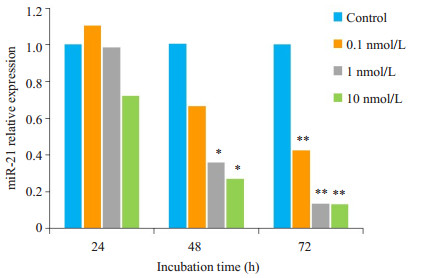
2 结果 2.1 1, 25(OH)2D3可抑制HTR细胞miR-21的表达不同浓度1, 25(OH)2D3作用细胞株后抑制了miR-21的表达,抑制作用呈浓度-时间依赖性增强(图 1)。
|
图 1 不同浓度1, 25(OH)2D3刺激HTR细胞24、48、72 h后miR-21的表达水平 Fig.1 Expression levels of miR-21 in HTR cells after stimulation by 0, 0.1, 1 and 10 nmol/L 1, 25(OH)2D3 for 24, 48 and 72 h (*P < 0.05; **P < 0.01 vs control). |
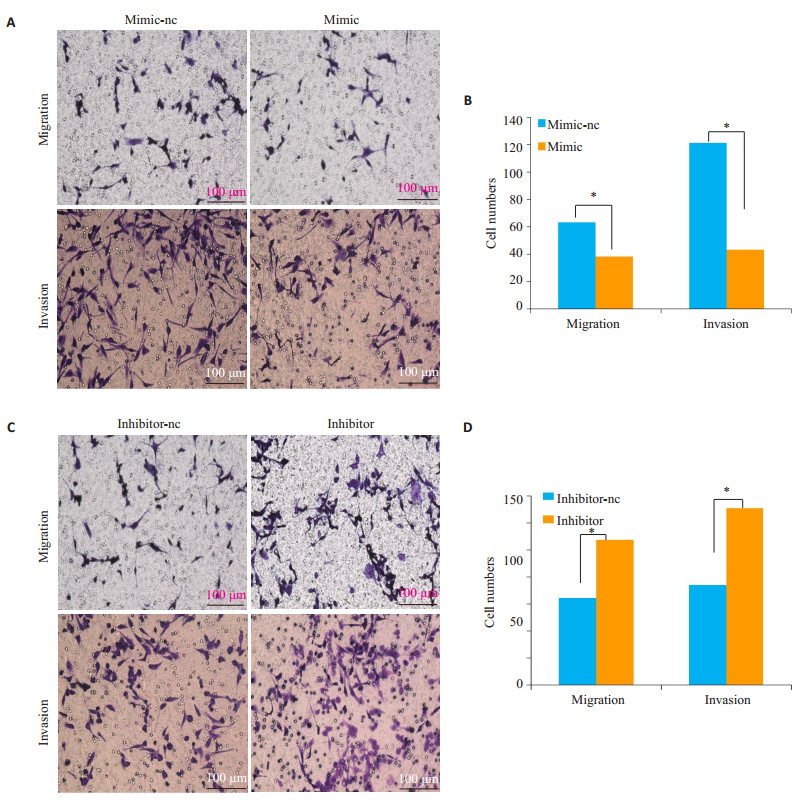
与阴性对照相比,转染miR-21 mimic后HTR细胞的迁移和侵袭能力受到抑制(P < 0.05)。与阴性对照组相比,转染miR-21 inhibitor后促进了HTR细胞的迁移和侵袭能力(P < 0.05,图 2)。
|
图 2 Transwell实验检测miR-21 mimic /inhibitor刺激HTR细胞后对HTR的迁移、侵袭能力的影响及统计分析 Fig.2 Transwell assayfor assessing the migration and invasion of HTR cells after transefection with the miR-21 mimic and inhibitor (A, C) and quantitative analysis of the results (B, D). *P < 0.05. |
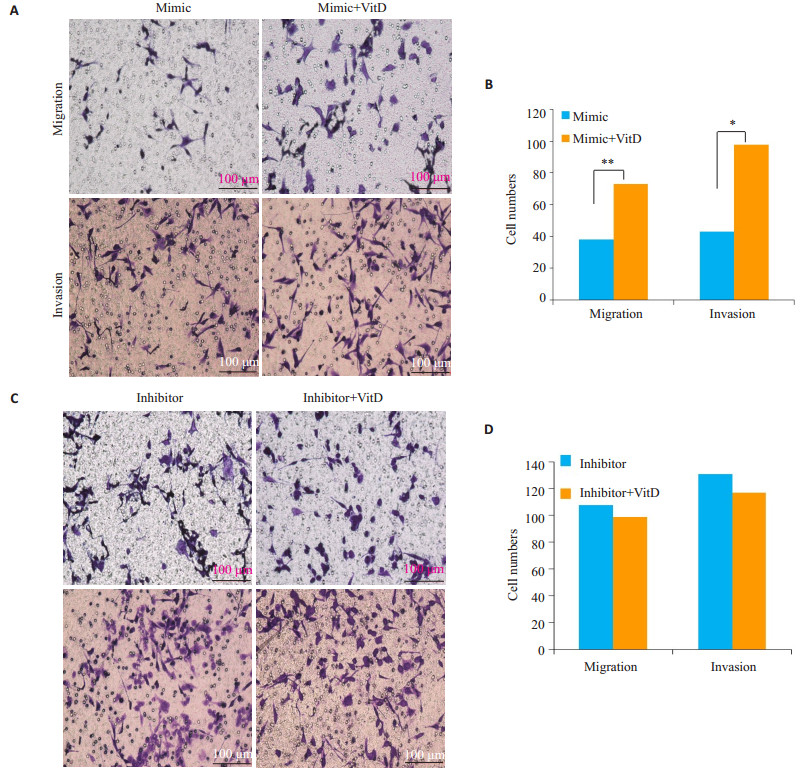
与单独转染miR-21mimic组相比,miR-21mimic联合1, 25(OH)2D3刺激细胞减弱了miR-21过表达对HTR细胞迁移和侵袭的抑制作用(P < 0.05)。与inhibitor组相比,miR-21 inhibitor联合1, 25(OH)2D3刺激则与单独转染miR-21 inhibitor对HTR细胞的迁移、侵袭能力无明显改变(P>0.05)。
|
图 3 Transwell实验检测miR-21 mimic/inhibitor联合1, 25(OH)2D3刺激HTR细胞后对HTR的迁移、侵袭能力的影响及统计分析 Fig.3 Transwell assayfor assessing the migration and invasion of HTR cells after transefection with the miR-21 mimic and inhibitor in the presence or absence of 1, 25(OH)2D3 (A, C) and quantitative analysis of the results (B, D) (*P < 0.05, **P < 0.01). Transwell assayfor assessing the migration and invasion of HTR cells after transefection with the miR-21 mimic and inhibitor (A, C) and quantitative analysis of the results (B, D). *P < 0.05. |
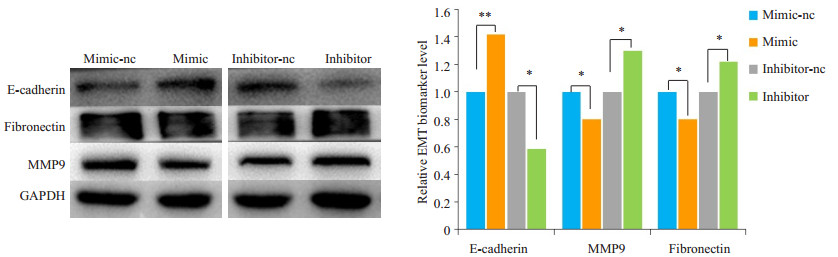
WB结果显示,HTR细胞转染miR-21mimic后,上皮标记物E-cadherin蛋白表达水平增加,间充质标记物fibronectin蛋白表达水平降低,MMP9表达水平降低。瞬时转染miR-21 inhibitor则结果相反(图 4)。
|
图 4 Western blot检测miR-21mimic/inhibitor刺激HTR后EMT相关蛋白的表达情况 Fig.4 Western blot analysis of expressions of EMT-related proteins in HTR cell after transfection with the miR-21 mimic or inhibitor (*P < 0.05, **P < 0.01). |
按要求对细胞经相应处理后,WB结果显示,联合1, 25(OH)2D3后,与单独转染miR-21mimic相比,Ecadherin蛋白表达降低,Fibronectin、MMP9蛋白表达增加;与单独转染miR-21inhibitor相比,蛋白表达水平无明显变化(图 5)。
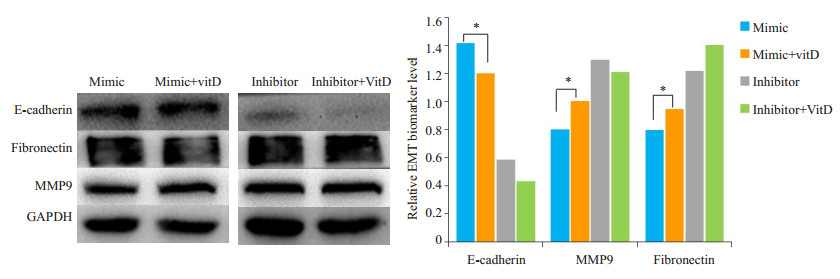
|
图 5 Western blot检测miR-21mimic/inhibitor联合维生素D刺激HTR后EMT相关蛋白的表达情况 Fig.5 Western blot analysis of the expressions of EMT-related proteins in HTR cells after transfection with the miR-21 mimic/inhibitor in the presnce or absence of vitamin D (*P < 0.05). |
近年来关于维生素D对人类机体健康影响的研究有了明显的进步。除了经典的调节钙磷代谢、影响骨骼发育外,它的抗炎症和抗癌特性越发引起人们的关注。目前许多miRNA被鉴定为维生素D靶标,如miR-17/ 22/100/146/155/21等[21, 24-25]。虽然,关于维生素D调控miRNA表达的研究较多,但有关维生素D在PE疾病中对miR-21表达的调控以及二者在PE发病机制中起何种作用的研究还不得而知。
在前期研究中,我们发现与健康妊娠妇女相比,PE患者存在维生素D水平降低和胎盘miR-21表达水平升高的现象。本次实验中,我们使用最常见的维生素D活化型产物—1, 25(OH)2D3刺激HTR细胞,发现1, 25(OH)2D3可抑制HTR细胞miR-21的表达,且抑制效果呈一定的浓度-时间依赖性增强。这表明1, 25(OH)2D3可能通过减弱PE患者高表达的miR-21从而影响PE的病理过程。
大量研究表明miR-21可通过不同机制调节多种癌细胞的侵袭性[10-12, 26-27],考虑到胎盘滋养细胞侵袭能力不足是PE发病的重要原因之一,我们推测胎盘中异常表达的miR-21也可能参与到滋养细胞的运动过程。于是,我们进行transwell实验研究了miR-21单独或联合1, 25(OH)2D3共同刺激细胞时对细胞迁移和侵袭的影响。结果显示,与NC组相比,转染miR-21mimic后抑制了HTR细胞的迁移和侵袭能力,当联合1, 25(OH)2D3后减弱了该抑制作用。转染miR-21 inhibitor后可促进HTR细胞的迁移与侵袭能力,然而,用1, 25(OH)2D3联合miR-21 inhibitor共同刺激细胞时,与单独miR-21 inhibitor刺激相比,细胞迁移和侵袭能力无明显变化。不同的刺激因素可能造成相似的细胞功能表现,但它们作用于细胞时具体激活了细胞的哪条通路以及miR-21抑制HTR细胞运动能力的具体机制,我们还不得而知。此外,1, 25(OH)2D3与miR-21 inhibitor两种处理方式均可抑制miR-21水平,细胞受外界刺激引起相应改变是要在一定的阈值以内的,当miRNA水平被一种刺激因素抑制到一个临界值时,继续增加刺激或许并不会有太明显的变化。这也许是此次研究中未能出现预期的1, 25(OH)2D3联合miR-21 inhibitor可协同促进HTR细胞迁移和侵袭的原因。
E-cadherin在母-胎界面的蜕膜上皮细胞及滋养细胞广泛表达,赵洪波等人研究表明高表达的E-cadherin可抑制滋养细胞的侵袭性[28]。Fibronectin在细胞粘附、生长和迁移中发挥重要作用,其表达水平与PE的严重程度具有一定的正相关性[29-30]。MMP9主要由滋养细胞分泌,它的表达有助于滋养细胞的侵袭和细胞外基质的溶解,MMP9异常可影响滋养细胞的侵袭能力,导致血管重铸不全[4, 31]。因此我们WB验证了细胞经相应处理后这些蛋白的表达情况。实验结果显示,miR-21过表达能上调E-cadherin,下调Fibronectin、MMP9蛋白的表达,而1, 25(OH)2D3能减弱该调控作用,转染miR-21 inhibitor则出现相反的结果,这与transwell实验结果相对应。进一步阐明了1, 25(OH)2D3可能通过抑制miR-21表达,引起EMT相关蛋白和MMP9蛋白表达的改变,进而影响滋养细胞的运动能力。
本次研究也存在一些不足之处。滋养细胞有JEG、HTR、BeWo、人绒毛膜滋养细胞4种细胞系,此次实验目前只选择了HTR这一种细胞株,尚需同步其他几种滋养细胞株实验进行验证。此外,我们仅在细胞水平进行了验证,补充维生素D是否能通过降低miR-21来缓解PE的临床症状或疾病进展,以到达治疗PE的目的,这还需要进一步的动物实验加以验证。
综上所述,维生素D和miR-21与PE的发生、发展关系密切。维生素D可能通过抑制miR-21的表达促进滋养细胞的迁移与侵袭,从而影响PE的病理过程。本实验为维生素D对PE作用的进一步研究及应用于临床提供实验依据。随着研究的深入,维生素D在PE的临床防治上将会有更广泛的作用。
| [1] |
Ahmed A, Rezai H, Broadway-Stringer S. Evidence-Based Revised View of the Pathophysiology of Preeclampsia[J].
Adv Exp Med Biol, 2017, 956: 355-74.
|
| [2] |
Falco ML, Sivanathan J, Laoreti A, et al. Placental histopathology associated with pre-eclampsia:systematic review and meta-analysis[J].
Ultrasound Obstet Gynecol, 2017, 50(3): 295-301.
DOI: 10.1002/uog.17494. |
| [3] |
伍天文, 王钢, 李晓青, 等. 子痫前期发病机制的研究现状[J].
基因组学与应用生物学, 2017, 36(3): 1266-71.
|
| [4] |
孙雯, 陈敦金. 胎盘功能与子痫前期的研究进展[J].
中华产科急救电子杂志, 2013, 2(1): 51-4.
DOI: 10.3877/cma.j.issn.2095-3259.2013.01.015. |
| [5] |
Zeljic K, Supic G, Magic Z. New insights into vitamin D anticancer properties:focus on miRNA modulation[J].
Mol Genet Genomics, 2017, 292(3): 511-24.
DOI: 10.1007/s00438-017-1301-9. |
| [6] |
Chen DJ, Li LJ, Yang XK, et al. Altered microRNAs expression in T cells of patients with SLE involved in the lack of vitamin D[J].
Oncotarget, 2017, 8(37): 62099-110.
|
| [7] |
蒲元芳, 谢艳, 战玉峰, 等. 孕妇血清25羟基维生素D水平与妊娠合并症的关系[J].
生殖医学杂志, 2015, 24(1): 79-83.
DOI: 10.3969/j.issn.1004-3845.2015.01.018. |
| [8] |
邓娜, 范翠芳. 维生素D对子痫前期的影响及作用机制的研究进展[J].
安徽医药, 2018, 22(8): 1441-4.
DOI: 10.3969/j.issn.1009-6469.2018.08.003. |
| [9] |
Feng YH, Tsao CJ. Emerging role of microRNA-21 in cancer[J].
Biomed Rep, 2016, 5(4): 395-402.
DOI: 10.3892/br.2016.747. |
| [10] |
Fang H, Xie JP, Zhang M, et al. miRNA-21 promotes proliferation and invasion of triple-negative breast cancer cells through targeting PTEN[J].
Am J Transl Res, 2017, 9(3): 953-61.
|
| [11] |
Cao J, Liu J, Xu R, et al. MicroRNA-21 stimulates epithelial-tomesenchymal transition and tumorigenesis in clear cell renal cells[J].
Mol Med Rep, 2016, 13(1): 75-82.
DOI: 10.3892/mmr.2015.4568. |
| [12] |
Wu Y, Song Y, Xiong Y, et al. MicroRNA-21(Mir-21) promotes cell growth and invasion by repressing tumor suppressor PTEN in colorectal cancer[J].
Cell Physiol Biochem, 2017, 43(3): 945-58.
DOI: 10.1159/000481648. |
| [13] |
Sheane BJ, Smyth P, Scott K, et al. An association between MicroRNA-21 expression and vitamin D deficiency in coronary artery disease[J].
Microrna, 2015, 4(1): 57-63.
DOI: 10.2174/2211536604666150414203919. |
| [14] |
Liu P, Wheelwright M, Teles R, et al. MicroRNA-21 targets the vitamin D-dependent antimicrobial pathway in leprosy[J].
J Immunol, 2011, 186(1): 267-73.
|
| [15] |
Jairajpuri DS, Malalla ZH, Mahmood NA. Circulating microRNA expression as predictor of preeclampsia and its severity[J].
Gene, 2017, 627: 543-8.
DOI: 10.1016/j.gene.2017.07.010. |
| [16] |
Svecova I, Vazan M, Zubor P, et al. Overexpression of miR-21 and miR-122 in preeclamptic placentas[J].
Neuro Endocrinol Lett, 2015, 36(7): 695-9.
|
| [17] |
曾辛, 王枫, 黄齐香, 等. 重度子痫前期患者胎盘组织中miR-21的表达及其临床意义[J].
中国妇幼保健, 2012, 27(14): 2184-6.
|
| [18] |
Choi SY, Yun J, Lee OJ, et al. MicroRNA expression profiles in placenta with severe preeclampsia using a PNA-based microarray[J].
Placenta, 2013, 34(9): 799-804.
DOI: 10.1016/j.placenta.2013.06.006. |
| [19] |
Pillar N, Yoffe L, Hod M, et al. The possible involvement of microRNAs in preeclampsia and gestational diabetes mellitus[J].
Best Pract Res Clin Obstet Gynaecol, 2015, 29(2): 176-82.
DOI: 10.1016/j.bpobgyn.2014.04.021. |
| [20] |
Ma YY, Trump DL, Johnson CS. Vitamin D and miRNAs in cancer[J].
Curr Gene Ther, 2014, 14(4): 269-75.
DOI: 10.2174/1566523214666140612153537. |
| [21] |
Karkeni E, Bonnet L, Marcotorchino J, et al. Vitamin D limits inflammation-linked microRNA expression in adipocytes in vitro and in vivo:A new mechanism for the regulation of inflammation by vitamin D[J].
Epigenetics, 2018, 13(2): 156-62.
DOI: 10.1080/15592294.2016.1276681. |
| [22] |
Duan X, Guan Y, Li Y, et al. Vitamin D Potentiates the Inhibitory Effect of MicroRNA-130a in Hepatitis C Virus Replication Independent of Type Ⅰ Interferon Signaling Pathway[J].
Mediators Inflamm, 2015, 2015: 508989.
|
| [23] |
Alvarez-Diaz S, Valle N, Ferrer-Mayorga GA, et al. MicroRNA-22 is induced by vitamin D and contributes to its antiproliferative, antimigratory and gene regulatory effects in colon cancer cells[J].
Hum Mol Genet, 2012, 21(10): 2157-65.
DOI: 10.1093/hmg/dds031. |
| [24] |
Yu H, Xu M, Dong YZ, et al. 1, 25(OH)(2) D-3 attenuates pulmonary arterial hypertension via microRNA-204 mediated Tgfbr2/Smad signaling[J].
Exp Cell Res, 2018, 362(2): 311-23.
DOI: 10.1016/j.yexcr.2017.11.032. |
| [25] |
Ma Y, Hu Q, Luo W, et al. 1α, 25(OH)2D3 differentially regulates miRNA expression in human bladder cancer cells[J].
J Steroid Biochem Mol Biol, 2015, 148: 166-71.
DOI: 10.1016/j.jsbmb.2014.09.020. |
| [26] |
Su CY, Cheng X, Li YS, et al. MiR-21 improves invasion and migration of drug-resistant lung adenocarcinoma cancer cell and transformation of EMT through targeting HBP1[J].
Cancer Med, 2018, 7(6): 2485-503.
DOI: 10.1002/cam4.2018.7.issue-6. |
| [27] |
Luo G, Luo W, Sun X, et al. MicroRNA21 promotes migration and invasion of glioma cells via activation of Sox2 and betacatenin signaling[J].
Mol Med Rep, 2017, 15(1): 187-93.
DOI: 10.3892/mmr.2016.5971. |
| [28] |
赵洪波, 薛立荣, 李大金. E-钙黏蛋白(E-cadheri)对人滋养细胞侵袭能力及妊娠结局的影响[J].
生殖与避孕, 2012, 32(1): 10-6, 37.
|
| [29] |
杨铧琦, 蒋红. PE患者血清FN及sFlt-1的水平及临床意义研究[J].
医学研究杂志, 2016, 45(6): 175-9.
|
| [30] |
Griggs LA, Hassan NT, Malik RS, et al. Fibronectin fibrils regulate TGF-beta 1-induced epithelial-mesenchymal transition[J].
Matrix Biol, 2017, 60(SI): 157-75.
|
| [31] |
Sakowicz A, Lisowska M, Biesiada LA, et al. Association of maternal and fetal Single-Nucleotide polymorphisms in metalloproteinase (MMP1, MMP2, MMP3, and MMP9) genes with preeclampsia[J].
Dis Markers, 2018, 2018: 1371425.
|
 2019, Vol. 39
2019, Vol. 39

