非小细胞肺癌作为肺癌的主要组织学亚型, 约占所有肺癌的80%, 是癌症死亡的最常见原因[1]。绝大多数非小细胞肺癌(NSCLC)患者在确诊时已是晚期, 丧失了最佳的治疗时期, 5年生存率低于15%[2-3]。目前, 化疗是晚期非小细胞肺癌患者首选的治疗方案之一, 而一线的化疗药物效果并不理想, 且毒副作用较大[4]。近年来, 以吉非替尼为代表的小分子靶向药物, 虽然在NSCLC治疗中发挥出一定的治疗效果, 然而其费用较为昂贵, 特别是在表皮生长因子受体(EGFR)突变的NSCLC类型中不能发挥出很好的疗效, 不可避免的出现获得性耐药, 导致化疗失败[5-6]。因此, 寻找一种高效、低毒的治疗NSCLC的药物, 对于有效治疗NSCLC显得尤为重要。一直以来, 中药/天然药物具有较好的药用价值和低毒性, 是抗肿瘤药物研发中获得先导化合物的重要来源[7-9]。从天然植物中发现的抗肿瘤药物, 如紫杉醇、长春碱类等药物早已在临床广泛应用[10-11]。
南葶苈子是十字花科植物播娘蒿(Descurainia sophia L.)的干燥成熟种子, 主要分布在东北、河北、山东、河南、浙江等地[12]。作为传统中药, 南葶苈子具有泻肺平喘、利水消肿的功效[13]。临床多用于胸腹积水、肺水肿和心力衰竭等疾病[14]。研究表明, 南葶苈子中主要包含硫苷类、黄酮类、苯丙素类等化学成分[15], 且具有止咳利尿、强心作用、抗癌等生物活性[16-17]。我们前期筛选过程中, 发现中药南葶苈子的甲醇浸膏对人非小细胞肺癌H1975细胞具有较强的细胞毒性(抑制率57.5%, 50 μg/mL)。南葶苈子具有一定的抗肿瘤作用[18], 但是有关EGFR突变的H1975细胞的抗肿瘤作用未见报道。对中药/天然产物的研发过程中, 注重寻找的是具有生理活性的成分, 有效成分和有效部位[19]。同时, 对活性部位的开发, 可以将临床常用的经典方、经验方开发成新药, 具有生产工艺简单, 成本较低的优点。因此, 本研究在体外和体内水平上, 首次探讨和阐明南葶苈子的活性部位(乙酸乙酯浸膏)对H1975细胞增殖、凋亡的影响, 可为治疗肺癌的新型抗肿瘤药物的研发奠定物质基础。
1 材料和方法 1.1 材料 1.1.1 药材南葶苈子药材购买于亳州市药材市场亳州李氏药业, 由蚌埠医学院中医药基础教研室李红梅老师经粉末鉴别、显微鉴别及膨胀度的测定, 鉴定为南葶苈子正品。
1.1.2 细胞及实验动物人非小细胞肺癌H1975细胞株购买于中科院上海细胞库, 于液氮中保存。细胞培养于含15%胎牛血清的RPMI 1640培养基中, 在温度为37℃、饱和湿度、5% CO2的培养箱中培养。4~5周龄SPF级裸鼠购买于常州卡文斯实验动物有限公司, 合格证编号:NO. 20180829, 饲养于蚌埠医学院实验动物中心。
1.1.3 主要试剂与仪器17-DMAG (S700902):Selleck; 分析纯甲醇和乙酸乙酯(大茂); 色谱纯乙腈(TEDIA); 胎牛血清(四季青); RPMI 1640培养基(Hyclone); MTT试剂(Sigma); BCA蛋白定量试剂盒和结晶紫染液(碧云天); 谷草转氨酶和谷丙转氨酶检测试剂盒(森贝伽生物科技); Annexin V-FITC/PI(KeyGen Biotech); 兔抗人Akt抗体(CST); 兔抗人Bcl-2、Bax多克隆抗体(AB clonal); β-acting抗体(Santa Cruz); 恒温CO2培养箱(Thermo); 岛津SPD-20A型高效液相色谱仪(岛津); BD FACSVerse流式细胞仪(BD)。
1.2 方法 1.2.1 系统溶剂萃取法将南葶苈子药材2.0 kg粉碎成适当粉末, 用甲醇中浸泡2 d, 再经旋转蒸发仪将提取液浓缩、干燥, 得到甲醇浸膏116.5 g。采用系统溶剂萃取法, 南葶苈子的甲醇浸膏, 依次被同等体积的正己烷、二氯甲烷、乙酸乙酯萃取, 分别获得了正己烷层浸膏61.9 g、二氯甲烷层浸膏0.7 g及MEDS浸膏4.1 g (MEDS)。
1.2.2 MTT法检测肿瘤细胞存活率取对数生长期的H1975细胞, 用0.25%的胰酶消化, 细胞计数后以8×103/孔的密度接种于96孔板上, 继续培养。待细胞生长融合后, 分别给予不同浓度的MEDS (5、10、20、40、80 μg/mL)处理, 经24、48、72 h培养后, 每孔加入5 mg/mL的MTT染液10 μL, 继续培育4 h。弃上清液后, 每孔加入DMSO 100 μL, 置于37℃恒温箱中孵育30 min后, 用酶标仪490 nm波长下测量各孔的吸光度值, 并计算细胞存活率及IC50值。细胞存活率(%)=(实验组A值-调零组A值) (/对照组A值-调零组A值) ×100%。以上实验重复3次。
1.2.3 集落克隆法检测对肿瘤细胞增殖的影响取对数生长期的H1975 cell按6×103/孔均匀接种于6孔板中, 每孔2 mL培养基。待24 h细胞生长融合后, 分别给予0.625、1.25、2.5 μg/mL的MEDS处理, 继续培养7 d, 在显微镜下观察到细胞集落形成时, 即可弃去培养液终止培养。用PBS清洗2遍, 再用4%多聚甲醛进行固定10 min后, 加入1 mL结晶紫试剂进行染色10 min, 再用双蒸水洗涤直至颜色褪去。干燥保存, 荧光显微镜下拍摄图片, 并进行定量。
1.2.4 裸鼠移植瘤模型检测体内抗肿瘤活性及其毒性取生长状况良好的H1975细胞, 用无菌PBS重悬配置成密度为5×107/mL的悬液, 放在4℃冰上保存。在裸鼠的右背部, 使用皮下注射的方式进行种瘤, 每只裸鼠注射100 μL细胞悬液。待种瘤细胞接种成功, 肿瘤体积达到100 mm3左右时, 将裸鼠随机分为3组, 空白溶剂对照组、MEDS处理组(100 mg/kg)、17-DMAG组(阳性对照, 10 mg/kg), 每组3只裸鼠。通过腹腔注射的方式进行给药, 每3天给药1次, 并测量裸鼠体重及肿瘤大小, 计算瘤体积。瘤体积=1/2 (L×W2)。给药8次后, 将裸鼠进行脊椎脱臼处死, 把瘤体从裸鼠体内剥出, 拍照并称量瘤组织的重量。利用试剂盒测定血清中的谷草转氨酶(GOT)和谷丙转氨酶(GPT)的水平。为了进一步检测药物的体内毒性, 将裸鼠的肝、肺、肾取出, 用4%多聚甲醛固定, 进行HE染色观察。
1.2.5 Annexin V-FITC/PI流式细胞术检测细胞凋亡取对数生长期的H1975细胞, 按3×105 cell/孔均匀接种于6孔板中, 继续培养24 h至细胞贴壁, 用不同浓度的MEDS (0、10、20、40 μg/mL)处理细胞, 置培养箱中继续培养24 h后, 作用时间结束, 收集细胞, 1500 r/min离心10 min, 弃上清, 加入预冷的PBS重悬细胞, 置冰浴, 每管分别加入500 μL Buffer、5 μL Annexin V-FITC染液和5 μL PI染液, 避光染色20 min, 上流式细胞仪检测分析。实验重复3次。
1.2.6 免疫印迹法检测蛋白表达取对数生长期的H1975细胞, 按3×105 cell/孔均匀接种于6孔板中, 继续培养24 h至细胞贴壁, 分组及给药处理, 继续作用48 h。作用时间结束, 收集细胞, 2500 r/min离心10 min, 提取蛋白, 用BCA试剂盒进行蛋白定量处理。每组取50 μg蛋白进行电泳SDS-PAGE, 转膜PVDF, 封闭(5%脱脂牛奶, 2 h), 1×TBST洗3次, 每次5 min, 一抗(Akt、Bcl-2、Bax) 4℃孵育过夜, 1×TBST洗3次, 每次5 min, 二抗室温孵育2 h, 1×TBST洗3次, 每次5 min, ECL显影, Bio-Rad凝胶成像仪获取图像。
1.2.7 统计学方法采用SPSS16.0软件进行分析, 实验数据以均数±标准差表示。多组间比较为单因素方差分析, 各组间比较用双侧Dunnett t检验。P < 0.05时差异有统计学意义。
2 结果 2.1 南葶苈子中活性部位的筛选体外抗肿瘤活性筛选中, MEDS与其他萃取浸膏比较, 显示出较强的抑制H1975细胞增殖的活性(抑制率76.3%, 20 μg/mL)(表 1)。
| 表 1 南葶苈子各萃取浸膏对H1975细胞增殖的影响 Tab.1 Anti-proliferation activity of partitioned fractions from Descurainia sophia against H1975 cells |
MTT结果显示, 随着给药浓度的增加, MEDS对H1975细胞的增殖抑制作用明显增加, 呈现浓度和时间依赖性, 其IC50分别为19.53、10.23、5.99 μg/mL (图 1A)。根据MTT实验结果, 我们选用低浓度的MEDS (0.625、1.25、2.5 μg/mL)作用于人非小细胞肺癌H1975细胞, 观察MEDS对H1975细胞集落形成的影响。随着药物浓度的增加集落形成显著减少, MEDS在给药浓度2.5 μg/mL时, 其集落形成抑制率为54.8% (图 1B、C)。上述结果表明, MEDS具有较强的体外抑制H1975细胞增殖的作用。
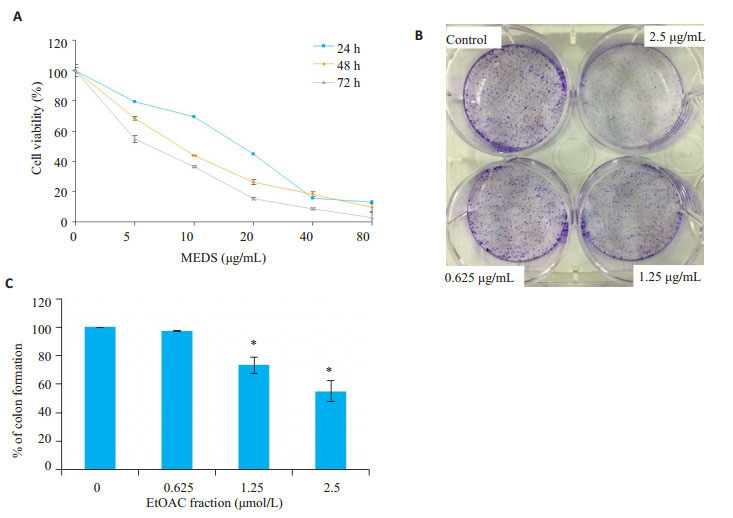
|
图 1 MEDS对人肺癌H1975细胞增殖的影响 Fig.1 Anti-proliferation effects of MEDS in human non-small cell lung cancer H1975 cell line. A:Dose-and time-response curve of the effect of MEDS on cell viability in H1975 cells; B: Representative images of H1975 cell colonies treated with MEDS for 7 days; C:Quantitifaction of the clone counts demonstrated that treatment with MEDS had a significantly inhibitory effect on colony formation in the H1975 cells. *P < 0.05 vs control group. |
裸鼠移植瘤结果表明, MEDS组的瘤体大小明显小于对照组, 25 d的给药组和对照组的瘤体积分别为388.6和1247.8 mm3, 即抑瘤率为68.9% (图 2AB)。小鼠体质量变化曲线结果 (图 2C)显示, MEDS组小鼠体质量略小于对照组, 但数值差异没有统计学意义(P> 0.05)。25 d后, 我们将裸鼠处死, 分离肿瘤组织、肺、肝脏、及肾脏, 通过眼球取血。图 2D结果显示, MEDS组小鼠血清中的GOP和GPT水平分别为9.8和5.2 U/L, 与对照组的差异没有统计学意义(P > 0.05)。H&E染色结果中, 相比于肿瘤组织, MEDS组的肺、肝及肾脏均无明显的变化, 说明MEDS在100 mg/kg有效剂量时对重要脏器毒副作用较低(图 2E)。以上结果充分证实了MEDS在体内具有较好的抗H1975细胞作用, 对裸鼠体质量和器官毒性较小。
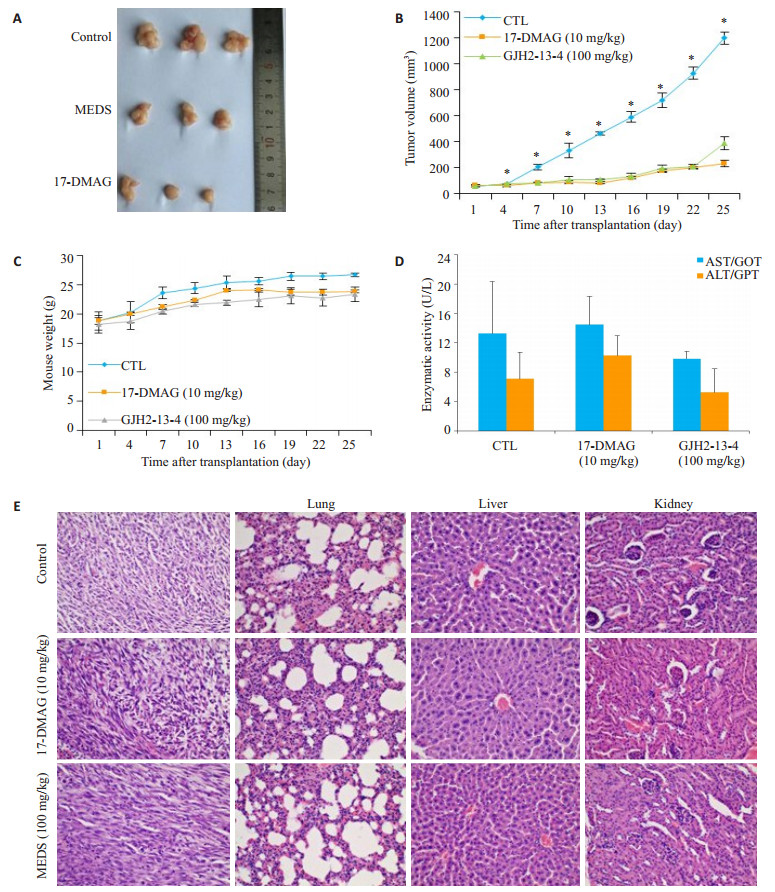
|
图 2 MEDS的体内抗肿瘤活性 Fig.2 Anti-tumor effects of MEDS on H1975 cell tumor xenograft growth in nude mice. A:Representative images of tumors from control group, MEDS, and 17-DMAG; B:Tumor volume of the mice; C:Body weight of the mice; D:The GOT and GPT activities (U/L); E:HE staining of the tumor, lung, liver, and kidney tissues form the mice (Original magnification:× 200). *P < 0.05 vs control groups. |
Annexin V-FITC/PI结果显示, 随着MEDS浓度的增加(10, 20和40 μg/mL), H1975细胞发生凋亡率逐渐提高, 分别为29.6%、43.9%及49.7% (图 3A)。随着MEDS浓度升高, H1975细胞内的Akt及抑凋亡蛋白Bcl-2表达量降低, 反之促凋亡蛋白Bax表达增加(图 3B和3C)。上述结果表明, MEDS能诱导H1975细胞发生凋亡, 其发生凋亡可能与下调Akt和上调Bax/Bcl-2比例相关。
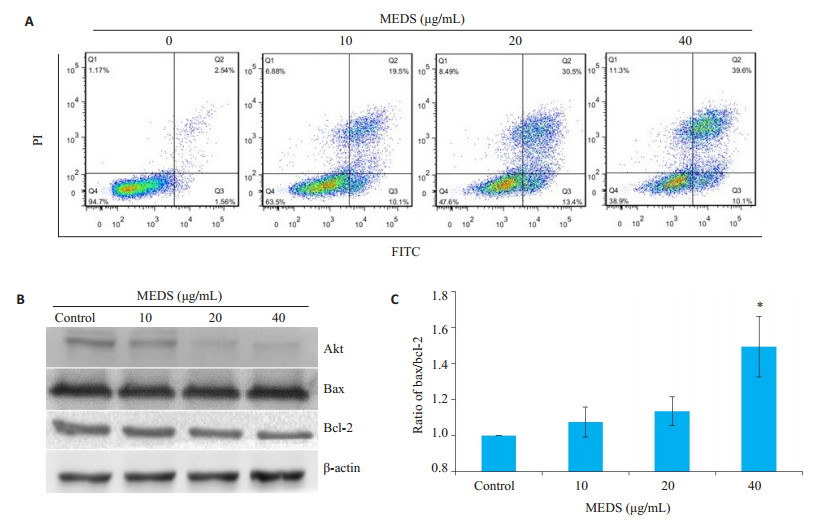
|
图 3 南葶苈子乙酸乙酯浸膏对H1975细胞凋亡的影响 Fig.3 MDES induces apoptosis in the human lung cancer H1975 cell line. A:Cell apoptosis measured by the Annexin VFITC/PI analysis using flow cytometry; B:Expression of Akt, Bcl-2, and Bax proteins detected by Western blotting; C: Quantitative analysis of Bax/Bcl-2 ratio in H1975 cells relative to that in the control cells. *P < 0.05 vs control group. |
近年来, 国外有文献报告, Hsp90抑制剂作为多靶点的抗肿瘤药可以治疗非小细胞肺癌[20-21], 而吉非替尼等经典的表皮生长因子受体络氨酸激酶抑制剂的原发性和获得性耐药限制了其临床应用。因此, 我们选择了一种Hsp90的特异性功能抑制剂17-DMAG作为阳性对照药。
本实验采用系统溶剂萃取法和MTT法对南葶苈子中有效部位进行筛选, 发现南葶苈子的乙酸乙酯浸膏对H1975细胞有明显的抑制作用, 且成浓度和剂量依赖性, 提示MEDS有明显的抗肿瘤作用。同时, 采用集落克隆检测MEDS对集落形成的影响, 发现MDES具有较强的体外抑制H1975细胞增值的作用。
我们采用Annexin V/PI双染的方法检测MEDS作用H1975细胞后的凋亡率, 结果说明MEDS对H1975细胞有促进凋亡作用。细胞凋亡是细胞在受到病理或生理性刺激下, 为维持内环境稳定, 出现的一种自发性死亡过程, 在肿瘤的发生、发展过程中起着重要作用[22], 其中诱导凋亡是抗肿瘤药物研发的策略之一[23]。促凋亡蛋白Bax和抑凋亡蛋白Bcl-2的比例对维持细胞内平衡起着重要作用。在本研究中, MEDS抑制抑凋亡蛋白Bcl-2的表达, 增强促凋亡蛋白Bax的表达, 使得Bax/ Bcl-2的比例增加, 同时下调Akt的表达。Bax是促凋亡家族成员之一, 在线粒体释放细胞色素c中起重要作用, 通过改变线粒体膜的通透性, 激活caspase-3, 引发caspase级联反应, 进而导致细胞凋亡。相反, 抗凋亡Bcl-2蛋白通过拮抗Bax的作用来促进细胞存活[24-25]。有研究指出, Akt蛋白的下降, 可以通过PI3k/Akt途径促进肿瘤细胞的凋亡, Akt参与线粒体介导的细胞凋亡的各种途径, 可以通过磷酸化或作用于细胞死亡因子来调节细胞凋亡[26-27]。我们通过Western blot方法测定Bcl-2, Bax, Akt表达量, 发现MEDS作用于H1975细胞后, 抑凋亡蛋白Bcl-2表达下降, 促凋亡蛋白Bax表达增加, 使得Bax/Bcl-2比例增加; 而Akt表达下降, 提示MEDS可以诱导H1975细胞的凋亡。根据以上结果, 我们推测MEDS通过上调Bax/Bcl-2的比例和抑制Akt蛋白的表达, 从而导致细胞凋亡的发生。
由于一个药物疗效的发挥不仅取决于它与靶点和结合能力, 而且与体内对药物的综合平衡能力(如, 药物的吸收、分布、代谢、排泄等)密切有关[28]。体外实验表明, MEDS具有较好的体外抗H1974细胞活性, 为探讨其临床成药的可能性, 本研究采用了裸鼠移植瘤模型, 综合评价了MEDS的体内抗肿瘤活性及其毒性。有趣的是, MEDS的体外和体内抗NSCLC活性平行, 且有效剂量下显示出低毒性, 表现出了一定的应用潜力。
综上所述, MEDS在体外和体内水平上具有较强的抗肿瘤活性, 抑制H1975细胞的增殖, 可能与通过上调Bax/Bcl-2的比例和下调Akt表达诱导凋亡有关, 对于发生凋亡的具体可能机制, 尚需通过进一步的实验进行研究。同时, MEDS作为南葶苈子的有效活性部位显示出低毒性, 为中药南葶苈子的新药研发奠定了基础。
| [] |
Wakelee H, Kelly K, Edelman MJ. 50 Years of progress in the systemic therapy of non-small cell lung cancer[M]. Am Soc Clin Oncol Educ Book, 2014: 177-89.
|
| [2] |
Molina JR, Yang P, Cassivi SD, et al. Non-small cell lung cancer:epidemiology, risk factors, treatment, and survivorship[J].
Mayo Clin Proc, 2008, 83(5): 584-94.
DOI: 10.1016/S0025-6196(11)60735-0. |
| [3] |
Wang LJ, Yu CH, Liu Y, et al. Lung cancer mortality trends in China from 1988 to 2013:new challenges and opportunities for the government[J].
Int J Environ Res Public Health, 2016, 13(11): 1052.
DOI: 10.3390/ijerph13111052. |
| [4] |
Reck M, Heigener DF, Mok T, et al. Management of non-small-cell lung cancer:recent developments[J].
Lancet, 2013, 382(9893): 709-19.
DOI: 10.1016/S0140-6736(13)61502-0. |
| [5] |
Tan DS, Camilleri-Broët S, Tan EH, et al. Intertumor heterogeneity of non-small-cell lung carcinomas revealed by multiplexed mutation profiling and integrative genomics[J].
Int J Cancer, 2014, 135(5): 1092-100.
DOI: 10.1002/ijc.v135.5. |
| [6] |
D'incecco A, Cappuzzo F. Gefitinib for non-small-cell lung cancer treatment[J].
Expert Opin Drug Saf, 2011, 10(6): 987-96.
DOI: 10.1517/14740338.2011.617738. |
| [7] |
王晋, 尹军强, 沈靖南, 等. 32种中草药提取物体外抗骨肉瘤作用的筛选[J].
南方医科大学学报, 2006, 26(9): 1293-6.
|
| [8] |
Stone R. Biochemistry:lifting the veilon traditional Chinese medicine[J].
Science, 2008, 319(5864): 709-10.
DOI: 10.1126/science.319.5864.709. |
| [9] |
Newman DJ, Cragg GM, Snader KM. The influence of natural products upon drug discovery[J].
Nat Prod Rep, 2000, 17(3): 215-34.
DOI: 10.1039/a902202c. |
| [10] |
Kundranda MN, Niu J. Albumin-bound paclitaxel in solid tumors:clinical development and future directions[J].
Drug Des Devel Ther, 2015, 9: 3767-77.
|
| [11] |
宋海星, 胡洪华. 羟基喜树碱抑制肺癌A549细胞的体外增殖并下调Bcl-2基因的表达[J].
南方医科大学学报, 2012, 32(9): 1341-5.
|
| [12] |
王爱芹, 王秀坤, 赵海誉, 等. 南葶苈子化学成分与质量研究[J].
中国药物与临床, 2005, 5(1): 5-6.
DOI: 10.3969/j.issn.1671-2560.2005.01.001. |
| [13] |
国家药典委员会.
中华人民共和国药典》 2015版(一部)[M]. 北京: 中国医药科技出版社, 2015: 333-4.
|
| [14] |
谢强, 王萧. 强心方对充血性心力衰竭的临床疗效观察[J].
临床军医杂志, 2001, 29(3): 34-7.
DOI: 10.3969/j.issn.1671-3826.2001.03.015. |
| [15] |
周喜丹, 唐力英, 周国洪, 等. 南北葶苈子的最新研究进展[J].
中国中药杂志, 2014, 39(24): 4699-708.
|
| [16] |
Nimrouzi M, Zarshenas MM. Phytochemical and pharmacological aspects of Descurainia sophia Webb ex Prantl:modern and traditional applications[J].
Avicenna J Phytomed, 2016, 6(3): 266-72.
|
| [17] |
Lee YJ, Kim NS, Kim H, et al. Cytotoxic and anti-inflammatory constituents from the seeds of Descurainia sophia[J].
Arch Pharm Res, 2013, 36(5): 536-41.
DOI: 10.1007/s12272-013-0066-x. |
| [18] |
Zhou N, Sun YP, Zheng XK, et al. A Metabolomics-Based strategy for the mechanism exploration of traditional Chinese medicine:descurainia sophia seeds extract and fractions as a case study[J].
Evid-Based Complement Alternat Med, 2017: 2845173.
|
| [19] |
陈建发, 陈引香, 李萍, 等. 半边旗提取物5F对人胃癌细胞凋亡的影响及其机制[J].
南方医科大学学报, 2011, 31(8): 1345-8.
|
| [20] |
Han J, Goldstein LA, Hou W, et al. HSP90 inhibition targets autophagy and induces a CASP9-dependent resistance mechanism in NSCLC[J].
Autophagy, 2018, 14(6): 958-71.
|
| [21] |
Mellatyar H, Talaei S, Pilehvar-Soltanahmadi YA, et al. Targeted cancer therapy through 17-DMAG as an Hsp90 inhibitor:Overview and current state of the art[J].
Biomed Pharmacother, 2018, 102: 608-17.
DOI: 10.1016/j.biopha.2018.03.102. |
| [22] |
周芳竹, 王欣, 代安亚, 等. 藏药桃儿七可促进慢性粒细胞白血病K562细胞的凋亡[J].
南方医科大学学报, 2017, 37(2): 226-31.
|
| [23] |
Sun Y, Peng ZL. Programmed cell death and cancer[J].
Postgrad Med J, 2009, 85(1001): 134-40.
DOI: 10.1136/pgmj.2008.072629. |
| [24] |
Hassan M, Watari H, Abualmaaty A, et al. Apoptosis and molecular targeting therapy in cancer[J].
Biomed Res Int, 2014: 150845.
|
| [25] |
Broek RV, Mohan S, Eytan DF, et al. The PI3K/Akt/mTOR axis in head and neck cancer:functions, aberrations, cross-talk, and therapies[J].
Oral Dis, 2015, 21(7): 815-25.
DOI: 10.1111/odi.2015.21.issue-7. |
| [26] |
Sithanandam G, Fornwald LW, Fields J, et al. Inactivation of ErbB3 by siRNA promotes apoptosis and attenuates growth and invasiveness of human lung adenocarcinoma cell line A549[J].
Oncogene, 2005, 24(11): 1847-59.
DOI: 10.1038/sj.onc.1208381. |
| [27] |
Yamaguchi H, Wang HG. The protein kinase PKB/Akt regulates cell surival and apoptosis by inhibiting Bax conformational change[J].
Oncogene, 2001, 20(53): 7778-86.
|
| [28] |
Carrara L, Lavezzi SM, Borella E, et al. Current mathematical models for cancer drug discovery[J].
Expert Opin Drug Discov, 2017, 12(8): 785-99.
|
 2019, Vol. 39
2019, Vol. 39

