2. 深圳市贝美药业有限公司,广东 深圳 518057;
3. 中山大学附属第七医院药学部,广东 深圳 518017
2. Shenzhen Beimei Pharmaceutical Co., Ltd, Shenzhen 518057, China;
3. Department of Pharmacy, Seventh Affiliated Hospital of Sun Yat-sen University, Shenzhen 518017, China
非酒精性脂肪肝(NAFLD)发病机制以“二次打击”学说为主[1],但如今该学说已不能完全揭示由肝细胞脂质堆积发展为非酒精性单纯性脂肪肝(NAFL),非酒精性脂肪性肝炎(NASH)及其相关肝纤维化和肝细胞癌的。近年提出的“多次打击”学说强调了内质网应激(ER stress)在NAFLD发生发展中的重要性[2]。许多肝脏的疾病均与内质网应激及其介导的细胞凋亡相关。持续、不可逆转的ER stress激活细胞内与NAFLD病理发展相关的多条信号通路,参与了肝脏细胞脂肪变性、炎症反应、细胞死亡等系列病理变化[3]。ER stress干扰了脂质合成和转运,抑制了脂肪从肝脏细胞的分泌;ER stress通过诱导胰岛素抵抗间接减缓甘油三酯的代谢;ER stress促进炎症反应因子及细胞凋亡因子的表达[4-5],加重炎症反应,推进NAFLD病程发展。因此,研究明确在NAFLD病程中ER stress信号因子的变化情况,及其如何参与调节细胞炎性反应、脂肪代谢、及细胞生存或细胞凋亡,为非酒精性脂肪肝患者提供新的预防和治疗策略,并发现新的药物治疗靶点有着重大的现实意义。
护肝清脂片由泽泻、山楂、荷叶、蒲黄、三七等中药组成,为我院用于防治非酒精性脂肪肝病的医院制剂,临床疗效确切。体内、外研究发现其对NAFLD具有显著防治作用,而其降脂抗炎作用涉及了多条信号通路[6-9],运用iTRAQ定量蛋白质组学技术及KEGG pathway富集分析结果得知多条信号通路参与了NAFLD的发生发展,如:脂肪酸代谢通路、PPAR信号通路、腺苷酸活化激酶信号通路、胰岛素信号通路等等。其中,内质网应激通路中多条通路被激活[10-11],如:PERK/ATF4通路、IRE1/XBP1通路,并在模型组与治疗组之间显示明显差异。为明确ER stress标志物在脂肪变性模型中表达情况及护肝清脂片是否通过缓解NAFLD所致ER stress发挥治疗作用,本实验利用1 mmol/LFFA诱导HepG2细胞发生脂肪变性,建立NAFLD细胞模型,探讨护肝清脂片对脂肪变性肝细胞所致内质网应激的影响作用及可能机制。
1 材料和方法 1.1 材料 1.1.1 动物及细胞株SPF级SD雄性大鼠30只,体质量200±10 g,购自南方医科大学动物实验中心,合格证号:SCXK(粤)2011-0015。HepG2细胞株购自中国科学院上海细胞生物研究所细胞库,本实验室自行冻存传代备用。
1.1.2 实验药物护肝清脂片(主要成份:泽泻,山楂,荷叶,蒲黄,三七)由南方医科大学珠江医院药学部制剂室生产提供(批号:201709),非诺贝特片由杭州民生药业有限公司生产(批号:T16F110),规格分别为0.6 g/片,0.1 g×20片/盒。
1.1.3 主要试剂胎牛血清、DMEM培养基(Invitrogen Gibco);油酸钠、棕榈酸钠(Sigma);饱和油红O试剂盒(索莱宝);甘油三酯(TG)试剂盒、谷草转氨酶(AST/GOT)、谷丙转氨酶(ALT/GPT)试剂盒(南京建成);BCA蛋白浓度测定试剂盒(碧云天);Trizol试剂盒(Invitrogen);Prime ScriptTM RT Master Mix, SYBR® Premix Ex TaqTM(Tli RNaseH Plus)(TAKARA Bio.);抗体GRP78、PKC-δ、p-PKC-δ、CHOP、CASPASE12(Abcam);抗体p-PERK(Affinity);抗体PERK、ATF6、ATF4(Cell Signaling);抗体GAPDH(Santa Cruz);GRP78,PERK,ATF6,XBP-1,CASPASE12,CHOP,PKC-δ,β-ACTIN引物自行设计,由生工生物工程(上海)股份有限公司合成。
1.1.4 仪器-86 ℃超低温冰箱(三洋);CO2培养箱(松下);生物安全柜(NUAIRE);高速冷冻离心机(赛默飞世尔);荧光倒置相差显微镜,荧光正置显微镜(莱卡);PCR测定仪(BIO-RAD);荧光定量罗氏480 PCR测定仪(罗氏);化学发光凝胶成像系统Tanon-5200(天能);酶标测试仪(BMGLAGTECH);Nanodrop ND-1000紫外分光光度计(Nano Drop)等仪器。
1.2 方法 1.2.1 细胞培养及分组HepG2细胞培养于含10%胎牛血清的DMEM培养基(含1%双抗),放置于37 ℃,5% CO2培养箱中培养。当细胞处于对数增长期则开始实验,实验分为6个组:正常对照组(CON);模型组(FFA);FFA+低、中、高剂量护肝清脂片含药物大鼠血清组(HG-L,HG-M,HG-H);以及FFA+非诺贝特含药物大鼠血清组(FF)。各组细胞分别用相应大鼠血清孵育24 h后,除正常对照组外,其余各组均添加1 mmol/L FFA诱导24 h,具体分组如表 1。
| 表 1 实验分组 Table 1 Treatment of the cells in different groups |
30只SD大鼠适应性饲养1周后,按体质量随机分为5组,每组6只,分别为空白组;低、中、高护肝清脂片组;非诺贝特组。护肝清脂片低、中、高剂量组分别按2.7、5.4、10.8 g/kg体质量剂量灌胃给药,非诺贝特组按0.4 g/kg体质量剂量灌胃给药,空白组按10 mL/kg灌服等量蒸馏水,1次/d,连续灌胃给药7 d,于第8天上午给药1 h后腹主动脉取血,室温静置3~4 h,3000 r/min、4 ℃离心,超净台上分离血清,56 ℃恒温水浴灭活30 min,0.22 μm滤膜过滤,-80 ℃保存备用[8]。
1.2.3 CCK8法确定实验中FFA给药浓度细胞以每孔105的密度接种于96孔培养板中,每孔内加入培养基100 μL,待细胞贴壁后加入以下处理因素,分别设置对照组和模型组,其中对照组加入1% BSA的DMEM培养基,模型组分别加入浓度为0.125、0.25、0.5、1.0、2 mmol/L的FFA,每组设6个复孔。加入FFA培养24 h后,吸去培养上清液,然后每孔加入10% CCK8(DMEM配置)100 μL,37 ℃孵育45 min~1 h,在酶标仪450 nm波长处测量各孔A。
1.2.4 药物血清毒性的检测细胞以每孔1×105的密度接种于96孔板中,用分别含0、10%、20%、30%、40%的大鼠血清的DMEM培养基预处理24 h,检测各组细胞培养上清中乳酸脱氢酶释放的含量,确定最佳血清添加比例。同样地,根据所得结果,进一步检测10%空白大鼠血清、10%低、中、高剂量护肝清脂片(HG-L、HG-M、HG-H)和10%非诺贝特药物血清(FF)作用于HepG2细胞24 h后的培养上清中的乳酸脱氢酶含量(已确定最佳血清添加比例为10%),评估药物血清对HepG2细胞是否具有毒性,LDH检测的相关具体操作按照南京建成试剂盒说明书上步骤测定。
1.2.5 HepG2细胞甘油三酯(TG)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)的测定按照1.2.1的方法培养细胞,收集细胞和培养上清液。采用RIPA裂解液裂解细胞,1.2×104 g离心,取上清,BCA蛋白浓度试剂盒检测蛋白含量,取上清液,按南京建成谷丙转氨酶(ALT/GPT)、谷草转氨酶(AST/GOT)测试盒测定ALT、AST含量。
1.2.6 HepG2细胞油红O染色① 去掉细胞培养基,用PBS洗涤2遍;②4%多聚甲醛固定10 min,水洗;③加油红O工作液1~2 mL,室温避光染色30 min,密封;④ 60%异丙醇冲洗30 s至背景透明,水洗;⑤苏木素染液复染细胞核30 s;⑥水洗变蓝,甘油明胶封片,室温晾干,镜下观察脂滴染色情况。
1.2.7 透射电镜观察内质网应激情况HepG2细胞以1×106/mL种植于6孔板,按1.2.1的方法分组培养细胞后,弃掉培养基,用细胞刮刀收集细胞,PBS洗两次,用10%戊二醛室温固定1 h,再移置4 ℃冰箱放置3 h后,送南方医科大学电镜检测室检测。
1.2.8 RT-PCR检测内质网应激相关基因mRNA表达按照Trizol法提取HepG2细胞RNA,用Nanodrop ND-1000分光光度计测定RNA的纯度及浓度,选取OD值在1.80~2.0间的样品按照TAKARA Prime ScriptTM RT Master Mix试剂盒说明书进行逆转录,逆转录体系为20 μL。RT-PCR反应体系为10 μL,按照TAKARASYBR Premix Ex TaqTMⅡ(TliRNaseH Plus)试剂盒说明书,采用LightCycler480进行实时荧光定量PCR反应。引物设计如下表 2。
| 表 2 引物设计 Table 2 Primer design |
按照蛋白提取试剂盒说明书提取各组细胞蛋白,采用BCA进行蛋白定量,-80 ℃保存备用。电泳(100 V,78 min);转膜(200 mA,120 min);5%BSA(TBST)室温封闭1 h;4 ℃敷育一抗过夜(一抗及稀释比例:GRP78,1:3000、PERK,1: 1000、p-PERK,1: 1000、ATF6,1: 1000、ATF4,1: 1000、CASPASE-12,1: 1000、CHOP,1: 1000、PKC-δ,1: 1000、p-PKC-δ,1: 1000);TBST洗膜3次,10 min/次;室温敷育二抗1 h;TBST洗膜3次,10 min/次;ECL显影,Image J灰度分析,以CON组为1,计算各蛋白相对表达量。
1.2.10 PKC-δ siRNA转染HepG2细胞细胞以5×105/mL的密度接种于六孔板中,待细胞融合率达到50%左右,开始转染步骤操作。按照riboFECTTM CP试剂说明书操作,将转染试剂和PKC-δ siRNA序列或阴性对照序列制备成混合液,并以终浓度为50 nmol/L加入对应各孔中进行转染。将转染后的细胞用1 mmol/L FFA或高剂量护肝清脂片药物血清干预后再用1 mmol/LFFA诱导处理,所得样品进行Western blot分析。si-PKC δ转染靶序列为5'-GCATGAATGTGCACCATAAdTdT-3',以上所用的序列及通用型阴性对照序列均由锐博生物科技有限公司设计合成。
1.2.11 统计学分析采用SPSS23.0统计软件对数据统计分析,数据以均值±标准差表示,多组均数间比较采用单因素方差分析,并采用LSD法或Dunnett T3法检验作两两比较。P < 0.05为差异有统计学意义。
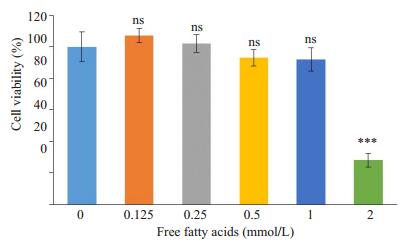
2 结果 2.1 FFA浓度确定采用混合脂肪酸FFA(油酸:棕榈酸=2:1)诱导HepG2细胞脂肪变性,分别加入浓度为0、0.125、0.25、0.5、1.0、2.0 mmol/L的FFA培养HepG2细胞,作用24 h后观察细胞存活状态。结果显示,FFA浓度为1 mmol/L以下时细胞生存率较高,在1 mmol/L时存活率约为91.92%(P>0.05),仅有少量细胞漂浮。当FFA浓度达2 mmol/L细胞出现大量漂浮死亡,存活率骤降至约28.06%(P < 0.001,图 1),确定1 mmol/L FFA为造模浓度。
|
图 1 不同浓度FFA对HepG2细胞生长的影响 Figure 1 Effects of Free fatty acids at different concentrations on viability of HepG2 hepatocytes (Mean±SD). nsP>0.05, ***P < 0.001 vs control group. |
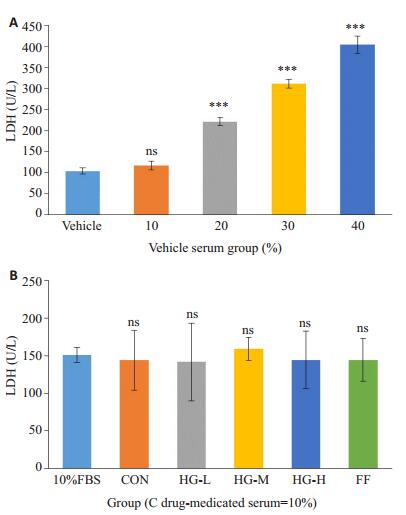
首先,为了确定大鼠血清在HepG2细胞培养中最佳比例。我们测定了在含10%、20%、30%、40%大鼠血清培养下各组细胞培养上清LDH的含量,以10%胎牛血清制备的DMEM完全培养基为对照,结果显示含10%空白大鼠血清培养的细胞LDH含量无明显差异(P>0.05),当浓度达到20%后,LDH随浓度的增加而显著升高(P < 0.001),由此确定了10%空白大鼠血清为最佳添加比例。另外,用含10%各组药物大鼠血清培养细胞,测得上清液LDH与对照组均无统计学差异(P>0.05)。因此,确定最佳含药血清添加比例为10%(图 2)。
|
图 2 FFA诱导的肝脂肪变性HepG2细胞上清LDH含量的测定 Figure 2 LDH release assay of the cells with different treatments (Mean±SD). A: Cells treated with normal rat serum at different concentrations; B: Cells treated with 10% medicated serum. nsP> 0.05, ***P < 0.001 vs control group. |
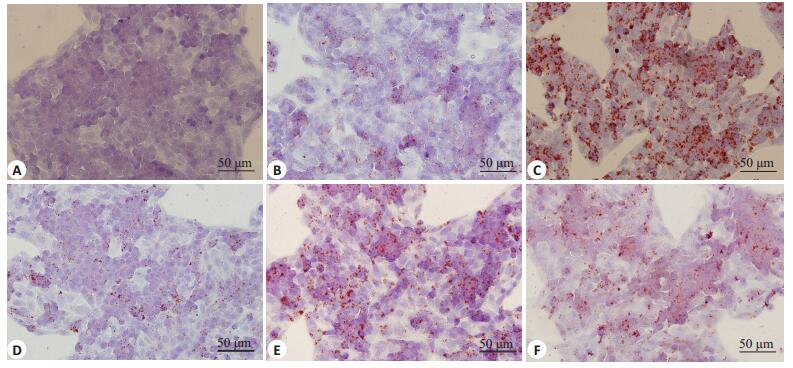
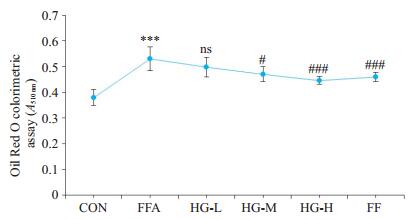
采用油红O染色法观察各组细胞脂肪堆积情况及定量测定脂质含量,经1 mmol/L FFA干预24 h后,与空白组相比,游离脂肪酸组细胞内染红的脂滴明显增加(图 4B,图 5),而经护肝清脂片药物血清的孵育24 h后,脂肪堆积情况有了显著地改善(图 4C~E,图 5),并随剂量的增加而逐渐恢复如正常细胞。另外,非诺贝特药物血清组细胞内脂肪病变也明显得到改善(图 4F,图 5)。
|
图 3 护肝清脂片药物血清对FFA诱导的肝脂肪变性HepG2细胞的油红O染色 Figure 3 Effects of Huganqingzhi (HGT)-medicated serum on FFA-stimulated HepG2 hepatocytes (Oil Red O staining, original magnification: ×200).A: CON; B: FFA; C: FFA+10% HG-L; D: FFA+10% HG-M; E: FFA+10% HG-H; F: FFA+10% FF. |
|
图 4 油红O染色法定量测定细胞内脂质含量 Figure 4 Lipid content in the cells determined by Oil red-based colorimetric assay. ***P < 0.001 vs CON; nsP>0.05, #P < 0.05, ##P < 0.01, ###P < 0.001 vs FFA(Mean±SD). |
|
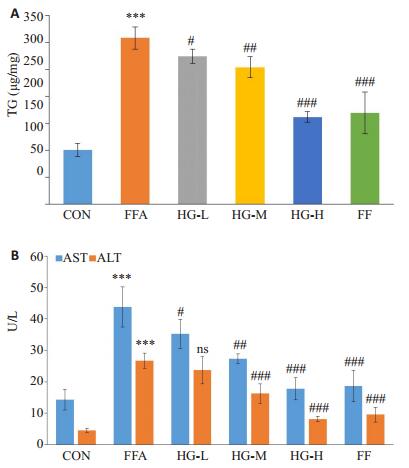
图 5 护肝清脂片药物血清对FFA诱导的肝脂肪变性HepG2细胞TG、AST、ALT含量的影响 Figure 5 Effects of Huganqingzhi (HGT)-medicated serum on TG content (A) and AST/ALT (B) level in FFAs-stimulated HepG2 hepatocytes (Mean ± SD). ***P < 0.001 vs CON; nsP > 0.05, #P < 0.05, ##P < 0.01, ###P < 0.01 vs FFA. |
定量测定HepG2细胞内甘油三酯的含量及AST、ALT肝功能指标的结果显示:FFA组细胞TG含量约超出正常组的3倍,经护肝清脂片药物血清治疗后,细胞内TG呈现剂量依赖性的下降的趋势,低剂量组与中剂量组均有一定程度的降低(P < 0.05,P < 0.01),而高剂量组甚至下降为模型组的1/2倍量(P < 0.001),与非诺贝特的降脂效果相当(P < 0.001,图 6A)。其次,经药物治疗后HepG2细胞的AST、ALT水平呈现剂量依赖性下降,中、高剂量组及非诺贝特组与模型组相比均具有统计学差异(P < 0.05,图 6B)。
|
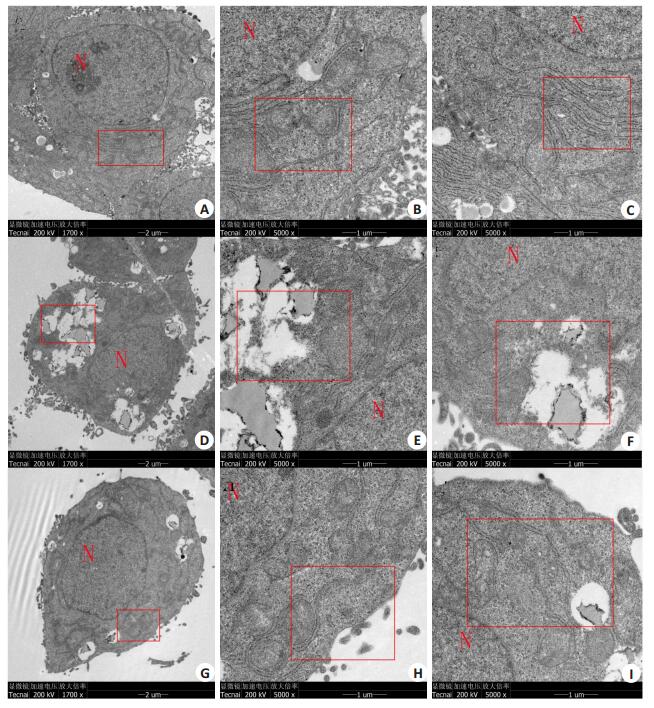
图 6 透射电镜观察各组HepG2细胞内质网结构变化 Figure 6 Transmission electron microscopy of the ER in each group of HepG2 hepatocytes (×1700, ×5000). A-C: CON; D-F: FFA; G-I: FFA+10% HG-H. |
体外培养的正常组HepG2细胞内质网排列有序,呈扁平囊状,各处内质网腔宽窄一致,核糖体紧密附着于外侧扁池膜上,胞浆内并未发现明显脂滴(图 7A~C);FFA组HepG2细胞内质网呈现严重损伤状态,内质网扩张成囊泡状的同时膜上核糖体颗粒脱落,胞浆内各处分布着大小不一的脂滴空泡使得内质网分布紊乱,结构破坏(图 7D~F);而经护肝清脂片高剂量药物血清干预后,细胞整体结构趋于正常,脂滴空泡现象明显减少,内质网结构与形态都有显著性改善(图 7G~I)。
|
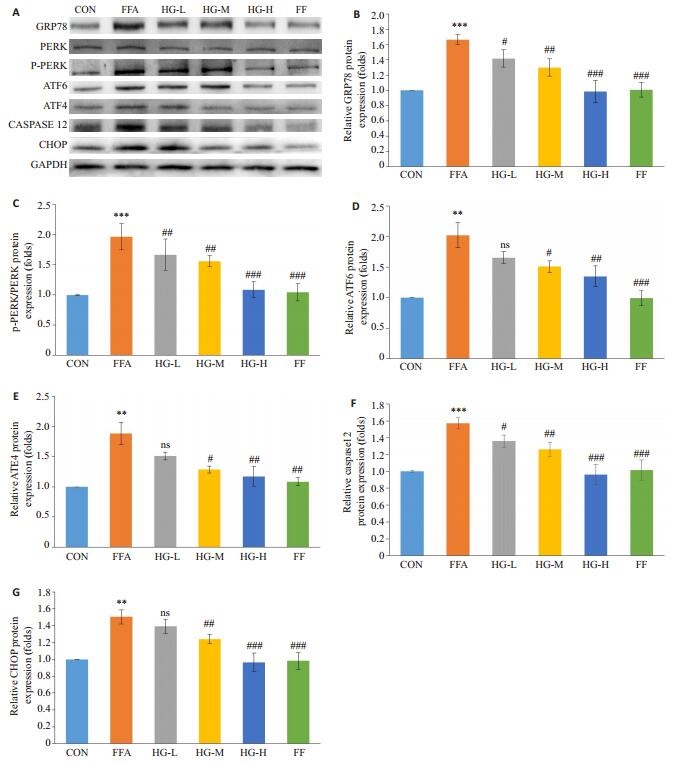
图 7 护肝清脂片药物血清对FFA诱导24 h后的GRP78、PERK、p-PERK、ATF6、ATF4、CASPASE-12、CHOP的表达情况的影响 Figure 7 Effects of Huganqingzhi (HGT)-medicated serum on the expressions of GRP78 (A, B), p-PERK/PERK (A, C), ATF6 (A, D), ATF4 (A, E), CASPASE-12 (A, F), and CHOP (A, G) in FFAs-stimulated HepG2 hepatocytes. ***P < 0.001 vs CON; nsP>0.05, #P < 0.05, ##P < 0.01, ###P < 0.01 vs FFA. |
采用Western blot及RT-PCR法对细胞ER stress蛋白的表达情况进行检测。与CON组相比,FFA组内质网应激标志性蛋白GRP78表达量约是CON组的1.74倍,差异有统计学意义(P < 0.001),护肝清脂片药物血清能剂量依赖性下调FFA诱导GRP78的表达(P < 0.05),其中HG-H组、FF组的表达量下降至与CON组相当(P>0.05,图 8);同样地,FFA组的p-PERK/PERK、ATF4、CHOP的表达水平明显高于CON组(P < 0.01),而护肝清脂片中、高剂量药物血清作用后三种蛋白均有所下调(P < 0.01),HG-H组与FF组逐渐趋于正常组的表达水平;ATF6是ER stress标志信号分子之一,FFA组ATF6表达量约为CON组的2倍(P < 0.01),而HG-M、HG-H、FF组ATF6的表达水平均有所下调(P < 0.05,0.01,0.001),此外,与CON组相比,FFA组CASPASE-12表达上调,差异具有统计学意义(P < 0.001),而经过护肝清脂片药物血清治疗后CASPASE-12的表达亦显示出一定的下降(P < 0.05)。
|
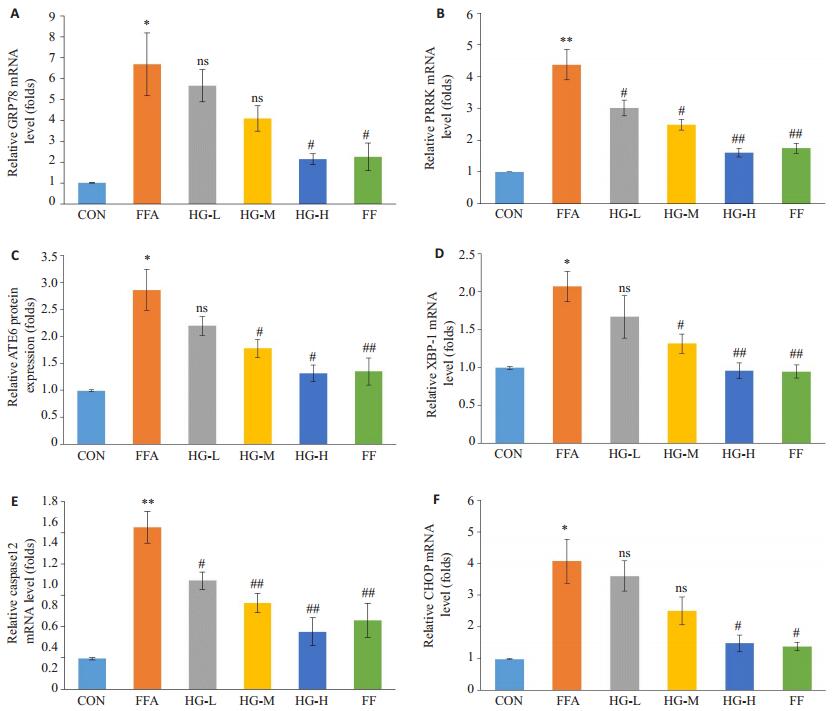
图 8 护肝清脂片药物血清对FFA诱导24 h后的GRP78、PERK、ATF6、XBP-1、CASPASE-12、CHOP基因的表达情况的影响 Figure 8 Effects of Huganqingzhi (HGT)-medicated serum on expressions of GRP78 (A), PERK (B), ATF6 (C), XBP-1 (D), CASPASE-12 (E), and CHOP (F) mRNAs in FFAs-stimulated HepG2 hepatocytes. ***P < 0.001 vs CON; nsP>0.05, #P < 0.05, ##P < 0.01, ###P < 0.01 vs FFA. |
为了进一步佐证上述蛋白表达结果,我们对各基因mRNA表达情况进行分析(图 9)。与正常对照组相比,FFA组中的上述mRNA的表达均显著性上调(P < 0.05)。经过护肝清脂片药物血清24 h干预后,由FFA诱导的脂肪变性HepG2细胞与ER stress相关的mRNA表达的表达水平均有一定程度的下调,除PERK、CASPASE-12外,HG-L组中,GRP78、ATF6、XBP-1、CHOP的mRNA表达水平与模型组间无显著性差异(P>0.05)。但是在护肝清脂片中、高剂量、非诺贝特药物血清干预下各基因表达均显著性下调(P < 0.05,0.01,0.001),并呈现一定的剂量依赖性,随剂量增加其表达水平逐渐趋于正常组水平,mRNA表达趋势与其蛋白水平结果相一致。
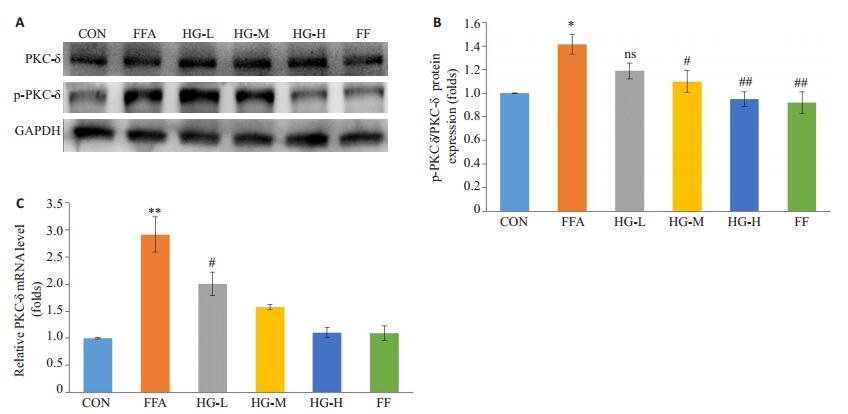
|
图 9 护肝清脂片药物血清对FFA诱导24 h的脂肪变性HepG2细胞PKC-δ、p-PKC-δ蛋白及PKC-δ mRNA表达情况的影响 Figure 9 Effects of Huganqingzhi (HGT)-medicated serum on expressions of PKC-δ protein, p-PKC-δ protein, p-PKC-δ/PKC-δ (A and B), and PKC-δ mRNA (C) in FFAs-stimulated HepG2 hepatocytes. ***P < 0.001 vs CON; nsP>0.05, #P < 0.05, ##P < 0.01, ###P < 0.01 vs FFA. |
各组HepG2细胞PKC-δ蛋白表达均无统计学差异(P>0.05),而其活化形式pPKC-δ蛋白在各组中表达各异。与CON组相比,经FFA作用24 h后,FFA组p-PKC-δ蛋白表达显著性上调(P < 0.05),经过护肝清脂片药物血清作用后,HG-M组、HG-H组p-PKC-δ蛋白表达下调,差异具有统计学意义(P < 0.05或0.01)。另外,PKC-δ mRNA在各组间也具有表达差异,并呈现出一定的剂量依赖性,随着药物血清剂量的增加,其表达水平相应的下调(P < 0.05或0.01,图 10)。
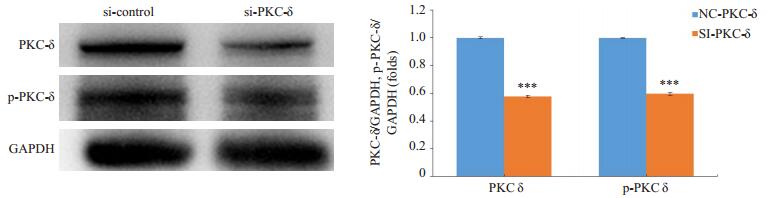
|
图 10 沉默PKC-δ后,HepG2细胞PKC-δ、p-PKC-δ蛋白表达情况 Figure 10 Expression of total and phosphorylated PKC-δ after treatment with PKC-δ siRNA. ***P < 0.001 vs si-control group. |
为进一步了解PKC-δ在护肝清脂片药物血清保护FFA诱导的HepG2细胞内质网应激损伤中所涉及到的功能。我们将PKC-δ选择性的沉默,然后再次检测了ER-stress标志性蛋白GRP78、PERK、P-PERK、CASPASE12以及CHOP蛋白的表达情况。经si-PKC-δ处理后明显下调HepG2细胞PKC-δ及P-PKC-δ蛋白的表达,差异具有统计学意义(P < 0.001,图 11)。与未沉默PKC-δ的HepG2细胞,沉默后的HepG2在1 mmol/LFFA作用后内质网应激损伤明显得以改善。虽然与si-PKC-δ+正常组相比,si-PKC-δ+ FFA组GRP78和P-PERK/PERK蛋白表达水平仍具有统计学差异(P < 0.001,P < 0.01),但是与si-Control+FFA相比,si-PKC-δ+FFA组GRP78、PERK、p-PERK、CASPASE-12、CHOP蛋白表达均有显著性下调(P < 0.001)。另外,与si-PKC-δ +FFA组相比,si-PKC-δ+HG-H组GRP78和P-PERK/PERK表达具有显著性差异(P < 0.001,P < 0.01),而CASPASE12和CHOP表达虽有一定下调但无明显差异(P>0.05)。
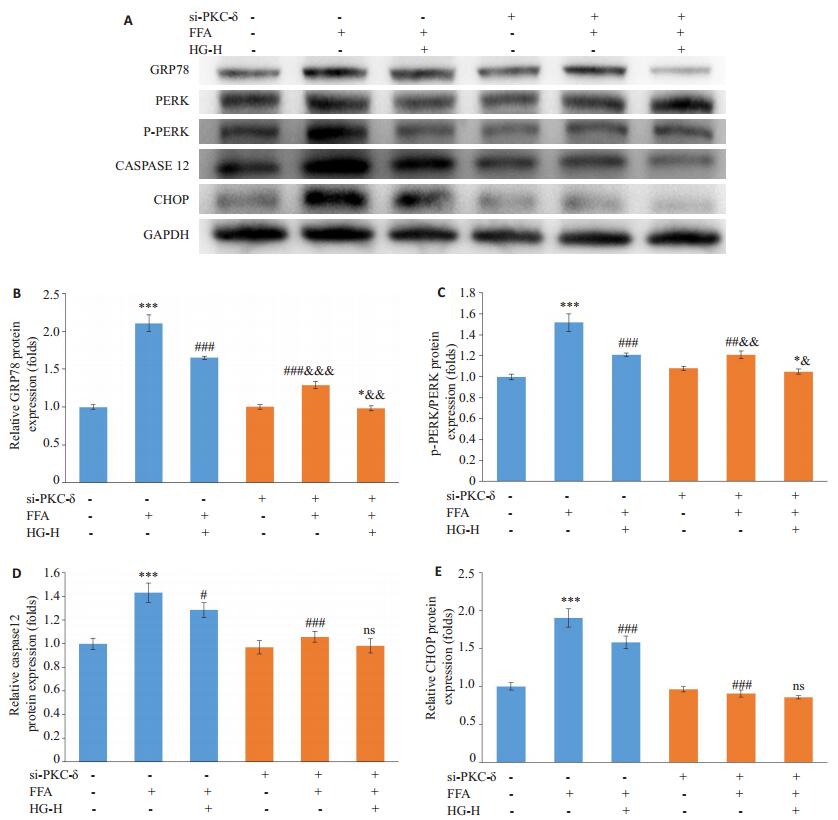
|
图 11 沉默PKC-δ后,HepG2细胞GRP78、PERK、p-PERK、CASPASE-12、CHOP蛋白表达情况 Figure 11 Expression of GRP78, PERK, p-PERK, CASPASE-12 and CHOP after treatment with PKC-δ siRNA. ***P < 0.001 vs si-Control group; #P < 0.05, ##P < 0.01, ###P < 0.001 vs si-Control+FFA group; &&P < 0.01, &&&P < 0.001 vs si-PKC-δ group; nsP>0.05,&*P < 0.01, &&*P < 0.001 vs si-PKC-δ+FFA vs si-PKC-δ+FFAgroup. |
NAFLD为早期可逆转性疾病,发病率高达20%~30%,并呈现年轻化趋势,其中发展为NASH占10%~20%,NASH是病程的拐点和防治关键,有可能恶化为肝硬化[12]。因此,明确疾病发生发展机制、尽早干预肝脏单纯脂肪病变向脂肪肝炎的发展,以期获得更好的预后效果。近年来研究发现,肥胖或非酒精性脂肪肝患者的肝细胞中检测出内质网应激信号蛋白异常表达,如GPR78、PERK、ATF6、IRE-1等,共同参与了NAFLD疾病的发展进程,与肝脏脂肪变性、胰岛素抵抗、炎症和细胞凋亡有关[13-15]。
在NAFLD发展进程中存在多种ER stress诱发因素,如FFA增多、高胆固醇、氧化应激、炎症反应等,而ER stress又经多条通路推动了NAFLD向NASH的转化。当细胞内钙离子失衡、未/错误折叠蛋白在细胞内积聚引发ER stress时,GRP78与内质网跨膜蛋白PERK、IRE1及ATF6解离活化,启动未折叠蛋白反应(UPR),而持续或过度的ER stress使细胞自身修复能力不足以抵抗外界刺激时,则会激活内质网超负荷反应(EOR)[16-17],继发脂肪堆积、炎症反应、胰岛素抵抗和凋亡等反应。本实验结果显示由1 mmol/LFFA诱导的脂肪变性HepG2细胞GRP78、PERK、ATF6、ATF4、XBP-1在mRNA或蛋白表达水平上比正常组显著升高(P < 0.05),信号分子的上调提示1 mmol/L FFA成功诱导HepG2细胞发生UPR。PERK/ATF4通路、IRE1/XBP1通路及ATF6通路,3条UPR信号通路可直接或间接地参与脂肪合成、分化及转运基因的表达,如沉默PERK可抑制FAS、ACL、SCD-1的合成[18];过表达ATF4可触发斑马鱼肝脏脂肪病变[19],而沉默ATF4后却使在小鼠肝脏及脂肪组织中PPAR γ、SREBP-1c、ACC和FAS表达下调[20];激活的XBP1、ATF6可直接与脂肪合成基因启动子相结合而上调相关蛋白的表达,调节VLDL的组装和分泌[21-24]。本实验研究结果与上述文献相一致,护肝清脂片或非诺贝特药物血清能显著下调ER stress标志性蛋白的表达,缓解其ER stress状态,从而有效改善了HepG2细胞脂肪变性及功能状态。此外,激活的IRE1-α、PERK经JNK/AP-1、IKK/NF-κB可介导炎性反应通路,上调TNF-α、IL-1β、MCP-1等多种炎症因子的表达,而其中TNF-α及IL-1β又与胰岛素抵抗相关,并且使库普弗细胞和肝星状细胞向肌纤维细胞转化,继而加重炎症应激、诱发肝纤维化和肝损伤,推动NAFLD向NASH的发展进程[25-26]。最后,NAFLD发展不仅与肝脏脂肪异常堆积、炎症反应、胰岛素抵抗有关,还与肝脏细胞凋亡程度相关,而持续性或不可逆转的内质网应激可导致细胞凋亡。长期处于ER stress下的细胞可经PERK/ATF4/CHOP、IRE1/JNK、CASPASE信号通路介导细胞发生凋亡,上调CHOP、CASPASE-12及JNK等蛋白的表达,一方面降低抗凋亡蛋白(如:Bcl-2、Bcl-x1),增加促凋亡蛋白(Bax、Bak)的表达,另一方面激动内质网钙外排受体使内质网内钙泄露、细胞质的钙浓度上升,以及氧自由基产生,最终激活细胞线粒体凋亡途径或非线粒体凋亡途径[27]。本实验中FFA组CHOP及CASPASE-12表达上调,提示在FFA长时间诱导下HepG2细胞已发生ER stress下的细胞凋亡,而经护肝清脂片及非诺贝特药物血清干预后,不仅下调了CHOP、CASPASE-12蛋白水平的表达,还能从整体水平上改善细胞内质网囊泡性扩张、核糖体脱落等异常结构,减少脂滴空泡的产生,从而使细胞整体结构趋于正常。综上所述,PERK/ATF4通路、IRE1/XBP1通路和ATF6通路激活所导致的ER stress与肝细胞脂质代谢的调节,炎症因子的产生,氧化应激及细胞凋亡坏死有关,参与了NAFLD发生发展的各个环节。综合实验结果证明,FFA诱导的脂肪变性细胞内质网形态结构发生了严重的损伤,从整体上提示FFA在引起细胞脂肪病变的同时诱发了细胞内质网应激作用,而护肝清脂片能有效的缓解细胞的内质网应激作用和抑制细胞内质网结构的病态发展,从而有效地改善细胞脂肪堆积和炎症反应。
此外,本实验中还发现FFA组PKC-δ基因表达上调。已有相关研究证实PKC-δ可经ER stress通路参与调节NASH的病程,并采用沉默PKC-δ基因或其通路抑制剂等方式,降低了NASH或糖尿病小鼠ER stress信号分子的表达、血脂含量、以及ALT水平等相关指标,从而改善肝脏脂肪堆积和肝纤维化[28-31]。这提示PKC-δ在HepG2脂肪变性、肝功能失调中起着重要的作用,而中、高剂量组护肝清脂片及非诺贝特含药血清有可能是通过降低PKC-δ表达水平,而起到缓解HepG2细胞ER stress的作用。进一步地实验发现,沉默PKC-δ的HepG2细胞在1 mmol/LFFA作用下表现出更强的抗内质网损伤的能力,在很大程度上下调了GRP78、p-PERK/PERK、CHOP及CASPASE12的蛋白表达,但si-PKC-δ+FFA组与si-PKC-δ+HG-H组间GRP78和pPERK/PERK蛋白表达水平仍具有统计学差异(P < 0.01),可见护肝清脂片药物血清缓解1 mmol/LFFA所致HepG2细胞ER stress的能力不仅仅通过下调PKC-δ起作用,还存在其他通路影响着细胞内质网应激状态。
综上,护肝清脂片药物血清可有效缓解1 mmol/L FFA所致的ER stress,不仅在蛋白和mRNA水平上有效地下调UPR信号分子GRP78、p-PERK、ATF6、ATF4、CHOP、CASPASE-12、XBP-1、PKC-δ、p-PKC-δ的表达,而且从整体水平上改善HepG2细胞内质网结构形态,从而有效防治FFA诱导的NAFLD细胞模型的脂肪变性,改善HepG2功能状态,其中改善ER stress的作用机制在一定程度上与下调PKC-δ的表达有关。
| [1] |
董姝, 刘平, 孙明瑜. 非酒精性脂肪肝发病机制——"二次打击"学说研究进展[J].
临床肝胆病杂志, 2012, 28(7): 551-5.
DOI: 10.3969/j.issn.1001-5256.2012.07.023. |
| [2] |
Pagliassotti MJ. Endoplasmic reticulum stress in nonalcoholic fatty liver disease[J].
Annu Rev Nutr, 2012, 32: 17-33.
DOI: 10.1146/annurev-nutr-071811-150644. |
| [3] |
Malhi H, Kaufman RJ. Endoplasmic reticulum stress in liver disease[J].
J Hepatol, 2011, 54(4): 795-809.
DOI: 10.1016/j.jhep.2010.11.005. |
| [4] |
Ji C. Dissection of endoplasmic reticulum stress signaling in alcoholic and non-alcoholic liver injury[J].
J Gastroenterol Hepatol, 2008, 23(Suppl 1): S16-24.
|
| [5] |
Afrin R, Arumugam S, Wahed MI, et al. Attenuation of endoplasmic reticulum stress-mediated liver damage by mulberry leaf diet in streptozotocin-induced diabetic rats[J].
Am J Chin Med, 2016, 44(1): 87-101.
DOI: 10.1142/S0192415X16500063. |
| [6] |
姚笑睿, 凡夏, 唐外姣, 等. 护肝清脂片对非酒精性脂肪肝大鼠肝脏中AMPK通路激活及NF-κB-p65蛋白的影响[J].
南方医科大学学报, 2017, 37(1): 56-62.
DOI: 10.3969/j.issn.1673-4254.2017.01.10. |
| [7] |
唐外姣, 周本杰, 周华. 护肝清脂片对非酒精性脂肪肝大鼠的药效学研究[J].
中药药理与临床, 2013, 29(2): 169-72.
|
| [8] |
Yin JJ, Luo YQ, Deng HL, et al. Hugan qingzhi medication ameliorates hepatic steatosis by activating AMPK and PPAR alpha pathways in L02 cells and HepG2 cells[J].
J Ethnopharmacol, 2014, 154(1): 229-39.
DOI: 10.1016/j.jep.2014.04.011. |
| [9] |
Tang W, Zeng L, Yin J, et al. Hugan qingzhi exerts anti-inflammol/ latory effects in a rat model of nonalcoholic fatty liver disease[J].
Evid-based ComplAlt, 2015: 810369.
|
| [10] |
Xia F, Yao XR, Tang WJ, et al. Isobaric Tags for relative and absolute quantitation (iTRAQ)-based proteomic analysis of hugan qingzhi and its protective properties against free fatty acid-induced L02 hepatocyte injury[J].
Front Pharmacol, 2017, 8: 99.
|
| [11] |
Yao X, Xia F, Tang W, et al. Isobarictags for relative and absolute quantitation (iTRAQ)-based proteomics for the investigation of the effect of HuganQingzhi on non-alcoholic fatty liver disease in rats[J].
J Ethnopharmacol, 2017, 15: 612-4.
|
| [12] |
王素琴, 黄缘. 非酒精性脂肪肝病的研究进展[J].
世界华人消化杂志, 2014, 22(23): 3410-5.
|
| [13] |
Maher JJ.
Pathogenesis of NAFLD and NASH[M]. Alcoholic and non-alcoholic fatty liver disease, 2016: 71-101.
|
| [14] |
孔思明, 张晓琳, 叶菲. 内质网应激与非酒精性脂肪性肝病[J].
国际药学研究杂志, 2016, 43(2): 234-8, 248.
|
| [15] |
Gentile CL, Frye M, Pagliassotti MJ. Endoplasmic reticulum stress and the unfolded protein response in nonalcoholic fatty liver disease[J].
Antioxid Redox Signal, 2011, 15(2): 505-21.
DOI: 10.1089/ars.2010.3790. |
| [16] |
王洪岩, 刘晓珺, 杜雅菊, 等. 内质网应激与肝脏疾病研究进展[J].
世界华人消化杂志, 2012, 20(6): 451-9.
|
| [17] |
Pahl HL. Signal transduction from the endoplasmic reticulum to the cell nucleus[J].
Physiol Rev, 1999, 79(3): 683-701.
DOI: 10.1152/physrev.1999.79.3.683. |
| [18] |
Bobrovnikova-Marjon E, Hatzivassiliou GA, Romero M, et al. PERK-dependent regulation of lipogenesis during mouse mammol/ Lary gland development and adipocyte differentiation[J].
Proc Natl Acad Sci USA, 2008, 105(42): 16314-9.
DOI: 10.1073/pnas.0808517105. |
| [19] |
Yeh K, Lai C, Lin C, et al. ATF4 overexpression induces early onset of hyperlipidaemia and hepatic steatosis and enhances adipogenesis in zebrafsh[J].
Sci Rep, 2017, 7(1): 16362.
DOI: 10.1038/s41598-017-16587-9. |
| [20] |
Xiao GZ, Zhang T, Yu SB, et al. ATF4 protein deficiency protects against high fructose-induced hypertriglyceridemia in mice[J].
J Biol Chem, 2013, 288(35): 25350-61.
DOI: 10.1074/jbc.M113.470526. |
| [21] |
Wang S, Kaufman RJ. How does protein misfolding in the endoplasmic reticulum affect lipid metabolism in the liver?[J].
Curr Opin Lipidol, 2014, 25(2): 125-32.
DOI: 10.1097/MOL.0000000000000056. |
| [22] |
So JS, Hur KY, Tarrio M, et al. Silencing of lipid metabolism genes through IRE1 alpha-mediated mRNA decay lowers plasma lipids in mice[J].
Cell Metab, 2012, 16(4): 487-99.
DOI: 10.1016/j.cmet.2012.09.004. |
| [23] |
Sha HB, He Y, Chen H, et al. The IRE1 alpha-XBP1 pathway of the unfolded protein response is required for adipogenesis[J].
Cell Metab, 2009, 9(6): 556-64.
DOI: 10.1016/j.cmet.2009.04.009. |
| [24] |
Maruyama R, Kamoshida Y, Shimizu M, et al. ATF6α stimulates cholesterogenic gene expression and de Novo cholesterol synthesis[J].
Biosci. Biotechol. Biochem, 2013, 77(8): 1734-8.
DOI: 10.1271/bbb.130295. |
| [25] |
Mollica MP, Lionetti L, Putti R, et al. From chronic overfeeding to hepatic injury: Role of endoplasmic reticulum stress and inflammol/ Lation[J].
Nutrition Metabolism and Cardiovascular Diseases, 2011, 21(3): 222-30.
DOI: 10.1016/j.numecd.2010.10.012. |
| [26] |
吴昌维, 范竹萍. 内质网应激相关炎性反应及其在非酒精性脂肪性肝病中的作用[J].
国际消化病杂志, 2012, 32(3): 138-41.
DOI: 10.3969/j.issn.1673-534X.2012.03.004. |
| [27] |
杨方万, 穆茂媛, 肖娟娟, 等. 内质网应激诱导细胞凋亡机制的研究进展[J].
医学研究杂志, 2014, 43(10): 176-80.
|
| [28] |
Lee SJ, Kang JH, Choi SY, et al. PKCδ as a regulator for TGFb1-induced a-SMA production in a murine nonalcoholic steatohepatitis model[J].
PLoS One, 2013, 8(2): e55979.
DOI: 10.1371/journal.pone.0055979. |
| [29] |
Greene MW, Burrington CM, Ruhoff MS, et al. PKC delta is activated in a dietary model of steatohepatitis and regulates endoplasmic reticulum stress and cell death[J].
J Biol Chem, 2010, 285(53): 42115-29.
DOI: 10.1074/jbc.M110.168575. |
| [30] |
Klymenko K, Novokhatska T, Kizub I, et al. PKC-delta isozyme gene silencing restores vascular function in diabetic rat[J].
J Basic Clin Physiol Pharmacol, 2014, 25(4): 1-9.
|
| [31] |
Lai SJ, Li Y, Kuang Y, et al. PKC delta silencing alleviates saturated fatty acid induced ER stress by enhancing SERCA activity[J].
Biosci Rep, 2017, 37(6): 1-10.
|
 2018, Vol. 38
2018, Vol. 38

