全麻药对发育中大脑的潜在风险近年来引起广泛关注,静脉麻醉药丙泊酚以起效快、苏醒迅速、不良反应小等优势,被广泛用于麻醉的诱导和维持。少突胶质细胞是神经胶质细胞中的一种,主要围绕神经元的轴突形成髓鞘,确保动作电位的准确传递[1]、支持轴突的存活[2]以及在神经元轴突损伤后引导轴突再生[3]。髓鞘碱性蛋白(MBP)是少突胶质细胞特异性表达蛋白[4],占髓鞘蛋白的1/3。研究表明,丙泊酚可下调新生SD乳鼠MBP蛋白表达[5],我们前期研究利用胚胎期斑马鱼丙泊酚暴露模型[6],发现丙泊酚可下调72 hpf幼鱼后脑、脊髓处MBP转录水平及蛋白表达,然而有关丙泊酚下调MBP表达机制尚不明确,近期研究显示丙泊酚可诱导孕期胎猴、新生猕猴少突胶质细胞凋亡增多[7],另外研究[8-9]发现少突胶质细胞转录因子表达异常可导致MBP表达减少,在此之上,我们认为丙泊酚下调MBP表达可能与少突胶质细胞凋亡增多及相关转录因子表达异常有关,因此本研究通过斑马鱼模型进一步探究丙泊酚下调MBP蛋白表达的作用机制。
1 材料和方法 1.1 材料丙泊酚原液(sigma,批号D126608)、兔抗斑马鱼MBP多克隆抗体(genetex,批号GTX54239)、兔抗GAPDH多克隆抗体(genetex,批号GTX100118)、兔抗- GFP抗体(abcam,批号ab290)、TUNEL试剂盒(Roche,批号12156792910)、qPCR引物由上海生工股份有限公司合成、逆转录试剂盒量(TaKaRa)、RNA提取试剂盒(TaKaRa)、RT-PCR试剂盒(TaKaRa)。PCR仪(LightCycle480,Roche瑞士);荧光电动显微镜(Olympus corporation日本)。
1.2 方法 1.2.1 斑马鱼饲养成年野生斑马鱼(AB型)、Tg(mbp: GFP)转基因品系,雌雄各半,鱼龄6~1年。养鱼系统为北京爱生公司净水系统,水温27.0~28.5 ℃,盐度为450~500 μS,pH为7.2~7.6,光照14 h/黑暗10 h交替循环。下午将雌雄鱼按1:1或1:2比例配对后,次日光照后收集鱼卵。将胚胎移入含亚甲蓝(0.2%)的幼鱼孵化液皿中,置于恒温孵箱中28.5 ℃孵育。6 h后于体视显微镜下选取发育为6 hpf的受精卵,随机分组至六孔板,每孔30卵。
1.2.2 实验动物分组胚胎期斑马鱼6~48 hpf浸泡于DMSO溶解的丙泊酚(20 μg/mL、30 μg/mL)养鱼液中,同时设立对照组、DMSO组(按30 μg/mL组中DMSO浓度为0.014%设置)。24 hpf移除死卵,更换各分组一半受试液,48 hpf所有分组更换为新鲜幼鱼孵化液。
1.2.3 qRT-PCR测定MBP、Olig1、Olig2、Sox10 mRNA转录水平收集斑马鱼幼鱼,每组80条,提取脑组织总RNA,行逆转录。所得cDNA产物进行荧光定量PCR,扩增条件为预变性95 ℃ 30 s;循环反应95 ℃ 5 s,60 ℃ 30 s,40个循环;冷却至50 ℃。PCR引物序列如下:
MBP上游引物5'-AATCAGCAGGTTCTTCGGA GGAGA-3',下游引物5'-AAGAAATGCACGACAGG GTTGACG-3';Olig1上游引物5'-CGGACTGAAAGT TTGAAGAATGC-3',下游引物5'-TCCTGTTACCCG TACCATTCTTG-3';Olig2上游引物5'-GTGGCTATT TTAGAGAGCTTGCGCAC-3',下游引物5'-GCGCTG AGGAGGACTCAATGGCTCTAA-3';Sox10上游引物5'-GAGACTGCTGAACGAGACGGATAAG-3',下游引物5'-GCTCTTGTAATGCGATTGGCTGTG-3';内参efla上游引物5'-TACTTCTCAGGCTGACTGTG-3',下游引物5'-ATCTTCTTGATGTATGCGCT-3'。结果采用2-ΔΔCt评价目的基因的相对表达量。
1.2.4 Western blot测定MBP蛋白表达提取72 hpf幼鱼总蛋白,80条/组,BCA法测定蛋白浓度。采用15% SDS-PAGE分离胶,每孔加样50 μg蛋白样品,恒压电泳。转膜后,5%脱脂奶粉封闭1 h,分别加入兔抗斑马鱼一抗MBP多克隆抗体(1:1000稀释)、兔抗GAPDH多克隆抗体(1:1000稀释),4 ℃摇床过夜。二抗使用羊抗兔HRP抗体(1:10000稀释)室温孵育。ECL发光试剂盒发光、显影,化学发光仪采集图像,Image J软件分析条带灰度值。
1.2.5 TUNEL染色收集72 hpf Tg(mbp:GFP)转基因幼鱼,6条/组,4%多聚甲醛固定,20%、30%蔗糖脱水后制备冰冻切片,行下一步TUNEL染色。枸橼酸抗原热修复,2%山羊血清封闭、通透后,加入兔抗-GFP抗体(1:200),4 ℃过夜;二抗山羊抗兔(1:500),室温避光1 h。按说明书比例配置TUNEL混合液,37 ℃避光孵育1h。DAPI核染后抗荧光淬灭剂封片,荧光显微镜下拍照。
1.2.6 统计学处理采用SPSS21.0软件,计量资料以均数±标准差表示,One-WayANOVA单因素方差分析,P < 0.05为差异有统计学意义。
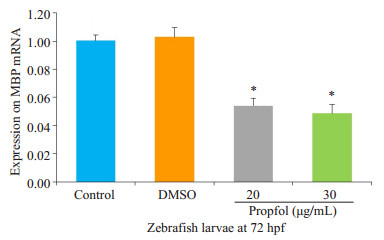
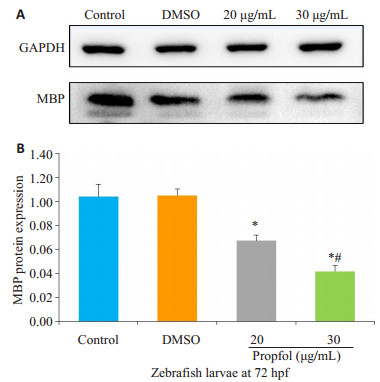
2 结果 2.1 丙泊酚对少突胶质细胞合成MBP mRNA及蛋白表达影响胚胎期斑马鱼6~48 hpf丙泊酚暴露后,与对照组相比,20 μg /mL、30 μg/mL丙泊酚暴露组幼鱼在72 hpf MBP mRNA表达明显下调(P < 0.05,图 1),DMSO组无明显变化(P > 0.05,图 1);20 μg/mL、30 μg/mL丙泊酚暴露组MBP蛋白表达显著下调(P < 0.05,图 2 A),其中,30 μg/mL浓度组较20 μg /mL浓度组蛋白表达明显减少(P < 0.05,图 2B)
|
图 1 72 hpf斑马鱼幼鱼MBP mRNA Figure 1 MBP mRNA expression in 72 hpf larvae. *P < 0.05 vs propofol group. |
|
图 2 72 hpf斑马鱼幼鱼MBP蛋白 Figure 2 MBP protein expression in 72 hpf larvae. *P < 0.05 vs control group. #P < 0.05 vs 20 μg/mL. |
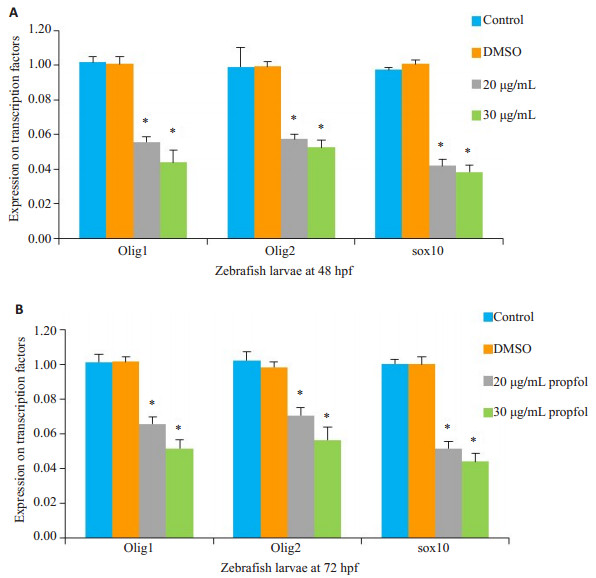
胚胎期斑马鱼6~48 hpf丙泊酚暴露后,于48 hpf、72 hpf检测Olig1、Olig2、Sox10 mRNA表达,结果显示,与对照组相比,48 hpf、72 hpf幼鱼20 μg/mL、30 μg/mL丙泊酚暴露组Olig2mRNA表达均明显减少,另外Olig1、Sox10 mRNA表达显著下调(P < 0.05,图 3),DMSO组无明显变化(P > 0.05,图 3)。
|
图 3 48 hpf、72 hpf斑马鱼幼鱼转录因子表达 Figure 3 Olig1, Olig2, and Sox10 mRNA expressions in zebrofish embryos at 48 hpf and 72 hpf. *P < 0.05 vs control group. |
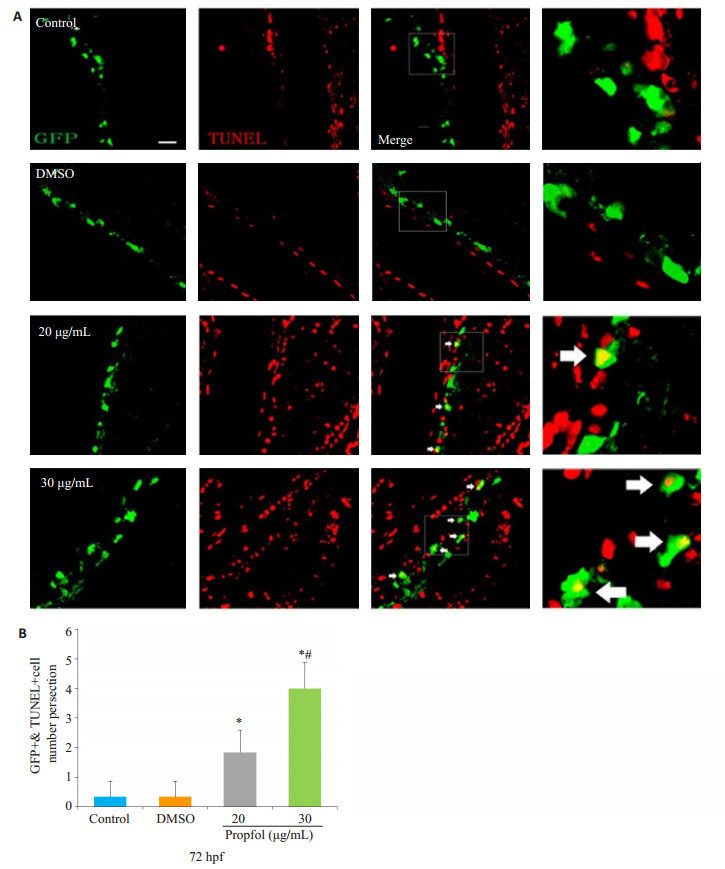
斑马鱼后脑冰冻切片TUNEL染色检测少突胶质细胞凋亡,绿色为少突胶质细胞,红色为凋亡阳性细胞。结果显示,与对照组相比,20 μg/mL、30 μg/mL丙泊酚暴露组少突胶质细胞凋亡显著增多(P < 0.05,图 4A),且随浓度增加,呈凋亡增多倾向;其中30 μg/mL浓度组较20 μg/mL浓度组凋亡数目明显增多(P < 0.05,图 4B),DMSO组无明显变化(P > 0.05,图 4)。
|
图 4 72 hpf斑马鱼少突胶质细胞凋亡 Figure 4 Apoptosis of oligodendrocytes in zebrofish larvae at 72 hpf. *P < 0.05 vs control group, #P < 0.05 vs 20 μg/mL (scale bar=20 μm). |
有关发育中大脑暴露于全身麻醉药的研究,大多动物实验已证实全麻药物可导致神经细胞凋亡、神经网络发育异常甚至行为改变[10-14],以啮齿类动物和猕猴为模型的动物实验显示,丙泊酚不仅促进神经元凋亡[15-17],还可诱导少突胶质细胞凋亡[7]。而麻醉药物导致的行为改变是否与少突胶质细胞受损有关尚不清楚。本研究旨在探究丙泊酚对胚胎发育的神经毒性作用,少突胶质细胞发育始于胚胎晚期,高峰期为出生后7 d左右,此时,髓鞘发育也达到高峰,而在此之前的丙泊酚暴露可能会对胚胎晚期及出生后少突胶质细胞发育和髓鞘化产生不良影响。斑马鱼作为筛查药物胚胎期神经毒性首选的模式生物,具有体外受精、体外发育、繁殖周期短、与人类基因同源性高达87%等优势。另外,斑马鱼还被证实为研究髓鞘的理想生物模型[18-20]。因此,我们采用斑马鱼模型研究胚胎期丙泊酚暴露对少突胶质细胞的神经毒性。
6~48 hpf为斑马鱼神经系统发育的起始至脑室形成时期[21-22],幼鱼孵化液中的丙泊酚经卵膜、皮肤渗透、口吸收。72 hpf是斑马鱼胚胎孵化至幼鱼的关键时期,也是MBP蛋白表达的初始时期,其作为成熟少突胶质细胞的标志性蛋白,是髓鞘结构的重要组成成分。新生儿脑发育中,髓鞘化为必不可少的过程,MBP表达异常可导致髓鞘形成受损,从而影响神经信号传导,导致脱髓鞘、神经脊髓炎、白质营养不良[23]等相关疾病,表现为认知功能障碍、语言、视力减弱、震颤、肌痉挛等[3]。我们研究发现,丙泊酚在72 hpf下调MBP基因与蛋白表达,此结果与朱晓勤[5]等以SD乳鼠为模型的研究所得相近,丙泊酚可在MBP生成初期下调其表达,同时说明该抑制效应可持续至出生后。然而,关于丙泊酚抑制MBP表达的机制尚不明确,且未有文献报道。
神经干细胞(NSCs)向成熟少突胶质细胞的定向分化受生长因子、激素、胞外基质相关分子等多种因素调控,而这些因素最终通过胞内Olig1、Olig2、Sox10等转录因子发挥作用[24-26]。Olig1、Olig2为Olig家族中最早发现并对少突胶质细胞发育成熟具有决定性的转录因子,其中Olig2偏向于少突胶质前体细胞分化形成的早期,而Olig1偏向于少突胶质细胞的晚期成熟和髓鞘形成。Olig1、Olig2通常与其它因子共同作用调控少突胶质细胞分化,包括Sox10(影响少突胶质细胞终末发育的重要因子),体外研究证实[27]Sox10可直接促进MBP表达,与Olig1形成复合物后该效应增强,而与Olig2复合后无增强效应。在斑马鱼胚胎发育中,Olig2最早见于20 hpf [28-29],Olig1最早见于36 hpf [30]。本研究于48 hpf、72 hpf两个时间点检测Olig1、Olig2、Sox10mRNA表达,分别为MBP未表达前与生成初期,结果显示Olig2表达持续减少,提示丙泊酚可能通过下调Olig2影响少突胶质细胞分化早期及成熟初期。既往研究[31]利用250 μmol/L的Olig2-MO(morpholino oligonucleotides)敲除法干扰斑马鱼Olig2 mRNA作用位点,发现MBP表达异常的幼鱼比例显著增多;对Olig2基因敲除的小鼠脊髓组织离体培养同样发现少突前体细胞晚期标志物不表达[32],证实Olig2在少突胶质细胞发育分化中的决定性作用。另外,参与少突胶质细胞晚期发育及髓鞘形成的Olig1下调,说明胚胎期丙泊酚暴露可影响少突胶质细胞的多个发育时期,Olig1与Olig2的共同减少可能导致少突胶质细胞的发育延迟及未成熟少突胶质细胞的比例增高,而Sox10表达减少可能为丙泊酚的直接作用或受Olig1、Olig2继发改变,影响Sox10-Olig1复合物生成对MBP表达的增强效应。此外,Olig1、Olig2、Sox10 [33-34]均可调控MBP转录水平,其表达减少可直接导致MBP在72 hpf表达初期下调。以上结果提示丙泊酚可通过抑制调控少突胶质细胞分化、成熟的转录因子发挥神经毒性作用。
神经细胞凋亡是哺乳类动物大脑发育过程中的重要环节,其中50%~70%的神经细胞通过细胞凋亡的形式死亡,异常因素引起细胞凋亡程序紊乱,会导致胎儿大脑发育异常。Creeley等[7]发现新生猕猴或孕期猕猴接触丙泊酚5 h,可导致新生猕猴或胎猴脑部少突胶质细胞凋亡明显增多。在酒精对斑马鱼胚胎发育神经毒性研究中,也显示24 hpf胚胎脑部细胞凋亡数量随酒精剂量升高而增加[35]。我们前期研究[6]发现胚胎期斑马鱼丙泊酚暴露可导致幼鱼脑部神经细胞凋亡增多,且伴随caspase-3、8、9表达上调。然而,关于MBP表达下调机制,目前尚未有研究报道,我们假设丙泊酚通过诱导少突胶质细胞凋亡增多下调MBP表达。MBP蛋白表达于少突胶质细胞及髓鞘浆膜面,Tg(mbp: GFP)转基因斑马鱼原理为将mbp基因的启动子与GFP基因重组,绿色荧光蛋白(GFP)阳性细胞即为MBP蛋白表达阳性的成熟少突胶质细胞。利用Tg(mbp: GFP)转基因斑马鱼于72 hpf GFP免疫荧光加强染色后行TUNEL凋亡染色,结果显示20 μg /mL、30 μg/mL丙泊酚暴露组随浓度增加,呈凋亡增多倾向。关于阿米洛利治疗受损脊髓的研究[36]发现用药组MBP蛋白表达上升与少突胶质细胞存活率增加有关,提示少突胶质细胞数量可影响MBP表达量,因此我们认为少突胶质细胞的凋亡增多导致MBP表达下调。另外,神经细胞再生和凋亡的平衡是大脑发育正常的保证,发育中的大脑具有高度可塑性,此时神经祖细胞具有较强分裂、增殖能力,我们发现丙泊酚抑制MBP表达可通过影响不同发育阶段的少突胶质细胞发挥作用,表现为成熟少突胶质细胞凋亡增多及前体细胞的发育成熟受阻。在多发性硬化及髓鞘损伤模型中,Olig1、Olig2代偿增多参与了促前体细胞增殖及髓鞘再生,而丙泊酚早期暴露引起的成熟少突胶质细胞凋亡增多、MBP表达异常是否会引起后期Olig1、Olig2的代偿反应及参与少突胶质细胞损伤修复,还需进一步实验证实。
综上所述,本研究首次利用胚胎期斑马鱼丙泊酚暴露模型探讨MBP表达下调机制,结果显示丙泊酚可下调72 hpf幼鱼MBP蛋白表达,进一步研究发现不仅与调控少突胶质细胞分化、成熟的转录因子Olig1、Olig2、Sox10表达下调有关,还与少突胶质细胞凋亡增多有关。既往研究[31, 37-39]认为丙泊酚诱导神经元凋亡是其产生神经毒性的重要机制,在此之上,我们在少突胶质细胞上证实了该结论。在明确了分子蛋白水平改变基础上,需进一步验证MBP表达减少是否会导致髓鞘结构的长期改变以及伴随相应行为学变化。
| [1] |
Miller G. The dark side of glia[J].
Science, 2005, 308(5723): 778-81.
DOI: 10.1126/science.308.5723.778. |
| [2] |
Simons M, Nave KA. Oligodendrocytes: myelination and axonal support[J].
Cold Spring Harb Perspect Biol, 2016, 8(1): a20479.
|
| [3] |
Czepiel M, Boddeke E, Copray S. Human oligodendrocytes in remyelination research[J].
Glia, 2015, 63(4): 513-30.
DOI: 10.1002/glia.22769. |
| [4] |
Barbarese E, Barry C, Chou CH, et al. Expression and localization of myelin basic protein in oligodendrocytes and transfected fibroblasts[J].
J Neurochem, 1988, 51(6): 1737-45.
DOI: 10.1111/jnc.1988.51.issue-6. |
| [5] |
朱晓勤, 林春水, 郭培培, 等. 丙泊酚对不同发育时期SD大鼠少突胶质细胞鞘磷脂蛋白的影响[J].
南方医科大学学报, 2017(12): 1615-9.
|
| [6] |
Guo P, Huang Z, Tao T, et al. Zebrafish as a model for studying the developmental neurotoxicity of propofol[J].
J Appl Toxicol, 2015, 35(12): 1511-9.
DOI: 10.1002/jat.v35.12. |
| [7] |
Creeley C, Dikranian K, Dissen G, et al. Propofol-induced apoptosis of neurones and oligodendrocytes in fetal and neonatal rhesus macaque brain[J].
Br J Anaesth, 2013, 110(Suppl 1): i29-38.
|
| [8] |
Li HL, Lu Y, Smith HK, et al. Olig1 and Sox10 interact synergistically to drive Myelin basic protein transcription in oligodendrocytes[J].
J Neurosci, 2007, 27(52): 14375-82.
DOI: 10.1523/JNEUROSCI.4456-07.2007. |
| [9] |
Li HL, Richardson WD. The evolution of Olig genes and their roles in myelination[J].
Neuron Glia Biol, 2008, 4(2): 129-35.
DOI: 10.1017/S1740925X09990251. |
| [10] |
Wilder RT, Flick RP, Sprung J, et al. Early exposure to anesthesia and learning disabilities in a population-based birth cohort[J].
Anesthesiology, 2009, 110(4): 796-804.
DOI: 10.1097/01.anes.0000344728.34332.5d. |
| [11] |
Ing C, Dimaggio C, Whitehouse A, et al. Long- term differences in language and cognitive function after childhood exposure to anesthesia[J].
Pediatrics, 2012, 130(3): e476-85.
DOI: 10.1542/peds.2011-3822. |
| [12] |
Raper J, De Biasio JC, Murphy KL, et al. Persistent alteration in behavioural reactivity to a mild social stressor in rhesus monkeys repeatedly exposed to sevoflurane in infancy[J].
Br J Anaesth, 2018, 120(4): 761-7.
DOI: 10.1016/j.bja.2018.01.014. |
| [13] |
Coleman K, Robertson ND, Dissen GA, et al. Isoflurane anesthesia has long-term Consequences on motor and behavioral development in infant rhesus macaques[J].
Anesthesiology, 2017, 126(1): 74-84.
DOI: 10.1097/ALN.0000000000001383. |
| [14] |
Wu ZY, Li XY, Zhang Y, et al. Effects of sevoflurane exposure during Mid-Pregnancy on learning and memory in offspring rats: beneficial effects of maternal exercise[J].
Front Cell Neurosci, 2018, 12: 122.
|
| [15] |
Fredriksson A, Ponten E, Gordh T, et al. Neonatal exposure to a combination of N-methyl-D-aspartate and gamma-aminobutyric acid type a receptor anesthetic agents potentiates apoptotic neurodegeneration and persistent Behavioral deficits[J].
Anesthesiology, 2007, 107(3): 427-36.
DOI: 10.1097/01.anes.0000278892.62305.9c. |
| [16] |
Jin LH, Song YY, Shen Y, et al. Post-Exposure exercise fails to ameliorate memory impairment induced by propofol and ketamine in developing rats[J].
Med Sci Monit, 2016, 22: 1038-46.
DOI: 10.12659/MSM.895443. |
| [17] |
Yin C, Gou LS, Liu Y, et al. Repeated administration of propofol upregulated the expression of c-Fos and cleaved- caspase-3 proteins in the developing mouse brain[J].
Indian J Pharmacol, 2011, 43(6): 648-51.
|
| [18] |
Murphey RD, Stern HM, Straub CT, et al. A chemical genetic screen for cell cycle inhibitors in zebrafish embryos[J].
Chem Biol Drug Des, 2006, 68(4): 213-9.
DOI: 10.1111/jpp.2006.68.issue-4. |
| [19] |
Kitambi SS, Mcculloch KJ, Peterson RT. Small molecule screen for compounds that affect vascular development in the zebrafish retina[J].
Mech Dev, 2009, 126(5/6): 464-77.
|
| [20] |
Rihel J, Prober DA, Arvanites A, et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation[J].
Science, 2010, 327(5963): 348-51.
DOI: 10.1126/science.1183090. |
| [21] |
Beattie CE. Control of motor axon guidance in the zebrafish embryo[J].
Brain Res Bull, 2000, 53(5): 489-500.
DOI: 10.1016/S0361-9230(00)00382-8. |
| [22] |
Kabashi E, Brustein E, Champagne N, et al. Zebrafish models for the functional genomics of neurogenetic disorders[J].
Biochim Biophys Acta, 2011, 1812(3): 335-45.
DOI: 10.1016/j.bbadis.2010.09.011. |
| [23] |
Fields RD. White matter in learning, cognition and psychiatric disorders[J].
Trends Neurosci, 2008, 31(7): 361-70.
DOI: 10.1016/j.tins.2008.04.001. |
| [24] |
Rowitch DH, Lu QR, Kessaris N, et al. Ano' ligarchy' rules neural development[J].
Trends Neurosci, 2002, 25(8): 417-22.
DOI: 10.1016/S0166-2236(02)02201-4. |
| [25] |
梅峰. 转录因子Olig1和Olig2在少突胶质细胞分化调控中作用机制的新的认识[C]. 2017.
|
| [26] |
Gaber ZB, Novitch BG. All the embryo's a stage, and Olig2 in its time plays many parts[J].
Neuron, 2011, 69(5): 833-5.
DOI: 10.1016/j.neuron.2011.02.037. |
| [27] |
Li HL, Lu Y, Smith HK, et al. Olig1 and Sox10 interact synergistically to drive myelin basic protein transcription in oligodendrocytes[J].
J Neurosci, 2007, 27(52): 14375-82.
DOI: 10.1523/JNEUROSCI.4456-07.2007. |
| [28] |
Shin J, Park HC, Topczewska JM, et al. Neural cell fate analysis in zebrafish using olig2 BAC transgenics[J].
Methods Cell Sci, 2003, 25(1/2): 7-14.
DOI: 10.1023/B:MICS.0000006847.09037.3a. |
| [29] |
Park HC, Mehta A, Richardson JS, et al. olig2 is required for zebrafish primary motor neuron and oligodendrocyte development[J].
Dev Biol, 2002, 248(2): 356-68.
DOI: 10.1006/dbio.2002.0738. |
| [30] |
Schebesta M, Serluca FC. olig1 expression identifies oligodendrocytes in zebrafish and requires hedgehog and notch signaling[J].
Dev Dyn, 2009, 238(4): 887-98.
DOI: 10.1002/dvdy.21909. |
| [31] |
Milanovic D, Pesic V, Loncarevic-Vasiljkovic N, et al. Neonatal propofol anesthesia changes expression of synaptic plasticity proteins and increases stereotypic and anxyolitic behavior in adult rats[J].
Neurotox Res, 2017, 32(2): 247-63.
DOI: 10.1007/s12640-017-9730-0. |
| [32] |
Lu QR, Sun T, Zhu ZM, et al. Common developmental requirement for Olig function indicates a motor neuron/oligodendrocyte connection[J].
Cell, 2002, 109(1): 75-86.
DOI: 10.1016/S0092-8674(02)00678-5. |
| [33] |
徐成岭. 转录因子Olig1, Olig2与Id2, Id4在MBP转录调控中的作用[D]. 蚌埠医学院, 2012.
http://cdmd.cnki.com.cn/Article/CDMD-10367-1012447870.htm
|
| [34] |
Xin M, Yue T, Ma ZY, et al. Myelinogenesis and axonal recognition by oligodendrocytes in brain are uncoupled in Olig1-Null mice[J].
J Neurosci, 2005, 25(6): 1354-65.
DOI: 10.1523/JNEUROSCI.3034-04.2005. |
| [35] |
Reimers MJ, Flockton AR, Tanguay RL. Ethanol-and acetaldehydemediated developmental toxicity in zebrafish[J].
Neurotoxicol Teratol, 2004, 26(6): 769-81.
DOI: 10.1016/j.ntt.2004.06.012. |
| [36] |
Imai T, Katoh H, Suyama K, et al. Amiloride promotes oligodendrocyte survival and remyelination after spinal cord injury in rats[J].
J Clin Med, 2018, 7(3): e46.
DOI: 10.3390/jcm7030046. |
| [37] |
Karen T, Schlager GW, Bendix I, et al. Effect of propofol in the immature rat brain on short-and long-term neurodevelopmental outcome[J].
PLoS One, 2013, 8(5): e64480.
DOI: 10.1371/journal.pone.0064480. |
| [38] |
Liang C, Du F, Cang J, et al. Pink1 attenuates propofol-induced apoptosis and oxidative stress in developing neurons[J].
J Anesth, 2018, 32(1): 62-9.
DOI: 10.1007/s00540-017-2431-2. |
| [39] |
Li Y, Jia CX, Zhang DL, et al. Propofol-induced neurotoxicity in hESCs involved in activation of miR-206/PUMA signal pathway[J].
Cancer Biomark, 2017, 20(2): 175-81.
DOI: 10.3233/CBM-170167. |
 2018, Vol. 38
2018, Vol. 38

