2. 西安交通大学第二附属医院麻醉科,陕西 西安 710004;
3. 西安交通大学医学部地方病研究所,环境与疾病相关基因教育部重点实验室,陕西 西安 710061
2. Department of Anesthesiology, Second Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710004, China;
3. Xi'an Jiaotong University Health Science Center, Institute of Endemic Diseases, Key Laboratory of Environment and Genes Related to Diseases, Xi'an 710061, China
关节骨软骨损伤的治疗是骨科临床工作的难题之一,组织工程的研究进展为关节骨软骨损伤的修复开辟了新途径[1-2]。支架材料是组织工程的重要组成部分,它不仅作为细胞的载体,而且对细胞的黏附,增殖,分化和表型的维持具有重要作用[3-4]。目前用于组织工程的支架材料主要有人工合成和天然材料两种。人工合成材料具有可控的降解速率、优良的力学性能和良好的可塑性,但其亲水性差,不利于细胞黏附[5]。天然材料接近细胞生长的生理环境,具有良好的生物相容性和亲水性,利于细胞的黏附,此外还含有生长因子类物质,可以促进细胞增殖和维持表型的稳定,但其主要缺点是力学强度不足[6]。
脱钙松质骨(DCB)以天然骨材料制备而来,是松质骨经去脂、脱钙,去除了骨形态发生蛋白(BMP)以外的95%非胶原蛋白和脂类而制成,具有胶原的特性,还有一定的力学性能,是一种比较理想的组织工程支架材料。由于具有成骨与软骨的诱导活性[7-8],DCB作为骨材料单独或与其它材料复合用于临床修复骨不连、骨缺损等骨科疾病[9-10],而用于修复关节骨软骨损伤尚未见报道。将DCB与骨髓基质干细胞复合培养构建组织工程软骨移植修复兔关节骨软骨缺损,术后3月在缺损处形成透明样软骨组织,显示DCB能作为软骨支架材料诱导干细胞修复骨软骨缺损[11]。我们前期用DCB复合同种异软骨细胞在体外成功构建了组织工程化软骨[12]。本实验将进一步评价DCB复合同种异体软骨细胞体内移植修复兔膝关节骨软骨缺损的效果。
1 材料和方法 1.1 实验动物及主要试剂和仪器1月龄雄性新西兰兔1只,体质量0.6 kg;4~5月龄新西兰兔35只,体质量2~3 kg,雌雄不限,均由西安交通大学医学部实验动物中心提供。DMEM-F12培养基、胰蛋白酶(Gibco),透明质酸酶(Cooper),Ⅱ型胶原酶(Sigma),Ⅱ型胶原单克隆抗体(calbiochem),CO2培养箱(Nuaire),光学显微镜(Nikon),扫描显微镜(Hitachi)。
1.2 脱钙松质骨的制备取5只新西兰兔干骺端松质骨,根据文献[12]方法进行去脂、去蛋白、脱钙等处理,扫描电镜观察。将制备的DCB修剪成直径约3 mm厚3 mm的圆柱状,环氧乙烷灭菌后备用。
1.3 体外构建组织工程软骨1月龄雄性新西兰兔1只,体质量0.6 kg,根据文献[12]方法分离关节软骨细胞原代培养后复合制备的DCB体外培养2周构建组织工程软骨。
1.4 组织工程软骨移植修复兔膝关节骨软骨缺损20%氨基甲酸乙酯5 mL耳缘静脉麻醉,双膝关节剪毛备皮,碘酒,酒精消毒,膝关节内侧切口,逐层切开皮肤,皮下组织和关节囊,髌骨向外侧脱位后暴露股骨内侧髁关节面,在股骨内侧髁制作直径3 mm、深3 mm,穿透软骨下骨板的关节骨软骨缺损模型。生理盐水冲洗缺损部位,20只兔子右侧膝关节植入体外培养2周的DCB-软骨细胞复合体(A组),左膝关节缺损处植入DCB(B组),10只双侧骨软骨缺损处未予处理作为空白对照(C组)。生理盐水冲洗伤口,逐层缝合关节囊,皮下组织和皮肤。兔子分笼饲养,自由活动。术后肌肉注青霉素800 000 U,连续3 d。
1.5 评价指标术后1月、3月、6月取股骨髁部修复组织标本进行评价。大体观察:取标本时观察缺损区修复组织充填情况、表面平滑度、色泽、质地以及与周围正常组织的整合情况;组织学与免疫组织化学染色:将获得的组织标本用中性福尔马林固定液固定24 h,EDTA脱钙1月左右,系列酒精脱水,石蜡包埋,5 μm切片染色,进行HE、TB及Ⅱ型胶原染色,观察骨软骨缺损的修复情况;组织学评分:根据修复组织的细胞形态、基质染色(蛋白聚糖)、软骨厚度以及软骨下骨板重建等,参照Pieter [13]和Manuel [14]的关节软骨半定量组织学评分标准对移植后6月的修复组织进行组织学评分,满分22分,分值越高说明修复效果越好。
1.6 统计学分析采用SPSS统计软件包进行分析,数据以均数±标准差表示,组间比较采用独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 DCB大体及扫描电镜观察制备得到的DCB为疏松多孔的海绵结构(图 1A),孔隙大小约为100~500 μm(图 1B),相互交通。

|
图 1 制备的DCB Figure 1 Prepared DCB from rabbits. A: Gross observation by anatomical microscope; B: Observation by scanning electron microscopy. |
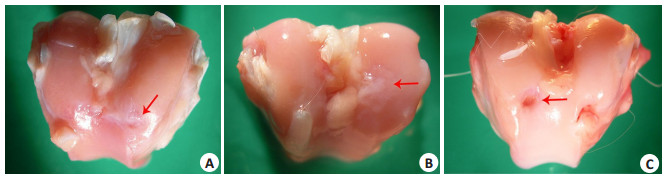
术后1月关节软骨缺损处新生组织与周围正常软骨相平,修复交界处已融合,但界限明显;3月缺损处修复组织略低于周围正常软骨,修复交界处模糊,修复组织表面光滑且有光泽;6月修复组织与周围正常软骨已愈合,修复组织表面基本平整,成乳白色,按压时弹性与周围正常软骨近似(图 2A)。
|
图 2 术后6月修复组织大体观察 Figure 2 Gross observation of reparative tissue at 6 months. A: Chondrocyte-seeded DCB group; B: DCB group; C: Control group (Red arrow: junctional area between repaired tissue and adjacent normal cartilage). |
术后1月缺损处修复组织与周围正常软骨相平,交界处有裂隙;3月缺损处修复组织低于周围软骨组织,分界明显,表面有裂纹,颜色暗红;6月修复组织与周围软骨分界明显,表面纤维增生,凹凸不平,色泽不均(图 2B)。
2.2.3 C组情况术后1月见缺损修复处凹陷明显,与正常软骨边界清楚;3月修复处表面不平,色暗光泽差;6月时缺损修复处仍凹陷,周围软骨磨损、退变,向缺损处倾斜(图 2C)。
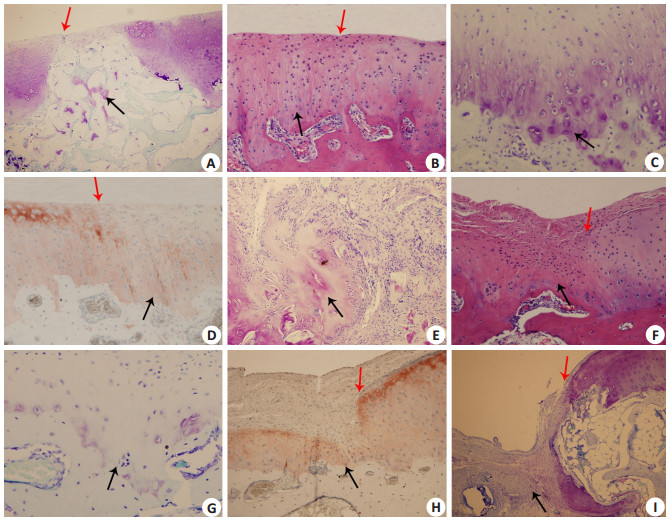
2.3 组织学与免疫组织化学观察 2.3.1 A组情况术后1月缺损处修复组织与周围正常关节软骨齐平,交界处表面融合,DCB部分溶解吸收,修复组织处软骨下骨板未形成,修复组织蛋白聚糖和胶原染色阳性。交界处周围正常软骨组织细胞增生,出现丛集现象,每个陷窝内可见2~5个不等的细胞,局部染色增强(图 3A);3月缺损处DCB完全被修复组织替代;修复组织略低于周围正常软骨,与周围正常软骨完全整合,软骨下骨板形成;6月修复组织为透明样软骨,与周围正常软骨组织厚度基本一致,修复交界区整合良好,软骨下骨板完整(图 3B)。修复区出现软骨组织排列结构,深层细胞柱状排列,基质蛋白聚糖(图 3C)和Ⅱ型胶原(图 3D)染色接近周围正常软骨。
|
图 3 修复组织组织学染色 Figure 3 Histological staining of the reparative tissue. A: TB staining at 1 month in chondrocyte-seeded DCB group (Original magnification: ×4); B: HE staining at 6 month in chondrocyte-seeded DCB group(×10); C: TB staining at 6 month in chondrocyte-seeded DCB group(×20); D: Collagen type Ⅱ staining at 6 month in chondrocyte-seeded DCB group(×20); E: TB staining at 3month in DCB group(×20); F: HE staining at 6 month in DCB group (×10); G: TB staining at 6 month in DCB group(× 20); H: Collagen type Ⅱ staining at 6 month in DCB group(× 10); I: TB staining at 6 month in control group(× 10). Black arrow: Repaired tissue; Red arrow: Junctional area between repaired tissue and adjacent normal cartilage. |
术后1月缺损处修复组织与周围正常软骨相平,交界处未融合,DCB降解较少,缺损底部与骨髓交界处可见少量软骨样组织,软骨下骨板未形成。在组织交界处及可见少量炎性细胞。3月缺损处DCB完全吸收,为纤维样组织充填,表面不整。修复组织结构混杂,修复组织底部与骨交界处可见片状软骨组织团,细胞排列无规律,软骨下骨板未形成(图 3E);6月缺损由纤维样软骨组织充填,表面不平整,可见纤维组织爬向周围正常软骨表面,软骨下骨板形成(图 3F)。修复组织无正常软骨组织排列结构,深层部分细胞在软骨陷窝内,蛋白聚糖(图 3G)和Ⅱ型胶原(图 3H)染色弱阳性。2.3.3 C组情况术后1月缺损区中央凹陷,缺损底部由薄层纤维组织覆盖;3月缺损区凹陷明显,部分纤维组织充填,软骨下骨板未形成,蛋白聚糖和Ⅱ型胶原染色阴性;6月缺损区仍凹陷,表面不平整,软骨下骨板不完整,修复处由纤维样组织充填,深层组织染色可见少量蛋白聚糖(图 3I),Ⅱ型胶原染色阴性。
2.4 组织学评分术后6月,A组修复组织中除软骨下骨板重建与B组比较后添加无差异外,其他评分均优于B组和C组,差异有统计学意义(P < 0.05),显示DCB复合软骨细胞修复骨软骨缺损效果优于单纯DCB和对照组。B组在术后6月,细胞形态,基质染色,软骨下骨板重建,软骨厚度评分优于C组,其他各个指标与C组比较,差异均无统计学意义(P > 0.05,表 1)。
| 表 1 软骨缺损修复的组织学评分 Table 1 Semiquantitative histologic score of reparative tissue at 6 month (Mean±SD) |
关节软骨损伤后缺乏自身修复能力,而目前临床常用的治疗方法都存在不同程度的问题[15-16]。微骨折适用于软骨损伤面小的病例,对大面积损伤(> 2 cm2)修复效果有限,且为纤维软骨修复,长期疗效不佳[17]。自体软骨细胞移植临床报道效果不一,新生修复组织主要为纤维软骨,在生理负荷下易发生退行性改变,并且可引起取材部位的损伤,需要二次手术[18-19]。组织工程的发展为软骨损伤的治疗提供了理想的途径,通过扩增种子细胞,与支架材料体外培养构建组织工程软骨移植修复软骨缺损。支架材料为种子细胞的黏附、生长增殖及营养交换提供力学支撑和空间,还要随着新生组织的形成逐渐降解,一直是组织工程中的研究热点[20]。
3.1 DCB作为组织工程软骨支架材料的优点良好的生物相容性DCB主要成分为Ⅰ型胶原,经脱钙、去脂等处理后,重要的抗原成分已被破坏,余下的抗原反应性弱,与宿主相容性良好[8]。宋等应用DCB体内植入修复兔关节软骨缺损,手术前后外周血淋巴细胞刺激增殖反应没有显著性差异[21]。本研究中DCB作为支架材料复合软骨细胞修复兔关节骨软骨缺损,1月时在缺损底部和DCB周围见到少量的炎性细胞,但未影响软骨细胞的分化增殖。软骨细胞在降解的DCB空隙内生长增殖,形成软骨样组织,基质染色阳性,维持了软骨细胞的分化表型。
生物可降解性和一定的力学强度DCB有良好的生物可降解性,研究显示DCB完全吸收大概需要8周,而软骨形成时间约6~8周,因此,DCB的吸收与软骨形成几乎同步,随着DCB的降解,为细胞增殖留下了空间[22]。本研究中DCB体内植入后4周开始分解吸收,在残余的空隙内形成软骨样组织,3月DCB完全降解,缺损处被新生软骨组织充填。而且在降解过程中,DCB所含的BMPs缓慢释放,发挥持久的诱导成软骨活性[23]。支架材料不仅起到充填缺损的作用,还要有一定的力学支撑作用。Pieter等应用胶原材料修复兔膝关节骨软骨缺损,术后1月修复组织交界处正常软骨组织斜向缺损处凹陷[13],说明胶原的力学强度不够, 多作为表面修饰与其他材料复合应用[24]。本试验应用DCB复合软骨细胞植入后1月修复组织与周围正常软骨基本齐平,未出现凹陷。显示DCB具有一定的力学性能,在修复组织形成前能够提供足够的力学支撑,可以分散缺损边缘正常软骨组织的应力。另外,DCB具有很好的可塑性,可根据需要制成圆形,长方形等各种形状,适合修复不同形状组织缺损的需要。
3.2 DCB复合同种异体软骨细胞修复骨软骨损伤的效果软骨组织工程的目的是要在体内重建软骨组织,恢复关节软骨的结构和功能,尤其是关节的力学性能。黄永波等用海藻酸钠复合软骨细胞移植修复骨软骨缺损,6月时修复组织为透明样软骨,但是没有正常软骨细胞的分层排列,修复组织与周围正常软骨之间存在裂隙,到一年时修复组织有一定程度的退变[25]。目前认为导致修复组织退变主要是由于新生的软骨组织没有达到正常关节软骨的生物化学和力学性能,与周围正常骨软骨存在裂隙、软骨下骨板不完整有关。修复组织与周围正常软骨交界处存在裂隙,使力学分布不均,局部应力增加,导致软骨退变[26]。软骨下骨板缺损,影响了表层软骨的稳定,传递力学的能力降低,新生软骨后期逐渐发生退变[27-28]。尹战海等应用DCB复合自体骨髓间充质干细胞构建组织工程软骨修复兔关节骨软骨缺损,6月缺损处修复的软骨组织与周围正常软骨组织连接良好,软骨下方骨板完整[29]。
本试验中DCB构建的组织工程软骨植入后3月修复组织与周围正常软整合良好,软骨下骨板重建。6月时软骨下骨板完整,修复交界区整合良好,组织学显示修复组织深部软骨细胞排列成柱状,Ⅱ型胶原和蛋白表聚糖表达近似周围正常软骨,无明显退变迹象。其原因可能是DCB具有良好的组织相容性和合适的生物可降解性,随着DCB的降解新的软骨组织形成,并且新生软骨的形成与DCB的降解相匹配。DCB与软骨细胞构建的组织工程软骨有一定的生物力学强度,在新生软骨形成前可以在缺损局部起到力学支撑作用,而且在组织工程软骨修复骨软骨缺损的同时重建了软骨下骨板,而软骨下骨板的同期恢复,为新生的软骨提供了生理性力学支持,有利于维持软骨细胞的表型以及新生软骨组织的重塑,使其力学性能接近或达到正常关节软骨。
本研究结果显示DCB复合同种异体软骨细胞修复骨软骨缺损取得了较好的效果,修复组织为透明样软骨,与周围正常软骨整合好,重建了软骨下骨板,是一种良好的软骨组织工程支架材料,但是修复的软骨组织远期是否发生退变,尚需要进一步的研究。
| [1] |
Lazarini M, Bordeaux-Rego P, Giardini-Rosa R, et al. Natural type Ⅱ collagen hydrogel, fibrin sealant, and adipose-derived stem cells as a promising combination for articular cartilage repair[J].
Cartilage, 2017, 8(4): 439-43.
DOI: 10.1177/1947603516675914. |
| [2] |
Musumeci G, Castrogiovanni P, Leonardi R, et al. New perspectives for articular cartilage repair treatment through tissue engineering:A contemporary review[J].
World J Orthop, 2014, 5(2): 80-8.
DOI: 10.5312/wjo.v5.i2.80. |
| [3] |
Ringe J, Sittinger M. Regenerative medicine:Selecting the right biological scaffold for tissue engineering[J].
Nat Rev Rheumatol, 2014, 10(7): 388-9.
DOI: 10.1038/nrrheum.2014.79. |
| [4] |
Gaut C, Sugaya K. Critical review on the physical and mechanical factors involved in tissue engineering of cartilage[J].
Regen Med, 2015, 10(5): 665-79.
DOI: 10.2217/rme.15.31. |
| [5] |
Liao J, Qu Y, Chu B, et al. Biodegradable CSMA/PECA/graphene porous hybrid scaffold for cartilage tissue engineering[J].
Sci Rep, 2015, 5(5): 9879.
|
| [6] |
Vázquez-Portalatı N N, Kilmer CE, Panitch A, et al. Characterization of collagen type Ⅰ and Ⅱ blended hydrogels for articular cartilage tissue engineering[J].
Biomacromolecules, 2016, 17(10): 3145-52.
DOI: 10.1021/acs.biomac.6b00684. |
| [7] |
Kapur SP, Reddi AH. Chondrogenic potential of mesenchymal cells elicited by bone matrix in vitro[J].
Differentiation, 1986, 32(3): 252-9.
DOI: 10.1111/j.1432-0436.1986.tb00581.x. |
| [8] |
Wang SJ, Jiang D, Zhang ZZ, et al. Chondrogenic potential of peripheral blood derived mesenchymal stem cells seeded on demineralized cancellous bone scaffolds[J].
Sci Rep, 2016, 6(6): 36400.
|
| [9] |
Ziran BH, Smith WR, Morgan SJ. Use of calcium-based demineralized bone matrix/allograft for nonunions and posttraumatic reconstruction of the appendicular skeleton:preliminary results and complications[J].
J Trauma, 2007, 63(6): 1324-8.
DOI: 10.1097/01.ta.0000240452.64138.b0. |
| [10] |
Kenneth JH, Lee MD, Jonathan G, et al. Demineralized bone matrix and spinal arthrodesis[J].
The Spine Journal, 2005, 15(5): 217-23.
|
| [11] |
Li Q, Tang JC, Sun ZY, et al. Repairing full-thickness articular cartilage defects with homograft of mesenchymal stem cells seeded onto cancellous demineralized bone matrix[J].
中国组织工程研究与临床康复, 2008, 12(45): 8943-7.
DOI: 10.3321/j.issn:1673-8225.2008.45.007. |
| [12] |
Yang B, Yin Z, Cao J, et al. In vitro cartilage tissue engineering using cancellous bone matrix gelatin as a biodegradable scaffold[J].
Biomed Mater, 2010, 5(4): 045003.
DOI: 10.1088/1748-6041/5/4/045003. |
| [13] |
Buma P, Pieper JS, van Tienen T, et al. Cross-linked type Ⅰ and type Ⅱ collagenous matrices for the repair of full-thickness articular cartilage defects——a study in rabbits[J].
Biomaterials, 2003, 24(19): 3255-63.
DOI: 10.1016/S0142-9612(03)00143-1. |
| [14] |
Ramallal M, Maneiro E, López E, et al. Xeno-implantation of pig chondrocytes into rabbit to treat localized articular cartilage defects: an animal model[J].
Wound Repair Regen, 2004, 12(3): 337-45.
DOI: 10.1111/wrr.2004.12.issue-3. |
| [15] |
Huang BJ, Hu JC, Athanasiou KA. Cell-based tissue engineering strategies used in the clinical repair ofarticular cartilage[J].
Biomaterials, 2016, 98(7): 1-22.
|
| [16] |
Makris EA, Gomoll AH, Malizos KN, et al. Repair and tissue engineering techniques for articular cartilage[J].
Nat Rev Rheumatol, 2015, 11(1): 21-34.
DOI: 10.1038/nrrheum.2014.157. |
| [17] |
Goyal D, Keyhani S, Lee EH, et al. Evidence-based status of microfracture technique:a systematic review of level Ⅰ and Ⅱ studies[J].
Arthroscopy, 2013, 29(9): 1579-88.
DOI: 10.1016/j.arthro.2013.05.027. |
| [18] |
Minas T, Von Keudell A, Bryant T, et al. The john insall award:a minimum 10-year outcome study of autologous chondrocyte implantation[J].
Clin Orthop Relat Res, 2014, 472(1): 41-51.
DOI: 10.1007/s11999-013-3146-9. |
| [19] |
Shekkeris A, Perera J, Bentley G, et al. Histological results of 406 BIOPSIES following ACI/MACI procedures forosteochondral defects in the knee[J].
Bone Joint J, 2012, 94-B: SUPP XXXVI12.
|
| [20] |
Camarero-Espinosa S, Rothen-Rutishauser B, Foster EJ, et al. Articular cartilage:from formation to tissue engineering[J].
Biomater Sci, 2016, 4(5): 734-67.
DOI: 10.1039/C6BM00068A. |
| [21] |
宋红星, 曹峻岭, 刘淼, 等. 同种异体软骨细胞移植修复兔膝关节软骨缺损的免疫反应[J].
中国矫形外科杂志, 2002, 9(1): 32-5.
DOI: 10.3969/j.issn.1005-8478.2002.01.010. |
| [22] |
Gruskin E, Doll BA, Futrell FW, et al. Demineralized bone matrix in bone repair:history and use[J].
Adv Drug Deliv Rev, 2012, 64(12): 1063-77.
DOI: 10.1016/j.addr.2012.06.008. |
| [23] |
杨渊, 林春博, 陈维平. 脱钙松质骨的骨支架材料制备及其生物学检测[J].
中国组织工程研究与临床康复, 2010, 14(47): 8769-72.
DOI: 10.3969/j.issn.1673-8225.2010.47.007. |
| [24] |
Haaparanta AM, Järvinen E, Cengiz IF, et al. Preparation and characterization of collagen/PLA, chitosan/PLA, and collagen/ chitosan/PLA hybrid scaffolds for cartilage tissue engineering[J].
J Mater Sci Mater Med, 2014, 25(4): 1129-36.
DOI: 10.1007/s10856-013-5129-5. |
| [25] |
黄永波, 卫小春, 翁卫生, 等. 海藻酸钠-成年软骨细胞培养移植修复成年兔关节软骨缺损的研究[J].
中国实验外科杂志, 2004, 21(8): 988-90.
|
| [26] |
Wei X, Gao J, Messner K. Maturation-dependent repair of untreated osteochondral defects in the rabbit knee joint[J].
J Biomed Mater Res, 1997, 34(1): 63-72.
DOI: 10.1002/(ISSN)1097-4636. |
| [27] |
Schlichting K, Schell H, Kleemann RU, et al. Influence of scaffold stiffness on subchondral bone and subsequent cartilage regeneration in an ovine model of osteochondral defect healing[J].
Am J Sports Med, 2008, 36(12): 2379-91.
DOI: 10.1177/0363546508322899. |
| [28] |
Madry HC. Mueller-Gerbl M.the basic science of the subchondral bone[J].
Knee Surg Sports Traumatol Arthrosc, 2010, 18(4): 419-33.
DOI: 10.1007/s00167-010-1054-z. |
| [29] |
尹战海, 张璐, 王金堂, 等. 双相" 组织工程软骨修复兔关节骨软骨缺损[J].
中国修复重建外科杂志, 2005, 19(8): 652-7.
DOI: 10.3321/j.issn:1002-1892.2005.08.017. |
 2018, Vol. 38
2018, Vol. 38

