2. 广州血液中心输血研究所,广东 广州 510000;
3. 南方医科大学 南方医院儿科,广东 广州 510515
2. Institute of Blood Transfusion, Guangzhou Blood Center, Guangzhou 510000, China;
3. Department of Pediatrics, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
人持续性G病毒(HPgV)是第一个被发现可以感染人类的黄病毒科持续性G病毒属病毒[2]。目前还没发现HPgV对人类有何致病性,因此美国食品药品监督管理局(FDA)不建议将HPgV作为献血人群筛查病毒[3]。相反,HPgV会降低艾滋病(AIDS)患者的病死率,最近还发现共感染HPgV的埃博拉出血热患者,死亡率明显降低[4],因此HPgV被认为是一种“保护性病毒”[5]。直到2015年,美国Kapoor团队首次在输入血源性凝血因子治疗的血友病患者中检出第二种感染人的持续性G病毒(HPgV-2)。在欧美国家HCV人群中感染率约为1.7~3.3%[1, 6];2017年在中国HCV合并HIV人群中为3.3%[7],而国外在该人群中更是高达10.9%[8],但在单独感染HIV人群中并没有检测出该病毒,这提示HPgV-2主要与HCV合并感染。
与HCV的传播途径类似,HPgV-2也是通过血源性传播并能产生慢性持续性感染,说明它可能通过输血或血制品传播[1, 9-10],但目前国内外关于该病毒的研究还没有涉及到血液安全的调查,该病毒是否对血液安全构成潜在威胁还是个未知数。另外,以往经典流行病学的研究重点在于揭示疾病的暴发、传播和流行,而近年来则更多地注重与临床观察和应用相结合,以更客观地评价某些疾病的临床过程。因此,本研究旨在通过检测献血人群和长期暴露于血液及血制品的反复接受输血患者中HPgV-2的感染情况,初步探讨HPgV-2是否引发输血后感染,为HPgV-2的防治及临床应用提供参考依据。
1 材料和方法 1.1 研究对象血清样本采集于广州血液中心的献血者血清和南方医院反复输血病人血清以及普通门诊病人和健康体检人群血清样本。共收集血清标本5680份,其中广州血液中心健康献血者1060份、HCV阳性献血者1402份、HBV感染者500份;来自南方医院的反复输血病人和血友病病人分别为570份和248份,健康体检者和普通门诊病人分别为457和1443份。样本采集回来后分装编号并-80 ℃冻存备用。
1.2 检测方法 1.2.1 抗体检测方法抗体检测采用酶联免疫吸附法(ELISA)。乙肝表面抗原(HBsAg)和抗HCV抗体检测:HBsAg和抗-HCV均采用商用ELISA试剂盒检测,每个项目使用两种不同品牌相互验证(HBsAg:上海科华、北京万泰;抗-HCV抗体:上海科华、珠海丽珠)。
抗HPgV-2 IgG抗体和抗HPgV-2 IgM抗体检测具体操作步骤如下:(1)包被:合成的3个肽段等量混合后用缓冲液PBS稀释成工作浓度为5 μg/mL,50 μL/孔包被96孔酶标板,4 ℃冰箱过夜;(2)洗板:PBST洗3次;(3)封闭:加入200 μL 5%的脱脂牛奶,37 ℃温箱封闭1 h;(4)洗板:PBST洗1次,浸泡时间30~60 s;(5)加样:加入1:100稀释的待检血清、阳性和阴性对照(PBS)各1 μL,混匀,用封板膜封板后,37 ℃恒温箱孵育1 h;(6)洗板:PBST洗3次,浸泡30~60 s;(7)加酶标二抗:加入50 μL/孔1:5000稀释的辣根过氧化物酶(HRP)标记的羊抗人IgG抗体检测抗HPgV-2特异性IgG抗体,若检测抗HPgV-2 IgM抗体时,此步骤加入的二抗为羊抗人IgM抗体,37 ℃恒温箱孵育30 min;(8)洗板:同步骤(6);(9)显色:加50 μL显色底物(TMB)在室温下避光显色15 min;(10)终止:加50 μL 2M H2SO4终止反应;(11)读数:450 nm波长的A值。HPgV-2抗体阳性样本,进一步用尿素处理,以确定抗体反应的特异性,方法是在加二抗IgG前先用50 μL 4 M尿素洗脱10 min。
1.2.2 血清总IgG检测血清总IgG检测,采用ELISA双抗体夹心法,除包被一抗不同外;其余步骤同上。包被:将鼠抗人的IgG抗体用缓冲液0.01 mol/L的PBS稀释工作浓度为5 μg/mL,50 μL/孔包被96孔酶标板,放置4 ℃冰箱过夜。
1.2.3 核酸检测方法HPgV-2 RNA、HPgV RNA、HBVDNA检测:采用罗氏核酸提取试剂盒(德国)从200 μL血清样里提出病毒RNA,再使用罗氏逆转录试剂盒将RNA转成cDNA,操作过程严格按照说明书进行,病毒RNA、cDNA存-80 ℃保存待用。PCR扩增反应使用TaKaRa公司预混的Taq酶。巢式PCR检测HPgV 5'端非编码区(5'UTR)基因,PCR引物及反应条件参照相关参考文献[9]。HPgV-2非结构蛋白基因NS3和5'UTR区的PCR检测方法参考之前已发的文章[6],HBV DNA的扩增引物及PCR反应条件参照相关文献[11],HPgV- 2的全基因组扩增引物及方法参考本课题组已发表的文章[7],PCR扩增出目标条带后送去生工生物工程(上海)股份有限公司测序。
1.3 资料分析系统进化树分析:所有扩增及测序成功的样本只有正反向测序结果相匹配才是准确的有效序列,将这些序列提交至NCBI在线比对网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对,比对结果符合HPgV-2的序列进行下一步分析。查阅相关文献,选取参考株进行比对正确后,从Genbank中下载已上传的所有HPgV-2全长序列,部分HCV以及HPgV-1的参考序列,采用MEGA(6.0版本)软件[12]中的Clustal W对序列进行比对,构建系统进化树采用最大似然法。将本研究中得到的所有HPgV-2序列提交到GenBank获取登录号,其中5条HPgV-2 NS3片段序列的登录号为:KY126373-KY126377,2条HPgV-2 RNA全基因组序列登录号为MF770985-MF770986。
统计分析方法:使用统计软件IBM SPSS 22.0里的χ2和t检验等方法分析数据,P < 0.05为差异有统计学意义。GraphPad Prism 5软件绘制抗体吸光度(A)值直观分布图。
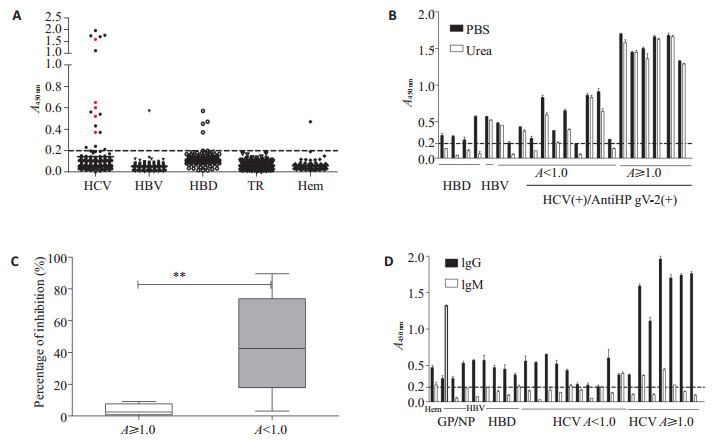
2 结果 2.1 健康献血者HPgV-2感染率血液中心对献血者常规筛查HBV、HCV和HIV-1病毒的感染情况,故本研究中的健康献血者是指以上3种病毒经检测均为阴性的人群。为调查HPgV-2在健康献血人群中的感染情况,我们在广州血液中心收集了1060份健康献血者血清标本。采用直接ELISA法检测,包被用的多肽选择HPgV-2基因组的NS3(P4),NS5A(P9)和NS4A/B(P16)3个非结构肽段等量混合。结果发现仅有3份样本抗HPgV-2抗体弱阳性,检出率为0.28%(表 1,图 1A)。为了排除非特异性吸附,在抗体检测过程中增加了尿素洗脱10 min这一步骤,结果上述3例抗HPgV-2弱阳性样本全部变成阴性(图 1B),而且这3份样本HPgV-2 RNA经巢式PCR检测均为阴性,抗HPgV-2 IgM检测也阴性(图 1D),故不排除是由于非特异性吸附造成的假阳性。同时随机抽取了100份健康献血者血清,检测HPgV-2 RNA和HPgV RNA,结果HPgV-2 RNA均阴性,仅1份样本HPgV RNA阳性(表 1)。上述结果表明,在我国健康献血者中HPgV-2感染率很低,且未发现病毒血症。我们的结果与之前已报道的一致[1, 9-10],证实HPgV-2很少感染健康献血者。
| 表 1 HPgV-2和HPgV在不同人群中抗体或核酸检测结果 Table 1 Serological and molecular detection of HPgV-2 and HPgV in different populati |
|
图 1 HPgV-2抗体检测的A值分布 Figure 1 Detection of anti- HPgV-2 antibodies. A: Detection of anti-HPgV-2 antibodies in HCV (+) or HBV (+) blood donors, healthy blood donors (HBD), transfusion recipients (TR), and hemophilia patients (Hem). ELISA was used to detect humoral immune responses against the 3 mixed HPgV-2 peptides. The dashed line represents the cutoff value of the test. The antibody levels are shown as Mean ± SD of absorbance from 3 independent analyses. The red dot indicates positivity for both anti-HPgV-2 and HPgV-2 RNA; B: ELISA was used to detect anti-HPgV-2 antibodies in the samples treated with 4 mol/L urea (white) to remove nonspecific reaction, with PBS as control (black). (HCV+) BD (A < 1.0 or A≥1.0) indicates the HCV(+)/anti- HPgV- 2(+) blood donors with anti-HPgV-2 A level of < 1.0 or ≥1.0, respectively; C: Box plots of the average reduction rate of the absorbance for anti-HPgV-2 after urea treatment. **P < 0.05; A < 1.0 indicates that the samples (n=16) are weakly or moderately positive for anti-HPgV-2; A≥1.0 indicates the samples (n=6) that are strongly anti-HPgV-2 positive; D: IgG and IgM responses to the 3 mixed HPgV-2 peptides in all the 22 anti- HPgV- 2- positive individuals. IgG (black) and IgM (white) levels (A) are shown as the Mean± SD of absorbance from 3 independent analyses. |
由于HPgV-2感染与HCV密切相关[1, 9-10],我们检测了1402份HCV RNA和抗HCV抗体均阳性(RNA+/ Ab+)的献血者血清标本,发现17份(1.21%)抗HPgV-2抗体阳性,且阳性率在HCV感染者和健康献血者中存在明显差异(χ2=6.47,P=0.01)。此外,17份抗HPgV-2抗体阳性血清中,5例(29.41%)HPgV-2 RNA阳性,3例HPgV RNA阳性(17.65%)。我们又随机抽取了60份抗HPgV-2抗体阴性的样本,HPgV-2 RNA检测结果均阴性,但检出其中7份HPgV RNA阳性(11.67%)(表 1)。值得注意的是,5例HPgV-2 RNA阳性样本中,4例(36.36%)是来自抗HPgV-2抗体弱阳性(A值< 1.0)样本,而6例抗体强阳性(A>1.0)中只有1例(16.67%)HPgV-2 RNA阳性(图 1A)。此外,11份抗HPgV-2抗体弱阳性血清标本经4M尿素洗脱处理后,有4份转为阴性,且总的抗体A值下降率约为75%;而6例抗体强阳性样本经尿素处理后结果几乎没有变化,抗体A值下降率不到10%(图 1B、C)。这些结果提示,部分抗HPgV-2抗体弱阳性血清可能是HPgV-2急性感染,但进一步检测抗HPgV-2 IgM抗体,仅1份样本为IgM弱阳性(图 1D),当然不排除可能是IgM抗体检测方法敏感性较低所致。
在500份感染HBV的献血者中,仅1份抗HPgV-2抗体阳性而核酸阴性(表 1,图 1A),该样本经4M尿素处理后抗HPgV-2仍然阳性(图 1B),但抗HPgV-2 IgM阴性(图 1D),可能代表HPgV-2既往感染。这些实验结果显示HPgV-2主要感染HCV阳性献血者,而与同是血源性传播的HBV感染关联性不大。
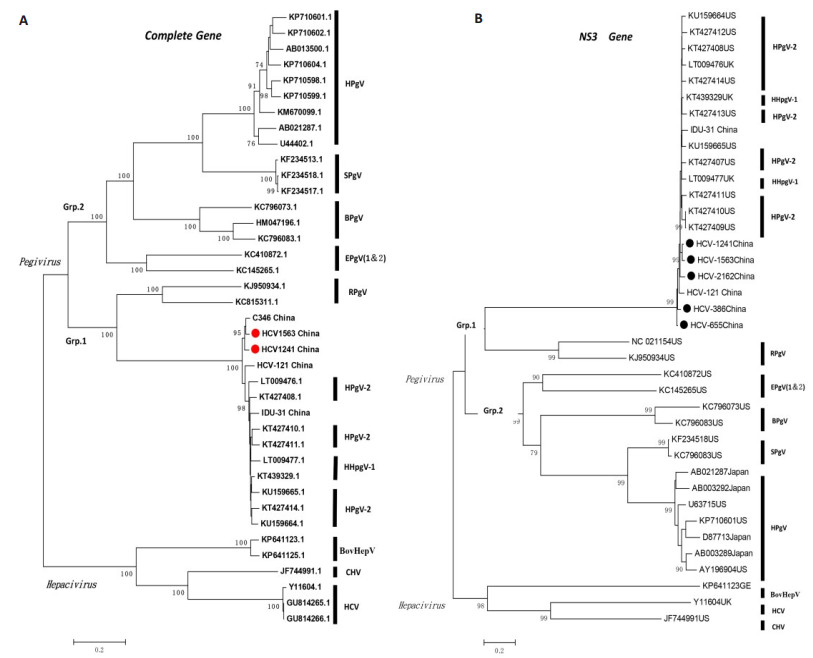
2.3 HPgV-2同源性分析从HCV阳性献血者中获得5份HPgV-2 5'UTR和NS3均阳性的样本。核酸同源性分析显示:5'UTR区同源性达99%,NS3区基因与NCBI网站已发表的序列比对同源性达92%~94%。作分子进化树分析发现,PCR获取的5条HPgV-2 NS3全长片段与国外已发表HPgV-2 NS3基因、以及先前本课题组在HCV感染者和IDU人群中得到的2条HPgV-2 NS3基因聚集在一起,形成一个独立的分支,处在持续性G病毒属第1组,与来自啮齿类(RPgV)的持续性G病毒最接近(图 2B)。本研究从献血者中扩增出来的两株HPgV-2全基因组序列,其核苷酸相似性约为95%,与GenBank已上传序列相比核酸相似性为93.8~96.6%,所有HPgV-2全长序列聚集在同一个分支(图 2A),该结果提示本次从献血者中发现的HPgV-2病毒株序列与国内外已分离到的HPgV-2毒株存在高度同源性,证实为HPgV-2感染,且核酸序列变异较小。另外,值得注意的是,基因保守区域NS3全长序列的系统进化树分布形状(图 2B)和HPgV-2毒株近全基因组序列进化树分布(图 2A)基本相一致,这进一步验证NS3区作为保守序列用于筛查HPgV-2核酸阳性样本的可靠性。
|
图 2 HPgV-2的全长基因组(A)和NS3片段基因(B)的进化系统分析 Figure 2 Maximum-likelihood phylogenetic analysis of full length genes (A) and NS3 (B) of pegiviruses and hepaciviruses. The two full length sequences (red circles) and five NS3 (black circles) of HPgV-2 identified in this study are compared with the reported sequences of pegiviruses and hepaciviruses infecting different mammalian species. Phylogenetic analysis of each data set used 1000 bootstrap replicates to determine the grouping robustness. The values are shown on nods of various branches. Bootstrap values below 70% are not shown. Sequences downloaded from GenBank are cited with accession numbers. PgV: Pegivirus; R: Rodent; E: Equine; B: Bat; S: simian; H: Human; BovHepV: bovine hepacivirus; HCV: Hepacivirus; CHV: Canine hepacivirus. |
共收集了570份患有白血病、贫血、肿瘤等疾病的反复接受输血患者血清,年龄为24.82±18.99岁,男女性别比例无差异(P>0.05,表 2)。这些病人输入的血液及血制品主要包括:血浆、血小板、红细胞、白细胞、洗涤红细胞、凝血因子、全血等,平均输血次数为36次/年,其中80%的病人>10次/年。检测结果显示570份病人血清抗HPgV-2抗体均为阴性,随机抽取50份样本检测HPgV-2 RNA也均为阴性,提示该人群中没有HPgV-2感染(表 1)。相反,反复接受输血患者中HPgV RNA阳性率为8%(表 1),HPgV在感染HCV的献血者和反复输血患者中的核酸阳性率无明显区别(P>0.05)。
| 表 2 反复输血患者的临床特征 Table 2 Clinical characteristics of the transfusion recipients |
为了排除反复接受输血患者因自身免疫系统异常导致机体不能产生针对HPgV-2的抗体或是由于标本血清质量问题影响抗体检测结果,故又对该批血清检测了抗HCV抗体和HBsAg,阳性率分别为0.47%和5.58%(表 3)。作为对比,我们还收集了457份广州南方医院健康体检者和1443份普通门诊病人血清,发现抗HPgV-2抗体的阳性率分别为0.22%和0.14%(均为抗体弱阳性,A值< 0.6),但其中抗HCV抗体的阳性率分别为1.75%和1.32%。反复输血人群与健康体检者以及普通门诊病人比较,抗HPgV-2抗体和抗HCV抗体检出率在这三组样本之间进行卡方检验,结果均没有统计学差异(P>0.05,表 3)。众所周知,IgG具有重要的免疫功能,检测血清总IgG可以观察机体基础免疫状态,我们随机抽取了50份输血患者血清和50份健康献血员血清检测总IgG,发现两者的总IgG抗体A值相似(A值:1.48± 0.06 vs 1.45±0.06,P>0.05)。上述结果表明,本研究的样本质量和机体的免疫反应正常,并不影响抗HPgV- 2抗体与核酸的检测,进一步证实在反复接受输血患者中未见HPgV-2感染结果的可靠性。
| 表 3 HBV, HCV和HPgV-2在各类人群中的检测结果 Table 3 HBV, HCV and HPgV-2 detection rates in different popolations |
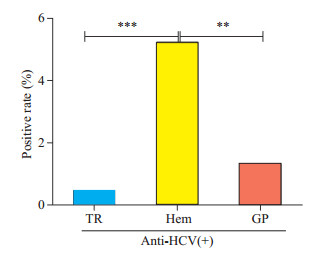
由于HPgV-2是在血友病患者中首次被发现,所以我们从南方医院陆续收集了248份血友病患者血清,最后检测出1例(0.4%)抗HPgV-2 IgG抗体阳性RNA阴性(表 1,图 1A)样本,抗HPgV-2 IgM也阴性(图 1D)。同反复输血患者一样,经多组样本间统计学分析显示血友病样本中除抗HCV抗体比其他人群偏高外(χ2= 15.85,P < 0.01),其它各项检测阳性结果和其他组间均无明显差异(表 3)。我们进一步分析多组样本间卡方检验的两两比较,结果显示差异性主要体现在血友病患者抗HCV抗体阳性率明显高于反复输血患者(P < 0.000)、血友病患者抗HCV抗体阳性率高于门诊普通病人(P < 0.001),各组间存在明显统计学差异(图 3)。
|
图 3 血友病组(Hem)分别与反复输血患者(TR)和普通门诊病人组(GP)之间抗HCV抗体阳性率的比较 Figure 3 Comparison of anti- HCV detection rates among the 3 populations. P value was calculated by partitions of χ2 method using SPSS 22.0 statistical software. A P value < 0.008 was considered to indicate a statistical significance (α'=α/(κ(κ-1)/2+1)=0.05/6=0.008). **P < 0.001, ***P < 0.000. |
因为横断面调查均没有在反复输血和血友病患者中检测到HPgV-2感染,我们进一步采取不定时、多次随机采样的方式对3例反复输血和6例血友病患者采集系列血清共34份(表 4),分别检测了HBV、HCV和HPgV-2感染情况,结果如表 4所示:3例白血病患者重复两次的血清样本HBsAg和/或HBV DNA阳性,但HCV和HPgV-2均阴性。7例血友病患者中2例HBV感染标志物持续阳性,3例抗HCV抗体持续阳性,1例血友病患者抗HCV抗体和HCV RNA持续阳性,但HPgV-2抗体和核酸均阴性,提示该类人群中HPgV-2的感染率确实很低。
| 表 4 反复输血和血友病系列血清(随访)中HBV, HCV和HPgV-2的检测结果 Table 4 The profile of HBV, HCV and HPgV-2 Infection between transfusion recipients and hemophilia patients |
迄今为止,HPgV和HPgV-2是两种可以感染人的持续性G病毒。HPgV感染非常普遍,在发达国家HPgV在献血者中的感染率为1~5%[13-14],在发展中国家HPgV感染率高达20%[15],在混合血样本中甚至高达80%[16]。本次研究在健康献血者中检测HPgV核酸的阳性率为1%,可能原因有:(1)由于近年来我国公共卫生事业受到高度重视以及卫生工作人员大量投入,HPgV随着HCV/HIV的防治在我国流行有下降的趋势;(2)随机抽取的样本量不足,结论有待进一步扩大检测数验证;(3)该阳性率主要是指核酸阳性,故按此计算的感染率较低,而一般测感染率时按抗体阳性率计算更能代表新旧感染。但因为还没有发现HPgV对人类有何致病性,对血液安全也不造成威胁[17-18]。与HPgV不一样,HPgV-2在中国一般人群流行率极低。尽管HPgV-2主要与HCV合并感染,但抗HPgV-2抗体阳性率也仅为1.21%,核酸阳性率为0.36%,与国内外1%~2%的感染率相一致[1, 9, 19]。但在HCV/HIV-1共感染的吸毒人群中,HPgV-2 RNA的阳性率可高达11%,说明可能存在HPgV-2感染的高危险人群[7-8]。
血友病(Hem)患者HCV感染率为5.24%明显高于普通门诊病人组(GP),该调查结果与国内相关研究结果一致[20],但高于我国一般人群1~59岁抗HCV抗体流行率约为0.43%[21],这提示血友病依然是血源性传播病毒HCV感染的高危人群。同是输入血液和/或血制品,血友病组抗HCV抗体阳性率明显高于反复输血组,这可能是:反复输血患者组病种多样(白血病、贫血、肿瘤等),患者间输血次数相差悬殊(每人从5~100次/年不等的范围),而血友病组病种单一,输血次数均较多(每人约2~3次/月)等原因综合作用的结果。血友病和反复输患者HBsAg阳性率差异不明显,但明显低于自然人群9.09%的感染率[22],推测原因可能是对供血者HBsAg严格筛查和乙肝疫苗的大量普及。动态地追踪HPgV-2仍然未发现任何感染迹象,这进一步提示该病毒确实很少引发输血后感染。
HPgV-2可能是经血液传播的病毒,本研究虽然没有检测血制品中HPgV-2的感染情况,但大多数反复输血患者均多次输入诸如血浆、血小板、凝血因子、洗涤红细胞等多种血制品,然而并未在该人群中发现该病毒感染,且经验证检测结果可靠;Zhang等[16]也报道过从美国和欧洲收集的10个混合血清中未发现HPgV-2 RNA,这说明HPgV-2并非输血后感染的常见病原体。推测原因:(1)该病毒本身的传播力可能较低;(2)HPgV-2与HCV尤其是与HCV+/HIV+病人共感染密切相关,而我国献血者常规筛检HCV和HIV时也相应涤除了可能感染HPgV-2的献血者;(3)血制品加工生产过程中工艺措施可能清除包括HPgV-2病毒在内的病毒,加上一些基因工程表达产品的使用,如重组表达的凝血Ⅷ因子代替血浆来源的凝血Ⅷ因子,减少了血制品传播HPgV-2的可能性。
近几年陆续在蝙蝠、啮齿类动物、非灵长类和灵长类动物中检测出持续性G病毒(pegivirus)[23],而且持续性G病毒属中的泰勒氏相关疾病病毒(TDAV)感染马后可致马急性肝炎爆发,提示至少某些持续性G病毒存在致病性[10]。已有研究表明HCV合并感染HPgV-2后并不加重人体肝功能的损害,HCV病毒载量也没有明显变化[7]。尽管目前还没有证据显示该病毒具有何种致病性,但其与HCV合并感染的相关机制却依然还是个迷[1, 6-7, 9]。本研究还发现,HPgV-2病毒抗体阳性人群中,大约29.41%(5/17)核酸为阳性,这提示仅约30%感染者转为慢性感染,而大约70% HPgV-2病毒核酸被清除;75%的HPgV感染者在感染后两年内可清除体内病毒,剩余的25%则形成以持续性病毒血症为特征的慢性感染[24]。而HCV感染者中大约55~85%会形成慢性感染[25]。同为持续性G病毒属的HPgV病毒,迄今共发现有7种亚型,基因型之间存在11%~14%的变异[26],与HPgV-2基因组类似的HCV也有6中基因型80多种基因亚型[27-28],HPgV-2作为RNA病毒,目前发现的病毒序列变异较小,原因有待进一步探索。HPgV-2是否会导致任何疾病,其易感人群及主要流行地区如何,尚需深入研究,以为疾病防治提供科学依据。
本研究首次在国内探讨HPgV-2在医院反复接受输血患者中的血清学和分子生物学特征。HPgV-2病毒主要与HCV或HCV合并HIV共感染,目前医院和血液中心对HCV/HIV的常规筛查可能进一步涤除感染HPgV-2的献血者,从而保证了血液及血制品的安全。所以,即使不开展HPgV-2筛查,HPgV-2可能也不会导致输血后感染,目前对我国血液安全还不至于构成威胁。
| [1] |
Kapoor A, Kumar A, Simmonds P, et al. Virome analysis of transfusion recipients reveals a novel human virus that shares genomic features with hepaciviruses and pegiviruses[J].
MBio, 2015, 6(5): e1415-66.
|
| [2] |
Stapleton JT, Foung S, Muerhoff AS, et al. The GB viruses: a review and proposed classification of GBV-A, GBV-C (HGV), and GBV-D in genus Pegivirus within the family Flaviviridae[J].
J Gen Virol, 2011, 92(2): 233-46.
DOI: 10.1099/vir.0.027490-0. |
| [3] |
Chandriani S, Skewes-Cox P, Zhong WD, et al. Identification of a previously undescribed divergent virus from the Flaviviridae family in an outbreak of equine serum hepatitis[J].
Proc Natl Acad Sci USA, 2013, 110(15): E1407-15.
DOI: 10.1073/pnas.1219217110. |
| [4] |
Stapleton JT, Chaloner K. GB virus C infection and non-Hodgkin lymphoma: important to know but the jury is out[J].
Int J Cancer, 2010, 126(12): 2759-61.
|
| [5] |
Bhattarai N, Stapleton JT. GB virus C: the good boy virus[J].
Trends Microbiol, 2012, 20(3): 124-30.
DOI: 10.1016/j.tim.2012.01.004. |
| [6] |
Bonsall D, Gregory WF, Ip CL, et al. Evaluation of viremia frequencies of a novel human pegivirus by using bioinformatic screening and PCR[J].
Emerg Infect Dis, 2016, 22(4): 671-8.
DOI: 10.3201/eid2204.151812. |
| [7] |
Wang H, Wan Z, Xu R, et al. A novel human pegivirus, HPgV-2 (HHpgV-1), is tightly associated with hepatitis C virus (HCV) infection and HCV/human immunodeficiency virus type 1 coinfection[J].
Clin Infect Dis, 2018, 66(1): 29-35.
DOI: 10.1093/cid/cix748. |
| [8] |
Kandathil AJ, Breitwieser FP, Sachithanandham J, et al. Presence of human hepegivirus-1 in a cohort of people who inject drugs[J].
Ann Intern Med, 2017, 167(1): 1.
DOI: 10.7326/M17-0085. |
| [9] |
Berg MG, Lee D, Coller K, et al. Discovery of a novel human pegivirus in blood associated with hepatitis C virus Co-Infection[J].
PLoS Pathog, 2015, 11(12): e1005325.
DOI: 10.1371/journal.ppat.1005325. |
| [10] |
Theze J, Lowes S, Parker J, et al. Evolutionary and phylogenetic analysis of the hepaciviruses and pegiviruses[J].
Genome Biol Evol, 2015, 7(11): 2996-3008.
DOI: 10.1093/gbe/evv202. |
| [11] |
Faleye TO, Adewumi MO, Omoruyi EC, et al. Detection of hepatitis B virus isolates with mutations associated with immune escape mutants among pregnant women in Ibadan, southwestern Nigeria[J].
Springerplus, 2015, 4(1): 43.
DOI: 10.1186/s40064-015-0813-1. |
| [12] |
Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J].
Mol Biol Evol, 2013, 30(12): 2725-9.
DOI: 10.1093/molbev/mst197. |
| [13] |
Nubling C, Groner A, Lower J. GB virus C/hepatitis G virus and intravenous immunoglobulins[J].
Vox Sang, 1998, 75(3): 189-92.
DOI: 10.1046/j.1423-0410.1998.7530189.x. |
| [14] |
Mushahwar IK. Verses, viruses, and the vulnerability of the blood supply in industrialized countries[J].
J Med Virol, 2007, 79(8): 1229-37.
DOI: 10.1002/(ISSN)1096-9071. |
| [15] |
Mohr EL, Stapleton JT. GB virus type C interactions with HIV: the role of envelope glycoproteins[J].
JViral Hepat, 2009, 16(11): 757-68.
DOI: 10.1111/jvh.2009.16.issue-11. |
| [16] |
Zhang W, Li LL, Deng XT, et al. Viral nucleic acids in human plasma pools[J].
Transfusion, 2016, 56(9): 2248-55.
DOI: 10.1111/trf.2016.56.issue-9. |
| [17] |
Horemheb-Rubio G, Ramos-Cervantes P, Arroyo-Figueroa H, et al. High HPgV replication is associated with improved surrogate markers of HIV progression[J].
PLoS One, 2017, 12(9): e184494.
|
| [18] |
Abuodeh RO, Al-Absi E, Ali NH, et al. Detection and phylogenetic analysis of human pegivirus (GBV-C) among blood donors and patients infected with hepatitis B virus (HBV) in Qatar[J].
J Med Virol, 2015, 87(12): 2074-81.
DOI: 10.1002/jmv.24289. |
| [19] |
Coller KE, Berg MG, Frankel M, et al. Antibodies to the novel human pegivirus 2 are associated with active and resolved infections[J].
J Clin Microbiol, 2016, 54(8): 2023-30.
DOI: 10.1128/JCM.00515-16. |
| [20] |
聂玉玲, 安利, 毛敏, 等. 新疆地区血友病患者HBV, HCV和HIV感染调查[J].
临床输血与检验, 2017, 27(2): 146-8.
|
| [21] |
陈园生, 李黎, 崔富强, 等. 中国丙型肝炎血清流行病学研究[J].
中华流行病学杂志, 2011, 32(9): 888-91.
|
| [22] |
梁晓峰, 陈园生, 王晓军, 等. 中国3岁以上人群乙型肝炎血清流行病学研究[J].
中华流行病学杂志, 2005, 26(9): 655-8.
|
| [23] |
Lauck M, Bailey AL, Andersen KG, et al. GB virus C coinfections in WestAfrican Ebola patients[J].
J Virol, 2015, 89(4): 2425-9.
DOI: 10.1128/JVI.02752-14. |
| [24] |
Tanaka E, Kiyosawa K, Shimoda K, et al. Evolution of hepatitis G virus infection and antibody response to envelope protein in patients with transfusion-associated non-A, non-B hepatitis[J].
J Viral Hepat, 1998, 5(3): 153-9.
DOI: 10.1046/j.1365-2893.1998.00095.x. |
| [25] |
Guidelines for the screening care and treatment of persons with chronic hepatitis C infection: updated version[M]. Geneva: World Health Organization, 2016.
|
| [26] |
Branco C, Esteves A, Piedade J, et al. A new genotype 2 subcluster identified among GBV-C strains circulating in the Lisbon metropolitan area of Portugal[J].
J Med Virol, 2010, 82(3): 452-9.
DOI: 10.1002/jmv.v82:3. |
| [27] |
吕铭洋. 丙型肝炎病毒基因分型的方法学建立及初步应用[D]. 中国疾病预防控制中心, 2015.
|
| [28] |
Hartlage AS, Cullen JM, Kapoor A. The strange, expanding world of animal hepaciviruses[J].
Annu Rev Virol, 2016, 3(1): 53-75.
DOI: 10.1146/annurev-virology-100114-055104. |
 2018, Vol. 38
2018, Vol. 38

