2. 苏州大学第一附属医院血液科,江苏 苏州 215006
2. Department of Hematology, First Hospital Affiliated to Suzhou University, Suzhou 215006, China
Leupaxin(LPXN)是1998年Lipsky等[1]从人的巨噬细胞cDNA文库中成功克隆出的一个桩蛋白(paxillin)家族新成员,主要表达于白血病、前列腺癌、乳腺癌、黑色素瘤等肿瘤细胞的胞浆[2-3]。LPXN常定位于黏着斑(FAP),构成细胞与细胞基质局部粘附的关键部位,同时也是细胞信号转导的重要位点,参与调节细胞的增殖与分化,调控肿瘤细胞的粘附与迁移[4-7]。目前,LPXN在肿瘤疾病中的研究主要集中于前列腺癌。比如国外有研究发现:LPXN在具有较强侵袭力的前列腺癌PC-3及DU 145细胞中表达很高,而在非侵袭性前列腺癌LNCaP细胞中表达很低;在这些细胞中,LPXN与actin、paxillin等主要聚集于FAP,与蛋白激酶FAK、PYK2、c-Src、蛋白磷酸酶PTP-PEST等相互作用后激活RAS-MAPK、PI3K/Akt、STAT1、P53、GTPase等下游通路,从而促进前列腺癌细胞的增殖、粘附与侵袭;通过RNA干扰下调LPXN的表达,促使前列腺癌细胞相互分离与自发凋亡,降低肿瘤细胞的增殖和侵袭[8-13]。
人们对于LPXN与白血病之间的研究也日益关注,但国内外迄今为止也仅有5例报道。其中Petti[14]、Tanaka等[15]发现LPXN通过表达水平的高低、磷酸化的改变影响白血病细胞株HMC-1、K562及TPH-1 [16]细胞的粘附、侵袭与迁移;戴海萍[17]及Abe等[18]均发现LPXN参与急性白血病相关染色体易位,促进急性白血病的发生和发展。在本课题组的前期研究中,我们发现(6.25~ 25)μmol姜黄素(Curcumin,Cur)或(0~2.0) μmol阿糖胞苷(Ara-C)均可通过激活磷酸化丝裂原活化蛋白激酶(p-MAPK)从而呈剂量依赖性抑制AML-5b型人急性单核细胞白血病细胞株SHI-1的体外增殖并诱导细胞凋亡[19];且在Cur药物体外作用SHI-1细胞时,下调了桩蛋白LPXN的表达。考虑人急性单核细胞白血病SHI-1细胞的多药耐药、高增殖、高恶性、高表达LPXN蛋白等特点[20],本研究拟进一步通过siRNA转染干扰下调LPXN分子表达并联合Cur或Ara-C药物,国内外首次探讨LPXN表达下调后对急性白血病SHI-1细胞的体外增殖以及细胞对常见治疗药物敏感性的改变,为临床探究急性白血病的药物治疗机制、寻求新的药物作用靶点提供实验依据。
1 材料和方法 1.1 主要材料SHI-1细胞株由江苏省血液病研究所惠赠;Cur(Sigma-Aldrich);一抗p-MAPKs,LPXN(Cell Signaling, Santa Cruz);LipofectamineTM2000转染试剂盒(Invitrogen);CCK-8试剂盒(同仁);小干扰RNA(siRNA)均由上海Genepharma公司合成。
1.2 细胞培养SHI-1细胞用含15% FBS的IMDM培养液于37 ℃、5% CO2饱和度的细胞培养箱中进行培养,2~3 d传代1次。
1.3 小干扰RNA (siRNA)转染SHI-1细胞用RNAi技术特异性沉默SHI-1细胞中LPXN的表达,针对LPXN基因的siRNA序列参照文献[22]由Genepharma公司合成如下两对:L1-siRNA(正义链5'-UAUUCCAACCCAGCUCCUC-3',反义链5'-GAGGAGCUGGGUUGGAAUA-3')和L2-siRNA(正义链5'-GGCGCAGCUCGUGUAUACUACCAAU-3',反义链5'-AUUGGUAGUAUACACGAGCUGCGCC-3')。另合成针对荧光素酶基因的siRNA序列(后续简写为N-siRNA)作为转染的阴性对照,合成荧光标记的FAMsiRNA序列作为转染的阳性对照。各对siRNA序列经LipofectamineTM2000转染入SHI-1细胞,具体实验操作参照试剂说明书并作适当修改,比如为了提高siRNA的转染效率,在siRNA转染SHI-1细胞前后,改用无血清Opti-MEM® I培养液洗涤、重悬和继续培养转染后的SHI-1细胞,并如转染后3 h添加15% FBS。
1.4 流式细胞仪(FCM)检测siRNA对SHI-1细胞的转染效率参照苏州大学王春玲博士、冯洒然博士利用脂质体LipofectamineTM2000将目的基因siRNA成功转染入SHI-1悬浮细胞的转染条件[23-24],本研究同样利用LipofectamineTM2000将阳性对照组中羧基荧光素标记的不同浓度FAM-siRNA和阴性对照组中的NsiRNA分别于24孔板中转染SHI-1细胞。收集每孔转染并培养12 h后的SHI-1细胞,用PBS洗涤2遍后经FCM检测siRNA转染效率,用来筛选和优化后续转染条件。
1.5 Western blot法检测LPXN-siRNA的干扰效果按照上述FCM检测结果,确定siRNA / LipofectamineTM2000的最佳混合比例以及合适细胞接种密度,并严格按照此转染条件将干扰LPXN表达的两种不同siRNA序列L1-siRNA与L2-siRNA,以及阴性对照N-siRNA分别转染SHI-1细胞。收集转染48 h后的各组SHI-1细胞,Western blot检测siRNA对SHI-1细胞中LPXN表达的影响,筛选有效干扰LPXN表达的siRNA序列进行后续研究。
1.6 CCK-8观察LPXN-siRNA对SHI-1细胞增殖以及药物敏感性的影响取对数生长期SHI-1细胞并以4×105/mL密度接种96孔板,同时设立不加细胞的空白对照组;稀释筛选出的能有效干扰LPXN表达的L2-siRNA以及阴性对照N-siRNA,分别转染SHI-1细胞;转染并培养24 h后,分别向每组细胞中加入不同浓度的Cur(终浓度分别为6.25、12.5、25 μmol)或Ara-C(终浓度分别为1.0、1.5、2.0 μmol),轻轻混匀后继续孵育24 h;再向每个培养孔内加入10 μLCCK8试剂,37 ℃继续孵育3 h,酶标仪读取450 nm波长下的吸光度(A)。
1.7 Western blot法检测LPXN-siRNA转染后SHI-1细胞中p-MAPK的表达将L2-siRNA及N-siRNA分别转染SHI-1细胞,培养24 h后加入不同浓度Cur或Ara-c,继续培养48 h。收集各组转染siRNA后又加入药物Cur或Ara-c的SHI-1细胞,按照Western blot操作步骤,检测细胞中p-JNK、p-P38 MAPK及p-ERK的表达,探究LPXN-siRNA影响SHI-1细胞增殖及药物敏感性的可能分子机制。
1.8 统计学方法实验数据以均数±标准差表示,采用SPSS 15统计软件进行处理,采用单因素方差分析,P < 0.05为差异有统计学意义。
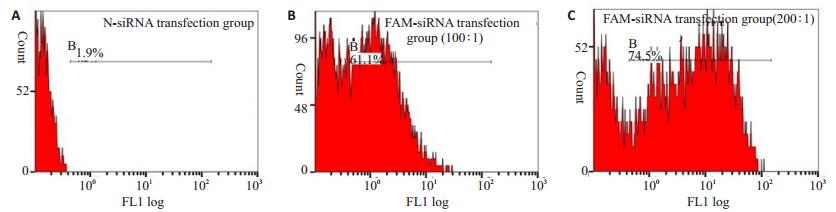
2 结果 2.1 FCM检测FAM-siRNA对SHI-1细胞的转染效率在SHI-1细胞采用4 × 105/mL接种密度,FAM-siRNA/LipofectamineTM2000=200 pmol/1 μL的混合比例条件下达到了最高转染效率74.5%,因此后续目的基因LPXN siRNA均按照此筛选条件进行SHI-1细胞的转染(图 1)。
|
图 1 流式细胞仪(FCM)检测FAM-siRNA对SHI-1细胞的转染效率 Figure 1 Transfection efficiency of FAM-siRNA in SHI-1 cells detected by flow cytometry. A: N-siRNA/Lip2000=200 pmol/1 μL; B: FAMsiRNA/Lip2000=100 pmol/1 μL; C: FAM-siRNA/Lip2000=200 pmol/1 μL. |
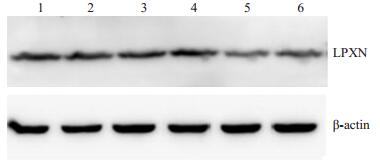
L1-siRNA转染组的1、2泳道与N-siRNA转染对照组的3、4泳道相比,LPXN蛋白表达基本无变化,提示L1-siRNA对LPXN蛋白表达无干扰效果(图 2)。L2-siRNA转染组的5、6泳道与N-siRNA转染对照组的3、4泳道相比,LPXN蛋白的表达均发生了下降,尤其是第5泳道中当L2-siRNA/Lip2000=200 pmol/1 µL混合比例时LPXN蛋白的表达下降更为明显,提示L2-siRNA对LPXN表达具有一定干扰效果。尤其当L2-siRNA/Lip2000=200 pmol/1 µL混合比例时达到更佳干扰效果,这和2.1中FCM检测结论相一致。因此后续实验中,我们仅选择L2-siRNA序列,按照L2- siRNA/Lip2000=200 pmol/1 µL的最佳比例进行转染和研究。
|
图 2 Western blot法检测两种不同的siRNA序列对SHI-1细胞中LPXN的干扰效应 Figure 2 LPXN-silencing effects of two different siRNA sequences detected by Western blotting in SHI-1 cells. 1:L1-siRNA/Lip2000=200 pmol/1 µL; 2: L1-siRNA/ Lip2000=100 pmol/1 µL; 3: N-siRNA/Lip2000=200 pmol/1 µL; 4: N-siRNA/Lip2000=100 pmol/1 µL; 5: L2- siRNA/Lip2000=200 pmol/1 µL; 6: L2-siRNA/Lip2000= 100 pmol/1 µL. |
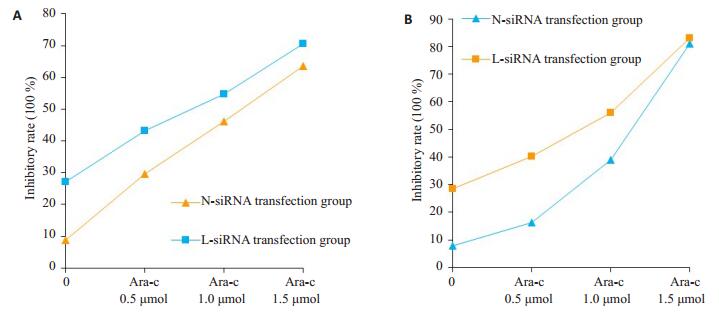
在不添加任何药物的情况下,N-siRNA转染组细胞的增殖抑制率为8.247±1.003,L2-siRNA转染组SHI-1细胞的增殖抑制率为27.043±2.051,表明L2-siRNA转染下调LPXN表达后在一定程度上抑制了SHI-1细胞的增殖(P < 0.05,图 3)。
|
图 3 CCK-8检测不同浓度Ara-C、Cur对L2-siRNA及N-siRNA两转染组中SHI-1细胞的增殖抑制率 Figure 3 Proliferation inhibition rates of LPXN-siRNA, Ara-C and Cur detected by CCK-8 reagent in SHI-1 cells. A: 0-2.0 μmol Ara-C group; B: 0-25 μmol Cur group. |
各浓度Ara-C分别作用N-siRNA及L2-siRNA两转染组相等时间后,L2-siRNA转染组细胞的增殖抑制率均高于N-siRNA转染组(P < 0.05,图 3A)。各浓度Cur作用两转染组相等时间后,L2-siRNA转染组SHI-1细胞的增殖抑制率均高于N-siRNA转染组。尤其是在Cur 6.25 μmol及Cur 12.5 μmol药物组,L2-siRNA转染组的细胞增殖抑制率均明显高于NsiRNA转染组(P < 0.05,图 3B)。
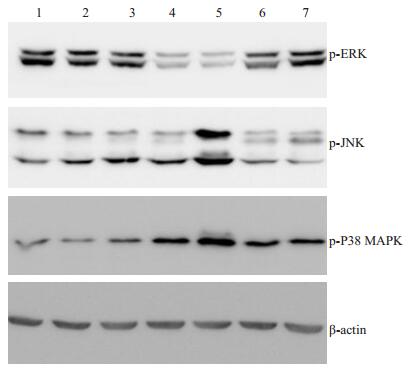
2.4 LPXN通过激活MAPK影响SHI-1细胞的增殖和药物敏感性第1~3泳道为未加任何药物组,其中第3泳道L2- siRNA转染组的p-JNK与p-P38MAPK,均比第1泳道仅加SHI-1细胞的空白对照组和第2泳道N-siRNA阴性转染组表达增高;而p-ERK在这3组中的表达均不变。
第4~7泳道均为转染siRNA后的加药组。其中第5泳道添加Cur药物的L2-siRNA转染组中p-JNK与p-P38 MAPK的表达分别比第4泳道N-siRNA对照组增高;同样,第7泳道添加Ara药物的L2-siRNA转染组中p-JNK与p-P38 MAPK的表达也分别比第6泳道对照组增高。而p-ERK在同样药物作用的两转染组中表达变化不大(图 4)。
|
图 4 Western blot检测L2-siRNA及N-siRNA两转染组添加Ara-C或Cur 48 h后SHI-1细胞内p-MAPK蛋白的表达 Figure 4 Expression of p-MAPK detected by Western blotting in SHI-1 cells 48 h after transfection with N-siRNA and L2-siRNA. 1: SHI-1 cell blank group; 2: N-siRNA transfection group; 3: L2- siRNA transfection group; 4 : N-siRNA transfection group with 12.5 μmol Cur; 5: L2-siRNA transfection group with 12.5 μmol Cur; 6 : N-siRNA transfection group with 1.5 μmol Ara-C; 7: L2- siRNAtransfection group with 1.5 μmol Ara-C. |
SHI-1细胞株是2002年由苏州大学、江苏省血液病研究所、江苏省免疫所共同培养与建立的国内第1株且国际第3株的人急性单核细胞白血病细胞系(AML-5b型),后经陈苏宁博士鉴定,该细胞株伴有特异的t(6; 11)(q27: q23)染色体易位,存在MLL-AF6融合基因,且经体外培养存在着多药耐药,其中对对足叶乙甙(VP16)最为明显;另高表达桩蛋白LPXN,具有高恶性、高增殖、强耐药等特性,因此是一个很有价值的白血病研究模型[20, 24]。结合我们前期研究中发现Cur药物通过p-MAPK激活、下调LPXN表达等影响SHI-1细胞的增殖和凋亡[19],本研究中我们首次尝试筛选有效siRNA序列干扰桩蛋白LPXN的表达,并观察LPXN表达下调后对SHI-1细胞增殖与药物敏感性的影响。我们通过带有荧光标记的FAM-siRNA,反复实验摸索出siRNA转染入SHI-1悬浮细胞的最佳转染条件为细胞密度4×105/mL时将siRNA/ LipofectamineTM2000混合比例配置为200 pmol/1 μL进行转染,可达到最高74.5%的转染效率,这与王春玲等[23]将MMP-2 siRNA转染入SHI-1细胞的转染结果基本一致。在后续目的基因LPXN-siRNA转染SHI-1细胞的研究中,我们均严格按照此转染条件进行,并通过Western blot筛选出L2-siRNA是一定程度上可干扰下调SHI-1细胞中LPXN蛋白表达的有效序列。
通过CCK-8试剂检测,我们发现L2-siRNA转染组在下调LPXN表达后一定程度上抑制了SHI-1细胞的增殖(P < 0.05),表明在SHI-1细胞中降低LPXN蛋白的表达能减弱白血病细胞的恶性增殖,通过RNA干扰下调LPXN的表达,促使前列腺癌细胞相互分离与自发凋亡,降低肿瘤细胞的增殖结论相一致[9-11]。进一步添加不同浓度Ara-C或Cur药物进入N-siRNA及L2-siRNA两转染组,我们还可看出L2-siRNA干扰下调LPXN表达后增强了该两种药物对SHI-1细胞的增殖抑制性,即在相同培养条件下,LPXN蛋白表达降低能进一步增强SHI-1细胞对Ara-C或Cur药物的敏感性,为临床改善该类型白血病病人的多药耐药提供了新的治疗思路。
本研究为进一步探讨LPXN蛋白表达下调后抑制SHI-1细胞增殖,增强其药物敏感性的可能分子机制,并参考其他对前列腺癌中LPXN分子参与的信号通路的研究结果[8-13],Western blot检测siRNA转染后SHI-1细胞内p-MAPK的表达。MAPK是细胞内的一类丝氨酸/苏氨酸蛋白激酶,大量研究表明MAPK家族的3个成员ERK、JNK和P38 MAPK磷酸化激活后参与细胞凋亡信号通路转导,调控肿瘤细胞的增殖、凋亡及分化[25-29]。结果在本研究LPXN表达下调后的L2-siRNA转染组p-JNK和p-P38 MAPK的表达均增加,而p-ERK的表达水平则与阴性对照组基本一致。表明L2-siRNA转染组在干扰下调LPXN表达后可能通过激活JNK和P38 MAPK,从而在一定程度上抑制SHI-1细胞的增殖,增强SHI-1细胞对Cur及Ara-C药物的敏感性。MAPK家族的ERK分子则与该过程可能无关。
总之,本研究成功筛选出能干扰下调桩蛋白LPXN表达的siRNA序列,并以较高效率转染入人急性单核白血病SHI-1细胞。我们发现siRNA干扰下调LPXN表达后不仅一定程度上抑制了SHI-1细胞的增殖,而且增强了相同培养条件下SHI-1细胞对Cur及Ara-C药物的敏感性;且相关分子机制可能与LPXN蛋白表达下调后激活MAPK家族的JNK及P38 MAPK蛋白酶有关。
| [1] |
Lipsky BP, Beals CR. Leupaxin is a novel LIM domain protein that formsacomplexwithPYK2[J].
JBiolChem, 1998, 273(19): 11709-13.
|
| [2] |
朱国华, 戴海萍, 沈群. Leupaxin参与调控前列腺癌转移的分子机制[J].
中华男科学杂志, 2013, 19(6): 555-8.
|
| [3] |
Watanabe N, Amano N, Ishizuka H, et al. Leupaxin binds to PEST domain tyrosine phosphatase PEP[J].
Mol Cell Biochem, 2005, 269(1/2): 13-7.
|
| [4] |
胡振红, 李清泉. 桩蛋白的分子结构及其在信号传导和肿瘤发生中的作用[J].
华南国防医学杂志, 2005, 19(1): 45-7.
|
| [5] |
Sundberg-Smith LJ, Dimichele LA, Sayers RL, et al. The LIM protein leupaxin is enriched in smooth muscle and functions as an serum response factor cofactor to induce smooth muscle cell gene transcription[J].
Circ Res, 2008, 102(12): 1502-11.
DOI: 10.1161/CIRCRESAHA.107.170357. |
| [6] |
Vanarotti MS, Finkelstein DB, Guibao CD, et al. Structural basis for the interaction between Pyk2-FAT domain and leupaxin LD repeatss[J].
Biochemistry, 2016, 55(9): 1332-45.
DOI: 10.1021/acs.biochem.5b01274. |
| [7] |
Dierks S, Von Hardenberg S, Schmidt TA, et al. Leupaxin stimulates adhesion and migration of prostate cancer cells through modulation of the phosphorylation status of the actin-binding protein caldesmon[J].
Oncotarget, 2015, 6(15): 13591-606.
|
| [8] |
Sahu SN, Khadeer MA, Robertson BW, et al. Association of leupaxin with Src in osteoclasts[J].
Am J Physiol Cell Physiol, 2007, 292(1): C581-90.
DOI: 10.1152/ajpcell.00636.2005. |
| [9] |
Kaulfuss S, Von Hardenberg S, Schweyer S, et al. Leupaxin acts as a mediator in prostate carcinoma progression through deregulation of p120catenin expression[J].
Oncogene, 2009, 28(45): 3971-82.
DOI: 10.1038/onc.2009.254. |
| [10] |
Kaulfuss S, Herr AM, Buechner A, et al. Leupaxin is expressed in mammary carcinoma and acts as a transcriptional activator of the estrogen receptor alpha[J].
Int J Oncol, 2015, 47(1): 106-14.
DOI: 10.3892/ijo.2015.2988. |
| [11] |
Kaulfuss S, Grzmil M. Leupaxin, a novel coactivator of the androgen receptor, is expressed in prostate cancer and plays a role in adhesion and invasion of prostate carcinoma cells[J].
Mol Endocrinol, 2008, 22(7): 1606-21.
DOI: 10.1210/me.2006-0546. |
| [12] |
Sahu SN, Nunez S, Bai G, et al. Interaction of Pyk2 and PTP-PEST with leupaxin in prostate cancer cells[J].
Am J Physiol Cell Physiol, 2007, 292(6): C2288-96.
DOI: 10.1152/ajpcell.00503.2006. |
| [13] |
Sahu SN, Khadeer MA, Robertson BW. Association of leupaxin with Srcinosteoclasts[J].
AmJPhysiolCellPhysiol, 2007, 292(1): C581-90.
|
| [14] |
Petti F, Thelemann A, Kahler J, et al. Temporal quantitation of mutant Kit tyrosine kinase signaling attenuated by a novel thiophene kinase inhibitor OSI-930[J].
Mol Cancer Ther, 2005, 4(8): 1186-97.
DOI: 10.1158/1535-7163.MCT-05-0114. |
| [15] |
Tanaka T, Moriwaki K, Murata SA. LIM domain-containing adaptor, leupaxin, localizes in focal adhesion and suppresses the integrininduced tyrosine phosphorylation of paxillin[J].
Cancer Sci, 2010, 101(2): 363-8.
DOI: 10.1111/cas.2010.101.issue-2. |
| [16] |
戴海萍, 朱国华, 吴丽丽, 等. LPXN过表达对THP-1细胞增殖, 粘附和侵袭的影响及其机制研究[J].
中国实验血液学杂志, 2017, 25(3): 673-7.
|
| [17] |
Dai HP, Xue YQ, Zhou JW, et al. LPXN, a member of the paxillin superfamily, is fused to RUNX1 in an acute myeloid leukemia patient with a t(11;21) (q12;q22) translocation[J].
Genes Chromosomes Cancer, 2009, 48(12): 1027-36.
DOI: 10.1002/gcc.v48:12. |
| [18] |
Abe A, Yamamoto Y, Iba S, et al. ETV6-LPXN fusion transcript generated by t(11;12) (q12.1;p13) in a patient with relapsing acute myeloid leukemia with NUP98- HOXA9[J].
Genes Chromosomes Cancer, 2016, 55(3): 242-50.
DOI: 10.1002/gcc.v55.3. |
| [19] |
Zhu GH, Dai HP, Shen Q, et al. Curcumin induces apoptosis and suppresses invasion through MAPK and MMP signaling in human monocyticleukemiaSHI-1cells[J].
PharmBiol, 2016, 54(8): 1303-11.
|
| [20] |
陈苏宁, 薛永权, 吴亚芳, 等. 人单核细胞白血病细胞系SHI-1的多药耐药和耐药蛋白的表达[J].
江苏医药, 2007, 33(10): 1015-7.
DOI: 10.3969/j.issn.0253-3685.2007.10.017. |
| [21] |
Shi J, Wu WJ, Hu G, et al. Regulation of beta-catenin transcription activity by leupaxin in hepatocellular carcinoma[J].
Tumor Biol, 2016, 37(2): 2313-20.
DOI: 10.1007/s13277-015-4060-4. |
| [22] |
Feng SR, Cen JN, Huang YH, et al. Matrix metalloproteinase-2 and- 9 secreted by leukemi cells increase the permeability of Blood-Brain barrier by disrupting tight junction proteins[J].
PLoS One, 2011, 6(8): e20599.
DOI: 10.1371/journal.pone.0020599. |
| [23] |
Wang CL, Chen ZX, Li ZJ, et al. The essential roles of matrix metalloproteinase-2, membrane type 1 metalloproteinase and tissue inhibitor of metalloproteinase-2 in the invasive capacity of acute monocytic leukemia SHI-1 cells[J].
Leuk Res, 2010, 34(8): 1083-90.
DOI: 10.1016/j.leukres.2010.01.016. |
| [24] |
陈苏宁, 薛永权, 潘金兰, 等. 人急性单核细胞白血病细胞系SHI-1在裸鼠体内的高致瘤性及其机制的初步研究[J].
中国实验血液学杂志, 2007, 15(4): 683-6.
|
| [25] |
张一典, 朱国华. 丝裂原活化蛋白激酶信号通路与白血病的研究新进展[J].
白血病·淋巴瘤, 2015, 24(8): 507-9.
|
| [26] |
Zhou YY, Li Y, Jiang WQ, et al. MAPK/JNK signalling: a potential autophagy regulation pathway[J].
Biosci Rep, 2015, 35(3): e00199.
|
| [27] |
朱红青, 唐宇宏, 沈群, 等. 葛根总黄酮体外诱导人早幼粒细胞白血病细胞株NB4凋亡的实验研究[J].
南方医科大学学报, 2009, 29(12): 2547-9.
DOI: 10.3321/j.issn:1673-4254.2009.12.030. |
| [28] |
朱国华, 沈群. 姜黄素抗白血病作用及其机制的研究进展[J].
中成药, 2015, 37(10): 2251-4.
|
| [29] |
朱国华, 张琦, 沈群, 等. 姜黄素诱导Jurkat细胞凋亡时MAPKs及MMPs家族的表达[J].
南方医科大学学报, 2013, 33(12): 1792-5.
DOI: 10.3969/j.issn.1673-4254.2013.12.18. |
 2018, Vol. 38
2018, Vol. 38

