肾间质纤维化是各种肾脏病缓慢进展至终末期肾病的最后通路,而近端肾小管上皮细胞肥大、上皮间充质转分化(EMT)、炎症等损伤可能是肾脏间质纤维化病理生理过程的重要原因[1-2]。既往研究发现肾小管上皮细胞G2细胞周期阻滞与急性肾损伤发生的纤维化密切相关[3]。GSK-3β是一种丝/苏氨酸激酶,有研究称GSK- 3β抑制剂氯化锂(LiCl)可增加GSK-3β的磷酸化水平及核β-catenin的表达量,减少高糖介导的肾小球系膜细胞凋亡,进而降低糖尿病肾病(DN)大鼠的蛋白尿[4-5],发挥肾脏保护作用。此外,还有研究表明LiCl能使肾脏间质细胞发生EMT[6],促进肾间质纤维化的发生[7]。这些研究提示着LiCl在肾脏组织中发挥着双刃剑的作用,而其具体作用部位、作用方式及其机制仍充满争议。
由此,我们提出疑问,GSK-3β抑制剂LiCl对肾脏细胞到底是发挥保护还是损伤作用,对肾脏细胞的细胞周期又有什么影响?我们在既往预实验中发现,使用LiCl干预足细胞时采取的浓度20 mmol/L[8]干预人近端肾小管上皮细胞(HK-2)细胞,能使HK-2细胞发生明显的形态学改变,但是HK-2的损伤标志物如肾脏损伤因子(KIM-1)以及中性粒细胞明胶酶相关脂质运载蛋白(NGAL)的蛋白及mRNA水平均有所改善,该实验结果也暗示LiCl可能为一把双刃剑。鉴于近端肾小管上皮细胞及细胞周期在肾间质纤维化的发生发展过程中扮演的重要角色,本研究拟探讨,GSK-3β抑制剂LiCl是否能调控HK-2细胞的细胞周期,初步阐明LiCl对HK-2细胞命运的调控作用的利弊与否及其信号通路。
1 材料和方法 1.1 细胞株与实验试剂HK-2细胞株(美国ATCC细胞库);抗p-AKT单克隆抗体、抗AKT多克隆抗体、抗p-GSK-3β单克隆抗体、抗GSK-3β单克隆抗体、辣根过氧化物酶标记的抗兔IgG抗体(Cell Signaling Technology),抗β-catenin多克隆抗体(Santa Cruz),抗GAPDH多克隆抗体(Bioworld),抗cyclin B1多克隆抗体、抗CDK1多克隆抗体(万类);LiCl(sigma);Cell Counting Kit(CCK-8试剂盒,同仁);周期试剂盒(凯基);ECL检测试剂盒(Millipore)。
1.2 方法 1.2.1 培养HK-2细胞及其分组将HK-2细胞培养于含10%胎牛血清的DMEM/F12培养基中,胰酶消化后接种于培养皿或6孔板,待细胞贴壁12 h后换为含2%胎牛血清的DMEM/F12培养基使细胞同步生长。分组如下:
时间梯度:取20 mmol/L的作用于每组细胞,(1)正常组(NC);(2)12 h组;(3)24 h组;(4)48 h组;(5)72 h组。浓度梯度:(1)正常组(NC);(2)5 mmol/L组;(3)12.5 mmol/L组;(4)20 mmol/L组;(5)25 mmol/L组。每组均作用48 h。
1.2.2 细胞周期检测细胞分组及处理方法同上,消化收集细胞并用PBS洗1次(离心2000 r/min,5 min),弃去PBS,加入200 μL PBS重悬细胞,边震荡边加入2 mL 70%冰乙醇固定细胞,并至4 ℃冰箱保存过夜。用PBS洗去固定液,加入100 μL RNase A于37 ℃水浴30 min,再加入400 μL PI染色混匀,4 ℃避光30 min。随后上机检测,记录激发波长488 nm处红色荧光。
1.2.3 CCK-8检测将细胞接种于96孔板,分组如前述,每组设置5个复孔。弃上清,并用PBS洗2遍,避光条件下每孔加入事先配制好的100 μL CCK-8工作液(含90 μL DMEM-F12基础培养基与10 μL CCK-8溶液)。将96孔板放置37 ℃孵箱孵育,每隔0.5 h用酶标仪测定一次波长为450 nm的吸光度。
1.2.4 Western Blot细胞培养及干预方法同上,RIPA裂解细胞后提取细胞总蛋白。聚丙烯酰氨凝胶电泳后转膜至PVDF膜。用5%脱脂奶粉或BSA封闭1 h后,在相应一抗中4 ℃孵育过夜。吸弃一抗,TBST洗膜,然后在二抗中室温孵育1 h。TBST洗膜,随后室温下ECL显色。以GAPDH作为内参。
1.2.5 统计学方法计量数据以均数±标准差表示,多组间比较采用单因素方差分析。方差齐时,组间两两比较采用LSD法;方差不齐时,组间两两比较采用Dunnett's T3法。采用SPSS20.0统计分析软件进行数据分析。P < 0.05视为差异有统计学意义。
2 结果 2.1 流式细胞术检测LiCl对HK-2细胞周期的影响本课题组前期预实验发现LiCl预处理HK-2细胞后,HK-2细胞形态明显增大,细胞数量减少。采用流式细胞术检测细胞周期的结果提示,HK-2细胞经过时间-浓度梯度的LiCl处理后,S期和G2期细胞比例明显增多,且G2期的比例随着时间-浓度梯度增加(图 1A~D,P < 0.05)。
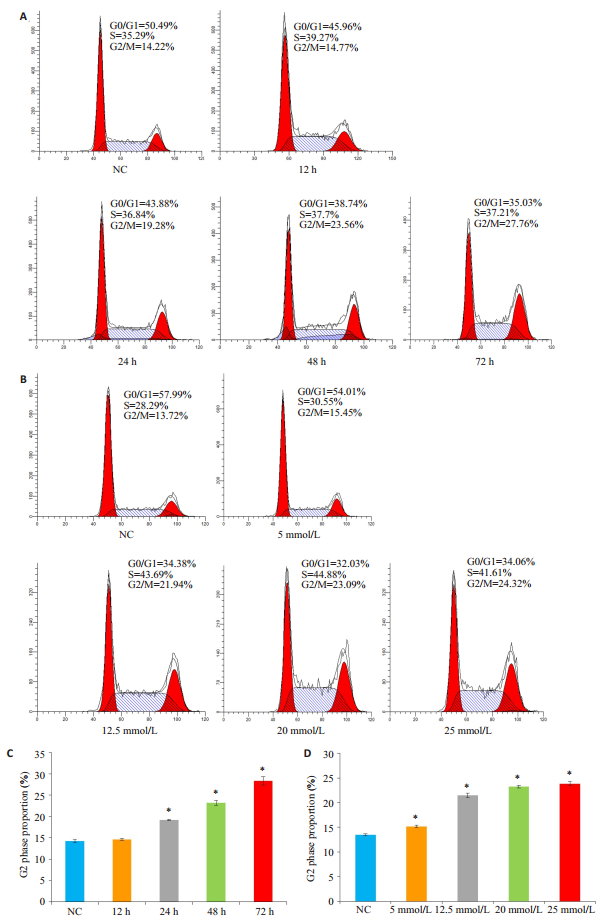
|
图 1 流式细胞术检测LiCl对HK-2细胞周期的影响 Figure 1 Flow cytometric analysis of the effect of LiCl treatment at different concentrations and for different time on HK-2 cell cycle. The results showed a time- and concentration-dependent increase in the percentages of G2 phase cells after the treatments. *P < 0.05 vs normal control (NC) group. |
Western blotting实验的结果显示,细胞从G2期进入到M期之间的关键蛋白Cyclin B1与CDK1的蛋白水平,随着LiCl作用的时间-浓度梯度的增加而减少(图 2,P < 0.05)。
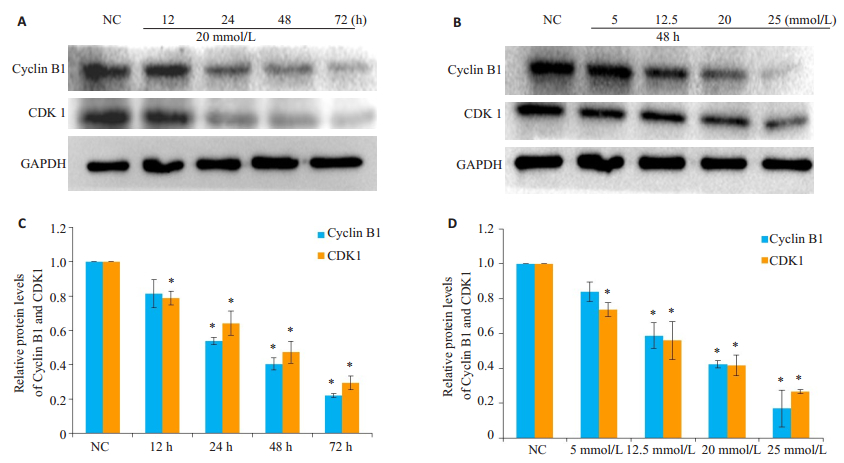
|
图 2 Western blotting检测LiCl对HK-2细胞周期的影响 Figure 2 Western blotting results of cyclin B1 and CKD1 expressions in HK-2 cells treated with LiCl at different concentrations and for different time. *P < 0.05 vs NC group. |
将不同浓度的LiCl作用HK-2细胞48 h以及将20 mmol/L浓度的LiCl分别作用12、24、48、72 h。CCK-8的结果显示,与正常组相比,LiCl能抑制HK-2细胞的活力,并呈现时间依赖(图 3A,P < 0.05)以及浓度依赖(图 3B,P < 0.05)。
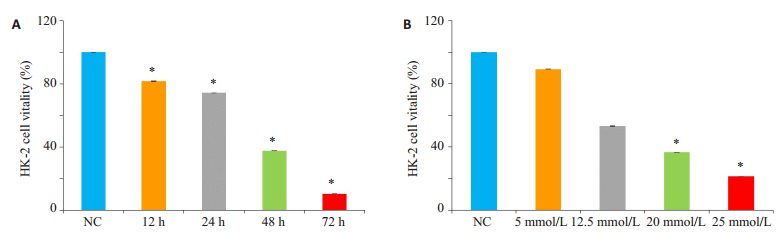
|
图 3 检测LiCl对HK-2细胞活力的影响 Figure 3 Effects of LiCl on HK-2 cell vitality. A, B: Results of CCK-8 assay of cell vitality in HK-2 cells treated with LiCl in different protocols. *P < 0.05 vs normal control (NC) group. |
AKT属于丝氨酸/苏氨酸蛋白激酶家族成员,参与多种重要细胞生物学事件的信号传导,参与促进细胞生长、维持细胞正常形态与功能[9-10]。糖原合成酶激酶3β(GSK-3β)GSK-3β是AKT的重要作用底物,可以通过磷酸化GSK-3β的丝氨酸位点从而抑制其活性[11],使得AKT/GSK-3β信号通路在生物信息的研究中受到越来越多的重视[12-13]。上述提到LiCl以时间-浓度依赖的方式使HK-2细胞的细胞G2周期比例增加,且明显降低HK-2细胞的细胞活力。为了探讨AKT/GSK-3-β信号通路是否介导了LiCl对HK-2细胞周期的影响,我们采用Western Blot实验进一步检测AKT/GSK-3β信号通路的相关蛋白在此过程中的作用。实验结果显示:AKT磷酸化水平随着LiCl刺激的时间及浓度的增加而减少,而GSK-3β蛋白磷酸化水平随着时间及浓度的增加而增加,GSK-3β蛋白的下游β-catenin蛋白也随之表现出逐渐增加的趋势(图 4,P < 0.05)
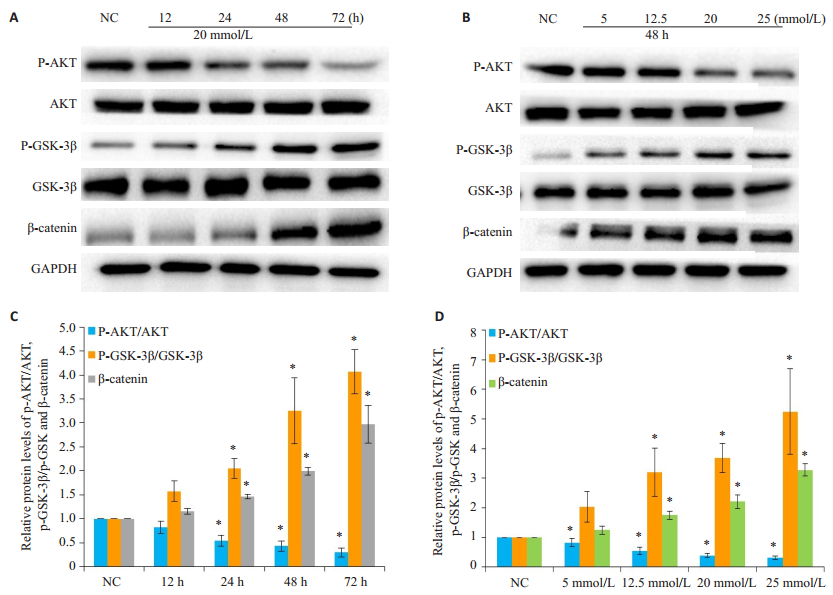
|
图 4 检测LiCl对HK-2细胞AKT/GSK-3β信号通路的影 Figure 4 Effect of LiCl on AKT/GSK-3β signal pathway in HK-2 cells. A-D: Western blotting for expressions of p-AKT, AKT, p-GSK-3β, GSK-3β, and β-catenin in HK-2 cells with different LiCl treatment protocols. *P < 0.05 vs normal control (NC) group. |
肾脏纤维化是各种慢性肾脏病包括DN进展至终末期肾脏病的最终共同通路[14],而受损的肾小管比肾小球更容易使病变进展至纤维化[15]。因此,探讨肾小管上皮细胞的病变的机制对延缓肾脏纤维化及肾脏疾病病情的进展显得尤为重要。
LiCl早期主要应用于神经、精神科,多作为治疗躁狂和抑郁症的临床药物[16-17],随着研究的多方向开展,LiCl在肾脏的作用也引起一定关注。本研究主要探讨LiCl对肾脏近端肾小管上皮细胞的影响。本研究首先发现LiCl以时间-浓度依赖的方式使HK-2细胞阻滞在G2细胞周期。主要依据有如下两点:首先,本实验采用流式细胞术发现HK-2细胞的G2期细胞比例随LiCl作用的时间-浓度的增加而增加,细胞进入分裂期(M期)受抑制,提示LiCl能将HK-2细胞阻滞在G2周期;其次,本实验的Western blotting实验结果显示,随着LiCl作用的时间或浓度梯度的增加,细胞周期中从G2期进入到M期之间的关键调控蛋白Cyclin B1与CDK1的蛋白水平表达逐渐下降,提示在G2期中,这些蛋白合成减少,使细胞缺少进入分裂期的使动关键蛋白,无法顺利进入到分裂期,即LiCl对HK-2细胞的细胞周期的影响是通过使细胞阻滞在G2周期实现的。新近研究表明Li能通过激活Wnt信号系统诱发肾脏间质细胞的EMT[6]。此外,Zhang等[18]发现,Li可通过减少AVP调节的集合管水通道中的AQP2蛋白的聚积诱发尿崩症;de Groot等[19]还发现Li能通过碳酸酐酶类效应诱发肾性尿崩症。然而,Huang等[20]的研究表明LiCl能缓解TGF-β1诱导的ARPE-19细胞发生的EMT,这些矛盾的结论使得LiCl的的作用备具争议。本研究首次提出HK-2细胞在病变过程中,其细胞周期的进程明显受LiCl影响,即LiCl表现出不利的一面,为LiCl在肾脏细胞及组织中的作用机制提出研究新方向。
CCK-8实验结果显示,随着LiCl作用于HK-2细胞的时间或浓度梯度的增加,HK-2细胞的细胞活力逐渐降低,提示LiCl可能通过阻滞细胞周期,影响细胞分裂增殖,进而影响细胞活力。近年众多研究表明各种生理病理的因素最终都会通过作用于细胞周期影响细胞结局如肥大、凋亡或增值。其中,有研究发现芹黄素能通过诱发G2期阻滞影响肾小管上皮细胞的增值;D-丝氨酸,一种新型尿毒症毒素,能使肾小管上皮细胞阻滞在G2细胞周期,最终促进肾小管间质纤维化的发生[22]。本研究首次提出LiCl可能通过阻滞HK-2细胞的G2周期,影响HK-2细胞的细胞活力及增值。
本研究Western blotting的结果显示AKT的磷酸化水平随着LiCl刺激的时间及浓度的增加而减少,而GSK-3β蛋白的磷酸化水平以及GSK-3β的下游β-catenin蛋白水平随着时间及浓度的增加而增加,提示LiCl以时间-浓度依赖的方式激活HK-2细胞中的AKT/GSK-3β信号通路。既往有学者发现LiCl能诱导原代角膜成纤维细胞的自噬水平升高以及下调细胞中TGF-β的蛋白表达[22]。更值得一提的是,LiCl是GSK-3β的经典抑制剂,大量研究认为抑制GSK-3β活性可激活Wnt/β-catenin信号通路,而Wnt/β-catenin信号通路的过度激活可促进肾脏细胞的凋亡,产生蛋白尿,导致肾脏纤维化并加重DN的病情[24-26],故而LiCl的作用机制十分具有研究价值。综上所述,本研究结果首次提示AKT/GSK-3β信号通路可能参与了LiCl诱导的HK-2细胞的G2期阻滞,揭示了LiCl作用于HK-2细胞周期的通路机制。
既往不同研究表明LiCl在肾脏组织与细胞中发挥着肾脏保护[5]与肾脏损伤[6, 19]的拮抗作用,本课题组以人近端肾小管上皮细胞HK-2细胞作为研究对象,深入从细胞周期探讨及明确LiCl对肾脏细胞的影响是积极的还是有害的,发现LiCl对HK-2细胞的作用倾向于后者。研究更是首次提出了LiCl可能通过激活AKT/ GSK-3β信号通路诱导HK-2细胞周期的G2期阻滞,进而影响细胞增殖,从新的角度提出LiCl作为GSK-3β的抑制剂,在肾脏疾病中发挥的作用机制并不是简单的利或弊,而是复杂的。
因此,本研究发现LiCl能以时间-浓度梯度依赖的方式使HK-2细胞阻滞在G2期,影响HK-2细胞的细胞活力,并提出AKT/GSK-3β信号通路参与了LiCl阻滞HK-2细胞周期的G2期,影响细胞的增值。与以往研究中提出的LiCl对肾脏纤维化具有修复作用的观点相反,本研究提出了LiCl对肾脏的肾小管上皮细胞的生长、增值是具有不利的一面,为研究LiCl对肾脏的影响提供了新的研究方向,但其更深入的双面作用机制仍有待深究与阐明。
| [1] |
Kinashi H, Falke LL, Nguyen TQ, et al. Connective tissue growth factor regulates fibrosis-associated renal lymphangiogenesis[J].
Kidney Int, 2017, 92(4): 850-63.
DOI: 10.1016/j.kint.2017.03.029. |
| [2] |
Eddy AA. Progression in chronic kidney disease[J].
Adv Chronic Kidney Dis, 2005, 12(4): 353-65.
DOI: 10.1053/j.ackd.2005.07.011. |
| [3] |
Yang L, Besschetnova TY, Brooks CR, et al. Epithelial cell cycle arrest in G2/M mediates kidney fibrosis after injury[J].
Nat Med, 2010, 16(5): U27-535.
|
| [4] |
Lin CL, Wang JY, Huang YT, et al. Wnt/beta-catenin signaling modulates survival of high glucose-stressed mesangial cells[J].
J Am Soc Nephrol, 2006, 17(10): 2812-20.
DOI: 10.1681/ASN.2005121355. |
| [5] |
Zhou YX, Shi LX, Yang H, et al. Effects of a GSK-3β inhibitor on the renal expression levels of RANK, RANKL and NF-κB in a rat model of diabetic nephropathy[J].
Exp Ther Med, 2016, 11(6): 2495-502.
DOI: 10.3892/etm.2016.3184. |
| [6] |
Price KL, Kolatsi-Joannou M, Mari C, et al. Lithium induces mesenchymal-epithelial differentiation during human kidney development by activation of the Wnt signalling system[J].
Cell Death Discovery, 2018, 4: 13.
|
| [7] |
Liu XJ, Hong Q, Wang Z, et al. MicroRNA21 promotes interstitial fibrosis via targeting DDAH1: a potential role in renal fibrosis[J].
Mol Cell Biochem, 2016, 411(1/2): 181-9.
|
| [8] |
苏晨皓. 高糖刺激对足细胞表型及GSK3β活性的影响[D]. 郑州大学, 2012.
|
| [9] |
Szymonowicz K, Oeck S, Malewicz NM, et al. New insights into protein kinase B/Akt signaling: role of localized Akt activation and Compartment-Specific target proteins for the cellular radiation response[J].
Cancers (Basel), 2018, 10(3): E78.
DOI: 10.3390/cancers10030078. |
| [10] |
Pompura SL, Dominguez-Villar M. The PI3K/AKT signaling pathway in regulatory T-cell development, stability, and function[J]. J Leukoc Biol, 2018, [Epub ahead of print].
|
| [11] |
Antoniv TT, Ivashkiv LB. Interleukin- 10- induced gene expression and suppressive function are selectively modulated by the PI3K-AktGSK3 pathway[J].
Immunology, 2011, 132(4): 567-77.
DOI: 10.1111/imm.2011.132.issue-4. |
| [12] |
Yi JH, Zhang J, Ko SY, et al. Fluoxetine inhibits natural decay of Long-Term memory via Akt/GSK-3β signaling[J]. Mol Neurobiol, 2018, [Epub ahead of print].
|
| [13] |
Wang Q, Zhang F, Hong Y. Blocking of autocrine IGF-1 reduces viability of human umbilical cord mesenchymal stem cells via inhibition of the Akt/Gsk-3β signaling pathway[J].
Mol Med Rep, 2018, 17(3): 4681-7.
|
| [14] |
Meng XM, Nikolic-Paterson DJ, Lan HY. Inflammatory processes in renal fibrosis[J].
Nat Rev Nephrol, 2014, 10(9): 493-503.
DOI: 10.1038/nrneph.2014.114. |
| [15] |
Liu P, Li F, Qiu M, et al. Expression and cellular distribution of TLR4, MyD88, and NF-κB in diabetic renal tubulointerstitial fibrosis, in vitro and in vivo[J].
Diabetes Res Clin Pract, 2014, 105(2): 206-16.
DOI: 10.1016/j.diabres.2014.04.020. |
| [16] |
Yong Y, Ding H, Fan Z, et al. Lithium fails to protect dopaminergic neurons in the 6-OHDA model of Parkinson's disease[J].
Neurochem Res, 2011, 36(3): 367-74.
DOI: 10.1007/s11064-010-0368-z. |
| [17] |
Li X, Friedman AB, Zhu W, et al. Lithium regulates glycogen synthase kinase-3beta in human peripheral blood mononuclear cells: implication in the treatment of bipolar disorder[J].
Biol Psychiatry, 2007, 61(2): 216-22.
DOI: 10.1016/j.biopsych.2006.02.027. |
| [18] |
Zhang Y, Peti-Peterdi J, Brandes AU, et al. Prasugrel suppresses development of lithium-induced nephrogenic diabetes insipidus in mice[J].
Purinergic Signal, 2017, 13(2): 239-48.
DOI: 10.1007/s11302-017-9555-6. |
| [19] |
De Groot T, Sinke AP, Kortenoeven ML, et al. Acetazolamide attenuates Lithium-Induced nephrogenic diabetes insipidus[J].
J Am Soc Nephrol, 2016, 27(7): 2082-91.
DOI: 10.1681/ASN.2015070796. |
| [20] |
Huang L, Zhang C, Su L, et al. GSK3β attenuates TGF-β1 induced epithelial-mesenchymal transition and metabolic alterations in ARPE-19 cells[J].
Biochem Biophys Res Commun, 2017, 486(3): 744-51.
DOI: 10.1016/j.bbrc.2017.03.113. |
| [21] |
Ju SM, Kang JG, Bae JS, et al. The flavonoid apigenin ameliorates Cisplatin-Induced nephrotoxicity through reduction of p53 activation and promotion of PI3K/Akt pathway in human renal proximal tubular epithelial cells[J].
Evid Based Complement Alternat Med, 2015, 2015: 186436.
|
| [22] |
Okada A, Nangaku M, Jao TM, et al. D-serine, a novel uremic toxin, induces senescence in human renal tubular cells via GCN2 activation[J].
Sci Rep, 2017, 7(1): 11168.
DOI: 10.1038/s41598-017-11049-8. |
| [23] |
Nie D, Peng Y, Li M, et al. Lithium chloride (LiCl) induced autophagy and downregulated expression of transforming growth factor β-induced protein (TGFBI) in granular corneal dystrophy[J]. Exp Eye Res, 2018, [Epub ahead of print].
|
| [24] |
Zhou L, Liu Y. Wnt/β-catenin signalling and podocyte dysfunction in proteinuric kidney disease[J].
Nat Rev Nephrol, 2015, 11(9): 535-45.
DOI: 10.1038/nrneph.2015.88. |
| [25] |
Wong DWL, Yiu WH, Chan KW, et al. Activated renal tubular Wnt/β- catenin signaling triggers renal inflammation during overload proteinuria[J]. Kidney Int, 2018, [Epub ahead of print].
|
| [26] |
Wang M, Chen DQ, Chen L, et al. Novel RAS inhibitors poricoic acid ZG and poricoic acid ZH attenuate renal fibrosis via a Wnt/β- Catenin pathway and targeted phosphorylation of smad3 signaling[J].
JAgric Food Chem, 2018, 66(8): 1828-42.
DOI: 10.1021/acs.jafc.8b00099. |
 2018, Vol. 38
2018, Vol. 38

