原发性高血压(EH)又称为高血压病,是体循环动脉压增高为特征的临床综合征。2015年全国第五次高血压调查初步数据(12个省)显示高血压患病率为27.9%[1],保守估计目前患者已超过3亿,EH现已成为我国一个严重的公共卫生问题。
近年来免疫因素在EH发病中的作用日益受到重视[2-4]。在大、小鼠等高血压动物模型上的研究表明,CD4+T淋巴细胞功能失调在EH病理改变中可能起重要的作用[5]。肾脏作为调节血压的重要器官,是高血压病较早累及的重要器官,肾脏功能的受损会进一步加重高血压病情[6]。近期研究表明[7-8],CD4+ T淋巴细胞中的亚群Th17细胞介导的免疫反应在高血压导致的肾损害中可能发挥着重要的致病作用。ICOS是Hutloff等[9]发现的CD28家族的第3个成员,优势表达在活化的T细胞表面,通过与其特异性配体ICOSL结合产生共刺激信号[10]。研究认为ICOS信号在CD4+ T细胞的增殖及功能分化等方面起关键作用[11]。并且ICOSL能在一些非淋巴细胞上诱导表达,故ICOS信号在局部的免疫应答和炎症反应中亦具有重要功能[12]。相关研究[13-17]发现ICOS信号与Th17细胞的功能密切相关。我们在前期研究[18]中亦发现高血压导致的肾损害中,ICOS介导的免疫反应可能起重要的作用。在EH发病过程中ICOS是否通过调控Th17细胞极化参与肾脏的纤维化的过程尚不明确。因此,本课题组应用高血压动物模型SHR大鼠为研究对象,采用ICOS单克隆抗体阻断干预,动态观察SHR大鼠Th17细胞分化以及肾纤维化情况,初步探究ICOS是否通过介导Th17细胞极化参与高血压肾纤维化的过程,为免疫干预EH导致的肾损害提供一定的实验依据。
1 材料和方法 1.1 实验动物4周龄SPF级雄性SHR大鼠,购自北京维通利华公司。按简单随机法将SHR大鼠分为SHR-C组及SHR-I组,分别用0.01 mol/L PBS(100 µL)、ICOS单克隆抗体(25 µg容积为100 µL)连续腹腔内注射2周。在6、10、30周龄分别进行实验观察。
1.2 主要试剂及仪器PE标记的抗大鼠IL-17A单克隆抗体、FITC标记的抗大鼠CD4单克隆抗体及相应同型对照抗体、抗大鼠ICOS、TGF-β1、IL-17A单克隆抗体(eBioscience);二步法抗兔/鼠通用型免疫组化检测试剂盒(上海基因);逆转录试剂盒、DNA聚合酶(Thermo Scientific);Trizol试剂(上海生工);Masson染色试剂盒(福州迈新);IL- 17A、TGF-β1 ELISA试剂盒(eBioscience)。XH200型恒温无创动物血压测量仪(淮北正华);Epics XL型流式细胞仪(Becton Dickinson);RM2235型切片机(Leica);PCR扩增仪(Eppendorf);高速冷冻离心机(Beckman);超净台(苏州净化);Mulitskan Ascent型酶标仪(Thermo Fisher Scientific);ChampGel 5000型凝胶摄像系统(北京赛智)。
1.3 大鼠血压的测定采用XH200型恒温无创动物血压测量仪,在大鼠清醒状态下直接测量大鼠的尾动脉收缩压,将待测大鼠放入恒温笼中露出尾巴,将加压及传感器装置置于鼠尾根部(传感器应置于尾部腹侧面),待脉搏曲线稳定后开始测量大鼠血压。当加压装置中压力逐渐下降,脉搏曲线重新出现时所对应的压力值即为大鼠尾动脉收缩压,当脉搏曲线恢复正常时所对应的压力值即为大鼠尾动脉舒张压。每只大鼠测量3次,每次间隔5 min,3次读数取平均值作为该大鼠的血压值。
1.4 大鼠脾淋巴细胞IL-17A表达检测每个流式管内加入大鼠脾淋巴细胞1×106(经PMA预先刺激4 h),流式管中加入FITC标记的抗大鼠CD4单克隆抗体(0.5 µL/管)及PE标记的抗大鼠IL-17A单克隆抗体(1.0 µL/管),并设置同型对照。加入固定/破膜工作液1 mL,旋涡震荡,重悬细胞,4℃避光孵育30 min。1200 r/min×5 min,洗2次,重悬细胞,经流式细胞仪测定细胞各种荧光强度,用CellQuest软件进行分析。
1.5 大鼠肾脏中IL-17AmRNA的表达取各期大鼠左肾组织50 mg,常规提取总RNA,按照逆转录试剂盒说明书合成cDNA。采用Primer 5.0软件设计PCR引物,以大鼠的GAPDH mRNA为内参。IL- 17A上游引物5'-CAACCTGAACATCCATAACC-3',下游引物5'-GTCGGCTCTCCATAGTCT-3',产物长度380BP。GAPDH上游引物5'-CCGTATCGG ACGCC TGGTT-3',下游引物5'-GCGGATCTCG CTCCTGGA AG-3',产物长度212BP。PCR产物应用ChampGel 5000型凝胶分析系统测量IL-17A mRNA的相对表达量。
1.6 大鼠肾脏IL-17A、TGF-β1的表达将上述各期大鼠右肾组织用4%中性甲醛溶液充分固定后进行常规脱水、包埋、连续切片(厚度为3 μm),应用二步法免疫组织化学技术对上述切片进行染色[19]。阳性判定标准为显现出境界清晰,突出于背景的棕黄色或棕褐色颗粒。每张切片随机选取5个不同视野,采用Image-Pro Plus 5.0.1图像分析系统对图像进行分析。
1.7 大鼠血浆中IL-17A、TGF-β1的表达采集上述各期大鼠血浆,按照ELISA试剂盒说明测定上述各期大鼠血浆中IL-17A和TGF-β1的水平。按照每块酶标板上的标准品的A450值绘制标准曲线,根据标准曲线计算待测样品中IL-17A和TGF-β1的含量(pg/mL)。
1.8 大鼠肾脏组织纤维化的检测取上述各时期大鼠的石蜡切片,按照Masson染色试剂盒说明书进行染色观察肾纤维化程度。胶原纤维被染为蓝色,而其他组织细胞则被染为红色,观察胶原沉积情况,选取图片上蓝色区域作为有效区域,依据1.6所述方法对图像进行分析。
1.9 统计学处理采用SPSS 13.0软件进行统计学分析,试验结果数据均以均数±标准差表示,组间比较应用单因素方差分析(One-way ANOVA),若方差齐者则采用LSD法比较两组间差异,当P < 0.05表示差异有统计学意义。
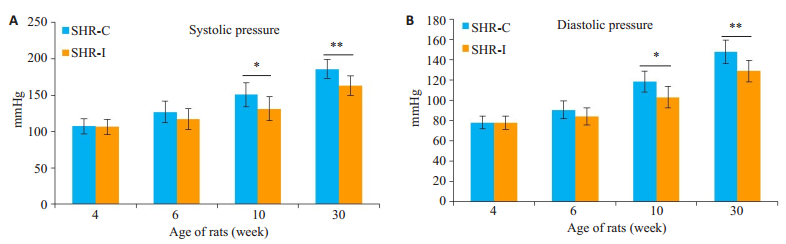
2 结果 2.1 大鼠的血压变化随着病程延长,SHR大鼠的血压逐渐升高,且SHR-C组大鼠血压高于SHR-I组大鼠,在10周龄、30周龄两者差异显著(P < 0.05或P < 0.01,图 1)。
|
图 1 SHR大鼠血压的变化 Figure 1 Changes in the blood pressure of SHR rats.A: Systolic pressure; B: Diastolic pressure; SHR-C group vs.SHR-I group, *P < 0.05, **P < 0.01. |
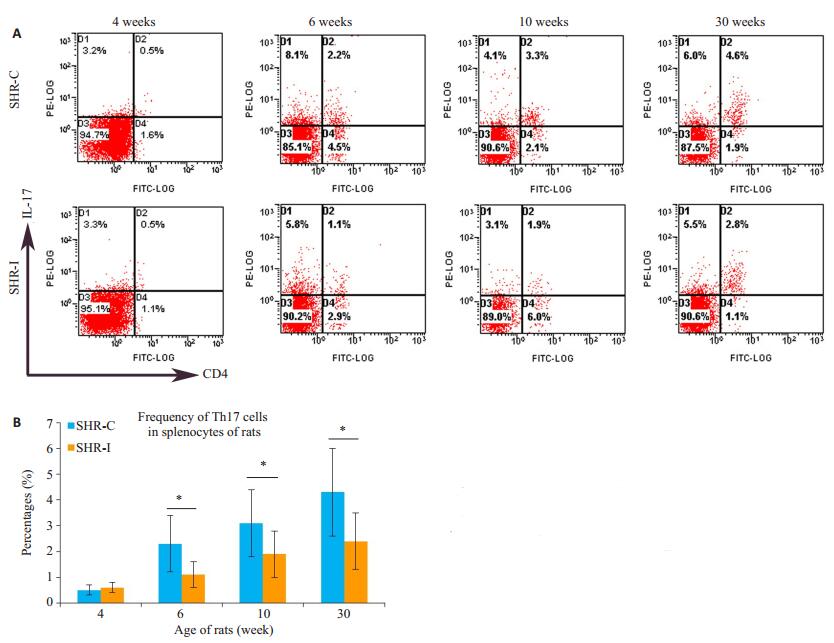
流式细胞术分析表明,随着病程延长,SHR大鼠脾淋巴细胞中Th17细胞的频数逐渐增高。且SHR-C组的水平高于SHR-I组,在6周龄、10周龄、30周龄均显著升高,两者差异有统计学意义(P < 0.05,图 2)。
|
图 2 大鼠脾淋巴细胞中Th17细胞的频数变化 Figure 2 Frequency of Th17 cells in in splenocytes of rats.A: Flow cytometry; B: Quantitative analysis of theresults, SHR-C group vs.SHR-I group, *P < 0.05. |
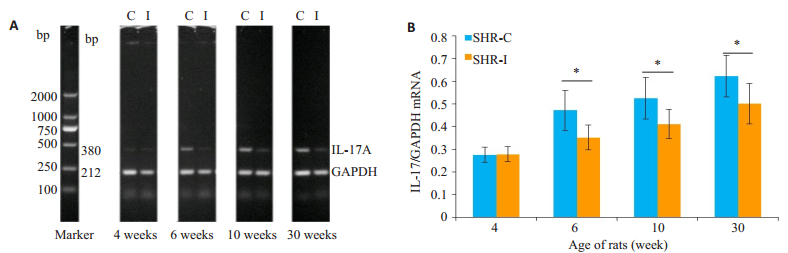
随着病程延长,SHR大鼠肾脏中IL-17A mRNA表达水平逐渐升高。但SHR-C组的水平高于SHR-I组,在6周龄、10周龄、30周龄均显著升高,两者差异有统计学意义(P < 0.05,图 3)。
|
图 3 大鼠肾脏中IL-17AmRNA的表达变化 Figure 3 Expression of IL-17A mRNA in the kidneys of the rats.A: RT-PCR; B: Quantitative analysis of the results, SHR-C group vs.SHR-I group, *P < 0.05. |
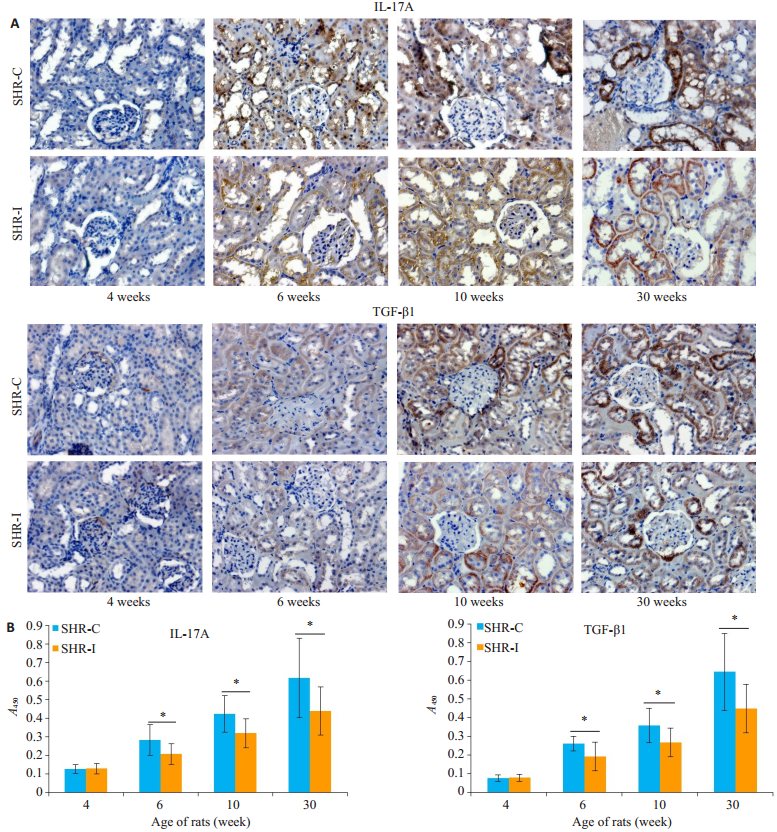
SHR-C组的大鼠肾脏中IL-17A蛋白水平高于SHR-I组,在6周龄、10周龄、30周龄(均显著升高,两者差异有统计学意义(P < 0.05);SHR-C组的大鼠肾脏中TGF-β1蛋白水平亦高于SHR-I组,在6周龄、10周龄、30周龄均显著升高,两者差异有统计学意义(P < 0.05) (图 4)。
|
图 4 大鼠肾脏中IL-17A、TGF-β1的表达水平 Figure 4 Expression of IL-17A and TGF-β1 in the kidneys of the rats.A: Immunohistochemistry (Original magnification: ×200); B: Quantitative analysis of the results.SHR-C group vs.SHR-I group, *P < 0.05. |
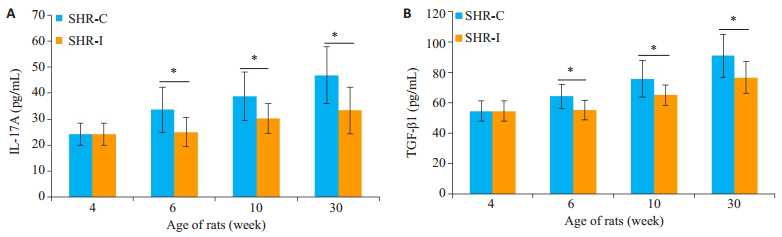
SHR-C组大鼠的血浆中IL-17A水平高于SHR-I组,在6周龄、10周龄和30周龄均显著升高,两者差异均有统计学意义(P < 0.05);SHR-C组的大鼠血浆中TGF-β1水平亦高于SHR-I组,在6周龄、10周龄和30周龄均显著升高,两者差异有统计学意义(P < 0.05,图 5)。
|
图 5 大鼠血浆IL-17A、TGF-β1表达水平 Figure 5 Expression of IL-17A and TGF-β1 in the plasma of the rats.A: IL-17A; B: TGF-β1.SHR-C group vs SHR-I group, *P < 0.05. |
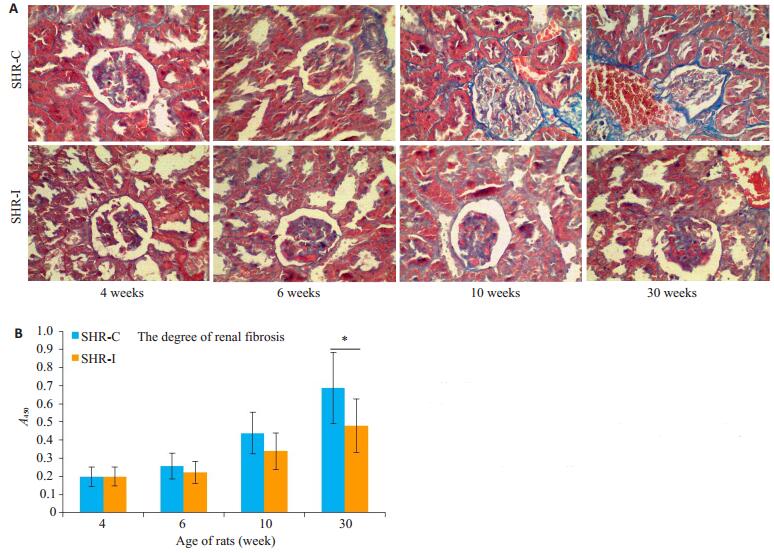
Masson染色结果显示,与SHR-C组相比,SHR-I组的大鼠肾脏纤维化水平降低,在30周龄显著降低,两者差异有统计学意义(P < 0.05,图 6)。
|
图 6 大鼠肾脏Masson染色及纤维化水平 Figure 6 Masson staining and severity of fibrosis in the kidneys of the rats.A: Masson staining (× 400); B: Quantitative analysis of the results of renal fibrosis. SHR-C group vs.SHR-I group, *P < 0.05. |
SHR大鼠是目前开展EH研究的常用动物疾病模型[20-22]。SHR大鼠的4周龄、6周龄、10周龄、30周龄相当于EH的0期、初始期、形成期、靶器官损害期。课题组在前期研究[18]中发现,SHR大鼠肾内ICOS表达动态变化与肾纤维化水平显著正相关,且肾内ICOS的表达变化与肾内和血浆中IL-17A及TGF-β1的表达水平变化趋势具有一致性。为了进一步明确高血压病程中ICOS是否通过介导Th17细胞极化参与肾纤维化,在实验研究中对4周龄SHR大鼠进行了连续2周的ICOS单克隆抗体腹腔注射,以期通过阻断ICOS信号途径来干扰Th17细胞的增殖分化,从而下调IL-17A、TGF-β1等相关致炎因子的表达,达到减轻SHR大鼠肾脏损害的目的。
实验结果显示,ICOS单克隆抗体封闭处理的SHR大鼠与对照组的SHR大鼠相比,其Th17细胞的频数显著降低,提示ICOS信号对SHR大鼠Th17细胞增殖分化起重要作用。相关研究发现Th17细胞在高血压中亦扮演着重要的角色[23-27]。Th17细胞主要通过生成IL- 17A、TGF-β1等细胞因子发挥作用的,最重要的效应因子是IL-17A[28]。Madhur等[25]发现由Ang Ⅱ诱导的高血压与Th17细胞增殖、IL-17A的生成密切相关。另有研究[26]发现注射IL-17A后C57BL/6小鼠收缩压显著性升高。醋酸去氧皮质酮-盐(DOCA-salt)诱导的高血压大鼠的Th17细胞活化与血压升高亦呈正相关,并且DOCA-salt诱导的高血压大鼠用IL-17A单克隆抗体治疗可以显著降低其血压[27]。TGF-β1既是Th17细胞的分化因子与效应因子[29],又是重要的诱导纤维化的细胞因子,TGF-β1与靶细胞膜上TGF-β1的Ⅰ型、Ⅱ型受体结合后,能激活肾间质成纤维细胞,促进成纤维细胞—肌成纤维细胞的转化[30],导致纤维连接蛋白和胶原在细胞外基质中的沉积增多,促进肾纤维化的形成[31]。在本实验中发现,应用ICOS单克隆抗体组的SHR大鼠与对照组的SHR大鼠相比,其肾内和血浆中IL-17A、TGF-β1的表达显著降低;且其血压亦显著降低的同时肾纤维化的程度也相应减轻,实验结果验证了阻断SHR大鼠体内的ICOS信号,能显著抑制Th17细胞的功能,使其主要的效应因子IL-17A、TGF-β1的表达下调,在降低SHR大鼠血压的同时亦减缓了肾纤维化的进程。实验结果提示ICOS通过调控Th17细胞极化,影响IL-17A、TGF-β1等效应因子的生成参与了肾脏纤维化的过程。
ICOS信号可以促进人Th17细胞内转录因子RORC2的表达,增加IL-21、IL-17A的分泌[14-15]。在衣原体感染中,ICOS信号在促进Th17细胞应答时部分是通过活化PI3K途径来实现的[16]。在对实验性自身免疫性脑脊髓炎动物模型的研究[17]中发现,ICOS信号不仅通过调节IL-23受体的表达和IL-17A的生成来调控Th17细胞的极化,而且还可以通过促进TFH细胞的增殖分化进而分泌大量的IL-21来调控Th17细胞的极化。至于SHR大鼠体内ICOS信号通过何种途径来调控Th17细胞的极化,则是后续研究需要进一步明确的。
综上所述,ICOS通过介导Th17细胞极化,在SHR大鼠肾纤维化进程中发挥重要作用。
| [1] |
陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2015》概要[J].
中国循环杂志, 2016, 31(6): 521-8.
|
| [2] |
Singh MV, Chapleau MW, Harwani SC, et al. The immune system and hypertension[J].
Immunol Res, 2014, 59(1/3): 243-53.
|
| [3] |
Caillon A, Schiffrin EL. Role of inflammation and immunity in hypertension: recent epidemiological, laboratory, and clinical evidence[J].
Curr Hypertens Rep, 2016, 18(3): 21.
DOI: 10.1007/s11906-016-0628-7. |
| [4] |
Carnevale D, Lembo G. Immunological aspects of hypertension[J].
High Blood Press Cardiovasc Prev, 2016, 23(2): 91-5.
DOI: 10.1007/s40292-016-0141-8. |
| [5] |
Zhang JD, Crowley SD. Role of T lymphocytes in hypertension[J].
Curr Opin Pharmacol, 2015, 21: 14-9.
DOI: 10.1016/j.coph.2014.12.003. |
| [6] |
Itani HA, Harrison DG. Memories that last in hypertension[J].
Am J Physiol Renal Physiol, 2015, 308(11): F1197-9.
DOI: 10.1152/ajprenal.00633.2014. |
| [7] |
Rodriguez-Iturbe B, Pons H, Johnson RJ. Role of the immune system in hypertension[J].
Physiol Rev, 2017, 97(3): 1127-64.
DOI: 10.1152/physrev.00031.2016. |
| [8] |
Lopez Gelston CA, Mitchell BM. Recent advances in immunity and hypertension[J].
Am J Hypertens, 2017, 30(7): 643-52.
DOI: 10.1093/ajh/hpx011. |
| [9] |
Hutloff A, Dittrich AM, Beier KC, et al. ICOS is an inducible T-cell co-stimulator structurally and functionally related to CD28[J].
Nature, 1999, 397(6716): 263-6.
DOI: 10.1038/16717. |
| [10] |
Yoshinaga SK, Whoriskey JS, Khare SD, et al. T-cell co-stimulation through B7RP-1 and ICOS[J].
Nature, 1999, 402(6763): 827-32.
DOI: 10.1038/45582. |
| [11] |
Simpson TR, Quezada SA, Allison JP. Regulation of CD4 T cell activation and effector function by inducible costimulator (ICOS)[J].
Curr Opin Immunol, 2010, 22(3): 326-32.
DOI: 10.1016/j.coi.2010.01.001. |
| [12] |
Gao X, Zhao L, Wang S, et al. Enhanced inducible costimulator ligand (ICOS-L) expression on dendritic cells in interleukin- 10 deficiency and its impact on T-cell subsets in respiratory tract infection[J].
Mol Med, 2013, 19: 346-56.
|
| [13] |
Wang B, Liang S, Wang Y, et al. Th17 down-regulation is involved in reduced progression of schistosomiasis fibrosis in ICOSL KO mice[J].
PLoS Negl Trop Dis, 2015, 9(1): e0003434.
DOI: 10.1371/journal.pntd.0003434. |
| [14] |
Vocanson M, Rozieres A, Hennino A, et al. Inducible costimulator (ICOS) is a marker for highly suppressive antigen-specific T cells sharing features of TH17/TH1 and regulatory T cells[J].
J Allergy Clin Immunol, 2010, 126(2): 280-7.
DOI: 10.1016/j.jaci.2010.05.022. |
| [15] |
Paulos CM, Carpenito C, Plesa G, et al. The inducible costimulator (ICOS) is critical for the development of human T(H)17 cells[J].
Sci Transl Med, 2010, 2(55): 55r.
|
| [16] |
Gao X, Gigoux M, Yang J, et al. Anti-chlamydial Th17 responses are controlled by the inducible costimulator partially through phosphoinositide 3-kinase signaling[J].
PLoS One, 2012, 7(12): e52657.
DOI: 10.1371/journal.pone.0052657. |
| [17] |
Bauquet AT, Jin H, Paterson AM, et al. The costimulatory molecule ICOS regulates the expression of c-Maf and IL-21 in the development of follicular T helper cells and TH-17 cells[J].
Nat Immunol, 2009, 10(2): 167-75.
DOI: 10.1038/ni.1690. |
| [18] |
钱小宝, 王瑜, 梅仁彪, 等. ICOS信号介导的免疫反应在SHR大鼠肾纤维化中作用的实验研究[J].
中国免疫学杂志, 2015, 31(12): 1610-5.
DOI: 10.3969/j.issn.1000-484X.2015.12.006. |
| [19] |
王瑜, 夏超明. 日本血吸虫感染可诱导共刺激分子配体基因敲除小鼠CD154和CD40动态变化及对Th1/Th2偏移的影响[J].
北京大学学报:医学版, 2015, 47(6): 898-904.
|
| [20] |
Attakpa ES, Bertin GA, Chabi NW, et al. Moringa oleifera-rich diet and T cell Calcium signaling in spontaneously hypertensive rats[J].
Physiol Res, 2017, 66(5): 753-67.
|
| [21] |
Rahali S, Li Y, Anand- Srivastava MB. Contribution of oxidative stress and growth factor receptor transactivation in natriuretic peptide receptor C-mediated attenuation of hyperproliferation of vascular smooth muscle cells from SHR[J].
PLoS One, 2018, 13(1): e0191743.
DOI: 10.1371/journal.pone.0191743. |
| [22] |
Almajdoob S, Hossain E, Anand-Srivastava MB. Resveratrol attenuates hyperproliferation of vascular smooth muscle cells from spontaneously hypertensive rats: Role of ROS and ROS-mediated cell signaling[J].
Vascul Pharmacol, 2018, 101(17): 48-56.
|
| [23] |
Cortvrindt C, Speeckaert R, MoermanA, et al. The role of interleukin- 17A in the pathogenesis of kidney diseases[J].
Pathology, 2017, 49(3): 247-58.
DOI: 10.1016/j.pathol.2017.01.003. |
| [24] |
Mcmaster WG, Kirabo A, Madhur MS, et al. Inflammation, immunity, and hypertensive end-organ damage[J].
Circ Res, 2015, 116(6): 1022-33.
DOI: 10.1161/CIRCRESAHA.116.303697. |
| [25] |
Madhur MS, Lob HE, Mccann LA, et al. Interleukin 17 promotes angiotensin Ⅱ-induced hypertension and vascular dysfunction[J].
Hypertension, 2010, 55(2): 500-7.
DOI: 10.1161/HYPERTENSIONAHA.109.145094. |
| [26] |
Nguyen H, Chiasson VL, Chatterjee P, et al. Interleukin-17 causes Rho- kinase-mediated endothelial dysfunction and hypertension[J].
Cardiovasc Res, 2013, 97(4): 696-704.
DOI: 10.1093/cvr/cvs422. |
| [27] |
Amador CA, Barrientos V, Peña J, et al. Spironolactone decreases DOCA-salt- induced organ damage by blocking the activation of T helper 17 and the downregulation of regulatory T lymphocytes[J].
Hypertension, 2014, 63(4): 797-803.
DOI: 10.1161/HYPERTENSIONAHA.113.02883. |
| [28] |
Park H, Li Z, Yang XO, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].
Nat Immunol, 2005, 6(11): 1133-41.
DOI: 10.1038/ni1261. |
| [29] |
Tipton AJ, Musall JB, Crislip GR, et al. Greater transforming growth factor-β in adult female SHR is dependent on blood pressure, but does not account for sex differences in renal T-regulatory cells[J].
Am J Physiol Renal Physiol, 2017, 313(4): F847-53.
DOI: 10.1152/ajprenal.00175.2017. |
| [30] |
Hills CE, Squires PE. TGF- beta 1- Induced Epithelial- to- Mesenchymal Transition and Therapeutic Intervention in Diabetic Nephropathy[J].
Am J Nephrol, 2010, 31(1): 68-74.
DOI: 10.1159/000256659. |
| [31] |
Grande MT, López-Novoa JM. Fibroblast activation and myofibroblast Generation in obstructive nephropathy[J].
Nat Rev Nephrol, 2009, 5(6): 319-28.
DOI: 10.1038/nrneph.2009.74. |
 2018, Vol. 38
2018, Vol. 38

