2. 泸州市院士工作站,四川 泸州 646000;
3. 南方医科大学 中医药学院,广东 广州 510515
2. Academician Workstation in Luzhou, Luzhou 646000, China;
3. School of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510515, China
膝关节骨性关节炎(KOA)是一种以关节软骨退行性变和关节周围骨质增生为特征的慢性退行性骨关节病[1-3],常见于中老年人,症状多为膝关节疼痛、肿胀、功能障碍,可导致关节畸形甚至残疾[4-6]。病理改变为关节软骨破坏、软骨基质减少、软骨细胞衰老及凋亡[7]。随着人口老龄化、肥胖、年龄等因素的影响,KOA在我国的发病率有明显的上升趋势,严重影响人们的健康和生活质量[8-10]。其治疗主要是延缓软骨退变、止痛、营养软骨等对症处理,尽量延缓关节置换时间[11]。如何延缓软骨细胞的衰老和凋亡是预防和治疗KOA的关键[12-13],而早期的药物干预仍是延缓关节置换时间的有效手段之一。
中药方剂在治疗KOA及缓解临床症状方面具有一定效果[14-16]。但临床运用于骨伤科的方剂大多是基于“肾主骨”理论所创,以“少阳主骨”理论为组方思想的方剂甚少[17-18],肾主骨,偏于骨之体[19]。我们对“少阳主骨”进行理论复活后重新强调了其在骨的生理作用方面的重要意义,并提出了“少阳主骨方”,前期临床运用发现其治疗KOA具有较好的疗效,但其机制尚不明确。p19Arf-p53-p21Cip1信号通路已被证实在细胞分化过程中对细胞增殖的调控起着重要作用[20-21],本研究从p19Arfp53-p21Cip1信号通路入手研究少阳主骨方对软骨细胞的调控机制,首次探究“少阳主骨方”如何调控软骨细胞增殖与退变从而延缓KOA进程,为“少阳主骨”理论及“少阳主骨方”的运用进一步提供依据。
1 材料和方法 1.1 实验动物SPF级老年雄性食蟹猴13只,年龄18~23岁;体质量6.3~6.8 kg;冠骶长0.44~0.47 m。均由云南英茂生物科技有限公司提供,实验程序经云南英茂生物科技有限公司实验动物伦理委员会审查通过,动物操作及福利按照国际实验动物饲养评估认证协会认证执行。
1.2 主要实验仪器倒置相差显微镜(Nikon,TS100,日本),组织包埋机(Leica,EG1150, 德国),石蜡切片机(Leica,德国),烤片机(Leica,RM2235,德国),超微量核酸蛋白检测仪(Eppendor,BioPhotometer plus,德国),PCR仪(Eppendor,5332,德国),离心机(Thermo,Micro17R,美国),电泳仪(Biorad,PowerPac,美国),垂直电泳槽(Biorad,MiniPROTEAN Tetra C,美国),电泳转膜仪(Biorad,TransBlot SD,美国),超低温冰箱(Kaltis,Prime,美国),化学发光成像仪(Biorad,ChemiDoc XRS+,美国)。
1.3 主要实验试剂舒泰50麻醉剂(维克,法国),伊红,苏木素染料,多聚甲醛,EDTA,二甲苯,石蜡,总RNA提取试剂盒(TIANGENB,ER501-02,北京),SYBR Premix Ex Taq Ⅱ(TaKaRa,RR820A,日本),PCR Master Mix试剂盒(TIANGEN,FP203,北京),多克隆兔抗人p19Arf、p53、p21Cip1一抗抗体及二抗抗体(BioVision,3036-100,美国),p19Arf、p53、p21Cip1及内参β-actin引物,PVDF膜,TRIZOL裂解液(Invitrogen,15596-026,美国),蛋白提取裂解液(Thermo,89821,美国),ECL发光试剂盒(Thermo,NCI4106,美国)等。
1.4 主要实验药物少阳主骨方:柴胡、法半夏、党参、甘草、黄芩、大枣、骨碎补、怀牛膝、山茱萸,由西南医科大学附属中医医院药剂科提供;氨糖美辛肠溶片(国药准字H20023171)由上海华中药业有限公司提供;生理盐水(国药准字H51021158)由四川科伦药业股份有限公司提供。
1.5 模型鉴定与分组食蟹猴纳入标准:①雄性,年龄≥18岁;②膝关节无外伤史,正常活动;③膝关节X线符合KOA影像学表现;④无感染征象。排出标准:①膝关节有外伤史或畸形,活动异常;②膝关节X线检查未见关节退变征象;③ 1月内有外伤史或感染征象;④合并其他可能影响实验的疾病。随机选取1只食蟹猴麻醉后实行安乐死,取关节软骨进行病理观察进一步明确软骨退变情况。其余12只通过随机数表法分为3组:少阳主骨方组、氨糖美辛组、生理盐水组,每组4只。食蟹猴适应性饲养1周后开始干预。
1.6 动物给药柴胡10 g、法半夏10 g、党参10 g、甘草6 g、黄芩6 g、大枣10 g、骨碎补10 g、怀牛膝6 g、山茱萸10 g,该计量为成人临床有效用药量,药物剂量和浓度按人与猴用药量比进行换算(Meeh Rubner公式)。少阳主骨方组食蟹猴以少阳主骨方汤剂灌胃,氨糖美辛组食蟹猴以氨糖美辛肠溶片溶于同体积蒸馏水灌胃,生理盐水组食蟹猴以等体积生理盐水灌胃,每日上午、下午各1次,连续8周。
1.7 标本制备与HE染色药物干预8周后麻醉下对食蟹猴实行安乐死,显露膝关节腔,生理盐水冲洗,观察关节软骨大体形态,完整切取关节软骨,置于无菌操作台上,分为两份,一份生理盐水清洗后以1.4%多聚甲醛4 ℃固定12~24 h;固定结束后以0.2 mol/L磷酸缓冲液充分漂洗备用。另一份用0 ℃无菌生理盐水反复冲洗,置入冻存管内,液氮暂存后转入-80 ℃冰箱冻存备用。
EDTA脱钙4周,石蜡包埋,做5 μm连续切片,60 ℃温箱烤片50 min→二甲苯Ⅰ 30 min→二甲苯Ⅱ 20 min→二甲苯Ⅲ10 min→常规梯度酒精→蒸馏水冲洗2 min→苏木素溶液染色5 min→自来水冲洗→盐酸乙醇分化10 s→蒸馏水冲洗→氨水返蓝2 min→蒸馏水漂洗1次→伊红溶液染色2 min→蒸馏水快速漂洗→85%乙醇急速分化3 min→95%乙醇3 min→无水乙醇2 min→二甲苯透明→中性树胶封片→光学显微镜下观察组织并采片。每个膝关节标本随机选取2张病理切片通过Mankin评分[22]评价软骨破坏程度。
1.8 RT-qPCR检测关节软骨中p19Arf、p53、p21Cip1的表达取50 mg软骨,加入1 mL TRIZOL液冰上匀浆,按试剂盒说明提取总RNA。超微量核酸蛋白检测仪测定RNA的浓度、纯度,剩余产物置于-80 ℃冰箱保存。取总RNA 1 μg参照试剂盒及相关引物说明建立反应体系,逆转录合成cDNA。SYBR Green作为荧光标记物,β-actin为内参,取1 μL cDNA进行RT-qPCR反应,重复3次独立试验,扩增反应结束后采用相对定量法2-ΔΔCt分析结果。引物由上海英骏生物技术有限公司利用AssayDesign软件合成。
p19Arf-F:5'-TCCCTCAGGCATCCCCGATT-3',62.91
p19Arf -R:5'-AGTGGGGGAAGGCGTATATCT-3',60.13;197 bp
p53-F:5'-TCTGTGACTTGCACGTACTCC-3',60
p53 -R:5'-TCCGTCATGTGCTGTGACTG-3',60.32;152 bp
p21Cip1-F:5'-AGGAGGTGAGAGAGCGGC-3',60.76
p21Cip1 -R:5'-CATGGCGCCTGCCACAG-3',61.56;154 bp
β-actin-F:5'-GATCAAGATCATTGCTCCTCCTG-3',58.93
β-actin-R:5'-GTCACAGTCCGCCTAGAAGC-3',60.46;163 bp
1.9 Western blot检测关节软骨中p19Arf、p53、p21Cip1蛋白的表达水平参照总蛋白提取试剂盒说明提取样品蛋白,BCA法测定蛋白浓度,凝胶缓冲液调节各管浓度一致。制备分离胶和浓缩胶(浓缩胶80 V,分离胶100 V),电泳。200 mA转膜2 h,脱脂奶粉封闭1 h,TBS液漂洗3次(5 min/次),将PVDF膜移至TBST平皿中,20 ℃下摇床上摇动封闭1 h。一抗和二抗4 ℃孵育过夜,TBST、TBS先后漂洗3次。每次5 min,按ECL发光试剂盒操作进行显影拍照,计算机Ouantity one-4.6.2软件分析。
1.10 数据分析实验数据资料使用SPSS17.0(IBM)统计软件进行分析,以均值±标准差进行描述,所有数据进行正态性检验,采取单因素方差分析(LSD-t检验)。检验水准为双侧α=0.05,P < 0.05为差异具有统计学意义。
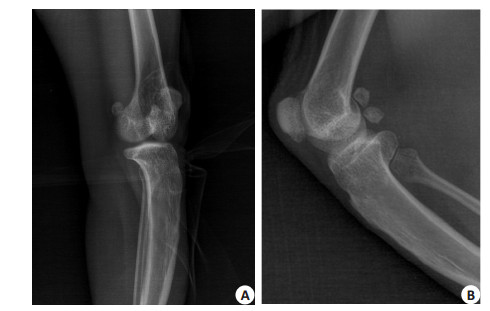
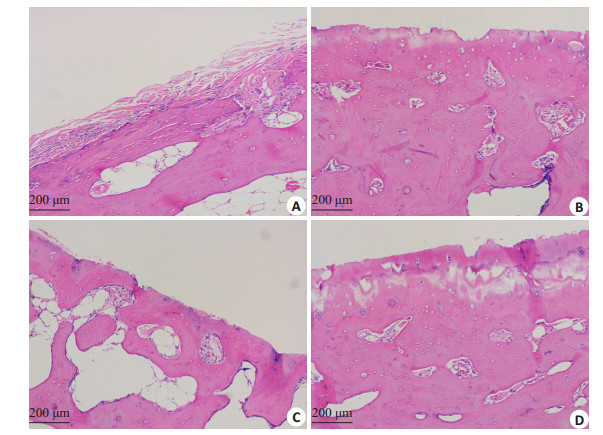
2 结果 2.1 食蟹猴膝关节X线表现及软骨HE染色膝关节X线检查见关节软骨出现退变,关节软骨变薄,关节面模糊,有不均匀骨赘增生,软骨下骨硬化,符合关节软骨退变的影像学表现(图 1);HE染色见软骨表面可见磨损,软骨层变薄,潮线模糊(图 2)。Mankin评分中,少阳主骨方组(7.38±0.52) < 氨糖美辛组(7.88± 0.83) < 生理盐水组(8.38±0.74),少阳主骨方组与生理盐水组之间差异具有统计学意义(P < 0.05)。
|
图 1 食蟹猴膝关节X片 Figure 1 Anteroposterior (A) and lateral (B) X-ray of cynomolgus monkey knee joints. |
|
图 2 关节软骨HE染色 Figure 2 HE staining of articular cartilage in cynomolgus monkeys. A: Articular cartilage in a cynomolgus monkey with naturally degenerative knee osteoarthritis (KOA); B: Articular cartilage in a cynomolgus monkey in SYZG Formula group; C: Articular cartilage in a cynomolgus monkey in ammonia moxime group; D: Articular cartilage in a cynomolgus monkey in saline group. |
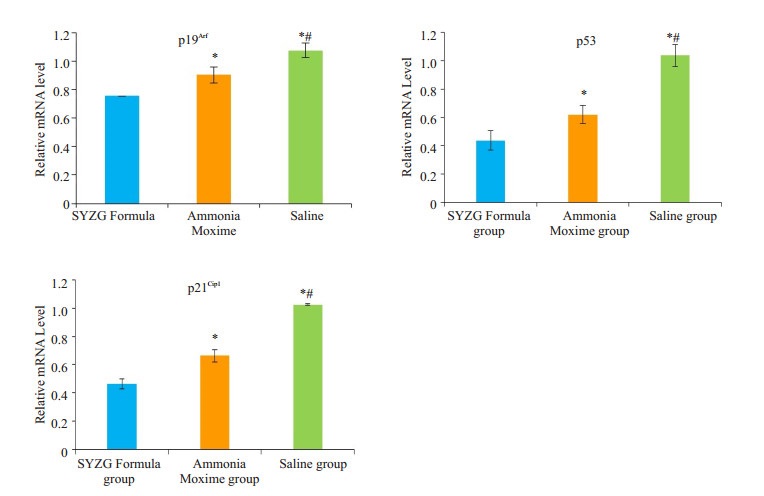
RT-qPCR检测关节软骨中p19Arf、p53、p21Cip1的mRNA相对表达量,p19Arf的表达少阳主骨方组 < 氨糖美辛组 < 生理盐水组,差异具有统计学意义(P < 0.05);p53的表达少阳主骨方组 < 氨糖美辛组 < 生理盐水组,差异具有统计学意义(P < 0.05);p21Cip1的表达少阳主骨方组 < 氨糖美辛组 < 生理盐水组,差异具有统计学意义(P < 0.05)(图 3)。
|
图 3 p19Arf、p53、p21Cip1mRNA相对表达量 Figure 3 Relative expressions of p19Arf, p53, and p21Cip1 mRNA in the 3 groups. *P < 0.05 vs. SYZG Formula group; #P < 0.05 vs. Ammonia Moxime group. |
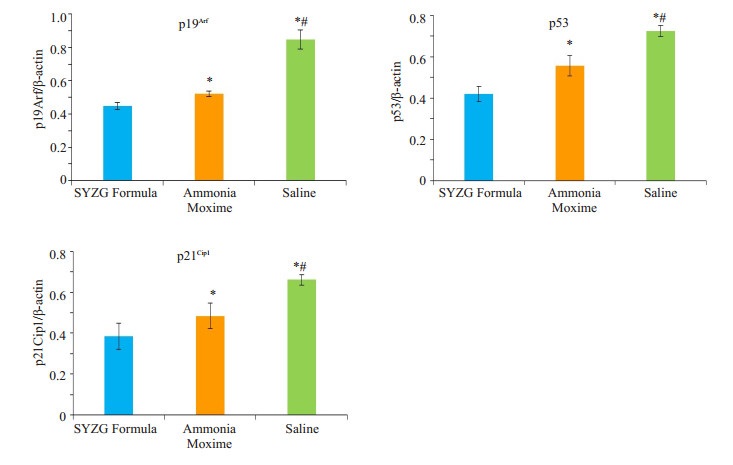
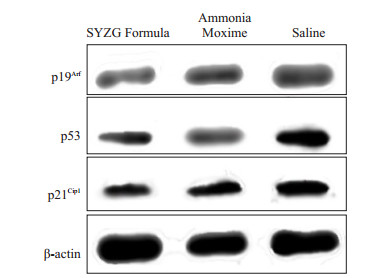
β-actin作为内参基因,Western-blot检测关节软骨中p19Arf、p53、p21Cip1在蛋白水平的表达量,p19Arf的表达少阳主骨方组 < 氨糖美辛组 < 生理盐水组,具有统计学差异(P < 0.05);p53的表达少阳主骨方组 < 氨糖美辛组 < 生理盐水组,具有统计学差异(P < 0.05);p21Cip1的表达少阳主骨方组 < 氨糖美辛组 < 生理盐水组,具有统计学差异(P < 0.05,图 4、5)。
|
图 4 p19Arf、p53、p21Cip1蛋白相对表达量 Figure 4 Relative expressions of p19Arf, p53, and p21Cip1 proteins in the 3 groups. *P < 0.05 vs. SYZG Formula group; #P < 0.05 vs. Ammonia Moxime group. |
|
图 5 蛋白印记图 Figure 5 Protein immunoblotting of p19Arf, p53, and p21Cip1 in the articular cartilage in the 3 groups. |
“少阳主骨方”以“少阳主骨”为理论指导,小柴胡汤为基础加减而来,由柴胡、法半夏、党参、甘草、黄芩、大枣、骨碎补、怀牛膝、山茱萸组成。通过在小柴胡汤基础上加用怀牛膝、骨碎补、山茱萸。怀牛膝具有补肝肾、强筋骨之效,又善引火下行;骨碎补善走肝肾,可活血续伤、补肾强骨;山茱萸补益肝肾、收敛固涩;诸药合用使全方温而不燥、补而不滞、标本兼治,药物之间各奏其功效又相辅相成,构成一个有机整体,具有和解少阳、强筋健骨之效。KOA属中医“骨痹”范畴,病理表现主要为关节软骨不可逆地进行性破坏,病理核心变化是软骨细胞衰老、退变、凋亡。“少阳主骨”理论始见于《灵枢·经脉》 [18],记载足少阳之脉“主骨所生病”,《素问·热论》曰:“少阳主骨”。中医理论中关于骨的生理病理描述有“肾主骨”与“少阳主骨”两种观点。前者重于藏象,后者偏于经脉。肾为先天之本,肾主骨偏于骨之体,即物质基础;而“少阳主骨”更多的是强调“骨之用”,包括了骨强度及骨代谢等方面,少阳主骨理论已在临床骨科得到一定应用,并取得一定效果[23-24]。
本文首次研究了少阳主骨方对软骨组织中p19Arfp53-p21Cip1信号通路的影响,运用RT-qPCR与Western blot从分子生物学水平验证了少阳主骨方延缓软骨细胞退变的作用。结果显示,少阳主骨方可以可以通过p19Arf-p53-p21Cip1信号通路下调p19Arf、p53、p21Cip1的表达,从而促进软骨细胞的增殖,延缓关节软骨退变,这可能是其治疗KOA的分子机制之一。但是从关节软骨Mankin评分中发现少阳主骨方组 < 氨糖美辛组 < 生理盐水组,一方面说明关节软骨的破坏呈进行性,药物干预只能在一定程度上延缓其退变的速度,并不能使其逆转;另一方面说明药物的干预在治疗中是有效的,本研究中少阳主骨方作用较强,并且与生理盐水组差异具有统计学意义,虽然在统计学上发现其与氨糖美辛差异无统计学意义,但是其在延缓关节软骨退变的作用仍强与氨糖美辛,并且中药汤剂的胃肠道刺激相对较氨糖美辛弱,对于需长期服药的KOA患者相对容易接受。
p19Arf-p53-p21Cip1信号通路在细胞分化过程中对细胞增殖的调控起着重要作用[20-21],而细胞周期的调控是p16和p19Arf共同作用的结果[25],p21Cip1是p53的直接靶点,而p53可导致细胞周期停滞或者细胞凋亡[26]。p21Cip1是引起G1期阻滞的直接原因[14],对阻滞细胞进入S期起着重要作用[27]。几种抑癌基因彼此相互作用,共同调控细胞周期,通过抑制相关基因表达可能是延缓关节软骨退变和软骨细胞衰老的重要机制。p53在细胞浆中可以通过泛素-蛋白酶体通路降解(MDM2),当MDM2/p53复合物由细胞核进入细胞浆时,p53发生降解而MDM2返回细胞核,故细胞核输出MDM2对p53的降解非常重要[28-29],通过形成p53/MDM2自身反馈调节循环[30],使p53保持低水平。p19Arf蛋白可以结合并抑制MDM2的活性,从而参与到P53途径[31],p19Arf的表达可阻抑MDM2往返于细胞核-胞质,p19Arf通过拖拽MDM2来增加p53的表达。当不同原因导致DNA损伤后,p19Arf表达上调,抑制MDM2活性,激活p53,而p53的激活可以诱导下游p21Cip1的表达,使细胞阻滞于G1期,引起细胞衰老[32-33]。也有研究发现p21Cip1在应激状态下直接使细胞生长停滞,但具体机制尚不明确[34]。
类似研究也表明了p19Arf-p53-p21Cip1信号通路在细胞衰老中的重要作用,付妮妮等[35]通过毫针深刺加电针对兔膝骨关节炎模型干预后发现其可以降低p53表达,减少软骨细胞凋亡,体外实验也发现p53表达下调可以防止软骨细胞凋亡或衰老[36]。此外,在正常人与KOA患者比较中发现p53的表达量随着KOA的严重程度增加,二者呈正相关性[37]。补肾壮筋汤对SD大鼠关节软骨细胞体外干预后发现补肾壮筋汤可以下调p21Cip1表达,从而促进软骨细胞增殖能力[38]。研究也发现p21Cip1除OA软骨外还在OA的滑膜组织中高表达[39]。在其他组织细胞中也有类似情况,通过对人胚肺二倍体成纤维细胞测序研究发现p21Cip1表达在细胞衰老时显著上升,但在整个细胞周期具有一定波动,其去甲基化可以加速细胞衰老[40]。而目前关于p19Arf在细胞衰老中的确切机制了解相对较少,p19Arf基因转染后的WI-38细胞生长明显减慢,细胞周期在G1期停滞,在一定程度上说明了p19Arf的过度表达会加速细胞衰老,同时会使p53、p21Cip1表达增加[41]。从上述研究中我们可以发现在细胞衰老过程中p19Arf、p53、p21Cip1表达均增高,但是p21Cip1的变化具有一定波动,何种原因引起尚不明确。这些研究结果与本研究在一定程度上具有一致性,p19Arf、p53、p21Cip1在KOA病变过程中表达增高,通过针灸、药物等治疗方式可在一定程度上降低其表达,从而延缓软骨细胞衰老、退变。少阳主骨方立足传统中医经典理论,从现代分子生物学水平证实了其对延缓关节软骨退变的机制,但是由于化学成分复杂,具体效应分子作用仍需要进一步研究。
| [1] |
Davis J, Eaton CB, Lo GH, et al. Knee symptoms among adults at risk for accelerated knee osteoarthritis: data from the osteoarthritis Initiative[J].
Clin Rheumatol, 2017, 36(5): 1083-9.
DOI: 10.1007/s10067-017-3564-2. |
| [2] |
Kidwai SS, Siddiqi SA, Nazir L, et al. Relationship of anthropometric measures with knee osteoarthritis in diabetes mellitus[J].
Pak J Med Sci, 2016, 32(5): 1077-81.
|
| [3] |
Barreto A, Braun TR. A new treatment for knee osteoarthritis: Clinical evidence for the efficacy of Arthrokinex TM autologous conditioned serum[J].
J Orthop, 2016, 14(1): 4-9.
|
| [4] |
Atukorala I, Makovey J, Lawler L, et al. Is there a Dose-Response relationship between weight loss and symptom improvement in persons with knee osteoarthritis[J].
Arthritis Care Res (Hoboken), 2016, 68(8): 1106-14.
DOI: 10.1002/acr.22805. |
| [5] |
Yao N, Chen N, Xu X, et al. Protective effect of Shenmai injection on knee articular cartilage of osteoarthritic rabbits and IL-1β-stimulated human chondrocytes[J].
Exp Ther Med, 2017, 13(6): 3013-20.
DOI: 10.3892/etm.2017.4349. |
| [6] |
余波, 冯能, 祁奇, 等. 肌内效贴短期缓解膝关节骨性关节炎症状的疗效研究[J].
中国康复医学杂志, 2012, 27(1): 56-8.
|
| [7] |
Henricsdotter C, Ellegaard K, Klokker L, et al. Changes in ultrasound assessed markers of inflammation following intraarticular steroid injection combined with exercise in knee osteoarthritis: exploratory outcome from a randomized trial[J].
Osteoarthritis Cartilage, 2016, 24(5): 814-21.
DOI: 10.1016/j.joca.2015.12.010. |
| [8] |
Deng ZH, Sun MH, Li YS, et al. Single nucleotide polymorphisms in the CD40 gene associated with the disease susceptibility and severity in knee osteoarthritis in the Chinese Han population: a casecontrol study[J].
BMC Musculoskelet Disord, 2017, 18(1): 115.
DOI: 10.1186/s12891-017-1466-8. |
| [9] |
Driban JB, Price LL, Eaton CB, et al. Individuals with incident accelerated knee osteoarthritis have greater pain than those with common knee osteoarthritis progression: data from the Osteoarthritis Initiative[J].
Clin Rheumatol, 2016, 35(6): 1565-71.
DOI: 10.1007/s10067-015-3128-2. |
| [10] |
付慕勇, 张智龙. 辨证取穴针刺治疗膝关节骨性关节炎:随机对照研究[J].
世界针灸杂志, 2011, 31(12): 1062-6.
|
| [11] |
Xu Q, Chen B, Wang Y, et al. The effectiveness of manual therapy for relieving pain, stiffness, and dysfunction in knee osteoarthritis: a systematic review and Meta-analysis[J].
Pain Physician, 2017, 20(4): 229-43.
|
| [12] |
Matsushita T, Tanaka T. Aging and homeostasis. Aging of articular cartilage and chondrocytes[J].
Clin Calcium, 2017, 27(7): 933-9.
|
| [13] |
Mcculloch K, Litherland GJ, Rai TS. Cellular senescence in osteoarthritis pathology[J].
Aging Cell, 2017, 16(2): 210-8.
DOI: 10.1111/acel.12562. |
| [14] |
Zhang W, Wang S, Zhang R, et al. Evidence of Chinese herbal medicine Duhuo Jisheng decoction for knee osteoarthritis: a systematic review of randomised clinical trials[J].
BMJ Open, 2016, 6(1): e008973.
DOI: 10.1136/bmjopen-2015-008973. |
| [15] |
Cao XW, Guo D, Liu JW, et al. The efficacy and safety of the Shaoyao Shujin tablet for knee osteoarthritis: study protocol for a randomized controlled trial[J].
Trials, 2016, 17(1): 3.
DOI: 10.1186/s13063-015-1121-3. |
| [16] |
Zhu L, Yang S, Wang S, et al. Effectiveness and safety of manufactured Chinese herbal formula for knee osteoarthritis: insights from a systematic review[J].
Evid Based Complement Alternat Med, 2015, 2015(9): 328642.
|
| [17] |
王鸿度, 张丰正, 游慧, 等. 少阳主骨"理论考辨[J].
中国针灸, 2008, 28(6): 469-71.
|
| [18] |
范薇, 杨剑, 夏丽娜, 等. 《黄帝内经》"少阳主骨"中医机理探析[J].
中国中医基础医学杂志, 2016, 22(5): 590-1.
|
| [19] |
Chang S, Shan X, Li X, et al. Toxoplasma gondii Rhoptry Protein ROP16 Mediates Partially SH-SY5Y Cells Apoptosis and Cell Cycle Arrest by Directing Ser15/37 Phosphorylation of p53[J].
Int J Biol Sci, 2015, 11(10): 1215-25.
DOI: 10.7150/ijbs.10516. |
| [20] |
廉亚茹, 刘新华, 韩苗, 等. p38-p53-p21信号通路参与调控血管紧张素-Ⅱ诱导的人血管平滑肌细胞衰老[J].
复旦学报:自然科学版, 2015, 54(6): 768-77, 785.
|
| [21] |
郑文婕, 童坦君, 张宗玉. 细胞衰老的重要通路: p16INK4a/Rb和p19ARF/p53/p21Cip1信号途径[J].
生命的化学, 2002, 22(4): 314-6.
|
| [22] |
Rohrbach D, Inkinen SI, Zatloukalová J, et al. Regular chondrocyte spacing is a potential cause for coherent ultrasound backscatter in human articular cartilage[J].
J Acoust Soc Am, 2017, 141(5): 3105.
DOI: 10.1121/1.4979339. |
| [23] |
范薇, 杨剑, 夏丽娜. 从"少阳主骨"看少阳对骨之作用机制[J].
时珍国医国药, 2016, 252(8): 1955-6.
|
| [24] |
王鸿度, 扶世杰, 陈庄, 等. 电针足少阳经穴对去卵巢大鼠骨质疏松的作用[J].
中医杂志, 2011, 52(4): 322-5.
|
| [25] |
Molofsky AV, He S, Bydon M, et al. Bmi-1 promotes neural stem cell self-renewal and neural development but not mouse growth and survival by repressing the p16Ink4a and p19Arf senescence pathways[J].
Genes Dev, 2005, 19(12): 1432-7.
DOI: 10.1101/gad.1299505. |
| [26] |
Llanos S, Clark PA, Rowe J, et al. Stabilization of p53 by p14ARF without relocation of MDM2 to the nucleolus[J].
Nat Cell Biol, 2001, 3(5): 445-52.
DOI: 10.1038/35074506. |
| [27] |
刘品月, 晋贞超, 邓小兰, 等. 自然衰老过程中小鼠海马神经发生的改变[J].
中国组织工程研究, 2016, 20(11): 1564-9.
DOI: 10.3969/j.issn.2095-4344.2016.11.007. |
| [28] |
扬帆, 钟源, 江学庆, 等. 微小RNA-339-5p通过靶向鼠双微体基因调节乳腺癌MCF-7细胞p53肿瘤抑制通路的研究[J].
中华实验外科杂志, 2016, 33(5): 1213-7.
|
| [29] |
Zhang Y, Zeng SX, Hao Q, et al. Monitoring p53 by MDM2 and MDMX is required for endocrine pancreas development and function in a spatio-temporal manner[J].
Dev Biol, 2017, 423(1): 34-45.
DOI: 10.1016/j.ydbio.2017.01.014. |
| [30] |
Røtterud R, Berner A, Holm R, et al. p53, p21 and mdm2 expression vs the response to radiotherapy in transitional cell carcinoma of the bladder[J].
BJU Int, 2001, 88(3): 202-8.
DOI: 10.1046/j.1464-410x.2001.02268.x. |
| [31] |
Kamijo T, Zindy F, Roussel MF, et al. Tumor suppression at the mouse INK4a locus mediated by the alternative reading frame product p19ARF[J].
Cell, 1997, 91(5): 649-59.
DOI: 10.1016/S0092-8674(00)80452-3. |
| [32] |
赵欢, 周斌. 细胞衰老研究现状[J].
中国细胞生物学学报, 2017, 39(6): 687-94.
DOI: 10.11844/cjcb.2017.06.9002. |
| [33] |
Xiong Y, Hannon GJ, Zhang H, et al. p21 is a universal inhibitor of cyclin kinases[J].
Nature, 1993, 366(6456): 701-4.
DOI: 10.1038/366701a0. |
| [34] |
Beauséjour CM, Krtolica A, Galimi F, et al. Reversal of human cellular senescence: roles of the p53 and p16 pathways[J].
EMBO J, 2003, 22(16): 4212-22.
DOI: 10.1093/emboj/cdg417. |
| [35] |
付妮妮, 李学智, 刘菲, 等. 深刺加电针对兔膝骨关节炎软骨的影响[J].
中国康复理论与实践, 2016, 22(1): 38-45.
|
| [36] |
Hashimoto S, Nishiyama T, Hayashi S, et al. Role of p53 in human chondrocyte apoptosis in response to shear strain[J].
Arthritis Rheum, 2009, 60(8): 2340-9.
DOI: 10.1002/art.v60:8. |
| [37] |
Zhu X, Yang S, Lin W, et al. Roles of cell cyle regulators cyclin D1, CDK4, and p53 in knee osteoarthritis[J].
Genet Test Mol Biomarkers, 2016, 20(9): 529-34.
DOI: 10.1089/gtmb.2016.0020. |
| [38] |
Li X, Chen J, Liang W, et al. Bushen zhuangjin decoction promotes chondrocyte proliferation by stimulating cell cycle progression[J].
Exp Ther Med, 2015, 9(3): 839-44.
DOI: 10.3892/etm.2015.2214. |
| [39] |
Masson AO, Hess R, O'brien K, et al. Increased levels of p21CIP1/ WAF1 correlate with decreased chondrogenic differentiation potential in synovial membrane progenitor cells[J].
Mech Ageing Dev, 2015, 149(149): 31-40.
|
| [40] |
张爱红, 郑全辉, 郑茗予, 等. p21Waf1/Cip1甲基化调控细胞衰老[J].
重庆医学, 2015, 44(8): 1035-8.
|
| [41] |
白雪源, 陈香美, 侯剀, 等. 细胞周期抑制因子p19ARF对人二倍体细胞衰老的影响[J].
中国科学C辑, 2007, 37(1): 15-9.
|
 2018, Vol. 38
2018, Vol. 38

