2. 南方医科大学口腔医院,广东 广州 510280;
3. 深圳市龙华新区中心医院口腔科,广东 深圳 518110
2. Stomatological Hospital, Southern Medical University, Guangzhou 510280, China;
3. Department of Stomatology, Longhua New District Central Hospital, Shenzhen 518110, China
变异链球菌(S. mutans)在龋病的发生发展中起重要的作用,其致龋性除与对牙面的粘附作用有关外,还与产酸性和耐酸性密切相关。关于S. mutans粘附性和产酸性的分子机制己很清晰,而对于其耐酸性的机制尤其是分子机制的研究不多[1]。耐酸性是细菌适应牙菌斑动态变化酸性环境关键的生存机制[2]。随着现代分子生物学技术的发展,越来越多的与S. mutans耐酸性相关的基因及其相关蛋白被发现。
乙酰化修饰是蛋白质重要的翻译后修饰类型之一,和蛋白质的磷酸化修饰一样,在生物体内是重要而且广泛存在的[3],如参与细胞信号传导、物质的代谢、蛋白质的降解、致病微生物的致病过程等。细胞的许多生理功能,例如细胞对外界环境的应答,也是通过动态的蛋白质翻译后修饰来实现的[4]。乙酰化修饰与细菌作用相关[5]。乙酰基转移酶对细菌形态,代谢和应激反应具有重要作用[6-7]。
S. mutans中SMU.2055蛋白被认为是假想的乙酰基转移酶[8],对其性质进行预测,发现其理论等电点为7.74,碱基对为489个,含有163个氨基酸残基。这类酶的主要作用是将乙酰辅酶A(AcCoA)上的乙酰基转移给底物上的氨基,选择性乙酰化4~5个氨基之一。有学者[9]发现赖氨酸的乙酰化能够促使大肠杆菌抵御不同环境的刺激,乙酰基转移酶YfiQ的提高,不仅会导致细胞浓度的增加,而且能够提高大肠杆菌抗热和抗氧化的应激能力。研究表明调节蛋白质乙酰化状态可以影响细胞壁的结构和通透性,影响细菌形态和生物膜的形成[10-11]。前期我们已通过基因克隆,蛋白质纯化,晶体筛选,解析了SMU.2055蛋白的三维晶体结构[12],该结构被收录于PDB(protein data bank),编号为3LD2。随后我们运用计算机辅助药物设计方法,设计并筛选出5个与SMU.2055蛋白结构匹配度高的小分子化合物,建立了S. mutans UA159蛋白抑制剂虚拟筛选模型,旨在通过小分子抑制剂改变S. mutans致龋性[8]。然而,目前国内外对于SMU.2055基因功能的研究尚且缺乏。我们探讨了该基因对S. mutans的形态及与致龋性相关的生物学特性的影响,结果显示,经预酸化处理,酸冲击,SMU.2055基因缺陷菌株在酸性条件下的生长受到明显的抑制,耐酸性降低[13]。SMU.2055基因缺陷菌株细胞膜完整性及不规则物质的形成均受到影响[13]。细胞膜的完整性受到影响将降低细胞的耐酸能力[14-15]。我们推测,SMU.2055基因与S. mutans的耐酸性密切相关。本研究拟通过观察SMU.2055基因缺陷菌株耐酸性的变化以及可能影响其耐酸性的因素,探讨SMU.2055基因在S. mutans耐酸性中发挥的作用,探究SMU.2055基因功能,对寻找龋病防治的有效靶标具有重要意义。
1 材料和方法 1.1 菌株及培养条件S. mutans UA159(北京大学口腔医学院中心实验室提供)采用脑心浸液(brain heart infusion, BHI)培养基(青岛海博生物技术有限公司)培养。SMU.2055基因缺陷菌株采用含1 mg/mL壮观霉素(spectinomycin, spe)(Sigma,美国)选择性BHI培养基培养。菌株的培养条件均为37 ℃、静置厌氧培养(10% CO2、10% H2、80% N2)。大肠杆菌(E.coli)DH5α[天根生化科技(北京)有限公司]采用Luria-Bertani(LB)培养基(青岛海博生物技术有限公司)培养,选择性LB培养基采用含0.1 mg/mL spe抗性培养基。E. coli的培养条件为37 ℃、200 r/min振荡需氧培养。
1.2 SMU.2055基因缺陷菌株的构建依据S. mutans UA159全基因组序列,利用Primer Premier 5.0软件设计SMU.2055基因上下游引物,具体见表 1。
| 表 1 SMU.2055基因缺陷菌株构建所用引物序列 Table 1 Sequences of primers for constructing SMU.2055-deficient mutant |
采用聚合酶链反应(PCR)扩增SMU.2055基因的上、下游片段,使用限制性内切酶BamHⅠ和HindⅢ经双酶切后与pFW5质粒(第四军医大学口腔医学院余擎教授惠赠)进行连接,使用E. coli DH5α感受态细胞进行转化。利用选择性LB培养基筛选阳性克隆,提取阳性克隆的质粒进行测序鉴定。将构建成功的SMU.2055基因缺陷重组质粒转化入S. mutans。使用1 μg/mL的感受态刺激肽(CSP, 上海生工生物工程股份有限公司合成)对野生型S. mutans UA159进行刺激,两者混合后进行自然转化[16]。利用选择性BHI培养基筛选阳性克隆,提取阳性克隆的基因组DNA进行PCR及测序鉴定。
1.3 SMU.2055基因缺陷菌株在不同pH条件下生长能力的检测S. mutans UA159及SMU.2055基因缺陷菌株过夜培养后,调节菌液A600≈0.8,按1: 100比例分别加入BHI液体培养基中(pH值为7.5或5.5),37 ℃厌氧培养24 h,每隔1 h测量菌液A600值,绘制生长曲线[17]。
1.4 SMU.2055基因缺陷菌株致死性pH值的检测以0.5为间隔配制pH值为2.5~7.0的BHI液体培养基。取对数中期菌液转入不同pH值的BHI培养基中,厌氧培养3 h后取样,稀释,涂板,48 h后计数活菌数。无细菌存活的最高pH值即为该菌的致死性pH值[18]。
1.5 SMU.2055基因缺陷菌株糖酵解能力的检测S. mutans UA159和SMU.2055基因缺陷菌株培养至静止早期,重悬于50 mmol/L KCl,l mmol/L MgCl2溶液中,调整A600至相同。KOH滴定至pH7.2以上,加葡萄糖至终浓度为1%,每隔2 min检测菌液pH值,连续监测30 min。pH所能达到的最低值为糖酵解最低pH值[19-20]。
1.6 SMU.2055基因缺陷菌株细胞通透性检测S. mutans UA159和SMU.2055基因缺陷菌株过夜培养后,取25 mL重悬在2.5 mL Tris-HCl缓冲液中(75 mmol/L,pH7.0,含有10 mmol/L MgSO4)。加入250 μL甲苯,37 ℃孵育5 min,冻融,重悬,根据BCA蛋白浓度测定试剂盒使用说明书检测蛋白浓度[21]。
1.7 SMU.2055基因缺陷菌株质子通透性检测S. mutans UA159和SMU.2055基因缺陷菌株过夜培养,重悬于PBS缓冲液,孵育2 h。离心,重悬于50 mmol/L KCl、1 mmol/L MgCl2溶液中至浓度达到20 mg/mL。调节pH至4.7以下,每10 min测量菌液pH值,在50 min时加入终浓度为10%的丁醇,破坏细胞膜,允许细胞内外的pH达到平衡,80 min时记录最终pH [22]。
1.8 SMU.2055基因缺陷菌株不同pH条件下H+-ATPase活性检测将制备好的通透细胞(pH值为7.5或5.5)重悬于75 mmol/L Tirs-HCl缓冲液(pH7.0,含10 mmol/L MgSO4)。取3 mL菌液,以同样的缓冲液为空白对照,测菌液A600。依据细胞干重与吸光度的关系曲线,推算出菌液浓度。根据H+/K+-ATP酶测定试剂盒使用说明书进行酶促反应,定磷[1]。以每小时每毫克干重菌体的ATP酶分解ATP产生1 μmoL无机磷的量为一个ATP酶活力单位,计算出H+-ATPase活性。
1.9 SMU.2055基因缺陷菌株不同pH条件下生物膜形成情况的观察S. mutans UA159和SMU.2055基因缺陷菌株过夜培养后,按1:100加入BHI液体培养基(pH值为7.5或5.5),取5 mL,分别转移至已放置无菌盖玻片的六孔板中,培养24 h,将游离的菌液吸除,洗涤,干燥,每孔加入200 μL使用浓度的SYTO9染色液,室温下避光孵育15 min。去除染色液,使用激光共聚焦显微镜在488 nm处对两菌株形成的生物膜进行观察,随机选择5个视野进行拍照[17]。
实验均重复3次,采用SPSS 20.0软件进行两独立样本t检验,检验水准为α=0.05。
2 结果 2.1 SMU.2055基因缺陷菌株的鉴定SMU.2055基因缺陷菌株PCR扩增的片段大小与使用相应重组质粒作为模版所扩增的片段大小一致,且与预计相符。将片段测序结果在NCBI上进行BLAST对比,结果显示99%相符。SMU.2055基因缺陷菌株PCR鉴定结果见图 1。
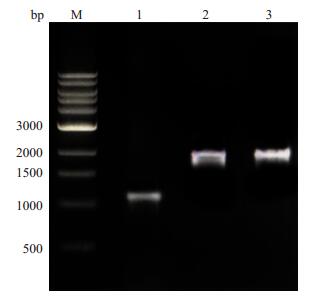
|
图 1 SMU.2055基因缺陷菌株的PCR鉴定 Figure 1 Identification of SMU.2055-deficient S. mutans by PCR. M: 1kb ladder; 1: Wild-type S. mutans UA159; 2: SMU.2055-deficient mutant; 3: SMU.2055 recombinant plasmid |
与野生菌株相比,SMU.2055基因缺陷菌株在pH7.5和pH5.5的BHI培养基中的早期生长均受到明显的影响(图 2)。在pH7.5和pH5.5时野生菌株分别在第4、6小时进入对数生长期,约第8、15小时进入平台期,而缺陷菌株的迟缓期延长,在pH7.5和pH5.5时分别在第7、10小时进入对数生长期,约第11、21小时进入平台期。pH5.5时两种菌株早期的A600明显低于pH7.5时,菌株的生长受到抑制,缺陷菌株生长受抑制情况更加明显,20 h后两种菌株在pH7.5和pH5.5时的终末菌液浓度没有明显差异。
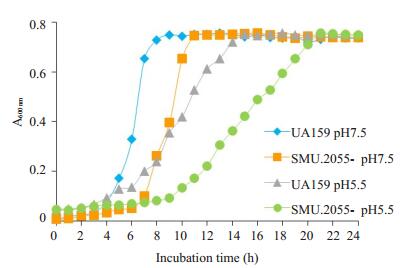
|
图 2 野生型S. mutans UA159和SMU.2055基因缺陷菌株不同pH条件下的生长情况 Figure 2 Growth curve of wild-type S. mutans UA159 and SMU.2055-deficient mutant at different pH levels |
随着pH逐渐下降,两种菌株的生存能力逐渐减弱。野生型S. mutans UA159的致死性pH为3.5,SMU.2055基因缺陷菌株的致死性pH为4.0。
2.4 SMU.2055基因缺陷菌株糖酵解pH降低情况加入葡萄糖后S. mutans UA159和SMU.2055基因缺陷菌株均能迅速地代谢底物产酸,使反应体系的pH迅速下降,在前18 min的各个时间点上,UA159反应体系的pH均低于缺陷菌株,早期野生菌株糖酵解速率明显高于缺陷菌株,差异具有统计学意义(P < 0.05)。但两者糖酵解的最低pH没有统计学差异(图 3)。说明SMU.2055基因的缺失没有影响细菌的糖酵解能力。
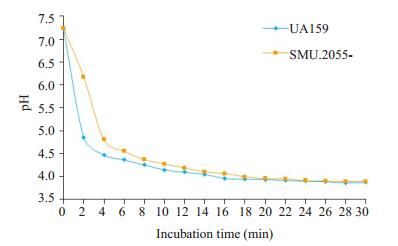
|
图 3 野生型S. mutans UA159和SMU.2055基因缺陷菌株糖酵解pH降低情况 Figure 3 Glycolytic pH of the wild-type S. mutans UA159 and SMU.2055-deficient mutant |
野生型S. mutans UA159的蛋白浓度为1.2768± 0.2639 mg/mL,SMU.2055基因缺陷菌株的蛋白浓度为1.6297±0.1249 mg/mL,与野生型相比,SMU.2055基因缺陷菌株细胞通透性增强(图 4),差异具有统计学意义(P < 0.001)。
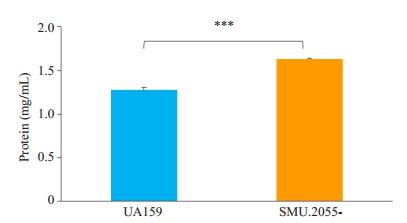
|
图 4 野生型S. mutans UA159和SMU.2055基因缺陷菌株的细胞通透性能力 Figure 4 Cell permeability of the wild-type S. mutans UA159 and SMU.2055-deficient mutant. ***P < 0.001 |
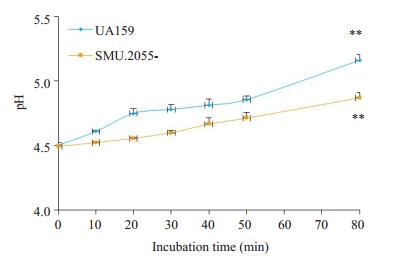
SMU.2055基因缺陷菌株在50~80 min时曲线的斜率小于野生菌株,80 min时pH值低于野生菌株(图 5),差异具有统计学意义(P < 0.05)。说明SMU.2055基因缺陷菌株对质子的通透性增强。
|
图 5 野生型S. mutans UA159和SMU.2055基因缺陷菌株的质子通透性能力 Figure 5 Proton permeability of the wild-type S. mutans UA159 and SMU.2055-deficient mutant. **P < 0.01 |
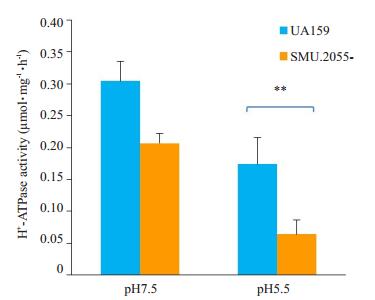
pH 7.5时,与野生型S. mutans UA159相比,SMU.2055基因缺陷菌株的H+-ATPase活性略微降低(图 6),差异没有统计学意义(P>0.05)。pH5.5时,SMU.2055基因缺陷菌株的H+-ATPase活性明显低于野生菌株,差异具有统计学意义(P < 0.01)。
|
图 6 野生型S. mutans UA159和SMU.2055基因缺陷菌株的H+-ATPase活性 Figure 6 H+-ATPase activity in the wild-type S. mutans UA159 and SMU.2055-deficient mutant. **P < 0.01 |
在pH7.5和pH5.5时,野生型S. mutans UA159形成的生物膜较为致密,细菌团块较大(图 7),SMU.2055基因缺陷菌株所形成的生物膜较野生型稀疏,细菌团块较小,呈网状结构,存在不规则圆形或椭圆形大小不一的孔隙。SMU.2055基因缺陷菌株形成生物膜的能力均明显低于野生菌株。在pH5.5时两种菌株形成生物膜的能力均高于pH7.5时,此时形成的生物膜更加致密,细菌团块更大,几乎遍布整个视野。

|
图 7 激光共聚焦显微镜观察野生型S. mutans UA159与SMU.2055基因缺陷菌株在不同pH条件下的生物膜形成情况 Figure 7 Confocal laser scanning microscopy of biofilms formed by wild-type S mutans UA159 and SMU.2055-deficient mutant at pH 7.5 (A, B) and pH 5.5 (C, D) (SYTO9 staining, ×100) |
SMU.2055蛋白被认为是假想的乙酰基转移酶,属于GNAT家族。该家族的乙酰基转移酶参与了细胞生长调控、基因转录激活和DNA损伤修复等[23]。乙酰基转移酶催化的乙酰化反应是蛋白乙酰化的主要方式之一。蛋白质乙酰化修饰在生物的抗逆境反应中具有重要作用,对控制病原细菌的发生具有重要意义[24],可以通过调控蛋白的活性、定位和蛋白间的相互作用或者蛋白质与DNA之间的相互作用来影响诸多生物过程[25]。乙酰化修饰可能在碳源代谢、脂肪酸合成、应激反应等过程中发挥重要作用。蛋白质乙酰化状态可以影响细菌形态和生物膜的形成,影响细胞壁的结构和通透性, 而这些因素与S. mutans的耐酸性密切相关[2]。因此,我们推测SMU.2055基因可能与S. mutans的耐酸性有关。
细胞密度可以调节S. mutans对酸性环境的适应能力,浮游状态下对数生长期的细菌和生物膜状态下的细菌能够更好的耐受酸性环境[26]。本研究中,在pH7.5或pH5.5时SMU.2055基因缺陷菌株的迟缓期明显延长,表明SMU.2055基因在S. mutans生长过程中起着一定的作用。这可能是因为乙酰化修饰参与了三羧酸循环等生长代谢过程[27],当乙酰化修饰受到影响时,会影响细菌对葡萄糖的利用[11]。在pH7.5或5.5时基因缺陷菌株其终末菌量与野生菌株基本相同,推测存在代偿机制对其生长进行补偿以维持生命。pH5.5时两种菌株生长均受到不同程度的抑制,终末菌量与pH7.5时基本相同,缺陷菌株生长更加缓慢,说明两种菌株均表现出适应性耐酸能力,缺陷菌株对低pH环境的抵抗力低于野生株。
生物膜形成是细菌为了抵抗外界干扰而存在的一种方式。微生物菌群、胞外多糖、水分、代谢产物等,共同组成生物膜的基质体。生物膜内的有机体可以补充营养缺乏,缓冲酸碱度的变化。生物膜形成障碍也是导致菌株耐酸性降低的原因之一[28]。本研究中,在pH值为7.5或5.5时,缺陷菌株形成生物膜的能力均明显低于野生菌株,可能是因为SMU.2055基因的缺失导致菌体间不规则物质的形成减少,S. mutans菌体间的不规则物质主要由胞外多糖、蛋白质等组成[13],影响了水不溶性胞外多糖形成,进而影响了细菌的黏附力[29]。另外乙酰化修饰的降低可能会影响脂质合成,进而影响细菌生物膜形成[11]。两种菌株在pH5.5时形成生物膜的能力均显著高于pH7.5时,可能是由于低pH环境下,生物膜中S. mutans独有的gtf BC基因的表达增加,水不溶性多糖形成增多, 促进细菌的黏附,使形成的生物膜更加致密,细菌团块更大[30]。
致死性pH值是反映基本耐酸性的一个指标,同时也是衡量适应性耐酸的一个重要参数。本实验证实SMU.2055基因缺陷菌株对致死性pH值环境的抵抗力低于野生菌株。可能是由于SMU.2055基因的缺失导致多种膜相关蛋白的合成受到了影响,从而影响了细胞膜的完整性和耐酸性[31],这些蛋白包括一般应激蛋白和酸特异性蛋白[32]。
糖酵解最低pH值越低,表明该菌株能够在酸性环境中代谢糖产酸的能力越强,即耐酸性越高。在本实验中,SMU.2055基因缺陷菌株早期的糖酵解速率明显低于野生菌株,但两者的糖酵解最低pH值没有显著差异。SMU.2055基因的缺失没有影响细菌的糖酵解能力,可能是由于SMU.2055基因的缺失诱导其他腺苷转移酶的产生,维持其糖酵解能力[19]。另一原因,由于过量的葡萄糖会造成类似的非酶催化乙酰化反应,而由于糖过载引起的乙酰化反应,能够反作用影响包括糖酵解在内的中心代谢途径[33]。
在酸性条件下S. mutans至少通过以下两种机制来维持细胞内环境的稳定,即:酸性产物的外排[34]以及通过细胞膜上的H+-ATPase水解ATP排出质子维持跨膜pH梯度,保持细胞内相对碱性环境[35],从而保护胞内的对酸敏感的酶和其他蛋白,使致龋菌具有对抗酸致死的能力。在本研究中,SMU.2055基因缺陷菌株细胞通透性增强,这可能是因为SMU.2055基因缺陷影响了乙酰化修饰的过程,乙酰化修饰可改变细菌细胞壁结构和通透性[11]。细胞通透性增强可以使细胞对H+有自由的通透性,细胞外的H+可顺浓度梯度进入细胞内,酸敏感酶和其他蛋白生物合成受到影响,可能影响H+-ATPase的活性,引起质子通透性增高[15],从而影响其耐酸性。也可能是SMU.2055基因的缺失影响了乙酰化修饰过程,影响了脂肪酸的合成[11],膜脂肪酸组成的改变是耐酸反应的一部分,可能直接地影响脂双层的质子通透性或间接地通过影响H+-ATPase活性而影响脂双层的质子通透性,进而影响耐酸性[36]。SMU.2055基因缺陷菌株质子通透性增强,低pH时H+-ATPase活性降低进一步验证了这一过程。
本研究探讨了SMU.2055基因对S. mutans耐酸性的影响。SMU.2055基因缺陷菌株耐酸能力的降低与其致死性pH值、细胞通透性、质子通透性、H+-ATPase活性,生物膜的形成能力有关,与其糖酵解能力无关。
| [1] | 卫华. 变形链球菌耐酸性相关基因的研究[D]. 武汉大学, 2004. http://www.cqvip.com/QK/95295X/200203/6257852.html |
| [2] | Matsui R, Cvitkovitch D. Acid tolerance mechanisms utilized by Streptococcus mutans[J]. Future Microbiol, 2010, 5(3): 403-17. DOI: 10.2217/fmb.09.129. |
| [3] | Kouzarides T. Histone proliferation acetylases and deacetylases in cell[J]. Curr Opin Genet Dev, 1999, 9(1): 40-8. DOI: 10.1016/S0959-437X(99)80006-9. |
| [4] | 郭燕婷, 李艳梅, 赵玉芬. 脂蛋白合成新进展[J]. 有机化学, 2004, 24(7): 722-7. |
| [5] | Xie L, Wang X, Zeng J. Proteome-wide lysineacetylation profling of the human pathogen Mycobacterium tuberculosis[J]. Int J Biochem Cell Biol, 2015, 59(4): 193-202. |
| [6] | Sang Y, Ren J, Ni JJ, et al. Protein acetylation is involved in salmonella enterica serovar typhimurium virulence[J]. J Infect Dis, 2016, 213(11): 1836-45. DOI: 10.1093/infdis/jiw028. |
| [7] | Pan JY, Ye ZC, Cheng ZY, et al. Systematic analysis of the lysine acetylome in vibrio parahemolyticus[J]. J Proteome Res, 2014, 13(7): 3294-302. DOI: 10.1021/pr500133t. |
| [8] | 陈晓丹, 展秀荣, 吴昕彧, 等. 变异链球菌SMU.2055蛋白晶体结构及其小分子抑制剂设计与筛选[J]. 华西口腔医学杂志, 2015(2): 182-6. DOI: 10.7518/hxkq.2015.02.016. |
| [9] | Lima BP, Antelmann HG, Chi BB, et al. In involvement of protein acetylation stressresponsi promoter transcription of a glucoseinduced[J]. Mol Microbiol, 2011, 81(5): 1190-204. DOI: 10.1111/mmi.2011.81.issue-5. |
| [10] | Lee DW, Kim D, Lee YJ, et al. Proteomic analysis of acetylation in thermophilic Geobacillus kaustophilus[J]. Proteomics, 2013, 13(15): 2278-82. DOI: 10.1002/pmic.v13.15. |
| [11] | 刘凤英. 可逆的赖氨酸乙酰化修饰对细菌生理功能的影响[D]. 中国科学院大学, 2014. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y2608440 |
| [12] | Zhao WH, Zhan XR, Gao XZ, et al. Preliminary X-ray crystallographic analysis of SMU.2055 protein from the caries pathogen Streptococcus mutans[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2010, 66(Pt 5): 530-3. |
| [13] | 陈璇, 许晓虎, 吴昕彧, 等. 变异链球菌UA159中SMU.2055基因在致龋性的作用[J]. 南方医科大学学报, 2017, 37(6): 786-91. |
| [14] | Yamashita Y, Takehara T, Kuramitsu HK. Molecular characterization of a Streptococcus muatns altered in environmental stress responses[J]. J Bacteriol, 1993, 175(19): 6220-8. DOI: 10.1128/jb.175.19.6220-6228.1993. |
| [15] | Boyd DA, Cvitkovitch DG, Bleiweis AS, et al. Defects in D-Alanyl-Lipoteichoicm acid synthesis in streptococcus mutans results in acid sensitivity[J]. J Bacteriol, 2000, 182(21): 6055-65. DOI: 10.1128/JB.182.21.6055-6065.2000. |
| [16] | Li YH, Lau PC, Lee JH, et al. Natural genetic transformation of Streptococcus mutans growing in biofilms[J]. J Bacteriol, 2001, 183(3): 897-908. DOI: 10.1128/JB.183.3.897-908.2001. |
| [17] | Wu X, Hou J, Chen X, et al. Identification and functional analysis of the L-ascorbate-specific enzyme Ⅱ complex of the phosphotransferase system in Streptococcus mutans[J]. BMC Microbiol, 2016, 16(3): 51. |
| [18] | 周颖, 卫华, 樊明文. 变形链球菌的适应性耐酸能力[J]. 现代口腔医学杂志, 2003, 17(4): 285-7. |
| [19] | Belli A, Marquis RE. Catabolite modification of acid tolerance of streptococcus mutans GS-5[J]. Oral Microbiol Immunol, 1994, 9(1): 29-34. DOI: 10.1111/omi.1994.9.issue-1. |
| [20] | Buckley AA, Faustoferri RC, Quivey RJ. β-Phosphoglucomutase contributes to aciduricity in Streptococcus mutans[J]. Microbiology, 2014, 160(4): 818-27. |
| [21] | Krol JE, Biswas S, King C, et al. SMU.746-SMU.747, a putative membrane permease complex, is involved in aciduricity, acidogenesis, and biofilm formation in Streptococcus mutans[J]. J Bacteriol, 2014, 196(1): 129-39. DOI: 10.1128/JB.00960-13. |
| [22] | Santiago B, Macgilvray M, Faustoferri RC, et al. The BranchedChain amino acid aminotransferase encoded by ilvE is involved in acid tolerance in Streptococcus mutans[J]. J Bacteriol, 2012, 194(8): 2010-9. DOI: 10.1128/JB.06737-11. |
| [23] | Carrozza MJ, Utley RT, Workman JL, et al. The diverse functions of histone acetyltransferase complexes[J]. Trends Genet, 2003, 19(6): 321-9. DOI: 10.1016/S0168-9525(03)00115-X. |
| [24] | Liang WX, Deutscher MP. Post-translational modification of RNase R is regulated by stress-dependent reduction in the acetylating enzyme Pka (YfiQ)[J]. RNA, 2012, 18(1): 37-41. DOI: 10.1261/rna.030213.111. |
| [25] | 徐骏宇. 微生物蛋白酰化修饰与合成代谢调控[D]. 上海: 华东理工大学, 2017. |
| [26] | 邱明, 黄晓晶. 生物膜状态下变异链球菌生物学行为研究[J]. 医学综述, 2008, 14(22): 3422-4. DOI: 10.3969/j.issn.1006-2084.2008.22.022. |
| [27] | Song LM, Wang GY, Malhotra A, et al. Reversible acetylation on Lys501 regulates the activity of RNase Ⅱ[J]. Nucleic Acids Res, 2016, 44(5): 1979-88. DOI: 10.1093/nar/gkw053. |
| [28] | Welin-Neilands J, Svensater G. Acid tolerance of biofilm cells of Streptococcus mutans[J]. Appl Environ Microbiol, 2007, 73(17): 5633-8. DOI: 10.1128/AEM.01049-07. |
| [29] | Loo CY, Corliss D, Ganeshkmnar N. Streptococcus gordonii biofilm formation: i dentification of genes that code for biofilm phenotypes[J]. J Bacteriol, 2000, 182(5): 1374-82. DOI: 10.1128/JB.182.5.1374-1382.2000. |
| [30] | Yunghua L, Robert A. Burne regulation of the gtfBC and ftf genes of streptococcus mutans in biofilms in response to pH and carbohydrate[J]. Microbiology, 2001, 147(10): 2841-8. DOI: 10.1099/00221287-147-10-2841. |
| [31] | Wen ZT, Burne RA. Functional genomics approach to identifying genes required for biofilm development by Streptococcus mutans[J]. Appl Environ Microbiol, 2002, 68(3): 1196-203. DOI: 10.1128/AEM.68.3.1196-1203.2002. |
| [32] | Hamilton IR, Svensater G. Acid-regulated proteins induced by Streptococcus mutans and other oral bacteria during acid shock[J]. Oral Microbiol Immunol, 1998, 13(5): 292-300. DOI: 10.1111/omi.1998.13.issue-5. |
| [33] | Schilling B, Christensen D, Davis R, et al. Protein acetylation dynamics in response to carbon overflow in Eschrichia coli[J]. Mol Microbiol, 2015, 98(5): 847-63. DOI: 10.1111/mmi.13161. |
| [34] | Dashper SG, Reynolds EC. Lactic acid excretion by streptococcus mutans[J]. Microbiol, 1996, 142(1): 33-9. DOI: 10.1099/13500872-142-1-33. |
| [35] | Hamilton IR. Adaptation by streptococcus mutans to acid tolerance[J]. Oral Microbiol Immunol, 1991, 6(2): 65-71. DOI: 10.1111/omi.1991.6.issue-2. |
| [36] | Quivey RJ, Faustoferri R, Monahan K, et al. Shifts in membrane fatty acid proifles associated with acid adaptation of Streptococcus muatns[J]. FEMS Microbiol Lett, 2000, 189(1): 89-92. DOI: 10.1111/fml.2000.189.issue-1. |
 2018, Vol. 38
2018, Vol. 38

