2. 广东省水电医院外科,广东 广州 511340
2. Guangdong Hydropower Hospital, Department of Surgery, Guangzhou 511340, China
脊髓损伤(SCI)是一种病情严重、预后不良的神经系统疾病,脊髓损伤具有高发生率、高致残率及高医疗耗费等特点, 现已成为全球性的医疗难题[1]。按照病程长短可以将脊髓损伤分为急性损伤和慢性损伤,急性脊髓损伤采用髓内外减压手术治疗获得一定临床疗效在国内已有报道[2-3],而近年有学者尝试采用此方法治疗颈椎退变性疾病所致慢性颈髓损伤,但临床疗效有待观察,深入的研究报道甚少[4],其相关机制尚不清楚。目前随着老龄社会的到来,颈椎退变性疾病发病率也逐渐增高[5-6],造成颈髓慢性损伤病人也越来越多,探索一种更好治疗慢性颈髓损伤的方法成为为脊柱外科医生亟待解决的难题。暨南大学附属第一医院自2008年1月~2015年1月收治的57例慢性颈髓损伤患者根据术式不同随机分成A、B 2组,A组行单纯髓外减压,B组行显微镜下髓内外减压,B组在病损部位取脑脊液检测炎症因子表达水平[7-8],观察发现B组较A组具有更好疗效,这可能与显微镜下切开硬脊膜、松解黏连、解除慢性压迫及降低损伤部位炎症因子水平有关。现具体报道如下:
1 资料和方法 1.1 纳入与排除标准[9]纳入标准:(1)第一诊断为慢性SCI者(病程3月以上);(2)采用美国脊髓损伤学会(ASIA)标准评价等级A~D级者[10];(3)均经保守治疗2月以上且无明显进展者;(4)术前MRI T2WI有异常高信号者(水肿或软化坏死灶);(5)多节段颈椎间盘突出及OPLL者(≥3节段)。
排除标准:(1)脊髓贯通伤或完全离断者;(2)2月内有重大脊柱骨折病史者;(3)感染所致SCI者;(4)心肺等基础疾病不耐受手术者;(5)伴有脑部或神经系统其他疾病者。
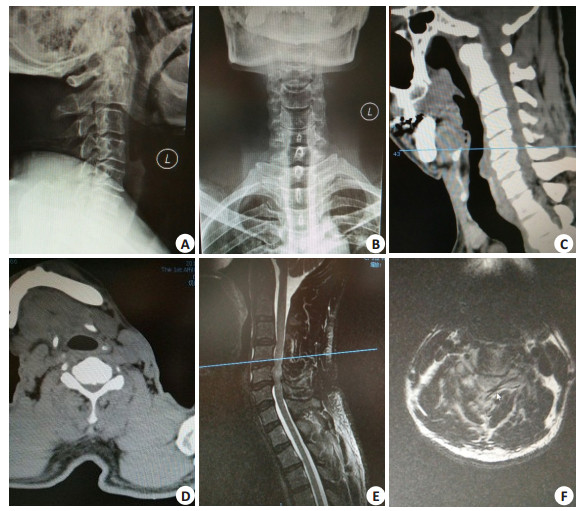
1.2 病历资料57例患者,男性38例,女性19例,年龄为30~68岁,病程为3月~10年。神经症状轻微外伤后加重者有19例,57例患者致病原因为多节段颈椎间盘突出17例,长节段OPLL 25例,颈椎黄韧带肥厚或钙化13例,陈旧性颈椎骨折2例。20例有肢体麻木、感觉减退、躯体束带感等感觉障碍,38例有四肢无力、步态不稳等肌力减退,5例有尿储留,16例有排尿困难, 体查多数患者均有不同程度Hoffmam's征阳性,膝跟腱反射活跃或亢进,踝阵挛阳性等上运动神经受损的体征表现,其中32例存在一定损伤平面以下的感觉异常。术前常规行颈椎DR、CT有骨质增生、椎管狭窄、黄韧带钙化等颈椎退变影像或椎管内骨折块影像,MRI检查T2WI信号上均显示病损节段脊髓异常高信号影伴或不伴椎间盘病变影像(图 1)。
|
图 1 56岁男性患者,C5、C6椎体骨质增生致慢性SCI的术前DR、CT及MRI表现 Figure 1 Preoperative DR, CT and MRI findings in a 56-year-old patient with chronic SCI caused by C5 and C6 vertebral body osteogenesis. A, B: Preoperative X-ray; C, D: Preoperative CT; E, F: Preoperative MRI T2WI |
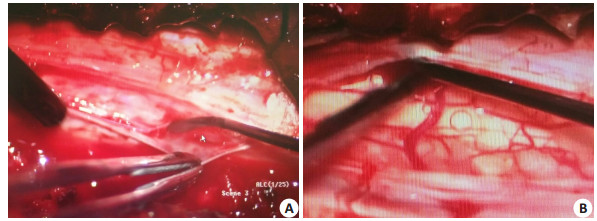
57例患者分为A、B 2组,A组31例患者中致病原因为多节段颈椎间盘突出9例,长节段OPLL15例,颈椎黄韧带肥厚或钙化6例,陈旧性颈椎骨折1例;B组26例患者中致病原因为多节段颈椎间盘突出8例,长节段OPLL 10例,颈椎黄韧带肥厚或钙化7例,陈旧性颈椎骨折1例。术前2组病例均计算其JOA评分,分别为5.93±1.06、6.34±0.38分。术前、术后均行颈椎DR、CT、MRI检查,所有患者术中减压前30 min均用甲强龙1000 mg静滴预防脊髓再灌注损伤。A组患者均采用后路单开门、椎管减压、椎管成形术,B组患者均采用后路单开门、脊膜切开局部减压、松解、大量冰生理盐水灌洗、椎管成形术。B组患者术中切开病损部位硬脊膜,显微镜下松解黏连后用5 mL注射器收取脑脊液标本,检测促炎因子IFN-γ、IL-17F、IL-6、sCD40L水平[8, 11],髓内减压的标准为脊髓恢复波动、脑脊液流动通畅及软脊膜表面血管明显扩张(图 2)。
|
图 2 髓内减压组术中松解减压目标 Figure 2 Objective of intramedullary decompression in intramedullary decompression group. A: Severely glued spinal cord before release; B: Spinal cord after effective release |
术后1、6、12月分别对患者复查随访,按日本骨科学会(JOA)神经功能评定标准对患者手术前后神经功能进行评定[12],了解植骨融合及神经功能恢复情况,记录JOA评分情况并计算其改善率。用SPSS20.0软件系统进行分析,采用多元重复测量资料方差分析方法,配对t检验比较两组各病例术后各时期与术前JOA评分及改善率,两组间差异比较采用两样本比较t检验,当P < 0.05为差异有统计学意义。JOA评分标准满分为17分,上、下肢功能分别计4分,身体感觉计6分,膀胱功能计3分。神经功能改善率=(术后评分-术前评分)/( 17-术前评分)×100%。送检脑脊液标本均采用液相芯片法检测4种促炎因子IFN-γ、IL-17F、IL-6、sCD40L[13],采用SPSS20.0软件系统对各种炎症因子与正常值进行方差齐性检验、F检验差异分析,当P < 0.05为差异有统计学意义。
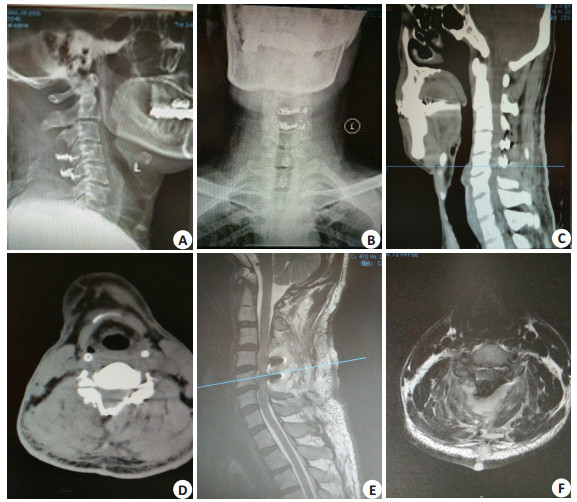
2 结果 2.1 影像学A、B两组术后2周复查DR、CT、MRI并与术前对比,提示原发病变得到解除,B组脊髓异常高信号多数解除,总体改善情况较A组好,部分病例需术后3月完全消失(图 3)。
|
图 3 56岁男性患者,C5、C6椎体骨质增生致慢性SCI的术后DR、CT及MRI表现 Figure 3 Postoperative DR, CT and MRI findings in a 56-year-old patient with chronic SCI caused by C5 and C6 vertebral body osteogenesis. A, B: Postoperative X-ray; C, D: Postperative CT; E, F: Postoperative MRI T2WI |
结果显示两组术后各时期JOA评分较术前均明显增高, 差异具有统计学意义(P < 0.05);B组术后各时期JOA评分均高于A组,两组间差异有统计学意义(P < 0.05);两组术前JOA评分经检验差异无统计学意义(P > 0.05);两组术后1月改善率分别为39.98%、52.18%,术后6月改善率分别为47.45%、58.38%,术后12月的改善率分别为52.33%、61.52%,两组间两样本比较差异有统计学意义(P < 0.05)。A、B两组术后均有疗效,并且B组近期疗效优于A组。
2.3 并发症A组3例出现脑脊液漏(均为OPLL患者),经常规处理愈合;1例出现硬膜外血肿,经打开止血愈合;1例出现内固定松动;B组1例出现门轴断裂,经重新固定恢复良好。
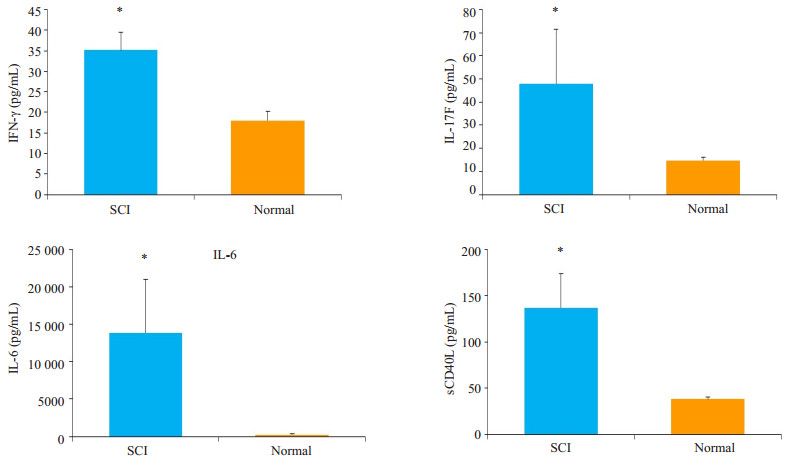
2.4 炎症因子4种炎症因子经过检测及数据分析结果显示慢性脊髓损伤后局部促炎因子IFN-γ、IL-17F、IL-6、sCD40L含量均较正常脑脊液明显增高(图 4),其中IL-6增高最为显著,各组与正常值比较差异有统计学意义(P < 0.05)。
|
图 4 颈髓慢性损伤部位脑脊液与正常脑脊液局部促炎因子IFN-γ、IL-17F、IL-6、sCD40L含量情况 Figure 4 Levels of IFN-γ, IL-17F, IL-6 and sCD40L in normal cerebrospinal fluid and cerebrospinal fluid after injury. (*P < 0.05 vs normal group) |
慢性颈髓损伤多见于颈椎退行性疾病,但颈椎骨折若未及时处理或处理不彻底,残存的骨折块对脊髓的持续压迫也是导致慢性颈髓损伤的一大原因[14-15]。慢性脊髓损伤通常涉及两个过程,即原发损伤(机械性)和继发性损伤(细胞),两者相继发生导致的神经组织的结构破坏,从而出现相应的神经功能障碍。前者是由于脱出的椎间盘、增生的椎体骨质、钙化的软组织或陈旧的碎骨片等通过破坏椎管连续性进而压迫脊髓引起机械性原发损伤,大量研究表明此类损伤过程通过髓外手术减压即可较好解除;后者则是在原发性损伤基础上通过一系列生理生化改变,如氧化应激、炎症反应及兴奋氨基酸过程释放等[16],使病灶周围组织发生自身破坏性病变,进一步加深损伤程度和扩大损伤范围[17-18],后者也是加重脊髓功能障碍的重要原因[19]。
| 表 1 两组患者随访不同时间JOA评分及改善率统计表 Table 1 JOA score and rate of improvement at different time points in the 2 groups |
研究表明,外科手术减压治疗慢性脊髓损伤,对其功能恢复具有明显的作用[20]。本研究通过观察A、B两组患者术后的疗效,发现不同时期B组JOA评分均高于A组(P < 0.05),术后12月JOA评分也较术前高,说明经过髓内减压的患者较单纯髓外减压的患者获得更好的近期疗效。分析其主要的原因如下:(1)脊髓损伤发生时,除受到原发性和继发性损伤作用外,不但受到骨性结构的挤压还会受到硬脊膜囊的限制,导致脊髓内、外压力增高,切开硬脊膜进行减压才能真正减轻髓内压力;(2)慢性颈椎病或陈旧性骨折所致慢性脊髓损伤不同于急性脊髓损伤[2, 21],其病程长,损伤过程已进入平台期,一般无出血,其水肿也不明显[22],更多是表现为血肿机化、组织坏死、硬脊膜黏连、脑脊液阻断、动静脉阻塞,术中所见也可证实了这一点,显微镜下通过术中松解硬脊膜黏连、恢复脑脊液和血液循环才能更好恢复神经功能;(3)通过术中冲洗减轻了局部慢性炎症反应造成的继发性损伤[23-24],大量研究表明炎症反应在SCI过程中具有神经损伤及神经保护双重效果[25],即适度的炎症反应是SCI后血管组织的正常生理反应,侵入的巨噬细胞可以吞噬并清除变性坏死的神经细胞及髓鞘碎屑,但过度的反应会扩大炎症级联反应,损伤神经细胞及髓鞘结构,诱导细胞凋亡和轴突变性,进一步加重脊髓组织损伤,妨碍脊髓神经元修复和再生,导致脊髓损伤加重[11, 21]。本研究中所检测的4种炎症因子IFN-γ、IL-17F、IL-6、sCD40L均为促炎因子[26-27],结果显示其在病变部位脑脊液中的浓度均较正常脑脊液高(P < 0.05),这也说明了脊髓损伤即使进入慢性期,局部慢性炎症损伤持续存在。再有,慢性炎症持续进展必然会加重硬膜下的黏连,黏连又会促使脊髓进一步受压而致缺血坏死,甚至脊髓软化、空洞等[19, 23],这将进入脊髓慢性损伤的恶性循环。目前,治疗SCI炎症反应的药物和细胞因子抑制剂较多,但其作用机制和用药方案尚未确认[18],虽有些药物对实验中动物脊髓损伤模型有效,但对人类疗效却有限;激素长期以来用于治疗急性脊髓损伤,但因副作用大、疗效不肯定,很少用于慢性脊髓损伤中,因此唯有通过手术的方式降低损伤部位的炎症因子水平进而改善局部的再生微环境来减轻继发性损伤[28-29]。
3.3 髓内减压适应征及禁忌征我们认为髓内外减压适应征主要为:有不同程度脊髓损伤,ASIA分级属A~D级者;MRI检查有长节段的脊髓受压且髓内有异常高信号者;体征符合脊髓损伤平面者;经保守治疗3月以上或行髓外减压术后效果不佳者;导致慢性脊髓损伤原发病因需行后路手术者。根据国内外相关文献及本团队的临床经验[30-31],认为髓内减压主要禁忌征有脊髓贯通伤,感染性脊髓疾病和其他内科系统引起的神经系统疾病。
3.4 显微镜下髓内减压手术经验 3.4.1 手术方法插管全麻下,患者取俯卧位,透视确定病变节段,行后路正中纵行切口,剥离棘突两侧肌肉,充分暴露病变节段棘突、椎板、侧块及椎弓根等。以症状轻的一侧为门轴,用高速魔钻或超声骨刀打开受压严重侧的椎板,部分折断门轴侧椎板,打开椎管,清除造成脊髓受压的病变组织;咬除开门侧的部分椎板,充分显露脊髓病变区(脊髓高信号区),在显微镜下纵向切开硬脊膜,用0号丝线悬吊牵引,用神经剥离子松解硬脊膜与软脊膜蛛之间的粘连带,适当分离蛛网膜可缓慢放出脑脊液(部分压力高者可见脑脊液喷出),收集脑脊液送检,用大量冰盐水反复冲洗;松解彻底后可见脑脊液流动好,减压局部脊髓恢复波动,软脊膜表现血管变得充盈,连续缝合硬脊膜;用支撑钢板或侧块螺钉固定掀开的棘突,门轴侧植骨,充分止血后,留置引流管,缝合切口。
3.4.2 手术时机选择我们认为不管是陈旧性骨折致慢性损伤还是退变性等原因引起的慢性脊髓损伤,只要经过保守治疗效果不理想且仍有神经功能障碍者都可尽早手术,因为随着病程延长,硬膜下黏连就越严重,脊髓血液微循环就越少,神经功能损害就越大。部分慢性颈椎病患者往往因为轻微外伤就会出现严重的脊髓损伤症状,对于轻微外伤症状急性加重前来就诊者,建议尽量在12 h内手术治疗。Batchelor等[32]荟萃分析结果提示伤后12 h内减压可获得稳定受益,而伤后12~24 h内减压受益相对较少。Carlson等[33]进行动物实验后发现成年比格犬功能性神经恢复的窗口期是在受伤后3~6 h。部分渐进性起病患者的慢性损伤病程都至少1月以上,即使已经达平台期,只要存在压迫、缺血、炎症损伤,并且有不同程度的神经功能障碍,核磁共振检查确定脊髓有异常信号改变和病理症状存在,12月内仍是良好手术时机,这与其他学者观点是一致的[34]。
3.4.3 减压成功标准经过查阅国内外相关文献及本团队手术经验积累,认为有以下3点可以借之判断:(1)脊髓恢复波动,(2)脑脊液流动通畅,(3)软脊膜表面血管明显扩张。
3.4.4 术后并发症防治显微镜下髓内减压术操作精细,避免了单纯髓外减压和单纯切开减压常见的严重并发症(如:人为脊髓损伤、脑脊液漏等)。比较常见的并发症是门轴断裂,偶有脑脊液漏并发症出现,只要术中注意动作轻柔,切勿粗暴和反复动作一般均可避免。如果出现门轴断裂并造成脊髓压迫,需重新减压和固定;若出现脑脊液漏,需加强伤口换药,防止发生脑脊液感染,注意补液及监测血常规、白蛋白、血沉、电解质等指标,视情况拔除引流管时间,若术后3~5 d仍有脑脊液漏出,可拔除引流管适当加压或腰大池置管引流等可免形成窦道[9],脑脊液漏一般均可愈合。
3.5 本研究技术局限性(1)由于患者依从性较差原因,本研究只进行了术后12月的近期疗效随访对比,术后1年以上两组患者神经功能改善情况未能继续评价,因此亟需相关专家团队对髓内减压远期疗效的进一步研究来指导临床。
(2)本研究中髓内减压组进行了4种常见炎症因子的检测,证实了慢性脊髓损伤局部慢性炎症反应持续存在,通过硬脊膜切开降低局部炎症因子,进而减轻了炎症反应带来的继发性损伤,这也为解释B组髓内外减压较单纯髓外减压获得更好疗效提供了其中一个有力证据。本研究只进行了髓内减压组脑脊液炎症因子检测,为避免增加术中脊髓医源性损伤,遂术中未行髓外减压组的有创脑脊液取样检测。
综上所述,对于明确慢性颈髓损伤的患者,只要有手术适应征并排除手术禁忌征,均应尽早行手术治疗;至于手术方式,尽量在显微镜下行硬脊膜切开减压、松解黏连、冰盐水灌洗术,该法较单纯髓外减压可获得更好临床疗效。这可能与解除了黏连引发继发性的压迫、降低了局部炎症因子所致的慢性炎症反应相关。当然此手术操作难度较大并存在一定风险和并发症,除了严格把握此项手术的适应征和禁忌征外,务必掌握一定的显微外科技术或经过一定的学习曲线条件下才可完成,防止因操作不当加重脊髓损伤。
| [1] | Ackery A, Tator C, Andrei K. A global perspective on spinal cord injury epidemiology[J]. J Neurotrauma, 2004, 21(10): 1355-70. DOI: 10.1089/neu.2004.21.1355. |
| [2] | 曲延镇, 罗政, 郭晓东, 等. 硬脊膜或脊髓切开减压治疗脊髓损伤后广泛水肿伴或不伴髓内血肿[J]. 中华骨科杂志, 2015, 35(7): 707-13. |
| [3] | Zhu H, Feng YP, Young Wise, et al. Early neurosurgical intervention of spinal cord contusion:an analysis of 30 cases[J]. Chin Med J, 2008, 121(24): 2473-8. |
| [4] | 李阳, 袁文, 张颖, 等. 伴脊髓高信号改变的颈椎后纵韧带骨化症手术治疗及疗效分析[J]. 中国矫形外科杂志, 2010, 18(1): 38-41. |
| [5] | 袁文. 多节段颈椎退变性疾病手术治疗中应思考的几个问题[J]. 中国脊柱脊髓杂志, 2010, 20(3): 177-9. |
| [6] | 武乐斌, 朱向玉, 王光彬, 等. 磁共振扩散张量成像对脊髓型颈椎病脊髓慢性损伤的评价[J]. 磁共振成像, 2010, 1(3): 188-93. |
| [7] | Kigerl KA, Gensel JC, Ankeny DP, et al. Identification of two distinct macrophage subsets with divergent effects causing either neurotoxicity or regeneration in the injured mouse spinal cord[J]. J Neurosci, 2009, 29(43): 13435-44. DOI: 10.1523/JNEUROSCI.3257-09.2009. |
| [8] | Stirling DP, Yong VW. Dynamics of the inflammatory response after murine spinal cord injury revealed by flow cytometry[J]. J Neurosci Res, 2008, 86(9): 1944-58. DOI: 10.1002/jnr.v86:9. |
| [9] | 梁兵, 杨枭雄, 宋科冉, 等. 外科手术脊髓松解减压对脊髓损伤患者功能恢复的影响[J]. 中国骨与关节杂志, 2016, 5(4): 290-6. |
| [10] | Samdani A, Chafetz RS, Vogel LC, et al. The international standards for neurological classification of spinal cord injury:relationship between S4-5 dermatome testing and anorectal testing[J]. Spinal Cord, 2011, 49(3): 352-6. DOI: 10.1038/sc.2010.144. |
| [11] | 马胜忠, 汤继文. 炎症细胞因子和趋化因子在脊髓损伤后免疫反应中的作用[J]. 中国微侵袭神经外科杂志, 2005, 10(9): 427-9. |
| [12] | 焦根龙, 李志忠, 潘永勤, 等. 髓内外减压在有脊髓信号改变的颈椎后纵韧带骨化症中的疗效分析[J]. 南方医科大学学报, 2013, 33(9): 1382-5, 1389. |
| [13] | 陈玮. 液相芯片技术的原理与应用进展[J]. 成都医学院学报, 2008, 3(3): 225-31. |
| [14] | 汪金荣, 刘洪, 郭敏, 等. 后路松解前路松开固定治疗晚期陈旧性颈椎骨折脱位[J]. 创伤外科杂志, 2010, 12(6): 8. |
| [15] | 孙国栋, 李志忠, 王晶, 等. 陈旧性下颈髓损伤治疗[J]. 中国矫形外科杂志, 2012, 20(2): 105-7. |
| [16] | Oyinbo CA. Secondary injury mechanisms in traumatic spinal cord injury:a nugget of this multiply cascade[J]. ActaNeurobiolExp(Wars), 2011, 71(2): 281-99. |
| [17] | Schwab JM, Chiang N, Arita M, et al. Resolvin E1 and protein D1 activate inflammation-resolution programmes[J]. Nature, 2007, 447(7146): 869-74. DOI: 10.1038/nature05877. |
| [18] | 王涛丽, 顾兵, 李华南, 等. 急性脊髓损伤后的炎症反应及其抗炎治疗[J]. 中国药理学通报, 2015, 31(4): 452-7. |
| [19] | 梁兵, 董健, 唐家广. 硬膜囊内减压治疗创伤性脊髓损伤的研究进展[J]. 中国骨与关节杂志, 2016, 5(11): 853-8. DOI: 10.3969/j.issn.2095-252X.2016.11.012. |
| [20] | Wilson JR, Singh A, Craven C, et al. Early versus late surgery for traumatic spinal cord injury:the results of a prospective Canadian cohort study[J]. Spinal Cord, 2012, 50(11): 840-3. DOI: 10.1038/sc.2012.59. |
| [21] | Zhou ZH, Chaturvedi P, Han YO, et al. IFN-gamma induction of the buman monocyte chemoattratant pritein (hMCP)-1 gene in astrocytoma cells:functional interaction between an IFN-gamma activated site and a GC-rich element[J]. J Immunol, 1998, 160(8): 3908-16. |
| [22] | 胥少汀, 葛宝丰, 徐印坎, 等. 实用骨科学[M]. 北京: 人民军医出版社, 2005: 586-9. |
| [23] | Gen-Long J, Zhi-Zhong L, Tan T, et al. Efficacy of spinal pia mater incision and laminoplasty combined with internal fixation for old spinal cord injury[J]. Chin Med Sci J, 2012, 27(3): 134-40. DOI: 10.1016/S1001-9294(14)60045-6. |
| [24] | 廖维宏, 张光铂. 进一步加强脊髓损伤修复研究[J]. 中国脊柱脊髓杂志, 2003, 13(9): 517-9. |
| [25] | Hohlfeld R, Kerschensteiner M, Meinl E. Dual role of inflammation in CNS disease[J]. Neurology, 2007, 68(3): S58-63. |
| [26] | Cua DJ, Tato CM. Innate IL-17-producing cells:the sentinels of the immune system[J]. Nat Rev Immunol, 2010, 10(7): 479-89. DOI: 10.1038/nri2800. |
| [27] | 宗少晖, 方晔, 彭金珍, 等. 急性不完全脊髓损伤模型大鼠相关炎症因子表达[J]. 中国组织工程研究, 2014, 18(8): 2806-11. |
| [28] | Silver NA, Sousa N, Reis RL, et al. From basis to clinical:a comprehensive review on spinal cord injury[J]. Prog Neurobiol, 2014, 114(3): 25-57. |
| [29] | Bracken MB, Shepard MJ, Holfford TR, et al. Administration of methylprednisolone for 24 or 48 hours or tirilazad mesylate for 48 hours in the treatment of acute spinal cord injury[J]. JAMA, 1997, 277(20): 1597-604. DOI: 10.1001/jama.1997.03540440031029. |
| [30] | Van Middendorp JJ, Barbagallo G, Schuetz M, et al. Design and rationale of a Prospective, Observational European Multicenter study on the efficary of acute surgical decompression after traumatic Spinal Cord Injury:the SCI-POEM study[J]. Spinal Cord, 2012, 50(9): 686-94. DOI: 10.1038/sc.2012.34. |
| [31] | Gupta DK, Vaghani G, Siddiqui S, et al. Early versus delayed decompression in acute subaxial cervical spinal cord injury:A prospective outcome study at a Level I trauma center from India[J]. Asian J Neurosurg, 2015, 10(3): 158-65. DOI: 10.4103/1793-5482.161193. |
| [32] | Batchelor PE, Wills TE, Skeers P, et al. Meta-analysis of pre-clinical studies of early decompression in acute spinal cord injury:a battle of time and pressure[J]. PLoS One, 2013, 8(8): e72659. DOI: 10.1371/journal.pone.0072659. |
| [33] | Carlson GD, Minato Y, Okada A, et al. Early time-dependent decompression for spinal cord injury:Vascular mechanisms of recovery[J]. J Neurotrauma, 1997, 14(12): 951-62. DOI: 10.1089/neu.1997.14.951. |
| [34] | Huang SL, Yan HW, Wang KZ. Use of fidji cervical cage in the treatment of cervical spinal cord injury without radiographic abnormality[J]. Biomed Res Int, 2013, 2013: 1-5. |
 2018, Vol. 38
2018, Vol. 38

