2. 南方医科大学附属东莞市人民医院 肿瘤内科,广东 东莞 523059;
3. 南方医科大学附属东莞市人民医院 病理科,广东 东莞 523059
2. Department of Oncology, DongguanPeople's HospitalAffiliated to Southern Medical University, Dongguan 523059, China;
3. Department of Pathology, DongguanPeople's HospitalAffiliated to Southern Medical University, Dongguan 523059, China
肉瘤样癌是一种非常罕见的恶性肿瘤,是由恶性上皮样细胞和较多梭形细胞组成的癌[1-3]。已有各种术语,包括肉瘤样癌、未分化癌、多形性癌、化生性癌和间变型癌用于描述此类肿瘤。最新WHO关于消化道肿瘤的分类将此类肿瘤归于未分化癌,尚未将肉瘤样癌作为独立类型或亚型[4]。然而,基于其病理结构和免疫组织化学特征,肉瘤样癌是目前最普遍接受的术语,被推荐用于诊断性手术病理报告中[2-3]。肉瘤样癌多发生于呼吸道、乳腺、甲状腺、胰腺、肾脏、膀胱和食道等部位,在小肠发生的肉瘤样癌很少见报道,发生在空肠的肉瘤样癌更加罕见。经查阅国外文献,迄今为止,仅有18例已被报道,多发性仅有3例,本文为第4例报道。值得注意的是,与其他空肠肿瘤相比,肉瘤样癌更具易转移性和侵袭性[5],因此,这种疾病的患者预后极差。本研究报告1例空肠多发肉瘤样癌术后肺、脑转移患者,并进行相关文献综述。
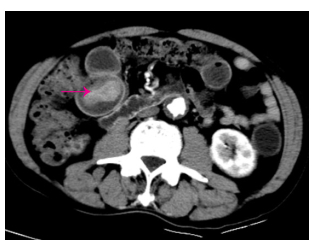
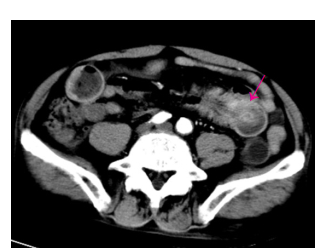
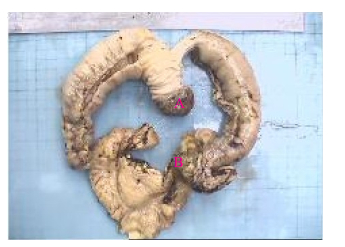
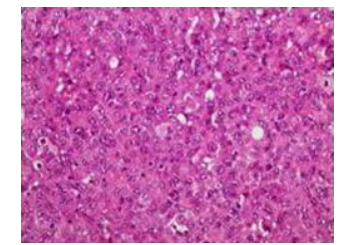
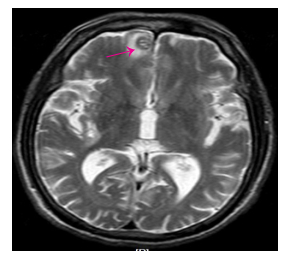
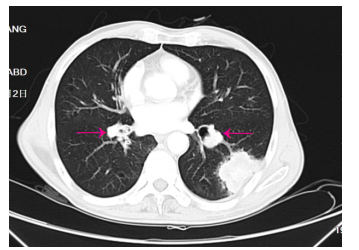
1 病例资料男,72岁,因反复上腹部疼痛、黑便、头晕4月于2016年6月17日收住我院消化内科,上腹部为阵发性胀痛,多能自行缓解,偶有呕吐,无呕吐咖啡样液或呕血,间歇性解黑便,每次量不大,头晕反复发作,无晕厥、黑朦、大汗淋漓、心悸。3 d前在外院查大便潜血阳性,患有高血压病2年余,规律服用降血压药物治疗,血压可控制。入院查体:中度贫血貌,心肺查体无异常,上腹部轻度膨隆,上腹部压痛,无反跳痛,未及腹部包块,肠鸣音活跃,6次/min,无气过水音。入院检查:白细胞10.86×109/L,血红蛋白76 g/L,红细胞压积0.25,血小板577×109/L,癌胚抗原21.78 ng/mL,大便潜血试验阳性。胃镜及结肠镜检查未见明显病变。胸片检查提示双下肺小许炎症。入院后禁食、质子泵抑制剂(PPI)抑酸护胃、止血、生长抑素、补液等治疗,上腹部胀痛无缓解,仍然间歇性有黑便解出。2016年6月24日查腹部CT提示(图 1、2):右上腹部空肠部分肠壁增厚、肠腔软组织密度肿块,考虑肿瘤病变;另左中腹部小肠局部肠壁增厚伴肠套叠改变,待排合并肿瘤,近段空肠轻度梗阻扩张。考虑小肠肿瘤并肠套叠、肠梗阻、小肠出血,遂于2016年6月25日行剖腹探查,术中见距离Treiz's韧带约50 cm处,空肠可扪及约5 cm大小肿物,质地硬,瘤体大部分位于小肠肠腔内,见肿瘤侵犯浆膜层;距离Treiz's韧带约60 cm处空肠见约5 cm肠管套叠,无法复位,其内可及约3 cm大小肿瘤,质地硬,考虑为肿瘤病变导致,空肠相关系膜内可见多发肿大淋巴结,最大直径约1.5 cm,质地韧,决定行空肠部分切除术:空肠切除约40 cm,近端肠管切缘约距离肿物约10 cm,远端肠管切缘约距离肠套叠病变约10 cm,包括扇形切除相应空肠系膜。术后病理显示(图 3):小肠肠管1段,长约35 cm,其中1段套叠,套叠长约6 cm,套叠内口直径约2 cm,外口直径约3 cm,肠管直径3~4.5 cm,距离一端切缘约10 cm处见溃疡型肿物,大小为5 cm×3 cm×0.7 cm,套叠肠管深处见1隆起型肿物,大小约为3.5 cm×3 cm×3 cm。光镜显示(图 4):异型细胞呈弥漫片状增生,局部呈巢团结构,细胞胞浆丰富,粉染,核大,圆形或不规则形,可见核仁,并可见大量瘤巨细胞,核分裂像多见。病理诊断:空肠肉瘤样癌,2个肿物,大小分别为5 cm×3 cm×0.7 cm、3.5 cm×3 cm×3 cm;侵犯肠壁全层;脉管见癌栓,未见神经侵犯,两端肠管切缘均未见癌累及;肠系膜淋巴结未见癌转移(0/29)。免疫组化:CK、CK19、Vimentin(+),CEA、CK20、Villin、CDX2、AFP、Hepatocyte(-),Ki-67约75%(+)。术后患者恢复顺利出院,拒绝行辅助化疗,密切随访,术后4月因精神异常返院复查,查颅脑MRI显示(图 5):双侧大脑半球及右侧小脑半球多发异常强化结节,考虑为转移瘤;脑萎缩。胸部CT显示(图 6):左肺上叶尖后段团块灶,伴空洞形成;右肺上叶后段肺门支气管-右肺门区肿块并右肺上叶阻塞性肺炎;双肺散在大小不等结节、团块灶;双肺肺气肿,多发肺大泡。纵隔内及双肺门区多发肿大淋巴结,部分伴坏死。腹部及盆腔CT增强扫描未发现明显肿物及肿大淋巴结等病变。考虑空肠肉瘤样癌术后肺、脑多发转移,术后8月因呼吸功能衰竭死亡。
|
图 1 空肠肿物 Figure 1 The tumor of the jejunum. |
|
图 2 空肠肿物并套叠 Figure 2 The jejunum with tumor and intussusception. |
|
图 3 纵形剖开肠管 Figure 3 Longitudinal section of the jejunum. A: A mushroom-like tumorabout 5 cm in diameter in the proximal jejunum cavity; B: Apolypoid tumor about 3.5 cm in the distal jejunum cavity with intussusception. |
|
图 4 肿瘤病理图 Figure 4 Pathologicalexamination of the tumor showing pleomorphic and diffusetumor cells with obvious pathological mitosis and nucleoli (HE staining, Original magnification: ×20). |
|
图 5 脑转移病灶 Figure 5 Brain metastasis. |
|
图 6 双肺转移病灶并空洞形成 Figure 6 Tumor metastasescausing cavities in the lungs. |
在PubMed上检索截至2017年5月发表的关于空肠肉瘤样癌的所有报道,检索主题词:"sarcomatoid carcinoma"、"undifferentiated cancer"、"pleomorphic cancer"、"metaplastic carcinoma"、"anaplastic carcinoma"以及" jejunum"、"small intestine",将其中在空肠以外小肠出现肉瘤样癌的文献报道剔除,共检索到个案报道14篇,包含18例病例。男9例,女9例,平均年龄59.2岁(35~85岁)。具体临床资料及治疗情况见表 1。
| 表 1 已发表关于空肠肉瘤样癌的文献资料汇总 Table 1 Review of published cases of sarcomatoid carcinomaof the jejunum |
小肠肉瘤样癌很少见,主要发生在回肠,其次是空肠和十二指肠[2],迄今为止文献报道仅有18例空肠肉瘤样癌。空肠肉瘤样癌中老年人发病为主,有研究报道,空肠肉瘤样癌男性发病偏多,男/女性比例为1.5:1.0[2];然而,我们的数据显示空肠肉瘤样癌患者性别比没有明显差异,男/女性比例为1.0:0.9。空肠肉瘤样癌通常只发现单一肿瘤病灶,只有4例病例报道(包括本例)出现多灶性肿瘤[6]。
在临床资料记载较完整的15例患者中(包括本例),最常出现的症状是贫血(60.0%),其次是腹痛(46.7%)、消化道出血(33.3%)、乏力(33.3%)、腹部肿块(26.7%)和体质量减轻(26.7%)等。此外,小肠梗阻(20.0%)、气促(13.3%)、心悸(13.3%)、呕吐(20.0%)、发热(13.3%)、恶心(6.7%)、腹泻(6.7%)、消化不良(13.3%)、厌食(6.7%)等也是空肠肉瘤样癌患者的常见症状。2名患者因癌性腹腔出血需要行急诊剖腹探查术[9],另外2例患者由于癌肿部位消化道穿孔合并急性腹膜炎[11, 13]亦需要行急诊剖腹探查术。本研究报道的病例是因为消化道出血及肠梗阻亦行急诊剖腹探查术。由于空肠肉瘤样癌的临床表现是非特异性的,加上小肠解剖部位的隐蔽性,这使得诊断时绝大多数这些患者已经为中晚期。
空肠肉瘤样癌通常形态是内生型或息肉样突起,中心常伴有溃疡性坏死、出血,平均尺寸为7.75 cm(3~ 16 cm),76.4%的瘤体大小在5~10 cm之间。肿瘤可发生在空肠任何部位,常具有局部淋巴结转移(81.8%),直接浸润邻近组织器官,包括小肠(42.9%)、结肠(28.6%)、肠系膜(28.6%)、网膜(28.6%)和卵巢(14.3%)等。此外,58.3%的患者中发现肿瘤侵犯周围淋巴管、血管或神经。尽管所有的空肠肉瘤样癌患者均进行手术切除,但肿瘤进展及转移迅速。最常见的转移部位是肺(53.8%),其次是远处淋巴结(包括主动脉旁淋巴结、锁骨上淋巴结、腋窝淋巴结和子宫旁淋巴结)和肝脏,而脑和骨盆也可能发生转移。报告的19例(包括本病例)患者中,17例完全随访的患者死于该病,基本上都死于肿瘤转移或复发,说明该肿瘤具有高度的侵袭性和转移性。总体而言,空肠肉瘤样癌患者的预后极差,诊断后中位生存期仅为5.5月(0.36~36月)。本研究报道的病例,空肠存在2个癌肿,较大的瘤体为内生型,并形成溃疡坏死出血,较小的瘤体为息肉样,为已知文献中第1例报道同时存在两种生长形态、第2例报道出现脑转移的病例,于诊断后8月因肿瘤转移而死亡。
组织学上,文献报道空肠肉瘤样癌可能表现为单向或双向模式的恶性肿瘤[5]。如果肿瘤主要成分为间叶细胞,具有非常小量或者缺乏上皮样细胞,这就是典型的单向模式。如肿瘤构成同时含有上皮样细胞和间叶细胞,这就是双向模式肉瘤样癌。空肠肉瘤样癌不能仅依靠HE染色确定诊断,需要根据多个生物标志物的免疫组织化学检查确定诊断[1-3]。所有报道的病例细胞角蛋白(CK)及有完整记载资料的病例波形蛋白(Vimentin)均为阳性,表明该肿瘤成分几乎都为存在上皮成分和间叶成分的双向模式。本病例的免疫组织化学结果显示CK和Vimentin阳性表达,故可明确肉瘤样癌的诊断。有个别病例报道空肠肉瘤样癌表现出相对较好的预后,这可能与Ki-67在肿瘤中表达较低有关[13]。本报道病例Ki-67约为75%阳性,预后相对较差,这与其他报道较差预后患者中Ki-67阳性值较高相符合[16]。高Ki-67阳性值可能与该类肿瘤高侵袭性和易转移性的临床特点相关。因此,Ki-67可能可以用作空肠肉瘤样癌患者的预后评估指标。
对于该病,目前没有相关的治疗指南,包括肿瘤在内的广泛切除是治疗的主要有效手段。有一些报道使用5-氟尿嘧啶和/或顺铂行术后辅助化学治疗、放射治疗等,但均没能有效改善预后。目前针对信号通路的免疫检测点程序性死亡受体Ⅰ(PD-1)及其配体PD-L1的单克隆抗体靶向治疗的临床试验,有报道对几种恶性肿瘤治疗获益。肿瘤细胞PD-L1表达上调,通过激活PD-1/PD-L1途径和抑制有效免疫应答来介导免疫逃逸,最终导致肿瘤细胞增殖[17]。既往的文献报告显示,肉瘤样肺癌中PD-L1表达上调的现象[18],而也有研究发现空肠肉瘤样癌中PD-L1蛋白的表达异常[16],因此,针对PDL1靶向免疫治疗可能对这种类型癌症有效。故对空肠肉瘤样癌患者,应该常规行PD-L1检测,以期为后续患者治疗提供有效治疗手段的可能。
空肠肉瘤样癌是多原性发病还是单一原发病灶容易多发转移目前尚未明确[19]。本研究报道的病例,术后4月发现脑部及肺部多发转移灶,不排除该例患者肿瘤为多原性发病或手术当时已经存在脑部和(或)肺部小转移病灶,由于当时未作进一步全身多部位扫描检查而未能发现这些小病灶;术后4月复查盆腹腔CT未发现肿瘤复发病灶,说明如能对局部的瘤体清除干净,可有效延缓肿瘤局部复发。假设早期发现这些转移灶,针对这些转移灶,如能行R0切除,或不适合行手术切除而运用目前治疗肿瘤确切有效的各种局部治疗手段(如射频消融、γ刀、放射性粒子等),达到消除肿瘤或控制肿瘤生长,患者预后的改善则可期。
从表 1看出,2009年以后,空肠肉瘤样癌病例报道明显增多,几乎每年都有新发病例,说明该病有一定发病率,可能由于既往诊断技术的落后或部分因为该病死亡的患者未能明确诊断而导致文献报道例数较少,随着影像学、病理免疫组化等诊断技术水平的提高,该病病例报道可能会明显增加,由于空肠肉瘤样癌是一种具有高转移性的侵袭性肿瘤、预后极差,因此,其诊断及治疗值得重视。运用目前各种先进的检查手段,尽可能早检查,明确诊断后行全身多部位扫描检查明确是否存在多发病灶或转移病灶,对病程的充分评估,行根治性手术切除,可有效改善患者的预后。针对多发病灶或转移病灶,行R0切除或运用目前治疗肿瘤的各种局部治疗手段,值得尝试。此外,肿瘤的发病机理、Ki-67作为空肠肉瘤样癌预后判断的生物标志物和PD-L1靶向免疫治疗的潜在价值需要进一步探究。
| [1] | Fukuda T, Kamishima T, Ohnishi Y, et al. Sarcomatoid carcinoma of the small intestine: histologic, immunohistochemical and ultrastructural features of three cases and its differential diagnosis[J]. Pathol Int, 1996, 46(9): 682-8. DOI: 10.1111/pin.1996.46.issue-9. |
| [2] | ReidM, Idrees M, Perino G, et al. Sarcomatoid carcinoma of the small intestine -A case report and review of the literature[J]. Arch Pathol Lab Med, 2004, 128(8): 918-21. |
| [3] | Lee HM, Cho MS, Kim YI. A surgically resected large sarcomatoid carcinoma of the jejunum: a case report and literature review[J]. J Gastric Cancer, 2015, 15(2): 143-6. DOI: 10.5230/jgc.2015.15.2.143. |
| [4] | Bosman FT, Carneiro F, Hruban RH, et al. WHO classification of tumours of the digestive system[M]. lyon: iarc press, 2010: 125-31. |
| [5] | RobeySS, Silva EG, Cleary KR. Anaplastic and sarcomatoid carcinoma of the small intestine: a clinicopathologic study[J]. Hum Pathol, 1989, 20(9): 858-63. DOI: 10.1016/0046-8177(89)90097-X. |
| [6] | Kwok CM. Sarcomatoid carcinoma of the jejunum with gastric metastases: a case report and review of the literature[J]. Int J Surg Case Rep, 2016, 28(11): 161-4. |
| [7] | Bak M, Teglbjaerg PS. Pleomorphic(giant cell) carcinoma of the intestine:an immunohistochemical and electron microscopic study[J]. Cancer, 1989, 64(12): 2557-64. DOI: 10.1002/(ISSN)1097-0142. |
| [8] | Lam KY, Leung CY, Ho JW. Sarcomatoid carcinoma of the small intestine[J]. Aust J Surg, 1996, 66(9): 636-9. DOI: 10.1111/ans.1996.66.issue-9. |
| [9] | Tsukadaira A, Koizumi T, Okubo Y, et al. Small-intestinal sarcomatoid carcinoma with superior vena cava syndrome[J]. J Gastroenterol, 2002, 37(6): 471-5. DOI: 10.1007/s005350200069. |
| [10] | Moriwaki Y, Sugiyama M. Severe anemia inducing preshock caused by sarcomatoid carcinoma of the small intestine[J]. Int Surg, 2009, 94(2): 164-70. |
| [11] | Yucel AF, Kocakusak A, Arikan SA, et al. A rare cause of acute abdomen: Perforated primary sarcomatoid carcinoma of the small intestine -Report of a case, with a brief review of the literature[J]. J Cancer Res Ther, 2011, 7(3): 348-50. DOI: 10.4103/0973-1482.87005. |
| [12] | Pata F, Sengodan M, Tang CB, et al. Concomitant jejunal sarcomatoid carcinoma and gastric GIST in patient with polymyalgia rheumatica: A case report[J]. Int J Surg Case Rep, 2013, 4(5): 449-52. DOI: 10.1016/j.ijscr.2013.02.007. |
| [13] | Han N, Han QH, Liu YZ, et al. Perforated sarcomatoid carcinoma of the jejunum: case report[J]. Oncol Lett, 2013, 6(2): 562-4. |
| [14] | Kang K, Yoon JH, Kang G. Sarcomatoid carcinoma of the small intestine: a case report and review of the literature[J]. J Korean Soc Radiol, 2013, 69(4): 295-9. DOI: 10.3348/jksr.2013.69.4.295. |
| [15] | Alfonso PN, JimenezC, Higuera MI. Sarcomatoid carcinoma of the jejunum presenting as obscure gastrointestinal bleeding in a patient with a history of gliosarcoma[J]. Gastroenterol Rep(Oxf), 2014, 2(2): 150-3. DOI: 10.1093/gastro/gou007. |
| [16] | Zhang B, Cheng BO, Wang L, et al. Primary sarcomatoid carcinoma of the jejunum with massive intra-abdominal hemorrhage: a case report and review of the literature[J]. Molec Clin Oncol, 2016, 4(5): 811-6. DOI: 10.3892/mco.2016.809. |
| [17] | Brahmer JR, Tykodi SS, Chow LQ, et al. Safety and activity of antiPD-L1 antibody in patients with advanced cancer[J]. N Engl J Med, 2012, 366(26): 2455-65. DOI: 10.1056/NEJMoa1200694. |
| [18] | Velcheti V, Rimm DL, Schalper KA. Sarcomatoid lung carcinomas show high levels of programmed death ligand-1 (PD-L1)[J]. J Thorac Oncol, 2013, 8(6): 803-5. DOI: 10.1097/JTO.0b013e318292be18. |
| [19] | 韩小于, 刘珺, 潘庆, 等. 小肠多发性肉瘤样癌一例[J]. 中华病理学杂志, 2017, 46(2): 118-9. |
 2017, Vol. 37
2017, Vol. 37

