2. 重庆医科大学附属第二医院,重庆 400010
2. Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
再生障碍性贫血(AA)是一种以骨髓造血功能低下、全血细胞减少和贫血、出血、感染为主要表现的造血功能衰竭症。我国的年均发病率为0.74/10万人,可发生于各个年龄段,老年人发病率较高,男、女发病率无显著差异[1]。AA致死率高且很难治愈,其中急性AA预后极差,仅少数病情较轻的患者可获得缓解或治愈[2]。为了对AA的发生发展及治疗方法进行深入研究,需要建立合适的AA动物模型。
AA的发病机制极为复杂,尚无定论,造模方法各异,包括物理方法、化学方法、物理化学方法、免疫介导方法等[3],但目前的造模方法存在着诸如AA期不稳定、三系水平降低不一致、操作过程复杂、诱发率低等缺点[4-8]。
为建立一种更符合临床AA特性、更稳定的AA动物模型,本课题组参考多种造模方法[5-12],对这些方法建立的模型的优缺点进行了分析,确定了苯和环磷酰胺联合使用在新西兰兔建立AA模型的方法,并参考以上方法中的实验参数进行了正交设计,以期建立更符合临床AA特性、稳定的AA动物模型,且在此基础上能筛选出较优方案。
1 材料和方法 1.1 材料 1.1.1 实验动物健康成年新西兰兔,共90只,雌雄不限,体质量2±0.2 kg,均由重庆医科大学实验动物中心提供[生产许可证:SCXK(渝)2012-0001]。所有动物都饲养在同样的实验室环境下(温度22±2 ℃,湿度45± 5%,12 h明暗周期)。实验中对所有动物的处理都符合2006年科技部颁发的《关于善待实验动物的指导性意见》。
1.1.2 试剂与仪器注射用苯(分析纯,国药集团化学试剂沈阳有限公司);环磷酰胺(江苏恒瑞医药股份有限公司);EDTA-2K(北京索莱宝科技有限公司);HEMAVET950FS型全自动五分类血液分析仪(美国DREW公司);SM2000R型石蜡切片机(德国Leica公司);Olympus-BX51型光学显微镜(日本OLYMPUS公司)。
1.2 方法 1.2.1 新西兰兔AA模型分组处理参照颜虹[13]主编的第2版医学统计学教材四因素三水平正交表L9(34)将90只新西兰兔随机分成9个实验组(表 1),每组10只。实验组严格按正交设计表给药,先背部皮下注射苯,隔日1次,直至注射完正交表规定的次数;待苯全部注射完毕,再于耳缘静脉注射环磷酰胺,每天注射,直至注射完正交表规定的次数。
| 表 1 苯和环磷酰胺正交设计表 Table 1 Orthogonal design table of benzene and cyclophosphamide (n=90) |
观察实验过程中新西兰兔的精神状态、皮肤毛发及体质量变化等情况并记录其死亡时间,计算生存率。
1.2.2.2 血常规检测每6 d检测1次血常规。将新西兰兔耳中动脉附近的兔毛拔除,用酒精棉球擦拭,待血管充盈后,用2 mL的注射器抽取1 mL血液,快速注入含EDTA二钾盐的一次性采血管中,来回摇晃采血管,防止血液凝固,2 h内使用全自动血细胞计数分析仪进行血常规分析,检测白细胞(WBC)、红细胞(RBC)、血小板(PLT)计数。
1.2.2.3 骨髓组织病理学观察于建模前、建模36 d后将新西兰兔耳缘静脉注射空气处死,在消毒的情况下解剖取小段股骨,取出的骨组织标本尽快浸泡于4%多聚甲醛溶液中固定,经过脱水、石蜡包埋、切片和苏木精—伊红染色法染色后,在光学显微镜下观察细胞的形态结构。
1.2.3 判定模型成功的标准白细胞下降≥50%,红细胞和血小板下降≥20%,并且骨髓涂片或切片显示骨髓增生低下,脂肪组织增加即可诊断为再生障碍性贫血[14-15]。
1.3 统计学分析应用SPSS 22.0统计软件对数据进行整理分析。各项数据均用均数±标准差表示,细胞计数日均下降速率之差采用测量时间固定的二水平模型分析,P<0.05认为差异有统计学意义。
2 结果 2.1 一般情况观察及生存率 2.1.1 一般情况观察新西兰兔用药结束后第6天有部分新西兰兔开始出现反应迟钝,耳廓苍白,皮毛光泽变差,部分新西兰兔有脱毛等表现,各组达到诊断标准的时间及死亡率(表 2),第1、2、3组新西兰兔分别最快于给药后第12、24、30天出现死亡,血常规均未达到诊断标准,死亡率分别为10%、20%、0%;第4、5、6组新西兰兔分别最快于给药后第16、22、16天出现死亡,血常规分别于第21、21、24天达到诊断标准,死亡率均为40%;第7、8、9组新西兰兔分别最快于给药后第3、6、9天出现死亡,血常规分别于第18、18、30天达到诊断标准,死亡率分别为70%、60%、70%。
| 表 2 兔的一般情况 Table 2 General condition of rabbit |
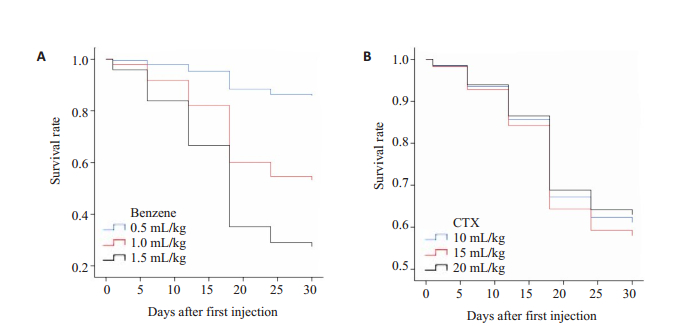
9组新西兰兔在联合使用苯和环磷酰胺后生存率出现了差异,并且随着苯剂量的增加而下降,使用SPSS22.0进行生存函数分析后发现仅有苯的剂量对生存率的影响有统计学意义(P<0.05),环磷酰胺的剂量对生存率的影响(图 1B)没有统计学意义(P>0.05,图 1A),且药物的注射次数对生存率的影响也不存在统计学意义(P>0.05)。
|
图 1 苯和环磷酰胺的剂量对各自生存率的影响 Figure 1 Effects of benzene and cyclophosphamide doses on survival rate of the rabbits. |
各组组间红细胞计数进行比较(表 3),第7、8、9组红细胞日均下降速率之差比部分其他组大,其中第7组与第2、3、4、5、6组红细胞日均下降速率之差存在统计学意义(P<0.05);第8组与第1、2、3、4、5、6组红细胞日均下降速率之差有显著差异(P<0.001),与第9组也存在差异(P<0.05);第9组与第2、4、8组红细胞日均下降速率之差有统计学意义(P<0.05)。按与其他各组存在统计学意义组数进行排序,第8组>第7组>第9组。
| 表 3 各组间红细胞日均下降速率之差的比较 Table 3 Comparison of daily mean descending rate of erythrocytes between groups (n=90) |
各组组间白细胞计数进行比较(表 4),第7、8、9组白细胞日均下降速率之差比部分其他组大,其中第7组与第1、2、3、4、5、6、8组白细胞日均下降速率之差存在明显差异(P<0.01);第8组与第2、6、7组白细胞日均下降速率之差存在差异(P<0.05);第9组与第2、3、6组白细胞日均下降速率之差存在差异(P<0.05)。按与其他各组存在统计学意义组数进行排序,第7组>第8组=第9组。
| 表 4 各组间白细胞日均下降速率之差的比较 Table 4 Comparison of daily mean descending rate of white blood cells between groups (n=90) |
各组组间血小板计数进行比较(表 5),第7、8、9组血小板日均下降速率之差比部分其他组大,其中第7组与第1、2、3、4、5、6组血小板日均下降速率之差存在差异(P<0.05);第8组与第5、6组血小板日均下降速率之差存在差异(P<0.05);第9组与第6组血小板日均下降速率之差存在差异(P<0.05)。按与其他各组存在统计学意义组数进行排序,第7组>第8组>第9组。
| 表 5 各组间血小板日均下降速率之差的比较 Table 5 Comparison of daily mean descending rate of platelet between groups (n=90) |
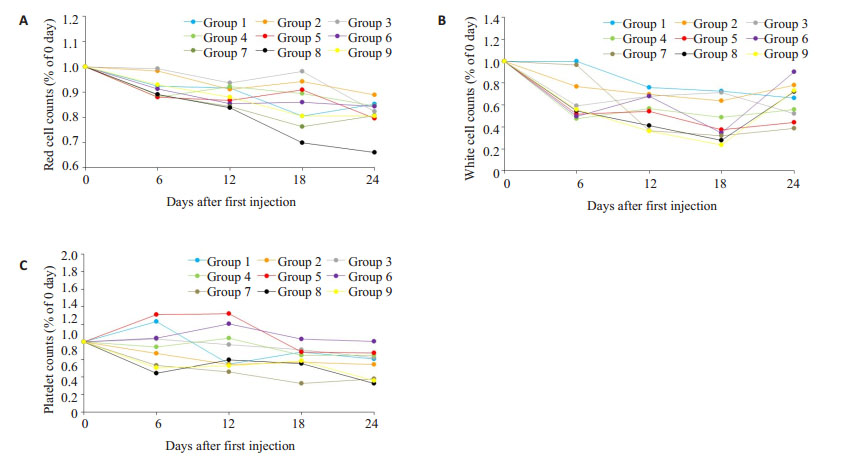
各组的红细胞、白细胞、血小板动态变化(图 2),红细胞数量给药后每天相对于0天的百分比变化(图 2A),由图可见下降幅度最大的为第8组,但18、24天仍出现了大幅下降,表明模型的稳定性较差,第7组下降迅速且保持稳定;白细胞数量给药后每天相对于0天的百分比变化(图 2B),从图中可以看出第6、8、9组在18天以后开始大幅度的升高,不利于建模,仅第7组下降后一直保持稳定;血小板数量给药后每天相对于0天的百分比变化(图 2C),从图中我们依然能够看出第8、9组12、18天有明显的回升,第24天继续下降,第7组是唯一一组稳定保持下降趋势的组;由此可见,第7组为9组中下降达到标准且最为稳定的组。
|
图 2 血常规动态变化 Figure 2 Dynamic changes in blood routine of the rabbits. |
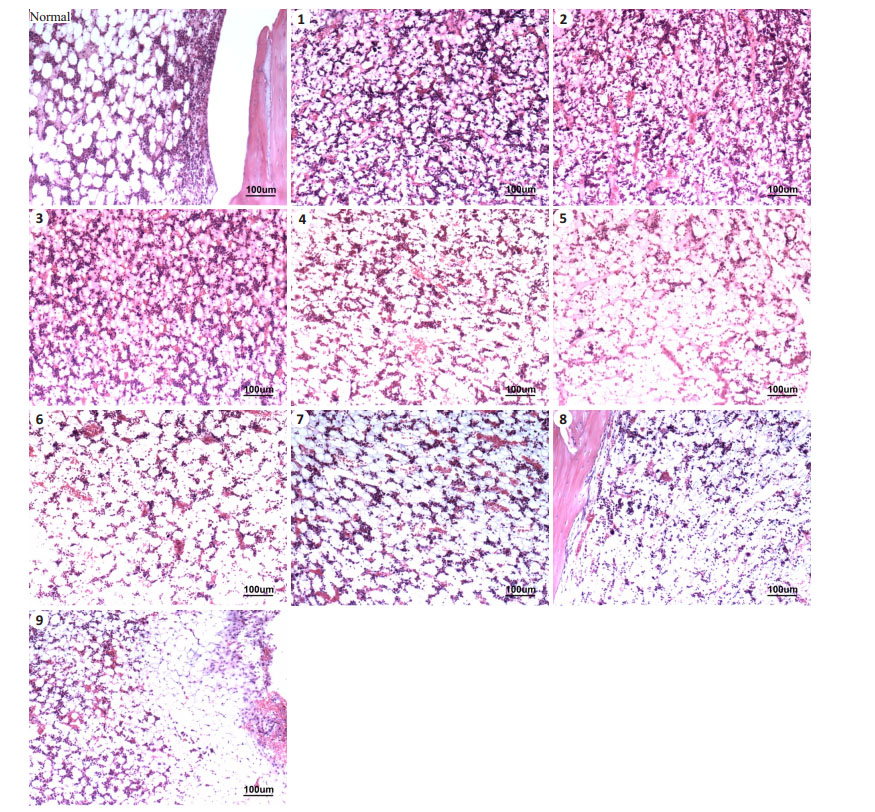
比较各组骨髓病理切片(图 3),由图可见1、2、3组新西兰兔骨髓切片造血组织较丰富,结构基本完整,不符合再障标准。4~9组骨髓增生低下,造血组织减少,巨核细胞减少或消失,脂肪细胞增多,与再障特征相符合。
|
图 3 新西兰兔骨髓病理切片 Figure 3 Cross sections of bone marrow of the rabbits (HE staining, Original magnification: ×100). The numbers 1-9 represent Groups 1-9 respectively. |
结合以上结果,发现4~9组各项指标均符合AA标准,其中第7、8、9组三系日均下降速率对比其他组有统计学意义,尤以第7组模型更佳。
3 讨论动物模型的建立是研究中毒性疾病极其重要的途径,各种造模方法各有优缺点,可依据不同的实验目的选择相应的动物模型来研究中毒性疾病的发生发展[16]。查阅国内外AA多种造模方法[5-11],发现绝大多数AA模型均采用小鼠做为实验动物,且成功建立AA模型。但剂量很难控制,量大小鼠容易死亡,量小个别小鼠不易达到抑制效果。小鼠血量较少,全血5.85 mL/100 g,血浆3.15 mL/100 g[17-18],很难实现长期短时间多次重复采血,且不对小鼠血液系统产生影响。本课题组考虑小鼠AA模型有这些缺点,采用新西兰兔作为实验动物,可实现短时间多次重复采血,对实验动物的影响较小,有利于AA模型的建立及持续稳定检测实验指标[19-20]。
苯是最常使用的化学毒物,慢性苯中毒时苯主要富集于骨髓,造成血液系统损害[4]。Velasco等[5]给CD1小鼠注射2 mL/kg苯,每周3~5次,共计20次,建立CD1小鼠AA模型,可见外周血细胞、骨髓细胞数量减少。雾化吸入苯10周可导致昆明鼠出现AA,主要表现为红细胞集落形成障碍,红系祖细胞减少[6],但操作过程复杂,诱发率低。张擎等[7]首次采用大剂量环磷酰胺200 mg/kg·b.w.尾静脉注射,紧接着连续7 d以维持剂量30 mg/kg·b.w.腹腔注射建立免疫低下动物模型,实验动物外周血象出现明显降低,骨髓象检查显示正常造血组织被抑制。单纯使用环磷酰胺造模发现外周血中白细胞显著下降[21],而红细胞下降缓慢且不明显,且停药后血象迅速上升,表明使用环磷酰胺仅能引起骨髓的可逆性损伤,如剂量依赖性的红细胞、血红蛋白、粒细胞集落刺激因子减少,而这些指标均可在停药后短时间内恢复正常[8]。孙纪元等[9]采用60Co-γ射线、环磷酰胺和氯霉素复合法获得了AA模型,但需要特殊设备,专业人员,操作不便,且辐射剂量难以控制,过程繁琐[3]。本研究借鉴文献及以往的经验科学合理的选用药物联合的造模方法。
研究结果显示,已成功建立新西兰兔AA模型。实验组相互之间比较,第1、2、3组未成功建立新西兰兔AA模型;第4、5、6组成功建立新西兰兔AA模型,但三系下降较慢,周期长,不稳定;第7、8、9组新西兰兔AA模型各项指标均符合AA标准,其中第7组AA模型更优,且该组新西兰兔的一般情况、三系血细胞计数、骨髓组织学检查均有较明显的变化,表明本组使用的药物剂量是AA造模比较理想的剂量。我们在第51天对第7组存活的新西兰兔的血常规进行了检测发现该组血常规仍满足AA诊断标准,说明该组模型稳定性强。本研究结果提示相对于单药使用,给药时间较长、AA发生时间不统一等缺点,我们采用该剂量苯与环磷酰胺联合使用建立的新西兰兔AA模型具有造模周期短,操作简便,成功率高,发生骨髓造血功能障碍的时间较为固定,各项指标与人的AA类似等优点。
AA的机制研究主要分为以下3个阶段。第1阶段:AA的发生被认为主要是由于药物及化学物质毒性作用所引起。第2阶段:随着各种微观科学的迅速发展,研究发现AA的病理机制呈现出高度的异质性,“种子(造血干细胞异常)”、“土壤(造血微环境异常)”和“虫子(免疫功能异常)”学说渐渐成为主流。第三阶段:随着机制研究的不断进展,T细胞功能亢进引发骨髓造血组织损伤的理论被越来越多的学者认可[22-24],可见AA的发病机制较复杂且目前尚不十分明确,仅能确定其主要涉及免疫功能异常等方面[25-27]。在此基础之上,我们运用机制第一阶段的研究,采用了药物及化学物质毒性作用引起再障。同时本实验第7组也满足AA的特征及诊断标准,AA的特征主要为外周血全血细胞减少和骨髓造血功能衰竭,不足在于未进行深入的机制研究,针对于此,后期实验研究将进一步加深对AA机制的探索。
本研究也有需要改进之处,苯剂是最早用于制作AA模型的试剂之一,可引起多品系小鼠的造血功能障碍[28]。第7组死亡出现较早,死亡率略高,其主要原因也是由苯的剂量引起,苯在建立AA动物模型中不可或缺。本次模型成功,但过高的死亡率会造成动物实验成本增大,因此后期还需要筛选苯的剂量以使该方法建立的模型更适宜国内研究者用于开展对AA的深入研究。
综上所述,采用苯1.5 mL/kg,8次/d,环磷酰胺10 mg/kg,4次/d,这一组合剂量建立的新西兰兔AA模型建模周期短、符合临床AA各项特征、且模型稳定,是一种可广泛应用于动物实验的建模方法。
| [1] | 葛均波, 徐永健. 内科学[M]. 8版. 北京: 人民卫生出版社, 2014. |
| [2] | Brodsky RA, Jones RJ. Aplastic anaemia[J]. Lancet, 2005, 365(9471): 1647-56. DOI: 10.1016/S0140-6736(05)66515-4. |
| [3] | 孙婷婷, 徐文瑞, 祝晓玲. 再生障碍性贫血动物模型研究概况[J]. 中药药理与临床, 2012(02): 191-3. |
| [4] | Yu K, Yang KY, Ren XZ, et al. Amifostine protects bone marrow from benzene-induced hematotoxicity in mice[J]. Int J Toxicol, 2007, 26(4): 315-23. DOI: 10.1080/10915810701489697. |
| [5] | Ly H. Genetic and environmental factors influencing human diseases with telomere dysfunction[J]. Int J Clin Exp Med, 2009, 2(2): 114-30. |
| [6] | 张宇辰, 赵明峰. 针对不同发病机制建立再生障碍性贫血动物模型的研究概况[J]. 中国实验血液学杂志, 2015, 23(1): 285-9. |
| [7] | 张擎, 彭红娟, 余晓彬, 等. 环磷酰胺诱发小鼠血小板减少症模型的建立及其血小板功能的测定[J]. 南方医科大学学报, 2003, 23(12): 1277-9. |
| [8] | Krośniak M, Papież MA, Kaczmarczyk J, et al. Influence of fructose and fatty-rich diet combined with Vanadium on bone marrow cells[J]. Biol Trace Elem Res, 2013, 155(2): 276-82. DOI: 10.1007/s12011-013-9791-8. |
| [9] | 孙纪元, 王四旺, 谢艳华, 等. 再生障碍性贫血的动物模型实验研究[J]. 中国比较医学杂志, 2000, 10(4): 210-2. |
| [10] | Jung S, Ro SW, Jung G, et al. Sleeping Beauty transposon system harboring HRAS, c-Myc and shp53 induces sarcomatoid carcinomas in mouse skin[J]. Oncol Rep, 2013, 29(4): 1293-8. DOI: 10.3892/or.2013.2264. |
| [11] | 肖纯, 黄越燕, 黄桂林, 等. 环磷酰胺和甲苯合用复制小鼠再生障碍性贫血模型及病理学观察[J]. 中国比较医学杂志, 2005, 15(1): 7-9. |
| [12] | 李锐, 陈文娜, 范梦天. 苯诱发再生障碍性贫血小鼠模型建立[J]. 中国公共卫生, 2010(6): 738-9. DOI: 10.11847/zgggws2010-26-06-43. |
| [13] | 颜虹. 医学统计学[M]. 2版. 北京: 人民卫生出版社, 2010. |
| [14] | Chatterjee S, Dutta RK, Basak P, et al. Alteration in marrow stromal microenvironment and apoptosis mechanisms involved in aplastic anemia:an animal model to study the possible disease pathology[J]. Stem Cells International, 2010: 932354. |
| [15] | Chatterjee S, Chaklader M, Basak P, et al. An animal model of chronic aplastic bone marrow failure following pesticide exposure in mice[J]. Int J Stem Cells, 2010, 3(1): 54-62. DOI: 10.15283/ijsc.2010.3.1.54. |
| [16] | 赵波, 菅向东, 张忠臣, 等. 几种中毒性疾病实验动物模型研究进展[J]. 毒理学杂志, 2009(06): 502-5. |
| [17] | 施新猷. 现代医学实验动物学[M]. 北京: 人民军医出版社, 2000. |
| [18] | 金岩. 小鼠发育生物学与胚胎实验方法[M]. 北京: 人民卫生出版社, 2005. |
| [19] | Bär C, Huber N, Beier F, et al. Therapeutic effect of androgen therapy in a mouse model of aplastic anemia produced by short telomeres[J]. Haematologica, 2015, 100(10): 1267-74. DOI: 10.3324/haematol.2015.129239. |
| [20] | Liu B, Luo Y, Luo D, et al. Treatment effect of low intensity pulsed ultrasound on leukopenia induced by cyclophosphamide in rabbits[J]. Am J Transl Res, 2017, 9(7): 3315-25. |
| [21] | Barreto JN, Mccullough KB, Ice LL, et al. Antineoplastic agents and the associated myelosuppressive effects: a review[J]. J Pharm Pract, 2014, 27(5): 440-6. DOI: 10.1177/0897190014546108. |
| [22] | 刘春燕, 邵宗鸿. 再生障碍性贫血发病机制研究进展[J]. 中国实用内科杂志, 2016, 36(5): 345-9. |
| [23] | Muir KR, Chilvers CE, Harriss C, et al. The role of occupational and environmental exposures in the aetiology of acquired severe aplastic anaemia: a case control investigation[J]. Br J Haematol, 2003, 123(5): 906-14. DOI: 10.1046/j.1365-2141.2003.04718.x. |
| [24] | Jung M, Dunbar CE, Winkler T. Modeling human bone marrow failure syndromes using pluripotent stem cells and genome engineering[J]. Mol Ther, 2015, 23(12): 1832-42. DOI: 10.1038/mt.2015.180. |
| [25] | Kordasti S, Marsh J, Al-Khan S, et al. Functional characterization of CD4+ T cells in aplastic anemia[J]. Blood, 2012, 119(9): 2033-43. DOI: 10.1182/blood-2011-08-368308. |
| [26] | Xiao Y, Wang Y, Li L, et al. Homing of chloromethylbenzoyl ammonia-labeled bone marrow mesenchymal stem cells in an immune-mediated bone marrow failure mouse model in vivo[J]. Genet Mol Res, 2014, 13(1): 11-21. DOI: 10.4238/2014.January.3.2. |
| [27] | Zhao W, Zhang Y, Zhang P, et al. High programmed death 1 expression on T cells in aplastic anemia[J]. Immunol Lett, 2017, 183: 44-51. DOI: 10.1016/j.imlet.2017.01.016. |
| [28] | 张凯竟, 杨云芳, 董丽华, 等. 苯中毒性再生障碍性贫血发病机制研究[J]. 中华内科杂志, 2007, 46(1): 61-3. |
 2017, Vol. 37
2017, Vol. 37

