2. 青岛大学附属医院感染科, 山东 青岛 370200;
3. 广东省广州市番禺区人民医院消化内科, 广东 广州 510000
2. Department of Infectious Disease, Qingdao University Affiliated Hospital, Qingdao 370200, China;
3. Department of Gastroenterology, Guangzhou Panyu Central Hospital, Guangzhou 510000, China
Peutz-Jeghers综合征(PJS)是一种常染色体显性遗传病,其特征是胃肠道多发息肉,皮肤、黏膜黑色素过度沉着,全身多器官罹患肿瘤风险增高[1]。胃肠道息肉的病理类型以错构瘤息肉为主,其细胞组成成分正常,但细胞排列极性紊乱,纤维间质增生,内部结构扭曲[2]。前期研究表明,有多条信号通路参与了PJS错构瘤的恶变过程[3],但目前对参与PJS错构瘤的前期演变过程的机制研究较少。肝激酶B1(LKB1)基因作为抑癌基因,定位于19p13.3染色体,其编码的丝氨酸/苏氨酸蛋白激酶对维持细胞极性、代谢、细胞增殖等细胞功能至关重要[4-5]。该基因突变为PJS的主要病因,约80% PJS患者可检测到LKB1突变[6]。LKB1突变可使LKB1激酶活性降低,甚至丧失[7]。上皮间质转化(EMT)过程可使上皮细胞获得迁移能力,近年来研究发现病理性EMT过程能促进器官纤维化及肿瘤进展[8-9]。但目前PJS错构瘤内是否存在LKB1调控EMT过程尚不明确。本研究以PJS错构瘤及肠细胞为研究对象,探讨LKB1调控EMT过程在PJS错构瘤演变中的作用,以期能为PJS错构瘤治疗提供新的有价值的依据。
1 资料和方法 1.1 材料与仪器NCM460细胞株为本实验室冻存保种,DMEM基础培养液、胎牛血清、青霉素/链霉素(Gibico),LKB1、ecadherin、vimentin、ncadherin、snail、slug(CST),RIPA缓冲液(Beyotime),蛋白酶抑制剂(Fdbio Science),慢病毒载体、转染试剂Polybrene及Enhance液(吉凯)。CCK8试剂(同仁)。Transwell小室(Corning)。逆转录及qPCR试剂盒(Takara)。
1.2 方法 1.2.1 临床样本收集收集南方医科大学南方医院2014年~2016年内镜下切除PJS息肉20例,其中男性8例,女性12例,年龄9~27岁,平均年龄16岁。所有PJS病人均无肿瘤病史,所有息肉经病理诊断证实为PJS错构瘤息肉。并搜集10例正常肠粘膜组织(取自肠癌组织切除残端,距离癌组织5 cm以上,切缘阴性)为对照组。所有标本均经资深病理科医师审查及筛选。
1.2.2 免疫组化取石蜡标本,所有标本4 μm连续切片,梯度酒精脱蜡、水化,常规抗原修复后用山羊血清封闭,分别对应加入LKB1一抗(1:100)、ecadherin一抗(1:100)、vimentin一抗(1:100),4 ℃冰箱孵育过夜。37 ℃恒温下二抗孵育30 min,PBS冲洗3次后滴加DAB显色。蒸馏水洗涤后苏木素复染,中性树脂封片。正置显微镜下观察LKB1、ecadherin、vimentin阳性表达情况。
1.2.3 Masson三色染色取石蜡标本,常规脱蜡至水,Masson复合染色液、5%磷钨酸、苯胺蓝分别染色5 min,0.2%醋酸水溶液洗涤,无水乙醇脱水,二甲苯透明,中性树脂封片。正置显微镜下观察胶原纤维沉积情况。
1.2.4 细胞培养NCM460细胞株用含10%胎牛血清和1%青霉素/链霉素的DMEM高糖培养基培养,在37 ℃、5% CO2孵箱中培育,定期换液。
1.2.5 细胞稳定转染以2~4×105/孔的密度将细胞均匀接种于6孔板,细胞贴壁24 h后,以Polybrene及Enhance液为转染介质,将针对LKB1的shRNA质粒(5'-'TCTACACTCAGGACTTCAC-3)'或空白对照序列转染至细胞,12~16 h后换液,72 h后嘌呤霉素筛选,得到稳定转染细胞株用于后续实验。
1.2.6 CCK8实验96孔板中每孔加入1000个细胞,在0、24、48、72、96 h各时间点加入10 μL CCK8试剂,37 ℃恒温孵育1 h。使用酶标仪在波长450 nm处检测各孔吸光度A。
1.2.7 Transwell迁移试验取对数生长期细胞消化、离心后,无血清培养基重悬细胞,细胞密度为3~5×105/mL。Transwell小室上室加入200 μL无血清培养基,下室加入500 μL含20%胎牛血清DMEM培养基。37 ℃,5% CO2孵箱孵育16~20 h后,4%多聚甲醛固定细胞后结晶紫染色。在显微镜下200×随机选取5个视野,计算迁移到下室的细胞数。
1.2.8 Western blot检测对数生长期细胞用PBS洗涤,加入RIPA缓冲液及蛋白酶抑制剂提取总蛋白,BCA法检测蛋白浓度。10% SDS-PAGE凝胶电泳分离蛋白质,转膜后用5%脱脂牛奶孵育PVDF膜,LKB1,ecadherin,ncadherin,vimentin,snail,slug和GAPDH一抗分别孵育过夜。加入对应二抗室温孵育1 h,TBST洗涤后化学发光显示。
1.2.9 荧光定量PCR按照Trizol试剂盒说明书提取细胞总RNA。使用逆转录试剂盒逆转录第一条cDNA链。使用SYBR Green混合物在罗氏LightCycler480系统上进行荧光定量PCR。通过2-△△ct方法计算基因表达。
1.2.10 免疫荧光在细胞爬片上培养细胞至合适密度,4%多聚甲醛固定细胞,0.5% Triton X-100通透。ecadherin或vimentin一抗4 ℃孵育。用带有罗丹明荧光的二抗常温下孵育细胞1 h,并用DAPI染细胞核,抗荧光淬灭剂封片。使用荧光倒置显微镜和共焦显微镜观察目的蛋白在细胞内的位置和表达。
1.3 统计学分析使用SPSS 19.0软件,GraphPad PRISM5.01版、Image J软件进行分析,Spearman相关和线性回归分析用于评估相关性,数据使用重复测量的方差分析或析因设计的方差分析,两两比较使用LSD法,P < 0.05认为差异具有统计学意义。
2 结果 2.1 LKB1蛋白在PJS错构瘤及正常肠组织中表达情况LKB1蛋白主要定位于细胞质。我们首先检测了LKB1在组织上皮细胞中表达情况,免疫组织化学显示,PJS错构瘤中,LKB1阴性表达或低表达共15例,正常组织中LKB1均为高表达。免疫反应性评分(IRS评分)提示PJS组织中LKB1强度评分较正常组织中明显降低,差异有统计学意义(P < 0.01,图 1A、B)。Masson染色显示,在错构瘤黏膜层间质区域中,胶原纤维的沉积明显增加(图 1C、D)。Spearman相关性分析显示,LKB1表达与纤维化面积呈负相关(r=-0.552,P < 0.01,图 1E)。
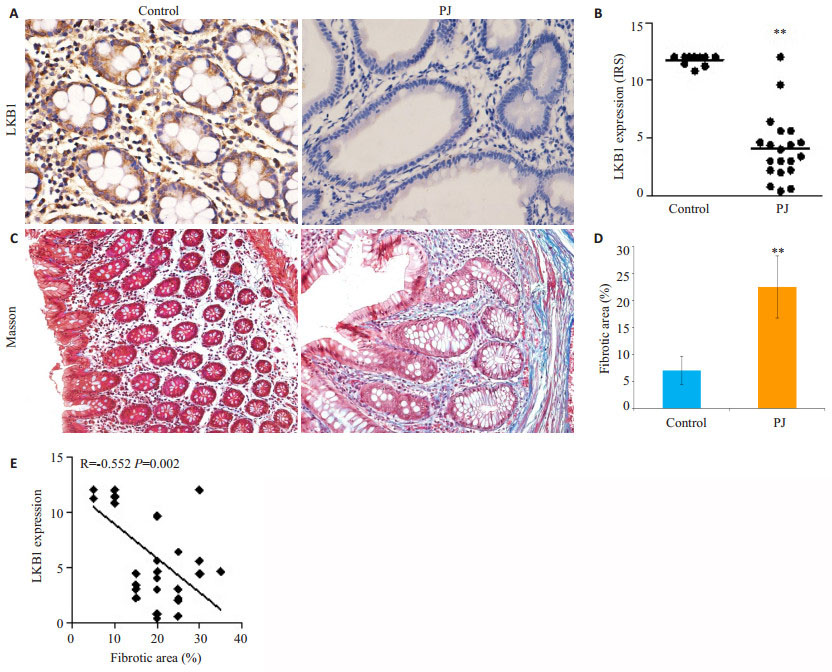
|
图 1 PJS错构瘤及正常肠道组织LKB1蛋白表达及纤维沉积情况 Figure 1 Expression of LKB1 (Original magnification: ×400) and fibrotic area (×200) in PJS hamartoma and normal intestinal tissues. Control: Normal intestinal tissues. PJ: PJS hamartoma. A, B: Protein expression of LKB1; C, D: Collagen fibrotic area analyzed with Masson trichrome staining; E: Correlation between the expression of LKB1 and collagen fibrotic area. **P < 0.01 vs control. |
Ecadherin蛋白主要定位在细胞膜,vimentin蛋白表达定位于细胞质。我们检测组织中EMT分子表达情况,免疫组织化学结果显示,与正常肠组织相比,PJS错构瘤上皮细胞细胞膜和细胞质中,ecadherin表达降低,差异有统计学意义(图 2A、B),而vimentin表达增高,差异有统计学意义(图 2C、D)。与LKB1进行相关性分析,结果显示LKB1的表达与ecadherin呈正相关(r=0.577,P < 0.01,图 2E),而vimentin与LKB1呈负相关(r=-0.483,P < 0.01,图 2F)。
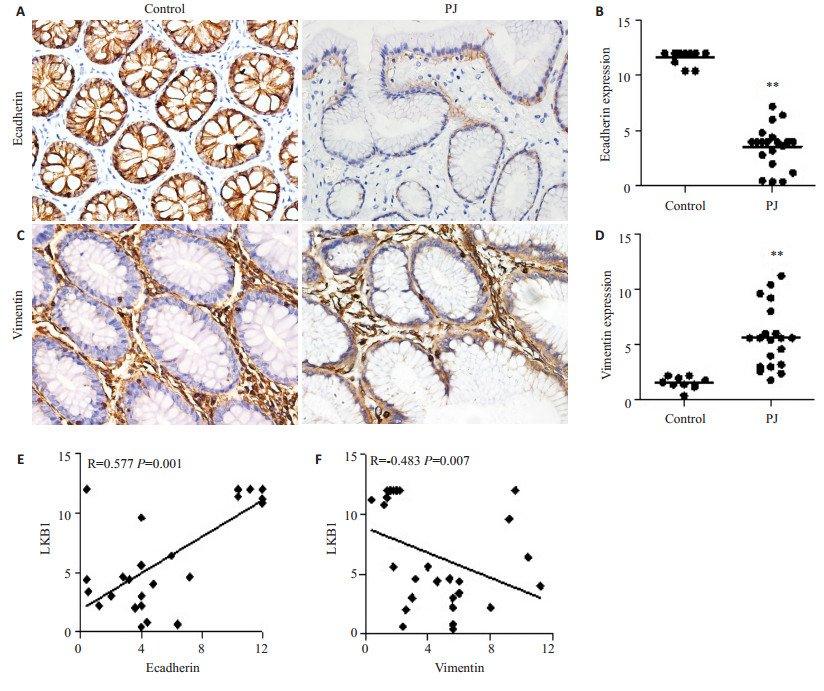
|
图 2 PJS错构瘤及正常肠道组织Ecadherin及Vimentin蛋白表达情况 Figure 2 Expression of Ecadherin and vimentin in PJS hamartoma and normal intestinal tissues (×400). A, B: Protein expression of Ecadherin; C, D: Protein expression of vimentin; E: Correlation between the expression of LKB1 and Ecadherin; F: Correlation between the expression of LKB1 and vimentin. **P < 0.01 vs control. |
Western blot检测细胞中LKB1表达水平,结果如图 3A所示。与正常细胞株相比,空载体稳转株的LKB1相对表达水平无明显变化,而LKB1敲低组的细胞株中LKB1相对表达水平明显降低。QPCR法检测LKB1表达水平,可见与空载体稳转株相比,LKB1在mRNA相对表达水平明显降低(P < 0.01,图 3B)。
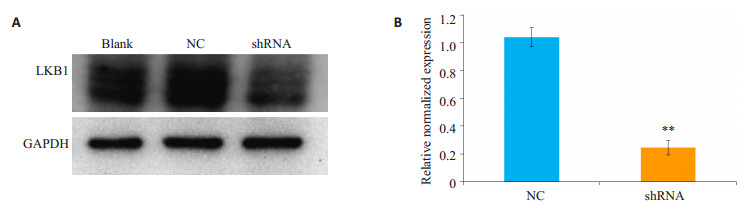
|
图 3 建立稳定表达LKB1敲低的NCM460细胞株 Figure 3 LKB1 expression in NCM460 cell line with stable LKB1 knockdown. Blank: Normal cells; NC: Cells transfected with negative control plasmid; shRNA: Cells transfected with LKB1 shRNA plasmid. A: LKBI expression at protein level tested by Western blotting; B: LKBI expression at mRNA level detected with qPCR. **P < 0.01 vs NC. |
CCK8实验检测LKB1敲低对细胞增殖能力影响,如图 4A所示,与空载体稳转株组相比,LKB1敲低后细胞增殖能力增强(P < 0.01)。Transwell迁移实验检测LKB1敲低对细胞迁移能力影响(图 4B、C),与空载体稳转株组相比,LKB1敲低后迁移至下室细胞数明显增多,细胞迁移能力增强(P < 0.01)。
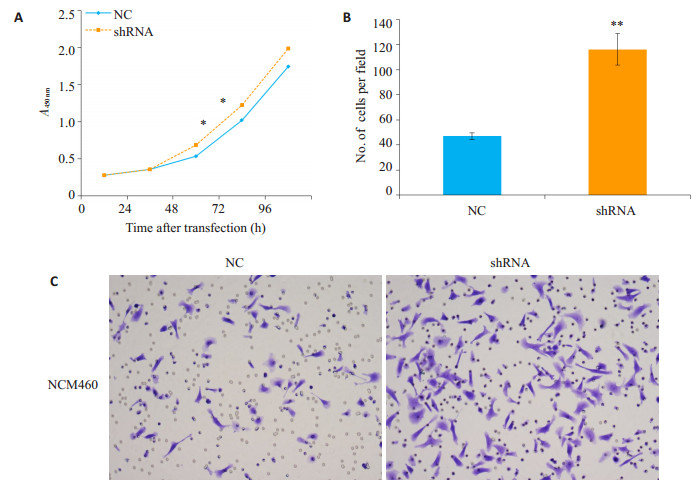
|
图 4 LKB1敲低后对NCM460细胞增殖、迁移能力影响 Figure 4 Proliferation and migration of NCM460 cells after LKB1 knockdown. NC: Cells transfected with negative control plasmid. shRNA: Cells transfected with LKB1 knockdown shRNA plasmid. A: Cell Proliferation was tested by CCK8 assay. B: Cell migration was analyzed by a transwell assay (×200). **P < 0.01 vs NC. |
Western blot检测LKB1敲低后对NCM460细胞株中ecadherin、vimentin、ncadherin、snail、slug蛋白表达水平的影响(图 5A、B),与正常细胞相比,空载体稳转株各指标的蛋白水平表达均无明显改变,而LKB1敲低后NCM460细胞株ecadherin表达降低,vimentin、ncadherin、snail、slug表达均明显增高。QPCR检测了LKB1敲低后对ecadherin表达的影响,与空载体稳转株组相比,LKB1敲低后细胞中ecadherin在mRNA水平上表达降低(P < 0.05,图 5C)。
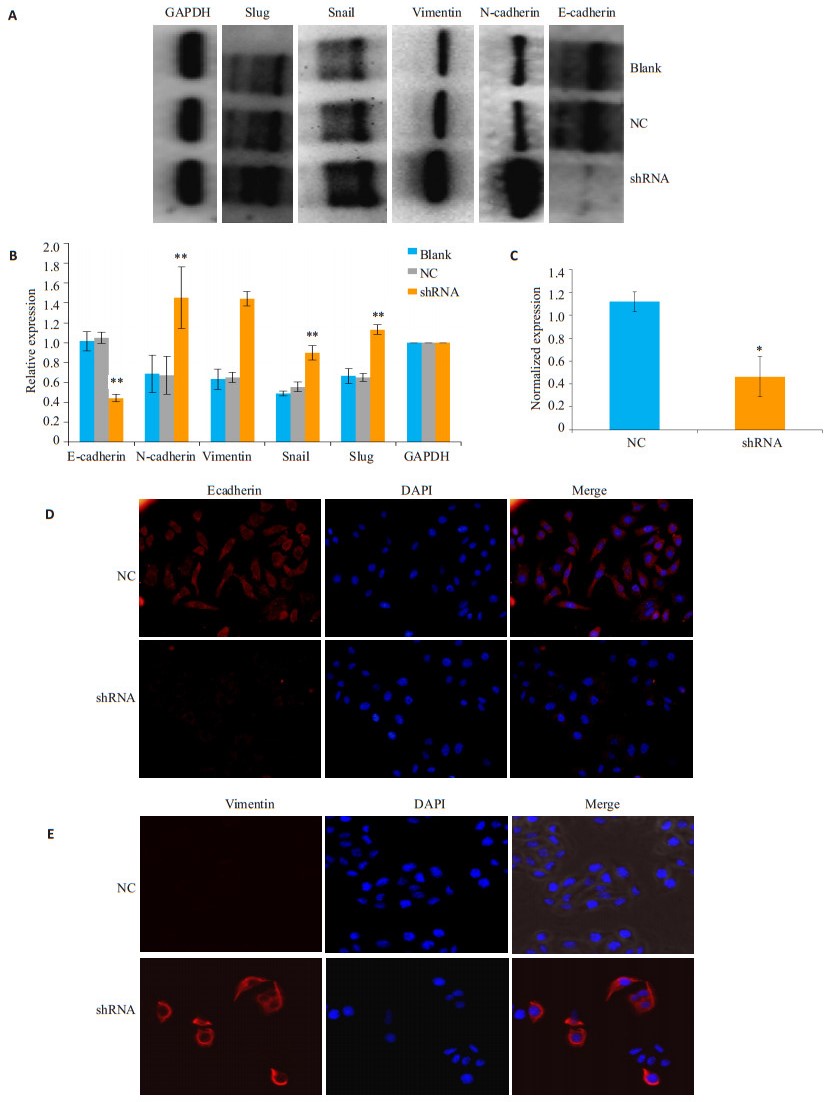
|
图 5 LKB1敲低后对EMT分子表达的影响 Figure 5 Expression of EMT markers in cells with LKB1 knockdown. A, B: Expression of Ecadherin, N-cadherin, vimentin, Snail and Slug at protein level tested by Western blotting; C: Ecadherin expression at mRNA level detected by qPCR. D, E: Expression of Ecadherin (× 400) and vimentin (×600) detected by immunofluorescence. **P < 0.01, *P < 0.05 vs NC. |
为了进一步观察LKB1敲低后细胞EMT分子的改变,采用免疫荧光检测细胞株中ecadherin及vimentin的表达。与阴性对照组相比,LKB1敲低的细胞中ecadherin的荧光表达强度明显减弱,没有发生明显核转移,但vimentin的荧光表达强度明显增强(图 5D、E)。
3 讨论PJS的主要特征是胃肠道多发错构瘤息肉,错构瘤容易复发,且有恶变风险。目前治疗方式以手术或内镜下切除为主。PJS错构瘤不突破基底膜,但出现间质增生,上皮细胞极性丧失,内部结构紊乱。EMT过程中可诱导产生成纤维细胞及其他相关细胞,发挥组织重建的作用[10]。但EMT过程是否参与PJS错构瘤的发生发展尚不明确。
EMT过程中,细胞逐渐丧失细胞间黏附能力及上皮表型,极性消失,并产生间充质和迁移细胞[11]。分子学上表现为e-cadherin、β-catenin等上皮标志物表达下调,而vimentin、n-cadherin、fibronecti等间质表型标志物表达上调[12]。上皮标志物e-cadherin降低或丧失是EMT的重要标志,病理的EMT过程能破坏上皮细胞基膜的完整性[13]。本研究中我们发现,与正常肠组织相比,PJS错构瘤上皮细胞中,ecadherin表达降低而vimentin的表达增高,错构瘤内部上皮细胞发生EMT改变。LKB1又称STK11(STK11),在PJS组织中存在表达缺失或下降[14]。在对乳腺癌[15-16]、非小细胞肺癌[17]、克罗恩病[18]等研究均发现LKB1缺失能促进EMT过程。Sagen等[19]在对LKB1敲除的GluLKB1KO小鼠模型的研究中发现,在LKB1缺失的表达胰高血糖素的肠内分泌细胞中,细胞发生EMT改变,而这些细胞最后形成多发的胃十二指肠错构瘤样息肉。因此我们推测,LKB1可能通过调节EMT过程促进PJS错构瘤的形成发展。研究中相关性分析发现LKB1表达与ecadherin表达正相关,与vimentin表达负相关,LKB1低表达与EMT具有相关性。据此,我们推测在LKB1表达失活并诱导EMT过程促进了PJS错构瘤的发生及乱序形态的形成。
PJS错构瘤的典型组织学特征是过度增生的粘膜肌层伸展入固有肌层,平滑肌纤维延伸至息肉叶内形成树枝样分支[20]。Udd等[21]研究发现PJS错构瘤中肌成纤维细胞增多。本研究中亦发现PJS错构瘤中纤维沉积明显增多,且纤维沉积面积与LKB1的表达与呈负相关,我们猜测错构瘤内胶原纤维异常沉积增多可能参与组织内部重塑,这进一步印证了PJS错构瘤中发生EMT的观点。
LKB1是一个进化保守的抑癌基因,与维持细胞增殖、凋亡、极性、代谢等稳定有关[22]。为了进一步研究LKB1激酶活性降低对肠上皮细胞EMT的影响,本研究通过LKB1特异的shRNA转染人肠上皮NCM460细胞,对LKB1进行敲低。我们通过Western blot和qPCR在蛋白及基因水平检测EMT标志分子的表达变化发现,与空白对照组及空载体组相比,LKB1敲低后NCM460细胞中上皮标志物ecadherin的表达明显下调,间质标志物vimentin、ncadherin表达明显上调。免疫荧光定量检测ecadherin及vimentin表达,发现ecadherin及vimentin在细胞中未发生明显移位,但ecadherin表达下降,vimentin表达增高。这些结果表明LKB1敲低后能促进NCM460细胞的EMT过程。有研究认为,转录因子包括snail、slug可直接或间接影响EMT过程[23-24],本研究通过Western blot检测显示,在LKB1敲低的NCM460细胞中,snail、slug表达均升高,说明NCM460细胞中LKB1敲低后可能通过调节转录因子snail、slug的活性发挥对EMT过程的促进作用。研究中CCK8及Transwell实验还发现,LKB1敲低后能促进细胞增殖、迁移能力,这可能与错构瘤内细胞数量明显增加及错构瘤明显凸出于组织表面有关。
综上所述,本研究初步证实了PJS错构瘤及肠上皮细胞中,LKB1激酶的失活可促进EMT过程发生,且这可能与错构瘤乱序形态、复发及组织重构有关。EMT可为PJS治疗提供新思路,后续实验将进一步阐明LKB1调控EMT的具体机制。
| [1] | Upadhyay S, Liu C, Chatterjee A, et al. LKB1/STK11 suppresses cyclooxygenase-2 induction and cellular invasion through PEA3 in lung cancer[J]. Cancer Res, 2006, 66(16): 7870-9. DOI: 10.1158/0008-5472.CAN-05-2902. |
| [2] | Cauchin E, Touchefeu Y, Matysiak-Budnik T. Hamartomatous tumors in the gastrointestinal tract[J]. Gastrointestinal Tumors, 2015, 2(2): 65-74. DOI: 10.1159/000437175. |
| [3] | Xu X, Su J, Li R, et al. Aberrant expression of Sonic hedgehog signaling in Peutz-Jeghers syndrome[J]. Hum Pathol, 2016, 50: 153-61. DOI: 10.1016/j.humpath.2015.09.044. |
| [4] | Swisa A, Granot Z, Tamarina N, et al. Loss of liver kinase B1 (LKB1) in beta cells enhances glucose-stimulated insulin secretion despite profound mitochondrial defects[J]. J Biol Chem, 2015, 290(34): 20934-46. DOI: 10.1074/jbc.M115.639237. |
| [5] | Nguyen HB, Babcock JT, Wells CD, et al. LKB1 tumor suppressor regulates AMP kinase/mTOR-independent cell growth and proliferation via the phosphorylation of Yap[J]. Oncogene, 2013, 32(35): 4100-9. DOI: 10.1038/onc.2012.431. |
| [6] | Volikos E, Robinson J, Aittom?ki K, et al. LKB1 exonic and whole gene deletions are a common cause of Peutz-Jeghers syndrome[J]. J Med Genet, 2006, 43(5): e18. |
| [7] | Hearle N, Schumacher V, Menko FH, et al. STK11 status and intussusception risk in Peutz-Jeghers syndrome[J]. J Med Genet, 2006, 43(8): e41. DOI: 10.1136/jmg.2005.040535. |
| [8] | Nieto MA, Huang RY, Jackson RA, et al. EMT: 2016[J]. Cell, 2016, 166(1): 21-45. DOI: 10.1016/j.cell.2016.06.028. |
| [9] | 陈晓敏, 郭俊明, 乐东海, 等. 上皮-间质转化:肿瘤转移的重要调控机制[J]. 中国细胞生物学学报, 2013, 35(9): 1367-75. DOI: 10.11844/cjcb.2013.09.0096. |
| [10] | Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer, 2002, 2(6): 442-54. DOI: 10.1038/nrc822. |
| [11] | 吴海兰(综述), 辛晓峰(审校). 上皮间充质转化与慢性阻塞性肺疾病的气道重塑[J]. 医学研究生学报, 2015, 28(9): 1004-8. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jlyb201509026&dbname=CJFD&dbcode=CJFQ |
| [12] | 曹罗元, 杨菁, 富显果, 等. miR-205通过下调ZEB1和ZEB2表达抑制肾小管上皮细胞转分化[J]. 南方医科大学学报, 2016, 36(12): 1700-5, 1711. DOI: 10.3969/j.issn.1673-4254.2016.12.19. |
| [13] | Flier SN, Tanjore H, Kokkotou EG, et al. Identification of epithelial to mesenchymal transition as a novel source of fibroblasts in intestinal fibrosis[J]. J Biol Chem, 2010, 285(26): 20202-12. DOI: 10.1074/jbc.M110.102012. |
| [14] | Shenoy S. Genetic risks and familial associations of small bowel carcinoma[J]. World J Gastrointest Oncol, 2016, 8(6): 509-19. DOI: 10.4251/wjgo.v8.i6.509. |
| [15] | Rhodes LV, Tate CR, Hoang VT, et al. Regulation of triple-negative breast cancer cell metastasis by the tumor-suppressor liver kinase B1[J]. Oncogenesis, 2015, 4: e168. DOI: 10.1038/oncsis.2015.27. |
| [16] | Li J, Liu J, Li P, et al. Loss of LKB1 disrupts breast epithelial cell polarity and promotes breast cancer metastasis and invasion[J]. J Exp Clin Cancer Res, 2014, 33: 70. DOI: 10.1186/s13046-014-0070-0. |
| [17] | Yao YH, Cui Y, Qiu XN, et al. Attenuated LKB1-SIK1 signaling promotes epithelial-mesenchymal transition and radioresistance of non-small cell lung cancer cells[J]. Chin J Cancer, 2016, 35: 50. DOI: 10.1186/s40880-016-0113-3. |
| [18] | Xu X, Sun S, Xie F, et al. Advanced oxidation protein products induce Epithelial-Mesenchymal transition of intestinal epithelial cells via a PKC δ-Mediated, Redox-Dependent signaling pathway[J]. Antioxid Redox Signal, 2017, 27(1): 37-56. DOI: 10.1089/ars.2015.6611. |
| [19] | Zac-Varghese S, Trapp S, Richards P, et al. The Peutz-Jeghers kinase LKB1 suppresses polyp growth from intestinal cells of a proglucagon-expressing lineage in mice[J]. Dis Model Mech, 2014, 7(11): 1275-86. DOI: 10.1242/dmm.014720. |
| [20] | Beggs AD, Latchford AR, Vasen HF, et al. Peutz-Jeghers syndrome: a systematic review and recommendations for management[J]. Gut, 2010, 59(7): 975-86. DOI: 10.1136/gut.2009.198499. |
| [21] | Udd L, Katajisto P, Kyyr?nen M, et al. Impaired gastric gland differentiation in Peutz-Jeghers syndrome[J]. Am J Pathol, 2010, 176(5): 2467-76. DOI: 10.2353/ajpath.2010.090519. |
| [22] | 朱凯丹, 张海涛. LKB1及其生物学功能[J]. 生命的化学, 2010, 30(2): 265-8. |
| [23] | 张登勇, 马翔, 吴斌全, 等. 敲低MSX2对胰腺癌PANC-1细胞上皮-间充质转化的影响[J]. 南方医科大学学报, 2015, 35(2): 179-84. |
| [24] | 丛宁宁, 张庆瑜. EMT在消化系肿瘤中的研究进展[J]. 世界华人消化杂志, 2013, 3: 205-10. |
 2017, Vol. 37
2017, Vol. 37

