浅部真菌病是指限于皮肤最外层、甲板、毛发和黏膜的感染,主要包括皮肤癣菌病、浅表念珠菌病和花斑癣等[1-2]。红色毛癣菌是最常见的一种皮肤癣菌,可引起各种癣病,且病程持久、难治愈、易复发,在免疫系统受损的人群中尤为显著[3]。然而,由于各种因素,例如逐年来耐药率的上升、由于疗程长导致的患者依从性差和肝肾功能损伤的副作用等[3-4],有必要寻找一种快速、安全的治疗方法。目前已有不少光疗用于真菌病治疗的报道。研究显示使用艾拉光动力(ALA-PDT)、1064 nm钇铝石榴石晶体(Nd:YAG)激光治疗难治性趾间真菌病、甲癣,安全有效[5-6]。强脉冲光(IPL)420 nm可通过类似光动力疗法的机制杀灭细菌及消炎[7],并应用于治疗痤疮丙酸杆菌感染的疾病[8],但目前仍没有其治疗红色毛癣菌感染的相关报道。研究发现无论是否使用光敏剂,光疗对微生物产生杀灭作用的同时伴有大量胞内活性氧(ROS)产生[9-10]。本文拟使用IPL420 nm照射红色毛癣菌作体外研究,观察IPL420 nm对红色毛癣菌的生长影响,检测相应氧化应激指标的变化,进一步探讨强脉冲光对真菌治疗的作用机制。
1 材料和方法 1.1 材料 1.1.1 主要试剂沙堡氏培养基(江门凯林),蛋白胨(杭州滨和)、葡萄糖(国药)、蒸馏水,灭菌生理盐水,噻唑蓝(MTT)(Sigma),DCFH-DA荧光探针以及MDA测定试剂盒(南京建成生物工程研究所),BCA蛋白浓度测定试剂盒(碧云天公司)。
1.1.2 菌株来源红色毛癣菌标准菌株ATCC4438购自美国菌种保藏中心(American type culture collection, ATCC)。
1.1.3 主要仪器IPL仪器(Profile超级平台),使用420 nm滤光片,脉宽150 ms,温度10 ℃,由美国Sciton提供。
1.2 方法 1.2.1 标准株形态的观察将红色毛癣菌在新鲜配制的沙保氏培养基上连续转种两次,28 ℃培养7 d,用洁净透明胶布贴取平板上菌落,乳酸酚棉兰染色,显微镜观察真菌形态。
1.2.2 平板菌落、菌悬液的制备取生长良好的菌落用于本实验并作如下处理:(1)在接受IPL干预前,将菌株传代培养在新的沙堡氏平板上(每个平板两个菌落);(2)取生长良好的菌落,通过使用无菌玻璃棒用3 mL灭菌生理盐水刷洗培养物表面,将所得到的孢子及菌丝悬浮液通过40 μmol/L过滤器过滤,离心,用无菌PBS清洗两遍,用沙氏葡萄糖蛋白胨液体(蛋白胨10 g,葡萄糖40 g,1000 mL蒸馏水)重悬。使用血细胞计数器计数使菌悬液浓度为5×104 cfu/mL,在28 ℃下培养,并加入96孔板中,每孔100 μL,备用。
1.2.3 真菌分组、IPL干预、菌落生长曲线变化及MTT检测真菌活力分别以12 J/cm2 6、8、10、12及14脉冲,11 J/cm2 12脉冲,10 J/cm2 12脉冲作用于平板菌落和菌悬液,另设正常对照组和空白对照。(1)在照射前(作为第1天)、照射后第2天、第3天,用数码相机对沙保氏平板上的处理和对照菌落的表面积进行拍照。使用Photoshop cx7软件以像素计算菌落的面积;(2)在IPL照射后6 h,通过MTT测定法测定菌悬液的活力。向每个孔中加入10 μL MTT试剂(5 mg/mL),并在28 ℃下孵育4 h。孵育4 h后,离心,随后除去上清液并加入150 μL DMSO,振荡10 min。酶标仪于波长490 nm测各孔吸光度(A)值,计算细胞活力[11]。
选择最佳治疗参数,将实验分为处理组(强脉冲光照射)和对照组(未照射),光学显微镜下观察各组真菌形态变化,并进行以下实验,检测相应氧化应激指标。
1.2.4 真菌内活性氧检测真菌悬液IPL处理后使用10 μmol/L的DCFH-DA荧光探针在28 ℃孵育30 min,并在生理盐水中洗涤两次。使用流式细胞仪在488 nm的激发波长和525 nm的发射波长下检测荧光信号强度。
1.2.5 真菌MDA含量检测真菌悬液IPL处理后收集并离心获得真菌,在冰水浴中使用超声波破碎机中匀浆,使用丙二醛(MDA)试剂盒,根据说明说步骤操作,检测真菌MDA含量。
1.2.6 统计学分析SPSS 20.0进行统计分析。所有数据均采用均数±标准差表示,两组间均数比较如方差齐性,采用两样本t检验;如方差不齐,采用Satterthwaite法。多组间均数比较采用单因素方差分析,如方差齐性,采用LSD-t法进行两两比较;如方差不齐,采用Dunnett's T3法进行两两比较,P < 0.05为差异有统计学意义。
2 结果 2.1 标准株红色毛癣菌ATCC4438形态光学显微镜下可见大量的分支、分隔的菌丝,小分生孢子侧生于菌丝两侧,偶见大分生孢子和厚壁孢子(图 1)。
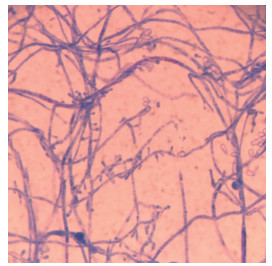
|
图 1 ATCC4438形态 Figure 1 Morphological observation of ATCC4438 (Original magnification: ×1000). |
菌落在IPL420 nm照射能量为12 J/cm2 12脉冲和14脉冲时,菌落停止生长,第2、3天的生长曲线趋于直线,偏离对照组生长曲线,并呈剂量和时间依赖(图 2A、B)。而照射剂量分别为12 J/cm2 6、8、10脉冲、11 J/cm2 12脉冲和10 J/cm2 12脉冲时,与对照组相比,生长曲线基本一致(图 2A、B)。另外,菌悬液作相应能量处理后,接受12 J/cm2 12脉冲和14脉冲照射6 h后,其活力较对照组下降30%,差异有统计学意义(P < 0.05,图 2C)。而其余照射能量参数干预后,与对照组相比,真菌活力无统计学差异(P > 0.05,图 2C)。最低有效能量剂量为12 J/cm2 12脉冲。光镜下示照射剂量12 J/cm2 12脉冲处理24 h后,菌丝部分扭曲、萎缩,分生孢子少见,菌丝壁与对照组无明显差异(图 2D)。
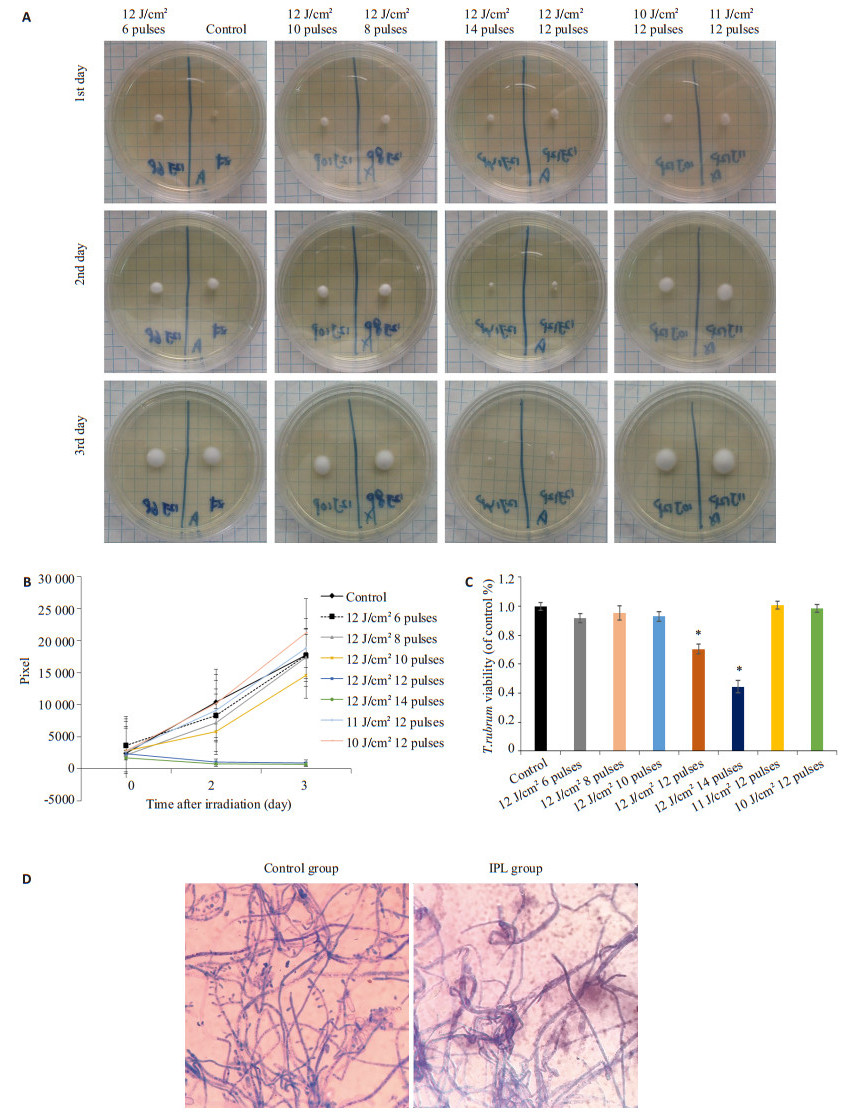
|
图 2 IPL420 nm对菌落生长曲线、真菌活力及形态的影响 Figure 2 Effects of intense pulse light (420 nm) irradiation on colony growth curve, fungal viability and morphology. A: Fungal colonies on SDA plates; B: Fungal growth curve; C: Viability of T.rubrum 6 h after irradiation (*P < 0.05 vs control group); D: Morphological changes of irradiated fungus (×1000). |
经IPL420 nm 12 J/cm2 12脉冲照射后,真菌内ROS含量与对照组相比明显增多,差异有统计学意义(P < 0.05,图 3)。
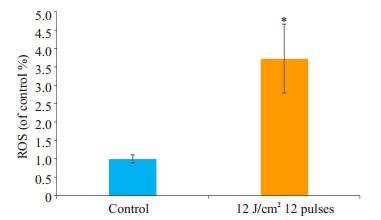
|
图 3 真菌内ROS变化 Figure 3 Changes of intracellular ROS in the fungus. *P < 0.05 vs control group. |
与对照组相比,IPL组真菌内MDA含量明显增多,差异有统计学意义(P < 0.05,图 4)。
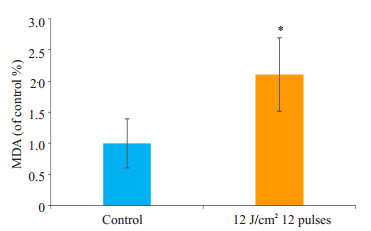
|
图 4 IPL处理对真菌MDA含量的影响 Figure 4 Effect of IPL treatment on MDA content. *P < 0.05 vs control group. |
很少有研究报道使用IPL治疗真菌感染的疾病,仅见Ghavam等[12]运用强脉冲光535 nm,872 nm 20 J/cm2 ,80 J/cm2 体外干预红色毛癣菌,但其并没有明显的抑制作用,而我们本次研究首次表明IPL420 nm对红色毛癣菌有生长抑制作用,此差异考虑为滤光片选择不同导致的不一样的治疗效果。我们的研究使用12 J/cm2 6、8、10、12及14脉冲,11 J/cm2 12脉冲,10 J/cm2 12脉冲不同参数能量进行干预,标准株ATCC4438无论是菌悬液还是平板菌落在接受12 J/cm2 及以上能量治疗后,真菌都受到明显抑制,并随着能量的增加,形成能量剂量依赖。另一方面随着时间的增长,观察各组平板菌落面积变化,形成时间依赖。再者,光镜下显示,真菌菌丝萎缩、皱瘪、粗细不一,提示IPL干预后真菌显微结构有一定损害;但光镜下真菌壁表面与对照组无明显差异,需进一步进行扫描电镜及透射电镜观察真菌超微结构。同时在临床已有不少光治疗真菌病的报道。Calzavara-Pinton等[6]使用ALA-PDT治疗9例由白色念珠菌、癣须菌、红色毛癣菌引起的难治性趾间真菌病,取得良好疗效。Sotirou等[13]也报道了ALA-PDT治疗30例甲癣,治愈率为43.3%。陆晟等[14]应用长脉宽1064 nm Nd:YAG激光治疗甲真菌病患者共79甲,临床有效率为67.1%,真菌学有效率为73.4%,复发或再感染率为19.0%。这提示单独使用光疗技术也可对皮肤浅表真菌病有一定疗效。综上可见,光疗法可抑制多种真菌的生长,用于治疗真菌相关性皮肤疾病,而根据我们研究表明IPL420 nm同样具有抑制真菌生长的作用。
Hyun等[15]单独使用发光二极管(LED)(370~630 nm)照射球形马拉色菌时,发现菌量明显下降,活性氧ROS和脂质过氧化物显著升高。Baltazar等[11]发现甲苯胺蓝和红色毛癣菌混合培养后可以被LED 630 nm杀灭,引起ROS氧化应激应激指标显著性上升,另外应用姜黄素作为光敏剂,应用波长为417±5 nm的蓝光照射,也可以抑制真菌的生长,同时引起活性氧显著上升[16]。我们可以推测各类光疗照射刺激胞内产生大量活性氧造成氧化损伤是光疗对真菌产生抑制作用的主要原因之一。很多研究也已经表明ROS在细胞死亡中发挥重要作用[17-20]。在本次研究中,我们试图找出IPL抑制真菌的作用机制。本实验中,红色毛癣菌接受IPL处理后,真菌孢内ROS的水平增高,与其损伤相一致,与正常组相比高出3.7倍以上。我们的研究结果表明,ROS的大量产生造成的氧化损伤可能是IPL对红色毛癣菌抗真菌作用的主要原因之一。
膜脂质对氧自由基非常敏感,并且容易被氧化[21]。而过量的ROS导致细胞内一系列氧化应激级联反应,可导致产生膜脂过氧化反应,导致细胞生物膜完整性损失也可以造成细胞的功能不可逆的损害[22]。而丙二醛(MDA)作为脂质过氧化的主要产物之一,其含量的测定被公认为是一个反映脂质过氧化反应的重要标准,以评估氧化应激的严重程度[23-24]。本实验结果显示IPL处理后,伴随ROS的大量增加,MDA含量也明显升高(P < 0.05)。由此我们推测红色毛癣菌接受IPL 420 nm干预后,ROS大量产生积聚,造成孢内氧化应激,而同时MDA作为是细胞膜脂质被大量ROS物质氧化后的副产物也大量产生,导致红色毛癣菌损伤甚至死亡。我们可以推测IPL抑制红色毛癣菌的作用机制之一,是通过激发真菌内ROS大量产生,进一步诱导脂质过氧化从而导致真菌损伤和死亡。
综上所述,我们的研究首次表明IPL420 nm对体外红色毛癣菌干预后,可能使真菌孢内产生大量ROS,损伤真菌生物膜产生脂质过氧化反应,从而导致真菌活力下降甚至死亡。但目前IPL420 nm对红色毛癣菌的作用机理还没有被完全研究清楚,结合本研究可以推断活性氧的大量产生及其诱发的一些列级联反应是重要的作用之一。虽然IPL420 nm作用于体内红色毛癣菌情况如何我们尚未清楚,仍需进一步实验探究,但由此次实验结果仍可得出,IPL420 nm有望成为我们治疗红色毛癣菌引起的浅表真菌病甚至其余浅表真菌病的一种新的有潜力的治疗方法。
| [1] | Burmester A, Shelest E, Gloeckner GA, et al. Comparative and functional genomics provide insights into the pathogenicity of dermatophytic fungi[J]. Genome Biol, 2011, 12(1): R7. DOI: 10.1186/gb-2011-12-1-r7. |
| [2] | Aly R. Ecology and epidemiology of dermatophyte infections[J]. J Am Acad Dermatol, 1994, 31(3 Pt 2): S21-5. |
| [3] | Peres NT, Maranhao FC, Rossi A, et al. Dermatophytes: host-pathogen interaction and antifungal resistance[J]. An Bras Dermatol, 2010, 85(5): 657-67. DOI: 10.1590/S0365-05962010000500009. |
| [4] | Schafer-Korting M. New systemic antifungal drugs: mechanisms of action, drug interactions and side effects[J]. Mycoses, 2003, 46(Suppl 1): 28-31. |
| [5] | Galvan Garcia HR. Onychomycosis: 1064-nm Nd:YAG q-switch laser treatment[J]. J Cosmet Dermatol, 2014, 13(3): 232-5. DOI: 10.1111/jocd.2014.13.issue-3. |
| [6] | Calzavara-Pinton PG, Venturini M, Capezzera R, et al. Photodynamic therapy of interdigital mycoses of the feet with topical application of 5-aminolevulinic acid[J]. Photodermatol Photoimmunol Photomed, 2004, 20(3): 144-7. DOI: 10.1111/ppp.2004.20.issue-3. |
| [7] | Babilas P, Schreml S, Szeimies RM, et al. Intense pulsed light(IPL): a review[J]. Lasers Surg Med, 2010, 42(2): 93-104. DOI: 10.1002/lsm.v42:2. |
| [8] | Chang SE, Ahn SJ, Rhee DY, et al. Treatment of facial acne papules and pustules in Korean patients using an intense pulsed light device equipped with a 530-to 750-nm filter[J]. Dermatol Surg, 2007, 33(6): 676-9. |
| [9] | 禚风麟, 张蕊娜, 王莉, 等. ROS在长脉冲1064 nm激光体外照射红色毛癣菌中的表达及作用[J]. 临床和实验医学杂志, 2014(13): 1041-4. DOI: 10.3969/j.issn.1671-4695.2014.13.001. |
| [10] | Lam M, Dimaano ML, Oyetakin-White PA, et al. Silicon phthalocyanine 4 phototoxicity in trichophyton rubrum[J]. Antimicrob Agents Chemother, 2014, 58(6): 3029-34. DOI: 10.1128/AAC.01448-13. |
| [11] | Baltazar LM, Soares BM, Carneiro HC, et al. Photodynamic inhibition of Trichophyton rubrum: in vitro activity and the role of oxidative and nitrosative bursts in fungal death[J]. J Antimicrob Chemother, 2013, 68(2): 354-61. DOI: 10.1093/jac/dks414. |
| [12] | Ghavam SA, Aref S, Mohajerani E, et al. Laser irradiation on growth of trichophyton rubrum:an in vitro study[J]. J Lasers Med Sci, 2015, 6(1): 10-6. |
| [13] | Sotiriou E, Koussidou-Ermonti T, Chaidemenos G, et al. Photodynamic therapy for distal and lateral subungual toenail onychomycosis caused by trichophyton rubrum: preliminary results of a single-centre open trial[J]. Acta Derm Venereol, 2010, 90(2): 216-7. DOI: 10.2340/00015555-0811. |
| [14] | 陆晟, 张振, 费烨, 等. 长脉宽Nd:YAG激光治疗甲真菌病疗效观察[J]. 中华皮肤科杂志, 2013, 46(2): 105-8. |
| [15] | Wi HS, Na EY, Yun SJ, et al. The antifungal effect of light emitting diode on Malassezia yeasts[J]. J Dermatol Sci, 2012, 67(1): 3-8. DOI: 10.1016/j.jdermsci.2012.04.001. |
| [16] | Baltazar LM, Krausz AE, Souza AC, et al. Trichophyton rubrum is Inhibited by Free and Nanoparticle Encapsulated Curcumin by Induction of Nitrosative Stress after Photodynamic Activation[J]. PLoS One, 2015, 10(3): e120179. |
| [17] | Cotoras M, Castro P, Vivanco H, et al. Farnesol induces apoptosislike phenotype in the phytopathogenic fungus Botrytis cinerea[J]. Mycologia, 2013, 105(1): 28-33. DOI: 10.3852/12-012. |
| [18] | Chiappini F, Pontillo C, Randi AS, et al. Reactive Oxygen species and extracellular Signal-Regulated kinase 1/2 mediate Hexachlorobenzene-Induced cell death in FRTL-5 rat thyroid cells[J]. Toxicol Sci, 2013, 134(2): 276-90. DOI: 10.1093/toxsci/kft117. |
| [19] | Dwyer DJ, Kohanski MA, Collins JJ. Role of reactive Oxygen species in antibiotic action and resistance[J]. Curr Opin Microbiol, 2009, 12(5): 482-9. DOI: 10.1016/j.mib.2009.06.018. |
| [20] | You J, Chan ZL. ROS regulation during abiotic stress responses in crop plants[J]. Front Plant Sci, 2015, 6(12): 1092. |
| [21] | Djebali W, Zarrouk M, Brouquisse R, et al. Ultrastructure and lipid alterations induced by Cadmium in tomato(Lycoper-siconesculentum) chloroplast membranes[J]. Plant Biol (Stuttg), 2005, 7(4): 358-68. DOI: 10.1055/s-2005-837696. |
| [22] | Allah EA, Abeer H, Alqarawi AA, et al. Alleviation of adverse impact of cadmium stress in sunflower by arbuscular mycorrhizal fungi[J]. Pakistan J Botany, 2015, 47(2): 785-95. |
| [23] | Savouré A, Thorin D, Davey M, et al. NaCl and CuSO4 treatments trigger distinct oxidative defence mechanisms in nicotiana plumbaginifolia L[J]. Plant Cell Envir, 1999, 22(4): 387-96. DOI: 10.1046/j.1365-3040.1999.00404.x. |
| [24] | Andriantsitohaina R, Duluc L, Garcia-Rodriguez JC, et al. Systems biology of antioxidants[J]. Clin Sci, 2012, 123(3/4): 173-92. |
 2017, Vol. 37
2017, Vol. 37

