2. 中国科学院大学存济医学院,北京
2. University of Chinese Academy of Sciences, Beijing 100049, China
随着人类饮食结构和生活方式的转变,不论在发展中国家还是发达国家,越来越多的人被肥胖所困扰,肥胖成为全球性的公共卫生问题[1-2]。肥胖是一些系统性疾病的独立危险因素,如高血压,心脏病和2型糖尿病等[3]。慢性牙周炎是细菌及宿主反应引起的牙周组织的慢性疾病,是全球发病率最高的口腔疾病之一。研究显示,发病率高且存在炎症反应是这两种疾病的共同特征[4]。在脂肪细胞中,炎症可以通过抑制胰岛素底物受体-1,抑制PPARγ的功能,增加血浆游离脂肪酸浓度来抑制胰岛素信号通路的活性, 引起胰岛素抵抗[5]。虽然两种疾病联系的确切机制仍然未知,但牙周炎引起的慢性低浓度炎症在肥胖等系统性疾病的发病过程中可能起了重要作用[4]。
非手术牙周治疗在慢性牙周炎的治疗中仍是金标准,包括机械去除细菌生物膜,刮除牙结石和根面平整,为微生物的平衡与牙周健康创建一个局部环境[6]。经过牙周治疗后,牙龈沟液和血清中的C-反应蛋白(CRP)水平出现了显著下降,糖化血红蛋白水平降低[7-8]。因此牙周非手术治疗在改善牙周组织的局部炎症,降低局部炎症因子水平的同时,循环系统中的炎症因子水平也可能随之降低[9]。非手术牙周治疗改善牙周局部环境的同时是否会影响全身炎症状态及改善肥胖者的代谢情况,现在的研究仍然有很多争议[10-13]。本实验在前期实验中已建立肥胖复合实验性牙周炎大鼠的模型,在此基础上,观察牙周非手术治疗对肥胖大鼠血清炎症指标及代谢水平的影响。
1 材料和方法 1.1 实验动物及实验流程选择16只已成功建立肥胖复合牙周炎模型的大鼠,随机分为2组,牙周治疗组(8只)和未治疗组(对照组,8只)。牙周治疗组予以拆除结扎线,并进行局部牙周非手术治疗(龈上洁治,龈下刮治,1%过氧化氢液冲洗,上碘甘油)。对照组未做牙周治疗处理。牙周治疗后2周过量麻醉处死大鼠。
大鼠及其普通饲料和高脂饲料均由广东省医学实验动物中心提供,实验设计经南方医科大学动物伦理委员会审核通过。高脂饲料的能量比:蛋白20%、碳水化合物20%、脂肪60%,约5.24 kcal/g。
1.2 口服糖耐量检测(OGTT)大鼠牙周治疗前及牙周治疗后2周均行OGTT检测。采用大鼠禁食12 h,50%葡萄糖灌胃,在0、30、60、120 min测定血糖,测定糖面积。Δ糖面积=(a+2b+3c+ 2d)/4-2a(a、b、c、d分别代表给药前及给药后30、60、120 min的血糖水平)[14]。
1.3 采血时间点及检测指标在牙周治疗前及牙周治疗后2周(大鼠处死前)这两个时间点,两组大鼠采血前大鼠禁食12 h,眼底静脉丛采血2 mL检测血糖、胰岛素和CRP。HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5,HOMA-β= 20×空腹胰岛素(mU/L)(/空腹血糖(mmol/L)-3.5)[15]。
1.4 牙周组织病理检测在牙周治疗后2周,两组大鼠采血后腹腔内10%水合氯醛1 mL/100 g致死,将大鼠仰卧固定于手术台上,取全部动物上颌第1、2恒磨牙的颌骨组织块,经生理盐水清洗后,立即放入4%多聚甲醛溶液中固定48 h,在滴水条件下进行组织修正,放入EDTA脱钙液(pH=7)4 ℃脱钙8周,常规石蜡包埋,制成上颌第2恒磨牙近远中向5 μm切片,做HE染色,用显微镜200倍下观察组织结构。
1.5 统计分析计量资料数据以均数±标准差表示,采用SPSS17.0对实验数据进组间的独立样本t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 治疗组和对照组大鼠的体质量比较牙周治疗前,对照组和治疗组大鼠的体质量相比无明显差异;牙周治疗后2周,两组的体质量均无明显差异(P > 0.05,表 1)
| 表 1 牙周治疗前后两组大鼠的体质量比较 Table 1 Comparison of body mass in rats before and after non-surgical periodontal therapy (Mean±SD, n=8, g) |
牙周治疗前,两组大鼠的空腹血糖值比较无明显差异;牙周治疗后2周,与对照组相比,治疗组大鼠的血糖出现了显著下降,差异有统计学意义(表 2,P < 0.05)。牙周治疗前后,两组之间的空腹胰岛素水平均无统计学差异。
| 表 2 两组大鼠空腹血糖及空腹胰岛素的比较 Table 2 Comparison of fasting blood glucose and fasting insulin in two groups of rats (Mean±SD, n=8) |
两组大鼠在治疗前后HOMA-IR组间无统计学差异。牙周治疗前,两组大鼠的HOMA-β比较无明显差异;牙周结扎后2周,与对照组相比,HOMA-β的数值出现上升,差异有统计学意义(表 3,P < 0.05)。这表明,牙周治疗后2周,胰腺的β细胞功能指数可能得到了一定的改善。
| 表 3 两组大鼠HOMA-IR及HOMA-β的比较 Table 3 Comparison of HOMA-IR and HOMA-β in two groups of rats (Mean±SD, n=8) |
牙周治疗前,两组大鼠血清CRP比较无明显差异;牙周结扎后2周,与对照组相比,治疗组大鼠的血清CRP值出现了显著下降,差异有统计学意义(表 4,P < 0.05)。
| 表 4 牙周治疗前后两组大鼠的CRP水平比较 Table 4 Comparison of CRP levels in rats before and after non-surgical periodontal therapy (Mean±SD, n=8, ng/mL) |
牙周治疗后2周,对照组和治疗组大鼠进行OGTT试验,在0、30 min时的血糖值无统计学差异;两组的分泌高峰均落在60 min;60、120 min两个时点,治疗组的血糖值[(10.65±0.31, 9.11±0.20)mol/L]低于对照组[(12.32±0.27, 11.67±0.32)mol/L],有显著的统计学差异(P < 0.05,图 1),治疗组的血糖值在120 min时出现较明显的回落;治疗组葡萄糖曲线下面积(9.62±0.57)低于对照组(12.59±0.58),两者之间有统计学差异(P < 0.05)。
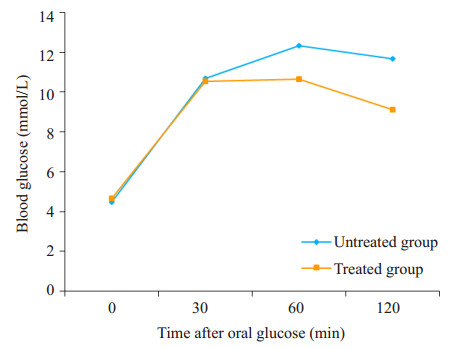
|
图 1 两组大鼠糖耐量试验的葡萄糖曲线 Figure 1 Glucose curves of glucose tolerance test in rats. |
光镜下观察,对照组大鼠的牙龈复层鳞状上皮破坏明显,沟内上皮出现糜烂和溃疡,上皮屏障出现破坏,结合上皮向根方增殖,大量炎症细胞浸润,胶原纤维水肿,变性,丧失,结缔组织层变薄,牙槽嵴顶上方有炎症细胞浸润(图 2A)。牙周治疗组大鼠的牙龈上皮无明显糜烂和溃疡,出现纤维性增生,结合上皮仍位于牙釉质骨质界的根方(图 2B)。
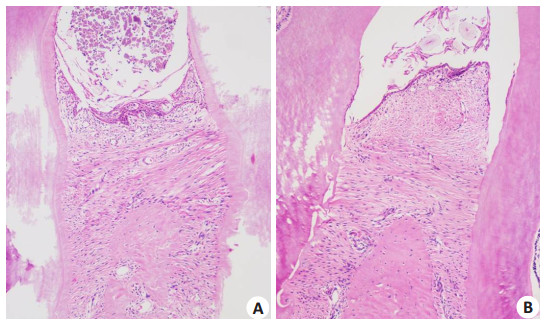
|
图 2 大鼠牙周组织HE染色光镜观察 Figure 2 Light microscopic observation of periodontal tissues in rats using HE staining (Original magnification: ×200). |
肥胖是2型糖尿病的重要危险因素,两者都有助于牙周炎的发生和进展,很难从临床研究中界定肥胖,2型糖尿病和牙周炎三者之间的因果关系[1, 17]。慢性牙周炎局部产生的IL-1,TNF-α,CRP等炎症因子会通过牙周袋内的溃疡表面进入循环系统,导致胰岛素抵抗,对血糖控制具有负面影响[18],而牙周治疗可以改善局部炎症状态,使牙周炎发炎表面积降低,降低炎症因子的水平,进而有助于改善血糖控制[19-20]。
在本研究中,牙周结扎后形成的实验性牙周炎,病理切片显示牙龈鳞状上皮出现溃烂,牙周组织的物理性屏障受到破坏;牙周治疗后,牙龈上皮出现了纤维性增生,无溃烂和破损,牙周治疗对牙周组织的局部恢复具有积极效果。
口服糖耐量试验用于测定机体糖利用能力,反映了胰岛β细胞功能。正常机体糖负荷2 h后一般恢复正常,若糖利用能力降低,则表现为糖负荷后2 h血糖仍处于较高水平,此为糖耐量异常,常为2型糖尿病的早期阶段。在本研究中,把肥胖复合牙周炎大鼠分成对照组和治疗组,OGTT试验中,牙周治疗前两组的糖面积无统计学差异,表明两组之间的糖代谢状况基本均衡。牙周治疗2周后,治疗组大鼠空腹血糖水平明显下降,伴随着β细胞功能水平的上升。糖耐量试验中,治疗组1、2 h的血糖水平显著低于对照组,糖负荷后,治疗组的血糖水平较对照组较快恢复到正常水平;牙周治疗后,糖面积显著低于对照组。分析其原因可能是牙周治疗后,血糖水平降低,可以解除高糖毒性,可以使β细胞得到一定程度的恢复,逆转早期的功能性损伤。
CRP是系统性炎症的重要生物学指标,CRP在血浆中的水平通常很低,当外伤和炎症时明显升高,恢复时明显下降。CRP被认为是连接肥胖和慢性牙周炎的指标[21]。本课题组在临床中的前期研究发现,慢性牙周炎与2型糖尿病患者血清超敏C反应蛋白浓度密切相关,即牙周感染越重,血清CRP浓度越高[22];牙周基础治疗能有效降低2型糖尿病患者血清CRP水平[23]。还有研究表明,单纯牙周治疗后1周可以改善炎症状态进而改善血管内皮功能[24]。在本实验中,牙周治疗后2周,治疗组的CRP水平均显著低于对照组,这也表明牙周治疗可能可以改善血清CRP水平。CRP水平与牙周感染成正相关,这种相关性可能会增加发生心血管疾病的风险[25],而牙周治疗可以降低血清CRP水平[26],可能在一定程度上有利于降低心血管疾病的风险。
慢性牙周炎会导致系统性炎症因子水平的升高,但该疾病是可以预防和治疗的,牙周基础治疗在改善局部炎症的同时,可能利于肥胖大鼠的血糖控制,进而改善胰岛素的β细胞功能,改善血糖代谢。所以越来越多的学者认为,牙周炎及牙周治疗应纳入到肥胖和糖尿病患者的疾病管理体系中。
| [1] | Zhu M, Nikolajczyk BS. Immune cells Link obesity-associated type 2 diabetes and periodontitis[J]. J Dent Res, 2014, 93(4): 346-52. DOI: 10.1177/0022034513518943. |
| [2] | Trends in adult body-mass index in 200 countries from 1975 to 2014. A pooled analysis of 1698 population-based measurement studies with 19.2 million participants[J]. Lancet, 2015, 387(200): 6-9. |
| [3] | Doll S, Paccaud F, Bovet P, et al. Body mass index, abdominal adiposity and blood pressure: consistency of their association across developing and developed countries[J]. Int J Obes Relat Metab Disord, 2002, 26(1): 48-57. DOI: 10.1038/sj.ijo.0801854. |
| [4] | Suresh S, Mahendra J. Multifactorial relationship of obesity and periodontal disease[J]. J Clin Diagn Res, 2014, 8(4): E1-E3. |
| [5] | Ye JP. Mechanisms of insulin resistance in obesity[J]. Front Med, 2013, 7(1): 14-24. DOI: 10.1007/s11684-013-0262-6. |
| [6] | Akram Z, Safii SH, Vaithilingam RD, et al. Efficacy of non-surgical periodontal therapy in the management of chronic periodontitis among obese and non-obese patients: a systematic review and meta-analysis[J]. Clin Oral Investig, 2016, 20(5): 903-14. DOI: 10.1007/s00784-016-1793-4. |
| [7] | Dias Goncalves TE, Feres M, Zimmermann GS, et al. Effects of scaling and root planing on clinical response and serum levels of adipocytokines in patients with obesity and chronic periodontitis[J]. J Periodontol, 2015, 86(1): 53-61. DOI: 10.1902/jop.2014.140266. |
| [8] | Calabrese N, D'aiuto F, Calabrese A, et al. Effects of periodontal therapy on glucose management in People with diabetes mellitus[J]. Diabetes Metab, 2011, 37(5): 456-9. DOI: 10.1016/j.diabet.2011.05.004. |
| [9] | Pradeep AR, Kalra N, Priyanka N, et al. Post-treatment levels of stem cell factor and hs-CRP in serum and crevicular fluid of chronic periodontitis subjects with type 2 diabetes[J]. J Investig Clin Dent, 2013, 4(2): 89-93. DOI: 10.1111/jicd.2013.4.issue-2. |
| [10] | Gaikwad SP, Gurav AN, Shete AR. Effect of scaling and root planing combined with systemic doxycycline therapy on glycemic control in diabetes mellitus subjects with chronic generalized periodontitis: a clinical study[J]. J Periodontal Implant Sci, 2013, 43(2): 79-86. DOI: 10.5051/jpis.2013.43.2.79. |
| [11] | Wang XX, Han X, Guo XJ, et al. The effect of periodontal treatment on hemoglobin a1c levels of diabetic patients: a systematic review and Meta-Analysis[J]. PLoS One, 2014, 9(9): e108412. DOI: 10.1371/journal.pone.0108412. |
| [12] | Giblin LJ, Boyd LD, Rainchuso L, et al. Short-term effects of non-surgical periodontal therapy on clinical measures of impaired glucose tolerance in People with prediabetes and chronic periodontitis[J]. J Dent Hyg, 2014: 23-30. |
| [13] | Henschel M, Keenan AV. Insufficient evidence of effect of periodontal treatment on prevention or management of cardiovascular disease[J]. Evid Based Dent, 2015, 16(1): 17-8. DOI: 10.1038/sj.ebd.6401079. |
| [14] | 王小燕, 顾耀, 闵旸, 等. 葡甘聚糖对四氧嘧啶糖尿病模型大鼠的疗效观察[J]. 上海医学, 2005, 28(5): 406-11. |
| [15] | Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man[J]. Diabetologia, 1985, 28(7): 412-9. DOI: 10.1007/BF00280883. |
| [16] | Angelo Cintra LT, Samuel RO, Carrara Prieto AK, et al. Oral health, diabetes, and body weight[J]. Arch Oral Biol, 2017, 73: 94-9. DOI: 10.1016/j.archoralbio.2016.10.002. |
| [17] | Islam SA, Seo M, Lee YS, et al. Association of periodontitis with insulin resistance, beta-cell function, and impaired fasting glucose before onset of diabetes[J]. Endocr J, 2015, 62(11): 981-9. DOI: 10.1507/endocrj.EJ15-0350. |
| [18] | Kocak E, Saglam M, Kayis SA, et al. Nonsurgical periodontal therapy with/without diode laser modulates metabolic control of type 2 diabetics with periodontitis: a randomized clinical trial[J]. Lasers Med Sci, 2016, 31(2): 343-53. DOI: 10.1007/s10103-016-1868-0. |
| [19] | Teshome A, Yitayeh A. The effect of periodontal therapy on glycemic control and fasting plasma glucose level in type 2 diabetic patients: systematic review and meta-analysis[J]. BMC Oral Health, 2016, 17(1): 31. |
| [20] | Bansal T, Pandey A, D D, et al. C-Reactive protein (CRP) and its association with periodontal disease: a brief review[J]. J Clin Diagn Res, 2014, 8(7): ZE21-4. |
| [21] | Chen L, Wei B, Li J, et al. Association of periodontal parameters with metabolic level and systemic inflammatory markers in patients with type 2 diabetes[J]. J Periodontol, 2010, 81(3): 364-71. DOI: 10.1902/jop.2009.090544. |
| [22] | Chen L, Luo G, Xuan D, et al. Effects of non-surgical periodontal treatment on clinical response, serum inflammatory parameters, and metabolic control in patients with type 2 diabetes: a randomized study[J]. J Periodontol, 2012, 83(4): 435. DOI: 10.1902/jop.2011.110327. |
| [23] | Elter JR, Hinderliter AL, Offenbacher S, et al. The effects of periodontal therapy on vascular endothelial function: A pilot trial[J]. Am Heart J, 2006, 151(1): 47. |
| [24] | Ryden L, Buhlin K, Ekstrand E, et al. Periodontitis increases the risk of a first myocardial infarction a report from the PAROKRANK study[J]. Circulation, 2016, 133(6): 576-83. |
| [25] | Ahn YB, Shin MS, Han DH, et al. Periodontitis is associated with the risk of subclinical atherosclerosis and peripheral arterial disease in Korean adults[J]. Atherosclerosis, 2016, 251: 311-8. DOI: 10.1016/j.atherosclerosis.2016.07.898. |
| [26] | Kamil W, Al Habashneh R, Khader Y, et al. Effects of nonsurgical periodontal therapy on C-reactive protein and serum lipids in Jordanian adults with advanced periodontitis[J]. J Periodontal Res, 2011, 46(5): 616-21. |
 2017, Vol. 37
2017, Vol. 37

