严重烧伤患者伤后容易发生多种难以控制的并发症,尤其是全身炎症反应综合征(SIRS)和多器官功能衰竭(MODS)甚至是死亡[1-2]。而导致诸多并发症发生的各种原因中,免疫功能紊乱是其中的重要因素之一[2-3]。
目前对于烧伤免疫方面的研究多是对免疫细胞、免疫因子的作用机制或感染、器官损伤等方面的研究,虽然在2008年及2010年就分别有学者利用基因芯片对烧伤后基因组的序贯变化做出探讨[4-5],但是其着重于创伤与烧伤之间的对比,并未对烧伤后基因转录水平变化进行深入的研究与分析。而对基因芯片数据的分析能帮助我们在烧伤早期寻找出新的诊断及治疗的靶标。本课题组在前期通过对GEO数据库中一组小鼠烧伤后白细胞基因芯片的数据进行分析,发现烧伤后小鼠白细胞表现为免疫系统过程、细胞过程、代谢过程、应对刺激反应等方面的紊乱,其中免疫系统过程、刺激反应等生物学过程贯穿整个烧伤早期[6-7],有研究显示Myd88、Stat3、Stat1、Jun等基因在烧伤早期刺激反应过程中起着重要的作用[7]。为从分子水平了解烧伤后免疫相关基因的表达情况的变化,并筛选出在其中占据重要位置的差异基因靶标,本实验利用生物信息学方法对小鼠烧伤早期免疫细胞差异基因表达谱进行分析并构建蛋白互作网络,筛选在烧伤后免疫系统功能变化过程中起到重要作用的潜在生物学靶标,然后利用实时荧光定量PCR及蛋白免疫印迹法对所筛选的基因表达变化情况进行验证,以期从分子水平了解烧伤后免疫功能变化情况,为临床上烧伤早期诊断及治疗靶点的筛选提供新方向。
1 材料和方法 1.1 实验动物健康成年的雄性BALB/C小鼠32只,体质量20~ 22 g,由南方医科大学实验中心提供(许可证编号:SCXK粤2011-0015),清洁级饲养。
1.2 试剂及仪器本实验所用主要试剂有小鼠外周血白细胞分离液试剂盒(细胞培养及分子生物学专用)(灏洋生物),柱式法Total RNA提取试剂盒、反转录试剂盒、SYBR法Q-PCR试剂盒(购自广州瑞真生物技术有限公司),蛋白提取液(购自碧云天生物)、十二羟硫酸钠(SDS)(广州威佳)、二硫苏糖醇(DTT)(Sigma)、甘油(国产)、丙烯酰胺(Sigma)、N,N'-亚甲基丙烯酰胺、四甲基乙二胺(TEMED)(上海生工)、过硫酸铵(AP)(国产广州化学试剂厂)、甘氨酸(Glycine)(鼎国)、Tris碱(Sigma)、甲醇(广州化学试剂厂)、吐温-20(Tween-20)(Sigma)、脱脂奶粉(伊利)、PVDF膜(BIO-RAD)、HRP标记二抗(武汉博士德)、内参抗体(广州艺佳生物)。
本实验所用的主要仪器有GeneAmp PCR System 9700扩增仪、罗氏480荧光定量PCR仪、超声细胞破碎仪(上海天呈科技有限公司)、垂直电泳仪及转移系统(BIO RAD)、射线摄影暗匣(5X7英寸富士X光片发光暗盒广州艺佳生物)、脱色摇床(Rotomix公司)。
1.3 基因芯片数据处理及分析从NCBI的GEO数据库http://www.ncbi.nlm.nih.gov/geo/)下载GSE7404数据集[5]。该数据集是AffymetrixMouse Genome 430 2.0 Array基因芯片。对烧伤后1 d的样本(小鼠,25% TBSAⅢ°烧伤,全血游离白细胞)进行分析,共有8个样本,其中4个为烧伤组,4个为对照组。差异基因的获取及统计分析采用开源统计软件R3.02版本(http://www.r-project.org)进行。原始数据进行RMA(robust multiarray average)背景矫正[8-9],采用配对样本t检验和倍比法(fold change, FC)[10]获取差异表达基因,同时满足P < 0.01以及|logFC|>1,且表达量变化为2倍者为差异基因。
1.4 烧伤后免疫相关基因蛋白互作网络构建及分析将选取的差异基因应用DAVID进行基因ID转换后输入到STRING9.1[11]数据库中,选取交互作用评分大于0.4(中等可信度)的互作关系构建蛋白互作网络(PPI)。并将所选出的差异基因进行Gene Ontology(GO)[12]功能富集分析,选取免疫过程相关的差异基因,从而构建免疫相关基因的蛋白互作子网络。网络分析及MCL子网络聚类分析采用生物图表可视化工具Cytoscape软件[13-15]进行。
1.5 动物模型的建立及分组假烫伤组(sham)16只,25% Ⅲ度烫伤组[16]16只。腹腔麻醉后,行眼部取血,血液行肝素抗凝处理。
1.6 小鼠全血游离免疫细胞的提取小鼠白细胞的分离按照小鼠外周血白细胞分离液试剂盒说明书进行操作:血液标本加于分离液液面上,18~22 ℃,400 g离心20 min后,用吸管吸取免疫细胞层及红细胞层置于另一新离心管内,加入细胞洗涤液混匀,250 g离心10 min后,弃上清液,再加入红细胞裂解液,吹打混匀后裂解1~2 min,400~500 g离心5 min,弃红色上清,洗涤1~2次,最后收集免疫细胞进行下步的RNA及蛋白提取。
1.7 小鼠白细胞总RNA的提取及浓度、纯度的检测及mRNA表达水平分析按照柱式法Total RNA提取试剂盒使用说明书提取小鼠白细胞总RNA,琼脂糖凝胶电泳判断RNA有无降解,并检测所提取RNA的浓度和纯度,RNA的A260/280吸光值在1.8~2.1范围内者方可进行后续实验。使用反转录试剂盒在PCR扩增仪上反转录合成cDNA,合成后的cDNA避光保存于-20 ℃冰箱。荧光定量PCR反应使用SYBR法Q-PCR试剂盒在罗氏480荧光定量PCR仪上操作。Stat1、Cdk1、Cd19、Lck及Jun基因和MM-GAPDH内参基因的引物序列(上海英潍捷基贸易公司合成)见表 1。最后采用2-△△Ct方法[17]计算基因相对表达值。
| 表 1 实时荧光定量PCR引物 Table 1 Primers for real-time PCR |
提取组织蛋白:将免疫细胞离心处理,沉淀置于干净研钵中,液氮研磨成粉末后加入裂解液,细胞超声处理组织提取液,超声完立即置于冰上,循环3次。离心取上清到新的EP管中,按1:100比例加入鸡尾酒蛋白酶抑制剂。
定量裂解后的蛋白质样品取100 μL加入5X蛋白上样缓冲液25 μL混匀,煮沸变性15 min,上样量为50 μg,SDSPAGE使5%积成层胶和12%分离胶电泳,积成层胶:60 V,25 min,分离胶120 V,60 min,350 mA恒流1 h湿转至PVDF膜上。5%脱脂奶粉TBST缓冲液室温封闭2 h后加入一抗(1:1000)室温孵育1 h。PBST洗膜5次,5 min/次,然后加入HRP标记的二抗(1:2500)室温孵育1 h,PBST洗膜5次,5 min/次,最后加入ECL发光液反应,使用凝胶成像仪拍摄条带。
1.9 统计学方法用SPSS 19.0软件进行统计学分析,数据均以均数±标准差表示,采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 差异基因筛选结果经过筛选,共有1825个基因满足P≤0.01以及|logFC|>1的条件,且表达量变化超过了2倍标准。其中上调基因658个,下调基因1167个。
2.2 免疫相关基因的蛋白互作网络的构建及分析将筛选得出的差异基因构建蛋白互作网络,该网络共有1211个节点,5176条边组成,每一个节点代表差异表达基因对应的蛋白,边代表蛋白之间存在互作关系,而在网络中一个节点(蛋白)的度表示与其相邻的节点的数目(图 1)。

|
图 1 伤后第1天差异基因蛋白互作网络 Figure 1 Interaction network of the 1825 differentially expressed genes (DEGs) at the 1st day post-burn. Red dots represent up-regulated genes and blue dots represent down-regulated genes. The edges represent interaction. |
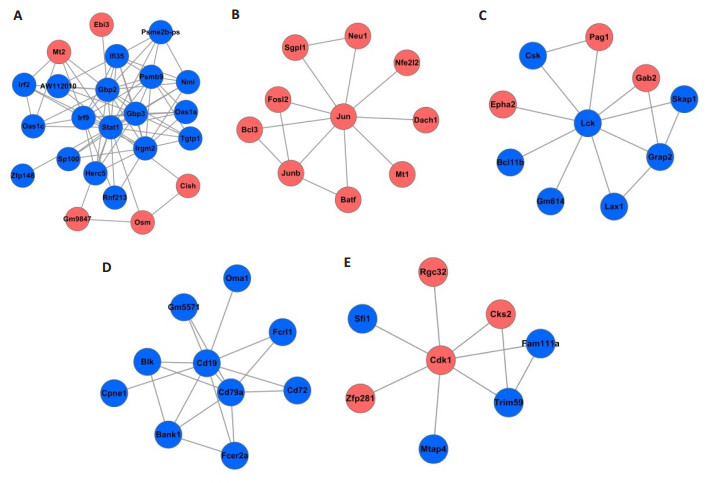
在蛋白互作网络中位于中心位置的蛋白具有最大的互作关系,并且在疾病的进展过程中可能发挥重要的作用[18]。我们发现,在蛋白互作网络中,Stat1,Jun,Lck, Cd40,Stat3,Cd19,Cd86,Cdkn1a,Cdk1以及Ptpn6基因具有最大互作关系(表 2)。运用BinGo[13]筛选PPI网络中关联紧密的模块,我们发现Lck、Cdk1、Jun、Cd19和Stat1这5个基因在相应的子网络中占据中心位置,与烧伤后早期机体的免疫反应过程相关,并具有较大的互作关系(图 2)。网络模块B包含有10个上调的差异表达基因,Jun在其中具有最大的度并位于模块中心位置(图 2),Go分析显示在以Jun为中心的子网络的功能主要富集于生物调节(FDR=8.8917E-5)。而在模块E中,以Cdk1为中心的子网络的功能主要富集在代谢过程(FDR=3.2853E-2)(表 3)。
| 表 2 互作关系最高的前10个差异基因 Table 2 Characteristics of the 10 genes identified in the PPI network |
|
图 2 MCL网络分析子网络图 Figure 2 Clusters and subnetworks in PPI network. Red nodes represent up-regulated genes and blue dots represent down-regulated genes. |
| 表 3 MCL网络功能富集分析结果 Table 3 The largest eight PPI subnetworks |
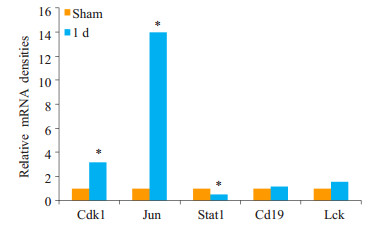
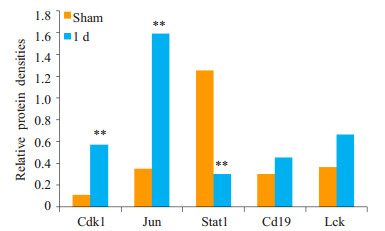
通过RT-PCR及Western blotting技术检测小鼠烧伤后白细胞中Lck、Jun、Cdk1、Cd19和Stat1蛋白的表达情况。Jun和Cdk1烧伤后第1天mRNA表达量较sham组增加(P < 0.05),其蛋白表达量较sham组明显增加(P < 0.01)。Stat1烧伤后第1天mRNA表达量较sham组下降(P < 0.05),蛋白表达量较sham组明显下降(P < 0.01),这与芯片数据分析结果相一致。但Lck及Cd19烧伤后第1天的表达量较sham组增加,与蛋白互作网络分析结果不一致,且与sham组无统计学差异(P>0.05,图 3~5)。
|
图 3 各基因在烧伤后1 d的mRNA表达水平的变化 Figure 3 Changes in mRNA expressions of the identifed DEGs in mice at the 1st day post-burn. *P < 0.05 vs sham group. |
|
图 4 各基因在烧伤后1 d的蛋白表达水平的变化 Figure 4 Changes in protein expressions of the identifed DEGs in mice at the 1st day post-burn. **P < 0.01 vs sham group. |

|
图 5 各基因在烧伤后1 d的Western blotting检测结果 Figure 5 Western blot analysis of the expressions of the identifed DEGs in mice at the 1st day post-burn. |
基因芯片技术自发明至今已被广泛应用到分子生物学中[19]。基因芯片技术和生物信息学分析方法为从转录水平或DNA层面全面了解烧伤后复杂的病理生理学变化过程提供了可能。在烧伤后第1天,通过对差异表达基因构建蛋白互作网络分析显示:Lck、Jun、Cdk1、Cd19和Stat1基因同时具有最大互作关系和在子网络中处于中心位置。我们通过动物实验证明了Stat1、Jun和Cdk1基因表达情况与数据分析结果相一致,但Lck及Cd19在烧伤后第1天的变化情况较对照组比较无统计学意义。
Cdk属于丝氨酸/苏氨酸蛋白激酶家族,首次在调节真核细胞周期进程中被发现,Neganova等[20]发现,在人类多能干细胞中Cdk1具有调控有丝分裂、G2/M期检查点执行维护、细胞凋亡、细胞多能性和基因组稳定性维护等作用,其作用机制主要是通过与CDK4相结合而形成一种复合体,以此启动E2F下游的信号系统,以达到缩短细胞周期,对于异常细胞周期或细胞增殖等情况进行调控的作用[21-23]。同时Tomasi等[24]的研究表明,在革兰氏阴性菌脂多糖(LPS)的作用下,CDK1可引起肝脏kupffer细胞中的Ubiquitin-Conjugating Enzyme9(UBC9)磷酸化,UBC9具有抗炎的作用,而磷酸化的UBC9则具有促进炎症的作用,UBC9在磷酸化后可使得NF-ΚB抑制因子α降解,NF-ΚB活性增加,从而激发后续的炎症反应。并且,磷酸化UBC9的累积以及UBC9的消耗将造成细胞的凋亡。本实验显示,在烧伤早期,CDK1表达增加可能与免疫细胞的增殖及相应的免疫炎症反应有关,据此推测在大面积烧伤的病人中,CDK1过量表达有可能使得机体的炎症反应加重,严重者会引起SIRS甚至死亡。
Jun基因是转录因子AP-1家族成员之一,Fos蛋白与Jun蛋白在细胞核内通过亮氨酸拉链结构形成异源二聚体复合物-转录因子AP-1,以高亲和力在靶基因的AP-1位点,进一步激活靶基因的表达而最终对刺激做出反应[25]。Jun在绝大多数细胞中呈极低水平表达,参与细胞生长、繁殖、分化等生理过程[26]。以c-Jun氨基末端激酶(JNK)为中心的信号通路可被细胞因子、生长因子、应激(如电离辐射、渗透压、热休克和氧化损伤)等多种因素激活,引起MAP3Ks活化,然后激活MAP2K异构体MKK4和MKK7,而后磷酸化JNK[27-28]。在一些细胞中,JNK和(或)p38的激活促进炎症、细胞凋亡[27]。病理条件下,Jun的过度表达及调控变化可能与多种疾病及机体损伤有关[29]。有相关研究发现,Jun在中枢神经系统的表达与伤害性感觉或痛觉有关,Jun可作为中枢神经系统对伤害性刺激反应的标志[30]。因此,本实验结果显示烧伤早期Jun基因表达上调可能与烧伤刺激、应激及炎症的激活有关。
信号传导与转录激活因子(Stat)蛋白家族是一组可以与不同细胞因子或生长因子结合的相关蛋白,在细胞因子-受体相互作用的过程中充当载体,保持信号在细胞内传递的内在特异性[31]。Stat1通过横跨细胞膜、胞浆的受体将信号传导入核,然后在核内调节基因的表达,因此其能够调节多种细胞生命活动,Stat1还能够影响不同细胞因子的活性,如干扰素、HMGB1、IL-27和IL35[32-33]。有研究发现Stat1活化促进INF-α/β/γ的表达,上调MHC-Ⅰ和Ⅱ类分子、共刺激分子和趋化分子表达,促进DC成熟分化[34]。也有研究证实IFN-α通过磷酸化Stat1,诱导NK细胞分泌IFN-γ,并增强其杀伤功能[35],而IFN-γ又可以引起Stat1磷酸化,从而增强巨噬细胞的活性[36]。同时Stat1可以影响促进向Thl型细胞分化和促进促炎症性细胞因子产生[37]。本实验结果示在烧伤后第1天Stat1表达量较对照组明显下降,反应了在烧伤早期机体已出现免疫功能抑制,从而导致临床上烧伤早期患者免疫功能低下易感染及死亡。
综上所述,小鼠烧伤后第1天全血游离白细胞Cdk1、Jun和Stat1基因在烧伤早期免疫细胞反应过程中发挥着重要的作用。本研究所筛选出来差异表达基因从分子水平为我们探讨烧伤早期免疫细胞反应机制提供理论依据,同时Jun、Stat1基因在烧伤早期刺激反应过程中也起着重要的作用,这就为临床上烧伤早期诊断及治疗靶点的筛选提供了新方向。我们会对烧伤后期免疫细胞反应进行进一步研究,探索机体从烧伤至完全恢复全过程差异表达基因的表达情况,为更全面探索烧伤刺激反应机制及临床烧伤诊治提供新的方向。
| [1] | Oppeltz RF, Rani M, Zhang Q, et al. Burn-induced alterations in toll-like receptor-mediated responses by bronchoalveolar lavage cells[J]. Cytokine, 2011, 55(3): 396-401. DOI: 10.1016/j.cyto.2011.05.004. |
| [2] | Shen H, De Almeida PE, Kang KH, et al. Burn injury triggered dysfunction in dendritic cell response to TLR9 activation and resulted in skewed T cell functions[J]. PLoS One, 2012, 7(11): e50238. DOI: 10.1371/journal.pone.0050238. |
| [3] | 彭代智. 我国烧伤免疫的研究[J]. 中华烧伤杂志, 2008, 24(5): 390-2. |
| [4] | Evers LH, Bhavsar D, Mailänder P. The biology of burn injury[J]. Exp Dermatol, 2010, 19(9): 777-83. DOI: 10.1111/j.1600-0625.2010.01105.x. |
| [5] | Lederer JA, Brownstein BH, Lopez MC, et al. Comparison of longitudinal leukocyte gene expression after burn injury or trauma-hemorrhage in mice[J]. Physiol Genomics, 2008, 32(3): 299-310. |
| [6] | 高艳彬, 卢志阳, 金辉, 等. 小鼠烧伤后时序芯片数据分析及免疫标志物的初步筛选[J]. 暨南大学学报:自然科学与医学版, 2015, 36(3): 275-81. |
| [7] | 金辉, 高艳彬, 卢志阳, 等. 差异基因表达谱分析小鼠烧伤早期免疫细胞刺激反应的相关基因靶标[J]. 南方医科大学学报, 2015, 35(12): 1775-81. DOI: 10.3969/j.issn.1673-4254.2015.12.22. |
| [8] | Irizarry RA, Hobbs B, Collin F, et al. Exploration, normalization, and summaries of high density oligonucleotide array probe level data[J]. Biostatistics, 2003, 4(2): 249-64. DOI: 10.1093/biostatistics/4.2.249. |
| [9] | Gao L, Gao H, Zhou H, et al. Retraction note: gene expression profiling analysis of the putamen for the investigation of compensatory mechanisms in parkinson's disease[J]. BMC Neurol, 2015, 15(1): 45. DOI: 10.1186/s12883-015-0307-3. |
| [10] | Mutch DM, Berger A, Mansourian R, et al. The limit fold change model: a practical approach for selecting differentially expressed genes from microarray data[J]. BMC Bioinformatics, 2002, 3(1): 17. DOI: 10.1186/1471-2105-3-17. |
| [11] | Franceschini A, Szklarczyk D, Frankild S, et al. STRING v9.1: protein-protein interaction networks, with increased coverage and integration[J]. Nucleic Acids Res, 2013, 41(Database issue): D808-15. |
| [12] | Ashburner M, Ball CA, Blake JA, et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium[J]. Nat Genet, 2000, 25(1): 25-9. DOI: 10.1038/75556. |
| [13] | Maere S, Heymans K, Kuiper M. BiNGO: a cytoscape plugin to assess overrepresentation of gene ontology categories in biological networks[J]. Bioinformatics, 2005, 21(16): 3448-9. DOI: 10.1093/bioinformatics/bti551. |
| [14] | Shannon P, Markiel A, Ozier O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13(11): 2498-504. DOI: 10.1101/gr.1239303. |
| [15] | Nastou KC, Tsaousis GN, Kremizas KE, et al. The human plasma membrane peripherome: visualization and analysis of interactions[J]. Biomed Res Int, 2014, 2014(1): 397145. |
| [16] | 刘毅, 薛晓东, 贾赤宇, 等. 恒温恒压电烫仪建立小鼠烫伤模型的实验研究[J]. 兰州医学院学报, 2001, 27(1): 6-8. |
| [17] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-8. DOI: 10.1006/meth.2001.1262. |
| [18] | Gao Y, Nai W, Yang L, et al. Construction of an immunorelated protein-protein interaction network for clarifying the mechanism of burn[J]. Burns, 2016, 42(2): 405-13. DOI: 10.1016/j.burns.2015.06.015. |
| [19] | Zhou B, Xu W, Herndon D, et al. Analysis of factorial time-course microarrays with application to a clinical study of burn injury[J]. Proc Natl Acad Sci USA, 2010, 107(22): 9923-8. DOI: 10.1073/pnas.1002757107. |
| [20] | Neganova I, Tilgner K, Buskin A, et al. CDK1 plays an important role in the maintenance of pluripotency and genomic stability in human pluripotent stem cells[J]. Cell Death Dis, 2014, 5(11): e1508. DOI: 10.1038/cddis.2014.464. |
| [21] | Padmakumar VC, Aleem E, Berthet C, et al. Cdk2 and Cdk4 activities are dispensable for tumorigenesis caused by the loss of p53[J]. Mol Cell Biol, 2009, 29(10): 2582-93. DOI: 10.1128/MCB.00952-08. |
| [22] | 胡振富, 罗力生. 病理性瘢痕中原癌基因c-myc和c-fos的表达[J]. 实用美容整形外科杂志, 2001, 12(4): 219-21. |
| [23] | 张明君, 舒申友, 周镜桂, 等. 探究增生性瘢痕成纤维细胞中CDK4、CDK2、CDK1基因与细胞周期的相关性[J]. 中国医学创新, 2015, 12(9): 4-6. |
| [24] | Tomasi ML, Ramani K, Ryoo M. Ubiquitin-Conjugating enzyme 9 phosphorylation as a novel mechanism for potentiation of the inflammatory response[J]. Am J Pathol, 2016, 186(9): 2326-36. DOI: 10.1016/j.ajpath.2016.05.007. |
| [25] | Angel P, Karin M. The role of Jun, Fos and the AP-1 complex in cell-proliferation and transformation[J]. Biochim Biophys Acta, 1991, 1072(2/3): 129-57. |
| [26] | Macara IG. Oncogenes and cellular signal transduction[J]. Physiol Rev, 1989, 69(3): 797-820. |
| [27] | 陈建勇, 王聪, 王娟, 等. MAPK信号通路研究进展[J]. 中国医药科学, 2011, 1(8): 32-4. |
| [28] | Weston CR, Davis RJ. The JNK signal transduction pathway[J]. Curr Opin Cell Biol, 2007, 19(2): 142-9. DOI: 10.1016/j.ceb.2007.02.001. |
| [29] | Jørgensen MD. Delayed c-fos proto-oncogene expression in the rat hippocampus induced by transient global cerebral ischemia_an in situ hybridization study[J]. Brain Res, 1989, 484(1/2): 393-8. |
| [30] | 冯雪, 段银钟, 林珠, 等. 大鼠实验性牙齿移动诱导中枢立即早期基因c-fos和c-jun的表达与调节[J]. 中华口腔医学杂志, 2000, 35(4): 305. |
| [31] | Lim CX. Structure, function, and regulation of STAT proteins[J]. Mol Biosyst, 2006, 2(11): 536-50. DOI: 10.1039/b606246f. |
| [32] | Lucas S, Ghilardi N, Li J, et al. IL-27 regulates IL-12 responsiveness of naive CD4 + T cells through Stat1-dependent and -independent mechanisms[J]. Proc Natl Acad Sci USA, 2003, 100(25): 15047-52. DOI: 10.1073/pnas.2536517100. |
| [33] | Collison LW, Delgoffe GM, Guy CS, et al. The composition and signaling of the IL-35 receptor are unconventional[J]. Nat Immunol, 2012, 13(3): 290-U115. DOI: 10.1038/ni.2227. |
| [34] | Lotze JD. Coordinate NF-κ B and STAT1 activation promotes development of myeloid type 1 dendritic cells[J]. Scand J Immunol, 2008, 67(3): 260-9. DOI: 10.1111/sji.2008.67.issue-3. |
| [35] | 林绮文, 吴长有. IFN-α磷酸化STAT1和STAT4诱导人NK细胞产生IFN-γ并增强其杀伤活性[J]. 免疫学杂志, 2011, 27(9): 752-5. |
| [36] | Barnholt KE, Kota RS, Aung HH, et al. Adenosine blocks IFNgamma-induced phosphorylation of STAT1 on serine 727 to reduce macrophage activation[J]. J Immunol, 2009, 183(10): 6767-77. DOI: 10.4049/jimmunol.0900331. |
| [37] | Dunn GP, Koebel CM, Schreiber RD. Interferons, immunity and cancer immunoediting[J]. Nat Rev Immunol, 2006, 6(11): 836-48. DOI: 10.1038/nri1961. |
 2017, Vol. 37
2017, Vol. 37

