2. 南方医科大学 基础医学院病理学系,广东 广州 510515;
3. 南方医科大学 第一临床医学院,广东 广州 510515
2. Department of Pathology, School of Basic Medical Science, Southern Medical University, Guangzhou 510515, China;
3. First Clinical Medical College, Southern Medical University, Guangzhou 510515, China
结直肠癌(CRC)是一种常见的恶性肿瘤,其发病率和肿瘤相关死亡率在所有肿瘤中高居第3位[1]。在我国,随着经济的发展和居民饮食结构的改变,结直肠癌发病率在以每年4%的速度递增,且具有发病年龄轻、分化程度低、恶性程度高以及晚期患者多见等特点。因此,阐明结直肠癌发生的分子机制、鉴定新的结直肠癌诊断及预后判断标志物,对改善结直肠癌的诊疗现状、降低结直肠癌死亡率具有重要意义。
课题组前期利用基因芯片技术对结直肠癌组织及正常粘膜组织进行差异表达谱分析,发现cAMP依赖性蛋白激酶抑制剂β(PKIB)的表达水平有明显变化,提示其可能在结直肠癌发生过程中发挥了重要作用。目前已证实PKIB在乳腺癌、前列腺癌和肺癌中呈高表达状态,促进肿瘤的生长和侵袭[2-4],但PKIB与结直肠癌的关系尚未见研究报道。本研究采用实时荧光定量PCR和免疫组织化学方法检测PKIB mRNA和蛋白在结直肠癌组织中的表达情况,并分析其与临床病理参数之间的关系,旨在揭示PKIB在结直肠癌中的表达水平与临床意义,探讨PKIB表达指导结直肠癌预后的可行性。
1 资料和方法 1.1 材料 1.1.1 组织标本34对新鲜结直肠癌组织及配对癌旁正常粘膜组织标本来自2000~2005年南方医科大学南方医院普外科手术切除标本。另收集南方医院病理科归档的结直肠癌石蜡组织标本72例,全组女性28例,男性44例,平均年龄57岁。低分化17例,中分化38例,高分化17例。参照2017年最新版NCCN指南中判别标准对肿瘤进行分期,其中Ⅰ期10例,Ⅱ期35例,Ⅲ期23例,Ⅳ期4例。病人的随访时间2~106月,中位随访时间52个月。
1.1.2 主要试剂PKIB兔抗人多克隆抗体购自Abcam,抗兔/鼠通用型免疫组化检测试剂盒、DAB显色试剂盒购自DAKO,免疫组化抗原修复液EDTA 8.0购自中杉金桥生物公司,山羊血清封闭液购自北京博奥森生物技术有限公司,PBS缓冲液、DEPC试剂购自武汉博士德生物技术有限公司,PrimeScript RT reagent Kit、Trizol、SYBR PrimeScript Real Time RT-PCR kit均购于大连TaKaRa宝生物工程有限公司。其他试剂:二甲苯、无水乙醇、30%过氧化氢均购自南方医科大学试剂中心。ABI PRISM 7500 Sequence Detection System(Applied Biosystems,Foster City,CA),高速低温冷冻离心机购自Heraeus,光学显微镜购自奥林巴斯公司。
1.2 方法 1.2.1 引物的设计及合成利用Primer Premier 5.0设计特异性引物,由上海Invitrogen贸易有限公司合成。以GAPDH作为内参。引物序列如下:PKIB上游5'-CGGAATGCCTTACCAGACATC-3',下游5'-TTCT TCATTTTGAGGCTTTTCC-3',片段长度153 bp;GAPDH上游5'-GCACCGTCAAGGCTGAGAAC-3',下游5'-TGGTGAAGACGCCAGTGGA-3',片段长度137 bp。
1.2.2 组织总RNA的提取按照Trizol RNA提取试剂盒说明书提取组织标本总RNA。采用紫外分光光度计测定总RNA纯度及浓度,保证1.80≤D260/D280≤2.00,总RNA浓度≥500 ng/μL。
1.2.3 逆转录反应按照逆转录试剂盒操作说明进行逆转录反应,按下列组份配制逆转录反应液:PrimerScript Enzyme Mix 12 μL,Total RNA 500 ng,最后加入RNase Free dH2O补充至10 μL体系,反应条件包括逆转录反应阶段(37 ℃,15 min)和逆转录酶的失活反应阶段(85 ℃,5 s)。
1.2.4 实时荧光定量PCR反应按照实时荧光定量PCR试剂盒操作说明进行反应液配制:SYBR Premix ExTaqTm(2×)5.0 μL,上游+下游引物(10 mol/L)1.0 μL,cDNA 1.0 μL,ROX Reference DyeⅡ(50×)0.2 μL,最后加入蒸馏水补充至10 μL体系。反应条件:95 ℃ 10 min,95 ℃ 30 s,55 ℃ 10 s,72 ℃ 40 s,40个循环,72 ℃ 10 min延伸。实验数据采用各细胞株中目的基因的Ct值与内参基因GAPDH的Ct值,进一步得出△Ct=Ct(目的基因)-Ct(内参基因),用2-△△Ct值表示实验组与对照组中目的基因与内参基因的相对表达量,其中△△Ct=△Ct(实验组)-△Ct(对照组)。所有实验均重复3次。
1.2.5 免疫组织化学标本经常规脱水、固定、石蜡包埋,连续切片,厚度4 μm,行病理常规染色检查及免疫组化研究。石蜡切片脱蜡至水,蒸馏水冲洗3次,PBS漂洗,用EDTA 8.0进行抗原修复7 min,PBS漂洗3 min× 5 min次,3%过氧化氢灭活内源性过氧化物酶10 min,PBS漂洗,滴加10%山羊血清封闭孵育30 min,兔抗人多克隆PKIB抗体浓度是1:50,4 ℃孵育过夜,PBS漂洗,滴加兔/鼠通用型二抗37 ℃孵育30 min,PBS漂洗,DAB显色,复染,脱水透明后,树胶封片。每次实验均设阴性及阳性对照,其余操作同上。结果判定:以细胞质呈清晰棕色为阳性。
1.2.6 判定标准根据染色强度和阳性细胞占总细胞的百分比两个指标综合起来评判实验结果。具体如下:染色强度为阴性者评为0分,轻度染色为1分,中度染色为2分,重度染色为3分;阳性细胞数占总细胞数的比例小于5%者为0分,5%~25%者为1分,26%~50%者为2分,51%~75%者为3分,76%~100%者为4分。上述两项评分相加,结果 < 3分评判为低表达,≥3分评判为高表达[5-6]。
1.2.7 统计学分析采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差表示。癌组织与对应癌旁正常组织间PKIB mRNA的比较采用配对t检验;PKIB蛋白与不同临床病理特征间的关系比较均采用Pearson Chi-square检验;Kaplan-Meier法分析患者生存曲线,并采用Log-Rank检验差异性,取P < 0.05为差异有统计学意义。
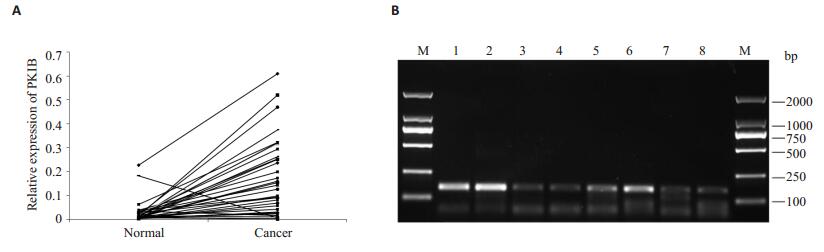
2 结果 2.1 结直肠癌组织中PKIB mRNA的表达利用实时荧光定量PCR方法检测了34对结直肠癌组织与癌旁正常组织中PKIB mRNA的表达量,结果显示,与癌旁正常组织相比,PKIB mRNA在结直肠癌组织中的表达量明显上调,差异具有统计学意义(P < 0.0001,图 1)。
|
图 1 结直肠癌组织和癌旁正常组织中PKIB mRNA的表达水平 Figure 1 Expression levels of PKIB mRNA in CRC tissues and paired adjacent tissues. A: Expression of PKIB in CRC tissues and normal tissues by SYBR real-time PCR; B: Agrose gel electrophoresis of the PCR products. Lanes 1, 3, 5, 7: Normal tissues; Lanes 2, 4, 6, 8: CRC tissues. |
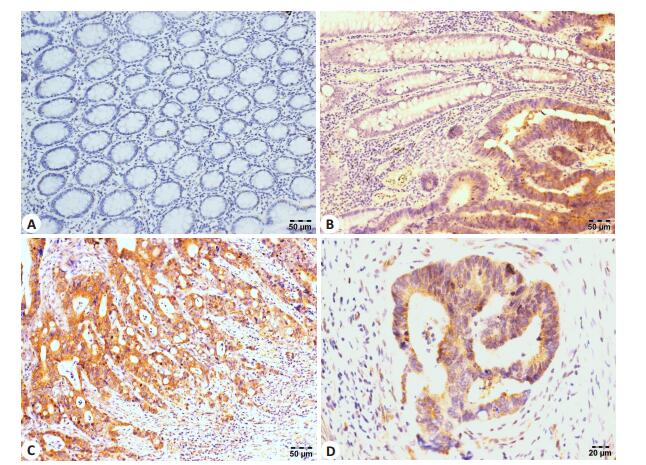
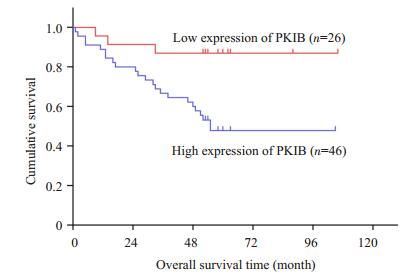
采用免疫组化方法检测结直肠癌组织中PKIB蛋白的表达水平,结果显示:PKIB的阳性信号位于细胞浆内,细胞核与细胞膜均未见着色(图 2)。我们分析了PKIB蛋白表达水平与结直肠癌患者临床病理参数间的关系,结果显示,PKIB蛋白表达水平与患者的T分期密切相关(P=0.038),结直肠癌患者T分期越高,PKIB的表达阳性率也越高。而PKIB的表达与结直肠癌患者的淋巴结转移(N分期)、远隔器官转移(M分期)以及患者的年龄、性别、肿瘤大小、发病部位之间无明显相关性(P>0.05,表 1)。运用Kaplan-Meier法分析PKIB的表达水平与结直肠癌患者生存时间之间的关系,发现高表达PKIB的结直肠癌患者生存时间为70.532±6.190个月,明显短于PKIB低表达的患者的生存时间(93.500± 5.847个月),差异具有统计学意义(P=0.023),提示PKIB的表达水平是判断结直肠癌患者预后的一个重要指标(图 3)。
|
图 2 结直肠癌及正常结肠粘膜组织中PKIB蛋白的表达 Figure 2 Expression of PKIB protein in CRC tissues and normal tissues. A: Expression of PKIB in normal tissues; B: Expression of PKIB in CRC; C: Expression of PK2B in adjacent normal tissues; D: Expression of PKIB in CRC tissues. |
| 表 1 PKIB表达与结直肠癌患者临床病理参数之间的关系 Table 1 Correlation between the clinicopathological features of the CRC patients and expression of PKIB |
|
图 3 Kaplan-Meier法分析PKIB不同表达水平的结直肠癌患者总生存曲线 Figure 3 Kaplan-Meier survival analysis of the overall survival of CRC patients with different expression levels of PKIB protein. |
PKI是一类耐热、耐酸的蛋白激酶抑制剂,它通过影响蛋白激酶PKA的活性和分布,在细胞信号传递过程及细胞调控中起重要作用[7]。PKA通路受PKA调控亚单位和内源性PKA抑制剂等多种因素调控。PKI家族主要包括3种类型的异构体:PKIA、PKIB和PKIG。所有PKI蛋白均包含两个保守的氨基酸序列,即与抑制C亚基(PKA催化亚基)活性有关的底物类似物位点,以及富含亮氨酸、疏水氨基酸的出核信号。PKI能自由进入细胞核与C亚基形成C-PKI复合物,在其出核信号的作用下,将C亚基从细胞核转运到细胞质中[8],从而减少细胞核内转录因子等发生磷酸化,维持细胞对外界刺激的正常应答[8]。PKIB定位于人染色体6q21-22.1,是一个由78个氨基酸组成的蛋白质,相对分子质量为8648 000,具有明显的蛋白激酶抑制活性[9-10]。研究发现,在衰老的人胚肺成纤维细胞中,PKIB表达高于幼稚的细胞,且在衰老的细胞中,PKIB与PKA催化亚单位结合较幼稚细胞中多,提示这种抑制作用与细胞的衰老有一定的关联作用[11]。有研究发现,PKIB能增强与G蛋白偶联的锌受体GPR39结构的活性,并可能在血管内皮细胞中发挥重要的作用[12-13]。近年来PKIB与肿瘤的关系也受到关注。在前列腺癌和乳腺癌中,PKIB在肿瘤组织中均呈现高表达状态[2-3, 14]。并且在前列腺癌中发现,PKIB蛋白的表达水平与Gleasen评分呈正相关[2],提示PKIB可能参与了前列腺癌进展过程。然而,PKIB在成年人的正常脑组织中高表达,而在人脑胶质瘤中低表达,提示PKIB基因可能与人脑胶质瘤的形成和人脑的发育过程有关[15]。但到目前为止,PKIB在结直肠癌中的表达水平及意义尚未见相关报道。本研究结果发现,结直肠癌组织中PKIB mRNA的表达水平明显高于正常结直肠组织,这与前列腺癌、乳腺癌组织中结论一致,说明PKIB可能在上皮性恶性肿瘤中发挥促癌的作用。除此之外,我们还发现PKIB蛋白的表达水平与肿瘤T分期密切相关,结直肠癌患者T分期越高,PKIB蛋白的表达也越高,提示PKIB特异性的高表达可能在结直肠癌的发生发展过程中发挥了重要作用。除此之外,我们利用Kaplan-Meier生存分析方法还发现,PKIB高表达的结直肠癌患者生存时间明显短于PKIB低表达的患者,提示PKIB的表达水平能够用于评估结直肠癌患者生存时间,有望成为一个新的结直肠癌预后判断的生物学指标。PKIA是一个PKA特异性抑制因子,可通过与PKA结合从而发挥其抑制作用,虽然PKIB蛋白与PKIA存在40%的同源性,但目前关于PKIB的作用机制尚不多见。
研究显示,在乳腺癌中PKIB蛋白表达水平与磷酸化Akt的表达水平呈正相关[3, 16],说明PKIB可能参与了Akt信号通路;而进一步分析发现PKIB的表达水平也与三阴性乳腺癌有关,提示PIKB可能具有控制乳腺癌细胞生物学行为并促进乳腺癌发展的作用[3]。在前列腺癌中,降低PKIB表达后可抑制前列腺癌细胞的增殖和侵袭能力,研究还发现,PKIB与PKA-C直接结合后可诱导PKA-C进入细胞核并促使Akt磷酸化,从而激活了Akt信号通路[2-3]。也有研究发现,PKIB能通过激活PI3K/Akt通路促进非小细胞肺癌细胞增殖和肿瘤发生[4]。上述结果说明,PKIB通过参与Akt信号通路参与了多种肿瘤的发生发展过程。Akt作为PI3K重要的下游信号分子[17],具有丝氨酸/苏氨酸激酶活性,在肿瘤中激活的Akt发生磷酸化,使下游蛋白如GSK3β、BAD[18-19]、mTOR[20]等发生活化和磷酸化,调节细胞增殖、分化、代谢和抑制凋亡[21-26]。此外,Akt还参与VEGF介导的血管生成过程中的多个阶段,促进VEGF在内皮细胞和肿瘤细胞中表达,从而促进肿瘤中新生血管的形成[27-28]。同时有研究发现,Akt在结直肠癌中高表达并与临床病理分期密切相关[29-30],提示PKIB在结直肠癌中也可能通过参与Akt信号通路从而发挥其重要作用。因此,PKIB在结直肠癌演进过程中所发挥的确切功能,以及PKIB促进结直肠癌发生发展的分子机制值得深入研究。
总之,本文通过免疫组化和实时荧光定量PCR方法检测了结直肠癌组织中PKIB的表达水平,证实了PKIB在结直肠癌中表达水平明显升高,高表达的PKIB与患者T分期及预后不良密切相关,提示PKIB可能在结直肠癌中发挥了重要作用并有望成为一种新的结直肠癌预后判断标志物。对PKIB在结直肠癌中的作用及作用机制进行深入研究,可以为阐明结直肠癌发病机制提供新思路,为结直肠癌临床诊治、预后监测及基因的精准化治疗提供重要的参考。
| [1] | Siegel R, Desantis C, Jemal A. Colorectal cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(2): 104-17. DOI: 10.3322/caac.v64.2. |
| [2] | Chung S, Furihata M, Tamura K, et al. Overexpressing PKIB in prostate cancer promotes its aggressiveness by linking between PKA and Akt pathways[J]. Oncogene, 2009, 28(32): 2849-59. DOI: 10.1038/onc.2009.144. |
| [3] | Dabanaka K, Chung S, Nakagawa H, et al. PKIB expression strongly correlated with phosphorylated Akt expression in breast cancers and also with triple-negative breast cancer subtype[J]. Med Mol Morphol, 2012, 45(4): 229-33. DOI: 10.1007/s00795-011-0565-0. |
| [4] | Dou P, Zhang D, Cheng Z, et al. PKIB promotes cell proliferation and the invasion-metastasis cascade through the PI3K/Akt pathway in NSCLC cells[J]. Exp Biol Med (Maywood), 2016, 241(17): 1911-8. DOI: 10.1177/1535370216655908. |
| [5] | Wang S, Zhou J, Wang XY, et al. Down-regulated expression of SATB2 is associated with metastasis and poor prognosis in colorectal cancer[J]. J Pathol, 2009, 219(1): 114-22. DOI: 10.1002/path.v219:1. |
| [6] | Yang MH, Yu J, Chen N, et al. Elevated MicroRNA-31 expression regulates colorectal cancer progression by repressing its target gene SATB2[J]. PLoS One, 2013, 8(12): e85353. DOI: 10.1371/journal.pone.0085353. |
| [7] | 郑利华. 人类cAMP依赖型蛋白激酶抑制因子基因的克隆及特征分析[D]. 上海: 复旦大学, 2001. |
| [8] | Dalton GD, Dewey WL. Protein kinase inhibitor peptide(PKI): A family of endogenous neuropeptides that modulate neuronal cAMP-dependent protein kinase function[J]. Neuropeptides, 2006, 40(1): 23-34. DOI: 10.1016/j.npep.2005.10.002. |
| [9] | Jin R, Dai L, Zheng J, et al. Purification and structural study of the beta form of human cAMP-dependent protein kinase inhibitor[J]. Eur J Biochem, 2004, 271(9): 1768-73. DOI: 10.1111/ejb.2004.271.issue-9. |
| [10] | 郑锦彪. 人cAMP依赖型蛋白激酶抑制剂β与人ERp29的克隆、表达纯化和结构研究[D]. 上海: 复旦大学, 2006. |
| [11] | 韩秀丽, 陈丽婷, 谢步善, 等. PKIB抑制PKA活性调节细胞衰老[J]. 中国生物化学与分子生物学报, 2009(11): 1041-6. |
| [12] | Kovacs Z, Schacht T, Herrmann AK, et al. Protein kinase inhibitor beta enhances the constitutive activity of G-protein-coupled Zinc receptor GPR39[J]. Biochem J, 2014, 462(1): 125-32. DOI: 10.1042/BJ20131198. |
| [13] | Lum H, Hao ZP, Gayle D, et al. Vascular endothelial cells Express isoforms of protein kinase A inhibitor[J]. Am J Physiol Cell Physiol, 2002, 282(1): C59-66. DOI: 10.1152/ajpcell.00256.2001. |
| [14] | Dahlman-Wright K, Qiao YC, Jonsson PA, et al. Interplay between AP-1 and estrogen receptor in regulating gene expression and proliferation networks in breast cancer cells[J]. Carcinogenesis, 2012, 33(9): 1684-91. DOI: 10.1093/carcin/bgs223. |
| [15] | Qi ZY, Hui GZ, Li Y, et al. Expression and characterizations of a novel full-length gene PKIbeta related to human glioma[J]. Zhong Hua Yi Xue Za Zhi, 2008, 88(25): 1778-82. |
| [16] | Zhang JB, Song W, Wang YY, et al. Study on correlation between PKIB and pAkt expression in breast cancer tissues[J]. Eur Rev Med Pharmacol Sci, 2017, 21(6): 1264-9. |
| [17] | Fruman DA, Rommel C. PI3K and cancer: lessons, challenges and opportunities[J]. Nat Rev Drug Discov, 2014, 13(2): 140-56. DOI: 10.1038/nrd4204. |
| [18] | Massihnia D, Avan A, Funel N, et al. Phospho-Akt overexpression is prognostic and can be used to tailor the synergistic interaction of Akt inhibitors with gemcitabine in pancreatic cancer[J]. J Hematol Oncol, 2017, 10(1): 9. DOI: 10.1186/s13045-016-0371-1. |
| [19] | Tang B, Tang F, Wang Z, et al. Upregulation of Akt/NF-kappaBregulated inflammation and Akt/Bad-related apoptosis signaling pathway involved in hepatic carcinoma process:suppression by carnosic acid nanoparticle[J]. Int J Nanomedicine, 2016, 11(5): 6401-20. |
| [20] | 张笑飞, 邹小明. EGFR/PI3 K/Akt信号通路在结直肠癌中的研究进展[J]. 中华结直肠疾病电子杂志, 2015(3): 90-2. |
| [21] | 刁存启. Akt信号分子和结直肠癌的关系[J]. 中国肿瘤生物治疗杂志, 2014, 21(5): 584-8. DOI: 10.3872/j.issn.1007-385X.2014.5.019. |
| [22] | Cheung M, Testa JR. Diverse mechanisms of AKT pathway activation in human malignancy[J]. Curr Cancer Drug Targets, 2013, 13(3): 234-44. DOI: 10.2174/1568009611313030002. |
| [23] | O'donnell JS, Massi D, Teng M, et al. PI3K-AKT-mTOR inhibition in cancer immunotherapy, redux[J]. Semin Cancer Biol, 2017, 5(2): 1044-57. |
| [24] | 龚青, 陈洁. PTEN/PI3K/Akt信号转导通路与结直肠癌关系的研究现状[J]. 胃肠病学和肝病学杂志, 2016, 25(6): 706-10. |
| [25] | Fu QF, Liu Y, Fan YE, et al. Alpha-enolase promotes cell glycolysis, growth, migration, and invasion in non-small cell lung cancer through FAK-mediated PI3K/AKT pathway[J]. J Hematol Oncol, 2015, 8(3): 22. |
| [26] | Warfel NA, Kraft AS. PIM kinase (and Akt) biology and signaling in tumors[J]. Pharmacol Ther, 2015, 151(8): 41-9. |
| [27] | Wu G, Qin XQ, Guo JJ, et al. AKT/ERK activation is associated with gastric cancer cell resistance to paclitaxel[J]. Int J Clin Exp Pathol, 2014, 7(4): 1449-58. |
| [28] | 赵军, 皇甫辉. P13K/Akt信号通路及血管内皮生长因子对肿瘤血管生成的影响[J]. 国际耳鼻咽喉头颈外科杂志, 2014, 38(1): 5-6. |
| [29] | Zhang YX, Liu XM, Zhang JH, et al. The expression and clinical significance of PI3K, pAkt and VEGF in colon cancer[J]. Oncol Lett, 2012, 4(4): 763-6. |
| [30] | 孙琦. Akt、TGF-β1、mTOR在结直肠癌中的表达及意义[J]. 现代中西医结合杂志, 2015(21): 2351-2,2374. |
 2017, Vol. 37
2017, Vol. 37

