急性冠脉综合征(ASC)是以心肌细胞血供减少为特征的心脏病,目前已成为影响人类健康的常见病和高发病[1]。经皮冠状动脉介入(PCI)治疗能够快速改善ASC患者心肌血运,降低患者死亡率,目前已在ASC的治疗中广泛推广[2],但需要在术前及术后对患者进行氯吡格雷等抗血小板药物治疗,而在临床上发现有部分人在服用规定剂量的氯吡格雷后,并未起到抗血小板聚集的预防作用[3],即产生了氯吡格雷抵抗(CR)。对PCI术后个体化药物治疗,目前临床仍缺乏足够的认识,致PCI术后患者次级心血管事件的频繁发生。因此,规范PCI术后个体化药物治疗,真正根据不同患者的基础状况及危险因素制定合理的治疗措施,越来越得到人们的关注。
既往的研究表明CYP3A4是氯吡格雷药物代谢涉及的主要酶,且有些国内研究显示CYP3A4基因多态性是CR的关键因素之一,进而影响血栓栓塞性疾病的抗血小板药物治疗效果[4]。但也有其他的研究提出不同的观点,CYP3A4基因多态性并未对ACS患者PCI术后氯吡格雷药物治疗产生影响[5],CYP3A4基因多态性对ACS患者PCI术后个体化药物治疗的指导意义存在争议,本研究通过分析本地区ACS患者CYP3A4基因多态性及与PCI术后患者预后的关系,评价PCI术后患者服用氯吡格雷药物的有效性,从而为降低患者术后心血管事件的再发生率及其制定个体化的药物治疗方案提供参考依据。
1 资料和方法 1.1 对象入选我院心血管科2015 年1 月~2015 年12 月行PCI的皖北汉族ACS患者共275例,其中男168例,女107例,年龄(62.9±10.9)岁。入选标准:ACS包括非ST段抬高型ACS(NSTE-ACS)和ST 段抬高型ACS(STE-ACS)。其中NSTE-ACS包括非ST段抬高型心肌梗死(NSTEMI)和不稳定性心绞痛(UAP)。UAP为患者新近或静息时发生的心绞痛,或原有心绞痛症状近期逐渐加重,同时不伴有心肌损伤标记物的升高;若UAP 伴有心肌损伤标记物明显升高即为NSTEMI;STE-ACS通过检测心肌损伤标记物排除变异性心绞痛后,多数最终发展为ST段抬高型心肌梗死(STEMI),STEMI为持续剧烈的胸痛大于30 min伴心电图相邻两个以上导联ST段抬高,同时心肌损伤标记物的明显升高[5-6]。排除标准:入院前2周内已使服用过阿司匹林及氯吡格雷等抗血小板药物、近半年来出现脑卒中、皮肤及内脏出血性疾病、造血系统疾病、具有抗血小板禁忌症等患者。试验前充分告知研究对象并签署同意书。
1.2 研究方法对入选的275例患者入院时采外周静脉血5 mL测定5 μmol/L 腺苷二磷酸(ADP)诱导的血小板聚集率(PAR)。后分别给予阿司匹林及氯吡格雷负荷量各300 mg顿服。以后,每日给予阿司匹林100 mg、氯吡格雷75 mg维持剂量。入院后7 d再次测定PAR,以2次PAR差值≤10%定义为CR[7]。入院次日清晨空腹采集静脉血8 mL,其中5 mL放置肝素钠抗凝试管中用以测定血糖、血脂、C反应蛋白(CRP)等生化指标分析,剩余3 mL置于EDTA抗凝试管中采用基因芯片技术和荧光定量PCR检测CYP3A4基因894C>T位点的多态性。
冠状动脉造影:由专业医师操作完成冠状动脉造影,结果判断采用2001年美国ACC/AHA关于心血管疾病诊断和治疗的报道[8]。造影显示冠脉狭窄≥75%给予药物支架置入术,并记录患者冠脉造影结果及支架植入过程。支架植入成功标准按照国际惯例,即残余狭窄≤20%,TIMI3级血流。采用Gensini评分[9]对每部位冠脉的狭窄程度进行计算。
手术期内常规应用抗血小板、抗凝、扩冠脉、调脂等基础药物,同时根据患者心率、血压及胃肠道反应等加用控制心室率、降压及抑酸等药物。出院后定期通过电话或门诊随访3~12月。
收集指标:(1)患者的血糖、三酰甘油、胆固醇、CRP等一般情况;(2)血浆CYP3A4基因894C>T位点的多态性分布特征;(3)CR的发生率;(4)患者冠脉情况和其Gensini评分值;(5)记录3~12月后患者的随访结果及主要心脏不良事件。
1.3 统计学处理所有数据统计运用SPSS17.0软件处理。其中计量资料用均数±标准差表示;组间比较运用两样本均数t检验。计数资料以构成比描述,率的比较采用χ2检验。运用多元Logistic 回归分析法,以OR 及95%可信区间(95% CI)表示基因与CR间的关联强度。P<0.05为差异有统计学意义。
2 结果 2.1 基线资料对于通过实验室检测定义为CR的观察对象共108例(39.3%),在年龄、性别、吸烟史、血压、胆固醇(TC)、甘油三酯(TG)、C反应蛋白(CRP)、尿酸(UA)及影响血小板聚集功能的药物的基线治疗等一般资料无显著统计学差异(P>0.05),且ACS患者中UAP与AMI构成比例相近(表 1)。
| 表 1 两组观察对象临床及实验室基线资料对比 Table 1 Clinical and baseline laboratory data in the two groups |
将入选患者分为CR组及NCR组。两组患者分别对CYP3A4 基因894C>T位点进行检测后产生3 种结果,分别为CC、CT及TT型。其中在CR及NCR组中CYP3A4 基因894C>T位点的CC、CT及TT型分布为:88(81.48%)、19(17.59%)、1(0.93%)和128(76.65%)、38(22.75%)、1(0.60%),符合Hardy-Weinberg遗传平衡定律(图 1)。
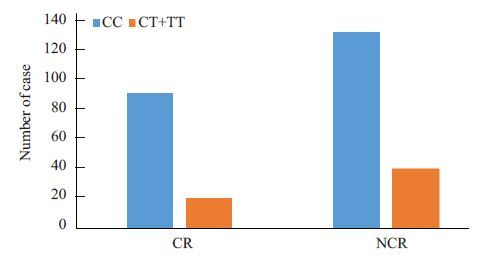
|
图 1 CYP3A4基因多态性分布特征 Figure 1 Distribution of polymorphism of CYP3A4 gene. |
分别对CR及NCR组患者行PCI 术,术后显示在108 例CR组中CYP3A4 基因894C>T位点为CC型的88例患者,其中3支病变、双支病变及单支病变所占比例分别为32.95%、22.73%及44.32%。20 例CYP3A4基因894C>T位点为CT+TT型的患者,上述3种病变所占比例分别为35.00%、25.00%及40.00%,两种基因型冠脉病变所占比之间无统计学差异。在167例NCR组中,CC型患者3支病变、双支病变及单支病变所占比例分别为49.22%、18.75%及32.03%。CT+TT型患者上述3 种病变所占比例分别为38.46%、25.64%及35.90%。两种基因型冠脉病变所占比之间无统计学差异。随后分别对CR 组及NCR 组中CC 型和CT+TT 型进行Gensini评分,两者之间也无统计学差异(表 2)。
| 表 2 两组观察对象冠脉病变数目及Gensini评分 Table 2 Number of coronary lesion and Gensini score in the two groups |
采用Logistic 回归分别分析CYP3A4+894C>T位点的基线资料、是否携带T突变基因等多个因变量与ACS患者发生CR之间的关系。结果显示CYP3A4 基因894C>T位点中携带T突变基因与ACS患者发生CR的相关性差异无统计学意义(OR 1.359,P>0.05)(表 3)。
| 表 3 Logistic多元线性回归分析 Table 3 Logistic multiple linear regression analysis |
患者出院后嘱其院外按时服用抗血小板、调脂等预防用药,并定期至我院门诊复查。同时观察者通过电话等方式随访3月以上,无失访。CR组中CYP3A4基因CC型患者死亡2例、支架内血栓18例、再发心血管事件(包括心绞痛、急性冠脉综合征、急性心肌梗死等)50例,CT+TT型患者无死亡病例、支架内血栓2例、再发心血管事件7例,组内两种基因型之间再发心血管事件病例数无统计数差异(P=0.053);NCR组中均无死亡及支架内血栓病例,CC基因型再发心血管事件24例,CT+TT基因型再发心血管事件11例,差异无统计数意义。CR组中总计发生心血管事件57例,占52.78%,NCR组中总计发生心血管事件35例,占20.96%,结合患者院外服药依从性、生活方式、门诊复查血压、血糖、血脂等结果发现,CR组比NCR组次级心血管事件发生率高,且差异有统计学意义(P<0.05)。
3 讨论氯吡格雷在临床上已被证实可以显著降低冠心病急性心肌缺血的发生几率。且在PCI术后抗血小板治疗过程中,氯吡格雷联合阿司匹林的治疗方案已得到广泛认可[11]。目前,已有研究发现部分冠心病患者对75 mg/d的氯吡格雷治疗反应并不敏感[12]。特别是在接受PCI术治疗后超过21%的患者出现氯吡格雷无反应现象,而这将使次级心血管事件发生率提升8倍以上[13]。一些实验证据也证实,运用血小板反应性的阈值高低可以评估PCI术后患者再次出现缺血、血栓及支架内血栓形成事件的风险性[14]。氯吡格雷需在体内通过一系列的代谢转化过程后才能发挥抗血小板聚集作用。近年来,国内外关于CYP3A4 基因多态性与CR关系仍存在争议,韩雅玲等发现编码CYP3A4基因的代谢酶是整个过程中的关键酶,且CYP3A4基因的多态性与CR有一定的相关性[15],Zhang等[16]研究显示CYP3A4基因中IVS7+894C>T 多态性在非心脏性局部缺血的患者中并不罕见,但与氯吡格雷的抗血小板效应并没有明确的相关性。Jia等[17]也证实CYP3A4基因多态性并没有明显影响应用氯吡格雷7 d维持剂量(75 mg/d)后的血小板聚集率,本地区CYP3A4基因多态性与氯吡格雷抵抗的关系,引起了我们的兴趣。
本试验通过对本地区ACS患者共275例CYP3A4基因894C>T位点的CC、CT及TT型分布特点及与CR的关系进行探讨,结果发现入选观察患者中发生CR的共有108例(39.3%),且随访3~12月后,CR组发生次级心血管事件几率明显高于NCR组,符合既往的研究结论。但两组之间CYP3A4 基因894C>T位点的CC、CT及TT 型分布并无统计学差异,提示CYP3A4 基因894C>T位点突变型并未对氯吡格雷在体内代谢产生明确的影响,其对临床上PCI术后患者个体化用药方面并未起到明确的指导意义。同时本实验显示,CYP3A4 基因多态性与ACS患者冠脉病变数目及Gensini评分差异无关。既往的试验指出CR在临床上的发生率为6%~44%不等,且不同地区及种族发生率有着明显的差异[18]。目前诊断CR的方法主要有实验室及临床两种,本实验采用国际上运用最广泛的实验室诊断标准即分别检测服药前后PAR的差值进行判断[19],得出在本地区ACS患者中CR的发生率为39.3%,而较高的CR发生率提示我们更加注重对本地区ACS患者PCI术后的个体化用药。
现有的研究对于CYP3A4 基因在氯吡格雷的代谢过程中的影响作用是明确的,但既往的试验对CYP3A4 基因不同的突变位点与CR的相关性却得到不同的结果。最新的研究报道指出CYP3A4基因位点IVS10+12G>A并未对氯吡格雷治疗后血栓再发风险产生影响[20],更有中国研究者指出CYP3A4 基因位点IVS10+12G>A多态性对CR具有保护效应[21]。而对CYP3A4 基因894C>T位点近几年来研究较少,而本试验的结果表明CR组与NCR相比并未显示出CYP3A4基因894C>T位点的构成差异性,同时运用Logistic回归分析了CYP3A4+894C>T位点突变型与ACS患者发生CR的相关性也无统计学意义(OR 1.359,P>0.05),最终证明了CYP3A4 基因894C>T突变型并不是CR的风险预测因子。同时本试验发现通过对PCI术后随访3~12 月后,CR组发生次级心血管事件概率明显高于NCR组,说明对于PCI术后患者通过定期检测PAR水平是预测患者再发心血管事件的关键因素,但CYP3A4+894C>T位点并未在其中发挥作用。同时,本课题前期通过相似的试验设计方法对CYP2C19基因多态性及血小板膜受体P2Y12基因C34T、G52T位点多态性的研究结果表明,上述二种基因多态性与CR具有明确的相关性[22]。同时,可以通过对CYP2C19及P2Y12基因的筛选来预测CR的高危人群和接受PCI术的ACS患者近期心血管事件的发生概率。
综上所述,在本地区ACS患者中,CR的发生率较高(39.3%),CR有较高的次级心血管事件发生率,且未被人们广泛认知。我们可以通过筛选患者中CR的高危人群,预防次级心血管事件的发生几率。但CYP3A4基因894C>T位点的多态性与CR性及PCI术后患者次级心血管事件发生的相关性,在本试验并未得到印证,且现有的国内外研究结论并不推荐通过对CYP3A4 基因多态性的筛选预测氯吡格雷抵抗的高危人群。由于基因多态性受到种族及地域等多方面因素的影响,且本试验入组观察人群为275例,存在一定的局限性,同时,我们虽对CYP3A4 基因894C>T位点进行测定,但并未排除CYP3A基因其他SNPs的影响。因此,所得的结论还需要进一步大规模的临床试验验证。
| [1] | 隋辉, 陈伟伟, 王文. 《中国心血管病报告2014》要点介绍[J]. 中华高血压杂志, 2015, 7 (7): 627-9. |
| [2] | 中华医学会心血管病分会, 中华心血管病杂志编辑委员会. 中国心血管病预防指南[J]. 中华心血管病杂志, 2011, 39 (1): 3-21. |
| [3] | Caruso R, Rocchiccioli S, Gori AM, et al. Inflammatory and antioxidant pattern unbalance in "Clopidogrel-Resistant" patients during acute coronary syndrome[J]. Mediators Inflamm, 2015 : 710123. |
| [4] | Liu R, Zhou ZY, Chen YB, et al. Associations of CYP3A4, NR1I2, CYP2C19 and P2RY12 polymorphisms with clopidogrelresistance in Chinese patients with ischemic stroke[J]. Acta Pharmacol Sin, 2016, 37 (7): 882-8. DOI: 10.1038/aps.2016.41. |
| [5] | Zhang HZ, Kim MH, Guo LZ, et al. CYP2C19 but not CYP2B6, CYP3A4, CYP3A5, ABCB1, PON1 or P2Y12 genetic polymorphism impacts antiplatelet response after clopidogrel in Koreans[J]. Blood Coagul Fibrinolysis, 2016 . DOI: 10.1097/MBC.0000000000000536. |
| [6] | 张奇, 沈卫峰. 非ST段抬高型急性冠脉综合征治疗策略流程—— 2014AHA/ACC指南解读[J]. 国际心血管病杂志, 2015, 42 (2): 65-7. |
| [7] | 陈炎, 陈亚蓓, 陶荣芳. 2013 ACCF/AHA ST 段抬高心肌梗死管理指南解读[J]. 中国实用内科杂志, 2013, 12 (33): 42-6. |
| [8] | Gurbel PA, Bliden KP, Hiatt BL, et al. Clopidogrel for coronary stenting: response variability, drug resistance, and the effect of pretreatment platelet reactivity[J]. Circulation, 2003, 107 (23): 2908-13. DOI: 10.1161/01.CIR.0000072771.11429.83. |
| [9] | 赵明中, 胡大一, 马志敏. ACC/AHA关于经皮介入指南简介[J]. 中国医药导刊, 2001, 3 (6): 418-22. |
| [10] | Braunwald E, Philadelphia WB, Gensini GG, et al. Coronary arteriography//Heart Disease[M], 1980: 352-3. |
| [11] | 中华医学会心血管病学分会介入心脏病学组, 中华心血管病杂志编辑委员会. 2012 年中国经皮冠状动脉介入治疗指南[J]. 中华心血管病杂志, 2012, 40 (4): 271-7. |
| [12] | Lee GY, Hahn JY, Lee SY, et al. Adjunctive cilostazol versus high maintenance dose of clopidogrel in patients with hyporesponsiveness to chronic clopidogrel therapy[J]. Yonsei Med J, 2013, 54 (1): 34-40. DOI: 10.3349/ymj.2013.54.1.34. |
| [13] | Nguyen TA, Diodati JG, Pharand C. Resistance to clopidogrel: A review of the evidence[J]. J Am Coll Cardiol, 2005, 45 (8): 1157-64. DOI: 10.1016/j.jacc.2005.01.034. |
| [14] | Legrand D, Barbato E, Chenu P, et al. The STIB score: a simple clinical test to predict clopidogrel resistance[J]. Acta Cardiol, 2014, 69 (1): 85-6. |
| [15] | 韩雅玲, 麦晓燕, 李毅, 等. 细胞色素P450 3A4 894C>T 位点基因多态性与氯吡格雷抵抗的关系[J]. 解放军医学杂志, 2008, 33 (8): 939-42. |
| [16] | Zhang S, Lai X, Li W, et al. VASP phosphorylation and genetic polymorphism for clopidogrel resistance in Chinese patients with non-cardioembolic ischemic stroke[J]. Thromb Res, 2014, 134 (6): 1272-7. DOI: 10.1016/j.thromres.2014.10.001. |
| [17] | Jia DM, Chen ZB, Zhang MJ, et al. CYP2C19 polymorphisms and antiplatelet effects of clopidogrel in acute ischemic stroke in China[J]. Stroke, 2013, 44 (6): 1717-9. DOI: 10.1161/STROKEAHA.113.000823. |
| [18] | Nguyen TA, Diodati JG, Pharand C. Resistance to clopidogrel: A review of the evidence[J]. JAM Coll Cardiol, 2005, 45 : 1157-64. DOI: 10.1016/j.jacc.2005.01.034. |
| [19] | Floyd CN, Ferro A. Antiplatelet drug resistance: Molecular insights and clinical implications[J]. Prostaglandins Other Lipid Mediat, 2015, 120 (SI): 21-7. |
| [20] | Danielak D, Kara?niewicz-?ada M, Wi?niewska K, et al. Impact of CYP3A4*1G allele on clinical pharmacokinetics and pharmacodynamics of clopidogrel[J]. Eur J Drug Metab Pharmacokinet, 2016 . |
| [21] | Liu R, Zhou ZY, Chen YB, et al. Associations of CYP3A4, NR1I2, CYP2C19 and P2RY12 polymorphisms with clopidogrel resistance in Chinese patients with ischemic stroke[J]. Acta Pharmacol Sin, 2016, 37 (7): 882-8. DOI: 10.1038/aps.2016.41. |
| [22] | 李妙男, 王洪巨, 汤阳, 等. 血浆细胞色素P4502C19基因多态性与皖北汉族急性冠脉综合征患者氯吡格雷抵抗及冠脉介入术后近期预后的关系[J]. 临床心血管病杂志, 2016, 32 (3): 272-6. |
 2017, Vol. 37
2017, Vol. 37

