2. 儿科学重庆市重点实验室;
3. 儿童发育重大疾病国家国际科技合作基地;
4. 儿科发育疾病研究教育部重点实验室, 重庆400014
2. Chongqing Key Laboratory of Pediatrics;
3. China International Science and Technology Cooperation Base of Child Development and Critical Disorders;
4. Ministry of Education Key Laboratory of Developmental Disorders in Children, Chongqing 400014, China
丙泊酚是临床麻醉最常用的静脉麻醉药之一,大量研究表明,反复应用丙泊酚可引起神经细胞凋亡增加,损伤学习、记忆、认知功能[1-4]。同时,低氧作为围术期容易被忽略的并发症,也是引起细胞凋亡、认知功能障碍的重要因素[5-6]。而丙泊酚又被报道具有减轻氧化应激作用[7]。氧化应激是指机体在遭受各种有害刺激时,机体或细胞内自由基的产生和抗氧化防御之间严重失衡,导致活性氧在机体或细胞内蓄积而引起细胞毒性反应,从而导致组织损伤的过程[8]。活性氧簇(ROS)是细胞内正常的代谢产物,在较低的水平时ROS是信号分子,而在高水平,就会氧化细胞内的蛋白质、脂类、DNA等生物大分子,尤其是线粒体蛋白易受到损害,造成细胞损伤,ROS水平可反应细胞氧化损伤程度[9]。超氧化物歧化酶(SOD)是机体内主要的超氧自由基清除剂,在机体的抗氧化系统中发挥着极其重要作用,是抵抗ROS损害的第一道防线,其活性高低代表了组织清除自由基的能力。如果SOD活性不足或含量降低,细胞就受到氧自由基的攻击,诱发细胞损伤[10]。目前研究显示低氧可通过抑制线粒体的呼吸作用,产生过量的ROS、过氧化氢等物质,使细胞或机体内的氧化压力增加,进而攻击核苷酸,导致细胞坏死或凋亡[11]。鉴于丙泊酚既具有抗氧化应激作用,其本身又可接到细胞损伤,那么低氧环境下丙泊酚究竟是通过减轻氧化应激作用从而减少低氧对神经元样PC12细胞的损伤凋亡,还是增加细胞损伤?尚不明确。因此,本研究拟探讨低氧环境下丙泊酚对神经元样PC12细胞凋亡的影响及机制。
1 材料和方法 1.1 主要试剂与仪器PC12细胞(由重庆医科大学基础医学院重庆市生物化学与分子药理学重点实验室馈赠);丙泊酚(批号:X14101B,意大利阿斯利康生产);DMEM/F12 培养基(美国GIBCO 公司);胎牛血清FBS(美国GIBCO 公司);胰蛋白酶(Hyclone 公司,美国);MTT 试剂;Annexin V. FITC/试剂盒(凯基,中国);ROS试剂盒(碧云天,S0033),总SOD活性检测试剂盒(S0101);培养箱(Thermo Forma 公司,美国);倒置相差光学显微镜Olympus 公司,日本);Epics2XL H 型流式细胞仪(Beckman Coulter 公司,美国);氧气培养腔(ThermoForma公司,美国);低氧培养箱(Thermo Forma公司,美国);数字测氧仪(艾普,中国)。
1.2 细胞培养与处理PC12细胞利用DMEM完全培养基(含FBS 10%)进行传代培养,细胞贴壁后加药(培养和传代要详细描述)。采用随机数字表法分为6 组:丙泊酚低氧组(PH组)、丙泊酚空气组(PA 组)和丙泊酚氧气组(PO组),丙泊酚浓度为10 μmol/L。低氧对照组(CH组)、空气对照组(CA 组)和氧气对照组(CO 组),(脂肪乳浓度均为10 μmol/L)。药物处理完毕后分别放入低氧(5% O2),空气和氧气(35% O2)环境的细胞培养箱培养24 h后检测相关指标。流式检测细胞凋亡,ROS试剂盒检测细胞内ROS水平,SOD试剂盒检测细胞SOD酶活力。
1.3 细胞增殖活力检测取对数生长期的PC12 细胞制成细胞悬液,使用Count Star软件进行细胞计数后接种于4块96孔板,每块96 孔板设置丙泊酚浓度梯度0、10、20、40、80 和160 μmol/L共6组,每组6个复孔,5000个细胞/孔,每孔加入含有10% FBS以及丙泊酚原液配制成的相应浓度DMEM完全培养基,每组设置6个复孔,空白孔加入不含细胞的培养液,加样完毕后放入37 ℃、含5% CO2,21% O2及饱和湿度的细胞培养箱中培养。于8、16、24和32 h时进行MTT检测细胞增殖指数,吸尽培养液后加入20 μL 5 mg/mL MTT+80 μL无血清培养液,继续培养4 h后吸尽反应液,加入150 μL DMSO后摇床溶解5 min,使用酶标仪492 nm波长测各孔A值,将各孔所测A值减去空白孔所测A值后的数据进行分析。根据不同浓度的丙泊酚对细胞增殖的能力影响,选择最佳作用时间及浓度(后续实验以此作为条件)。
1.4 流式细胞术检测细胞凋亡取对数生长期的PC12细胞消化后接种至T25培养瓶内,按1.2 所述处理细胞后,先用0.25%的胰酶消化细胞,将各组细胞用PBS洗2 次,收集1~5×105细胞加入500 μL Binding Buffer 和FITC 标记的AnnexinV(20 μg/mL)10 μL,室温避光30 min,再加入PI(50 μg/mL)5 μL,避光反应5 min后,立即用FACS进行流式细胞仪定量检测(一般不超过1 h),同时以不加AnnexinVFITC及PI的一管作为对照。本实验重复3次,每次同一组准备3管细胞待测。
1.5 ROS检测取对数生长期的PC12细胞消化后接种至6孔板,每孔2×105个细胞,每组设置3个复孔,按1.2所述处理细胞后,按照检测试剂盒说明书进行原位装载探针,通常活性氧阳性对照在刺激细胞20~30 min后可以显著提高活性氧水平。仅在阳性对照孔中加入Rosup作为阳性对照,其余孔不必加入Rosup。使用导致荧光显微镜,488 nm激发波长,525 nm发射波长,进行观察,荧光越强,ROS生成越多。
1.6 SOD水平检测按1.2所述处理细胞后,按照SOD试剂盒说明书收集细胞并加样后,37 ℃孵育30 min,在450 nm测定吸光度,并根据试剂盒说明书所给公式计算出SOD酶活力。
1.7 统计学处理应用SPSS 17.0软件对数据进行统计学分析,所得数值均以均数±标准差表示,应用双因素方差分析进行统计学处理,各组统计量之间做两两比较,P<0.05认为差异有统计学意义。
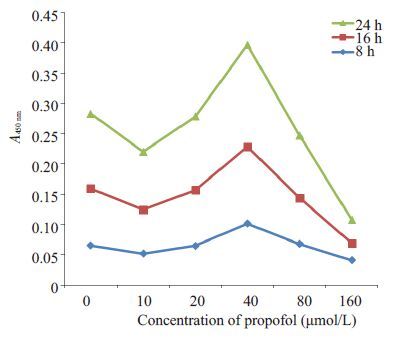
2 结果 2.1 丙泊酚对PC12细胞增殖的影响MTT分析发现,丙泊酚10 μmol/L干预8 h对PC12细胞的增殖有明显抑制作用(P<0.05,图 1)。结合文献[13],实验干预时间采用8 h,丙泊酚浓度10 μmol/L。
|
图 1 丙泊酚对PC12细胞增殖能力的影响 Figure 1 Effects of propofol on proliferation of PC12 cells. |
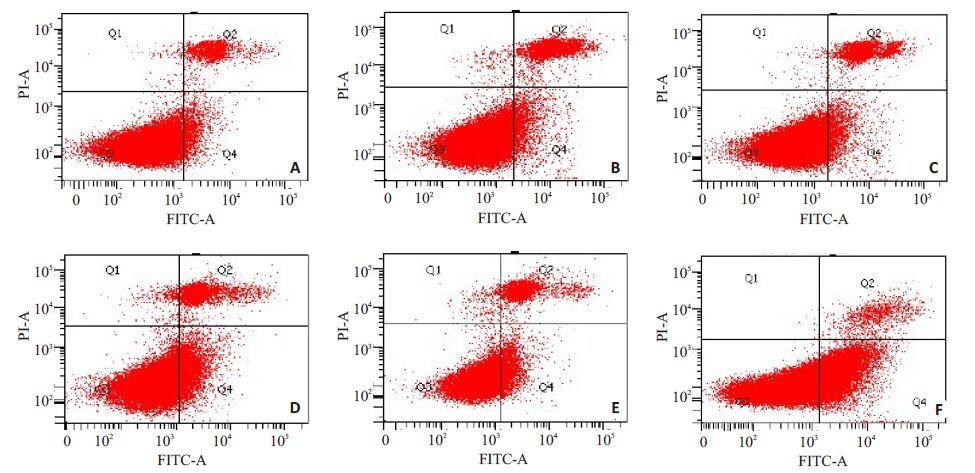
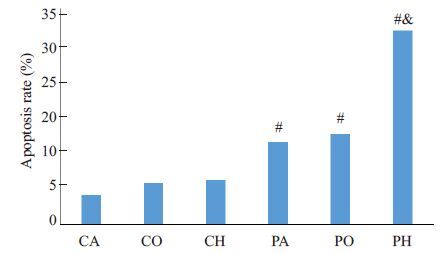
丙泊酚处理组凋亡率均大于各对照组,且PH组凋亡率大于PA及PO组,差异具有统计学意义(P<0.05)(图 2、图 3),表明低氧环境下丙泊酚导致PC12细胞凋亡明显增加。
|
图 2 流式检测细胞凋亡率 Figure 2 Apoptosis rate of PC12 cells in different groups detected by flow ceytometry (n=6). A: CA; B: CO; C: CH; D: PA; E: PO; F: PH. |
|
图 3 低氧环境下丙泊酚导致PC12细胞凋亡明显增加 Figure 3 Propofol increases apoptosis rate of PC12 cellsunder hypoxic conditions (n=6). #P<0.05 control groups;&P<0.01 vs PAand PO groups. |
丙泊酚各处理组PA、PO、PH组,较各对照组CA、CO、CH组,ROS水平均有升高;并且PH组较PA、PO组,ROS生成水平明显升高(图 4)。

|
图 4 低氧环境下丙泊酚导致PC12细胞内ROS水平显著升高 Figure 4 Propofol increases ROS level in PC12 cells under hypoxic conditions (Original magnification: ×40). A: CA; B: CO; C: CH; D:PA; E: PO; F: PH. |
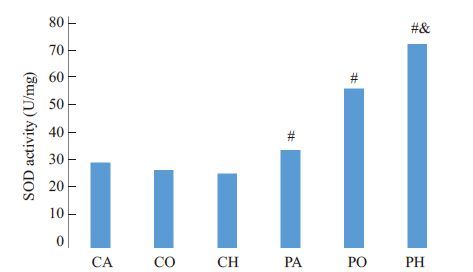
与CA、CO、CH组相比,各PA、PO、PH中SOD表达明显增加(P<0.05),PH组SOD水平较PA及PO组显著增加(P<0.05,图 5)。
|
图 5 低氧环境下丙泊酚导致PC12细胞内SOD水平显著升高 Figure 5 Propofol increases SOD activity in PC12 cells underhypoxic conditions (n=3). #P<0.05 vs control groups; & P<0.01 vs PAand PO groups. |
PC12细胞株源于大鼠肾上腺嗜铬细胞瘤,因其在形态、生理功能等方面与神经元相近,目前已被广泛应用神经细胞相关研究。本研究中参照文献[12]、MTT结果以及我们的前期预实验,我们选择丙泊酚10 μmol/L、8 h给药处理PC12细胞。
本研究发现单独低氧或单独丙泊酚处理可使PC12细胞凋亡增加,而在低氧环境下丙泊酚处理时细胞凋亡较单独低氧或单独丙泊酚处理时明显增加。已有研究报道在缺氧下最常见的是线粒体呼吸链产生过量ROS,可引起细胞损伤[13],反复应用丙泊酚可引起神经细胞凋亡增加,损伤学习、记忆、认知功能[1-4]。SOD是机体内主要的超氧自由基清除剂,在机体的抗氧化系统中发挥着极其重要作用。如果SOD活性不足或含量降低,细胞就受到氧自由基的攻击,诱发细胞损伤[10]。研究中我们提出假设在低氧环境下丙泊酚致PC12细胞凋亡的机制中,SOD抗氧化作用与ROS氧化作用的失衡发挥着重要作用。为此,我们检测了PC12细胞中ROS及SOD水平。我们的研究结果表明,低氧环境下丙泊酚处理细胞时ROS生成水平较其余各组显著升高。我们的研究还进一步证实,丙泊酚暴露组中SOD生成明显增加,且低氧环境下丙泊酚处理细胞时SOD水平较单独丙泊酚处理时显著增加。
丙泊酚化学结构为2,6.二异丙基苯酚,与已知的抗氧化剂2,6.二叔丁基对甲酚和内源性抗氧化剂维生素E在化学结构上有类似之处,被普遍认为具有抗自由基、抑制脂质过氧化反应的作用[14]。本研究中丙泊酚合并低氧时SOD水平显著升高可能是由于低氧导致ROS生成增加,为了抵抗ROS的氧化作用,丙泊酚的抗氧化作用使PC12 细胞内的SOD增加,但生成的SOD抗氧化作用仍不足以抗击ROS的氧化作用,最终细胞内氧化-抗氧化失衡,从而引起了低氧环境下丙泊酚处理时细胞凋亡较单独低氧或单独丙泊酚处理时明显增加。
虽然前期有大量文献报道丙泊酚可减轻缺血再灌注损伤所致的氧化应激反应[15-18],也有研究表明丙泊酚可通过氧化应激或者其他途径介导细胞损伤[2, 19-20],Wang等[21]发现丙泊酚可通过增加细胞ROS水平,加剧血管平滑肌细胞的损伤。此外,本研究也表明低剂量丙泊酚对大鼠皮层和海马脑片过氧化氢损伤具有保护作用,对脑片缺氧缺糖和谷氨酸损伤无保护作用,大剂量丙泊酚加重大鼠皮层和海马脑片缺氧缺糖和谷氨酸损伤[22]。但上述研究均为单独从低氧的损伤作用或丙泊酚的损伤及保护角度进行探讨。本研究将临床常用的静脉麻醉药物丙泊酚与临床常见的低氧并发症相结合,进行探讨研究,发现低氧环境下丙泊酚可导致PC12细胞凋亡增加,并初步证实其机制与氧化应激损伤(氧化与抗氧化失衡)有关。当丙泊酚的抗氧化应激作用不足以与低氧环境下细胞的氧化应激损伤相抗衡时,细胞内氧化-抗氧化失衡,最终可引起细胞凋亡。丙泊酚具有抗氧化应激作用同时又可能介导细胞损伤,其对细胞的保护作用与细胞所受损伤程度、细胞种类以及丙泊酚的使用情况等方面均有密切关系。本研究中使用的PC12细胞株虽在多个方面与神经元相近,但仍存在一定程度的差异,因此后续的深入研究若有条件可在神经元原代培养基础上进行。
综上所述,本研究初步证实低氧环境下丙泊酚可通过化应激损伤导致PC12细胞凋亡增加,但其具体机制仍需我们进一步的研究。
| [1] | Milanovic D, Pesic V, Loncarevic-Vasiljkovic N, et al. The Fas ligand/Fas death receptor pathways contribute to propofol-Induced apoptosis and neuroinflammation in the brain of neonatal rats[J]. Neurotox Res, 2016, 30 (3): 434-52. DOI: 10.1007/s12640-016-9629-1. |
| [2] | Konno A, Nishimura A, Nakamura S, et al. Continuous monitoring of caspase-3 activation induced by propofol in developing mouse brain[J]. Int J Dev Neurosci, 2016, 51 : 42-9. DOI: 10.1016/j.ijdevneu.2016.04.007. |
| [3] | Han D, Jin JH, Fang H, et al. Long-term action of propofol on cognitive function and hippocampal neuroapoptosis in neonatal rats[J]. Int J Clin Exp Med, 2015, 8 (7): 10696-704. |
| [4] | Chen C, Xu GH, Li YH, et al. Selective impairment of attention networks during propofol anesthesia after gynecological surgery in middle-aged women[J]. J Neurol Sci, 2016, 363 : 126-31. DOI: 10.1016/j.jns.2016.02.037. |
| [5] | Zhang B, Dong YL, Zhang GH, et al. The inhalation anesthetic desflurane induces caspase activation and increases amyloid beta-protein levels under hypoxic conditions[J]. J Biol Chem, 2008, 283 (18): 11866-75. DOI: 10.1074/jbc.M800199200. |
| [6] | Concas A, Santoro G, Mascia MP, et al. The general anesthetic propofol enhances the function of gamma-aminobutyric acidcoupled chloridechannel in the rat cerebral cortex[J]. J Neurochem, 1990, 55 (6): 2135-8. DOI: 10.1111/jnc.1990.55.issue-6. |
| [7] | Chikutei KI, Oyama TM, Ishida S, et al. Propofol, an anesthetic possessing neuroprotective action against oxidative stress, promotes the process of cell death induced by H2O2 in rat thymocytes[J]. Eur J Pharmacol, 2006, 540 (1/3): 18-23. |
| [8] | Konishi T. Brain oxidative stress as basic target of antioxidant tradi. tional oriental medicines[J]. Neurochem Res, 2009, 34 (4): 711-6. DOI: 10.1007/s11064-008-9872-9. |
| [9] | Kizaki M, Xian M, Sagawa M, et al. Induction of apoptosis via the modulation of reactive oxygen species(ROS)production in the treatment of myeloid leukemia[J]. Curr Pharm Biotechnol, 2006, 7 (5): 323-9. DOI: 10.2174/138920106778521541. |
| [10] | Otitoju O, Onwurah IE, Otitoju GO, et al. Oxidative stress and superoxide dismutase activity in brain of rats fed with diet containing permethrin[J]. Biokemistri, 2008, 20 (2): 93-8. |
| [11] | Sada K, Nishikawa T, Kukidome DA, et al. Hyperglycemia induces cellular hypoxia through production of mitochondrial ROS followed by suppression of aquaporin-1[J]. PLoS One, 2016, 11 (7): e0158619. DOI: 10.1371/journal.pone.0158619. |
| [12] | Pearn ML, Hu Y, Niesman IR, et al. Propofol neurotoxicity is mediated by p75 neurotrophin receptor activation[J]. Anesthesiology, 2012, 116 (2): 352-61. DOI: 10.1097/ALN.0b013e318242a48c. |
| [13] | Kolamunne RT, Dias IH, Vernallis AB, et al. Nrf2 activation supports cell survival during hypoxia and hypoxia/reoxygenation in cardiomyoblasts; the roles of reactive oxygen and nitrogen species[J]. Redox Biol, 2013, 1 (1): 418-26. DOI: 10.1016/j.redox.2013.08.002. |
| [14] | Kahraman S, Demiryurek AT. Propofol is a peroxynitrite scavenger[J]. Anesth Analg, 1997, 84 (5): 1127-9. DOI: 10.1213/00000539-199705000-00032. |
| [15] | Li YJ, Zhong DD, Lei L, et al. Propofol prevents renal Ischemiareperfusion injury via inhibiting the oxidative stress pathways[J]. Cell Physiol Biochem, 2015, 37 (1): 14-26. DOI: 10.1159/000430329. |
| [16] | Green TR, Bennett SR, Nelson VM. Specificity and properties of propofol as an antioxidant free radical scavenger[J]. Toxicol Appl Pharmacol, 1994, 129 (1): 163-9. DOI: 10.1006/taap.1994.1240. |
| [17] | Bellanti F, Mirabella L, Mitarotonda D, et al. Propofol but not sevoflurane prevents mitochondrial dysfunction and oxidative stress by limiting HIF-1 activation in hepatic ischemia/reperfusion injury[J]. Free Radical Biol Med, 2016, 96 : 323-33. DOI: 10.1016/j.freeradbiomed.2016.05.002. |
| [18] | Xu ZJ, Yu J, Wu JB, et al. The effects of two anesthetics, propofol and sevoflurane, on liver ischemia/reperfusion injury[J]. Cell Physiol Biochem, 2016, 38 (4): 1631-42. DOI: 10.1159/000443103. |
| [19] | Wang JW, Cheng WW, Xu T, et al. Propofol induces apoptosis and inhibits the proliferation of rat embryonic neural stem cells via gamma-aminobutyric acid type A receptor[J]. Genet Mol Res, 2015, 14 (4): 14920-8. DOI: 10.4238/2015.November.18.57. |
| [20] | Sun WC, Liang ZD, Pei L. Propofol-induced rno-miR-665 targets BCL2L1 and influences apoptosis in rodent developing hippocampal astrocytes[J]. Neurotoxicology, 2015, 51 : 87-95. DOI: 10.1016/j.neuro.2015.08.001. |
| [21] | Wang XB, Cheng YH, Liu XJ, et al. Unexpected pro-injury effect of propofol on vascular smooth muscle cells with increased oxidative stress[J]. Crit Care Med, 2011, 39 (4): 738-45. DOI: 10.1097/CCM.0b013e318206bd86. |
| [22] | 于布为, 薛庆生, 夏梦, 等. 丙泊酚对大鼠脑片不同性质损伤的影响[J]. 中华医学杂志, 2003, 83 (13): 1176-9. |
 2017, Vol. 37
2017, Vol. 37

