2. 皖南医学院 弋矶山医院病理科, 安徽 芜湖 241002;
3. 安徽省活性生物大分子重点实验室, 安徽 芜湖 241002
2. Department of Biochemistry Wannan Medical College, Wuhu 241002, China;
3. Anhui Provincial Key Laboratory of Active Biological Macro-molecules, Wuhu 241002, China
氧化应激(OS)被认为是诱导神经细胞损伤的一个主要原因,与多种神经变性疾病如帕金森病(PD)、老年痴呆症(AD)、肌萎缩性侧索硬化(ALS)等密切相关[1]。氧化剂和抗氧化剂产生的不平衡是引发氧化应激的主要原因,ROS作为机体的主要氧化剂,在中枢神经系统疾病中发挥重要作用[2]。因此,靶向ROS的来源可能成为一个治疗神经变性疾病的重要策略。NADPH 氧化酶(NOX)家族是胞内ROS 的重要来源,有7 个成员(NOX1,NOX2,NOX3,NOX4,NOX5,DUOX1,DUOX2)组成。在中枢神经系统中存在的NOX家族成员主要是NOX1,NOX2和NOX4。其中NOX2高表达于多种中枢神经系统疾病,是中枢神经系统疾病中ROS产生的主要来源。NOX2 有2 个胞膜亚基p22phox和gp91phox,3个胞质亚基p40phox,p47phox,和p67phox及1个相对低分子质量G蛋白(Racl 或Rac 2)构成[2-3]。细胞在外源刺激的作用下,NOX2的胞质亚基p47phox向胞膜募集,进而带动其它胞质亚基聚集在胞膜上,形成具有生物学活性的NOX2 聚合体,继而产生大量的ROS[2]。因此,靶向NOX2 可能作为治疗中枢神经系统疾病的一个重要策略。
红景天(Rhodiola rosea L.)是景天科,红景天属植物,生长在北极和海拔较高的高山地区,是目前研究较多的天然活性产物[4]。红景天苷,红景天的酚苷类成分,药理作用广泛,具有抗炎、抗氧化、抗肿瘤、肝保护、神经保护等作用[5-9],已有的研究表明,红景天苷能够通过PI3K-AKT,ERK等多条信号途径,在不同刺激诱发的神经细胞凋亡中发挥保护作用[8, 10]。也有研究发现,红景天苷的神经保护作用主要与减弱ROS的释放、降低胞内钙离子及抑制Akt,ERK等信号途径有关[8, 10-11],尽管已有研究发现,红景天苷可以抑制ROS的释放,也能够保护多种刺激诱导的神经细胞凋亡,但是,红景天苷作为抗氧化剂能否抑制NOX2 来源的ROS,进而抑制ROS介导的下游信号途径发挥神经保护作用尚未见报道。
本研究旨在探讨红景天苷保护H2O2诱导的PC12细胞凋亡的分子机制,是否与NOX2介导的ROS生成有关。该研究将为红景天苷的神经保护机制提供新见解,为红景天苷在神经变性疾病中的应用提供新的理论依据。
1 材料和方法 1.1 材料红景天苷(纯度>95%)购自阿拉丁生物试剂公司;30% H2O2和DAPI为Sigma公司产品;ROS检测试剂盒购于碧云天生物技术公司。兔单克隆抗体:Full PARP,pro-caspase 3,p-p38 MAPKs,p38 MAPKs,p-ERK,ERK,p-JNK,JNK,GAPDH,gp91phox 均为CST 公司产品;p47phox由Santa Cruze公司提供。
1.2 细胞培养PC12细胞由江苏省分子和医学生物技术重点实验室提供,细胞用含10%马血清,5%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素的高糖DMEM完全培养基,置于37 ℃、5%CO2的细胞培养箱培养,每2~3 d传代1次。
1.3 Western blotting取对数生长期的PC12细胞提前1 d接种于12孔细胞培养板,次日加入不同浓度的红景天苷(100,200,400 μg/mL)预处理细胞2 h,然后用200 μmol/L H2O2作用细胞不同的时间,收集胞内总蛋白。药物处理后的PC12细胞,每孔加入含蛋白酶抑制剂的细胞裂解液(碧云天)100 μL,冰上裂解30 min,期间不断摇晃细胞培养板,从而使细胞充分裂解。12 500 r/min,4 ℃离心10 min,收集细胞裂解液。测定各组蛋白浓度,最后加入loadding buffer 煮沸10 min。取等量蛋白上样,进行SDS-PAGE电泳。电泳后的蛋白样品转移到硝酸纤维素膜上,然后用5%的脱脂奶粉室温封闭1 h,TBST洗膜3次后加入相应一抗4 ℃孵育过夜。次日,TBST洗去一抗,加入Odyssey专用的荧光二抗室温孵育1 h,TBST洗膜3次,去离子水洗膜1次之后,用Odyssey双色红外激光成像系统扫膜,并使用配套分析软件处理实验结果。
1.4 DAPI染色PC12细胞提前1 d接种于12孔细胞培养板,次日进行实验分组:空白对照组,红景天苷处理组,H2O2处理组,红景天苷联合H2O2处理组。红景天苷(400 μg/mL)预孵育细胞2 h,然后200 μmol/L H2O2刺激细胞24 h,弃去细胞培养基,用PBS洗涤细胞2次,4%多聚甲醛室温固定20 min,PBS 洗细胞3次,加入DAPI(1 μg/mL)室温避光染色5 min,PBS洗涤细胞之后,于荧光倒置显微镜(Olympus DP72,Japan)下观察并拍照。
1.5 ROS含量检测PC12细胞实验分组同1.4,红景天苷400 μg/mL预处理细胞2 h,200 μmol/L H2O2处理细胞30 min,ROS检测试剂盒(碧云天)检测胞内ROS的水平。具体实验操作严格按照试剂盒说明书进行。
1.6 膜质分离实验提前1 d 将PC12 细胞接种于60 mm细胞培养小皿,实验分组同1.4。红景天苷400 μg/mL预处理细胞2 h,200 μmol/L H2O2处理细胞20 min,膜质分离试剂盒(碧云天)分别提取胞膜蛋白和胞质蛋白,按照试剂盒说明书进行相应操作。
1.7 免疫共沉淀实验实验分组和药物处理同1.6,细胞裂解液冰上裂解细胞30 min,收集胞内总蛋白。等量蛋白中加入p47phox一抗(1∶100),于静音混合器上4 ℃孵育过夜,次日加入Agarose A/G beads(Santa Cruze)20 μL继续孵育2 h,预冷的细胞裂解液洗涤beads 4 次,最后加入loaddingbuffer煮沸,免疫共沉淀样品进行SDS-PAGE电泳。后续实验同Western blotting。
1.8 统计分析实验数据以均数±标准差表示,SPSS 17.0 统计软件分析实验结果,统计分析采用单因素方差分析,P<0.05认为差异有统计学意义。
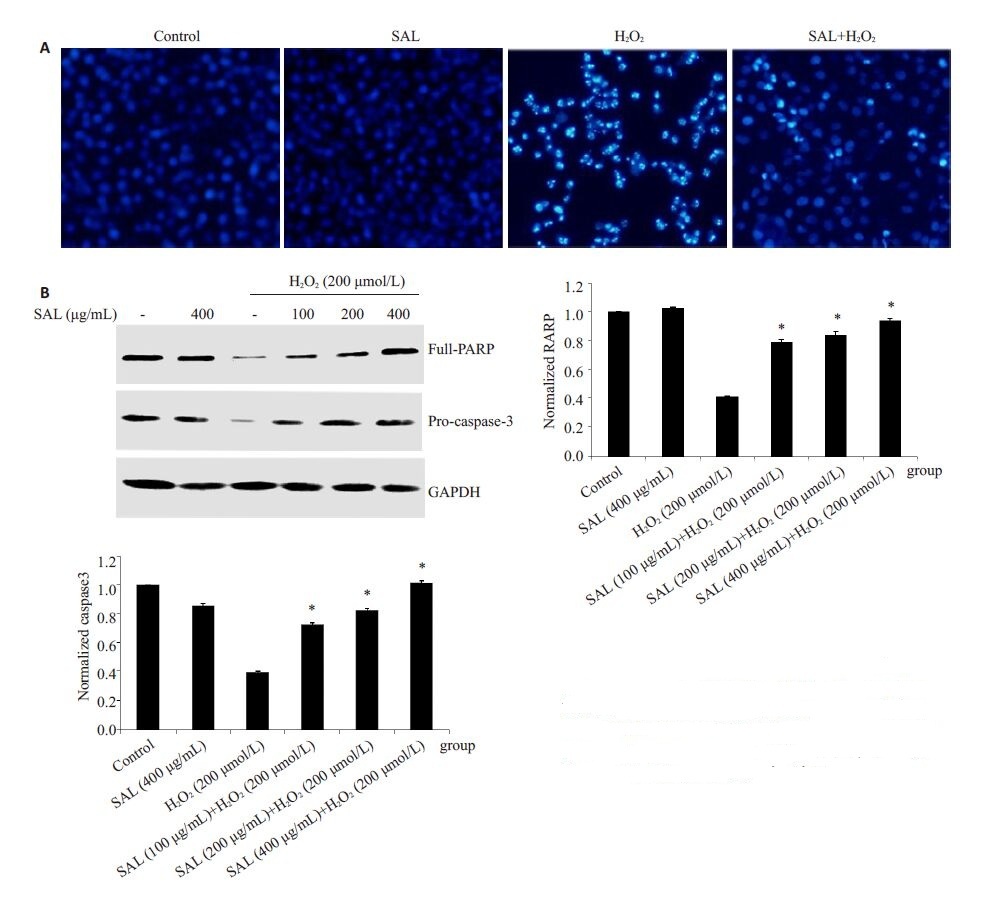
2 结果 2.1 红景天苷抑制H2O2诱导的PC12细胞凋亡为了验证红景天苷的神经保护作用,PC12细胞首先用红景天苷预孵育2 h,然后200 μmol/L H2O2刺激24 h,进行DAPI染色实验,荧光倒置显微镜观察细胞核的形态改变。我们的实验结果表明,对照组和红景天苷单独处理组细胞的胞核圆形,均一蓝染,H2O2刺激的细胞,细胞核出现典型的凋亡形态改变,主要表现为核浓缩,核碎裂。然而,红景天苷预处理的PC12 细胞,与H2O2单独刺激的细胞相比,细胞核浓缩与核碎裂现象明显减弱(图 1A)。Western blotting 检测凋亡相关蛋白Full PARP和pro-caspase 3 的表达。图 1B结果显示,H2O2刺激组胞内全长PARP的含量明显减少,而红景天苷预处理组细胞,全长PARP的含量与H2O2刺激组相比显著增加,并表现出浓度依赖性。H2O2单独处理组与对照组相比,pro-caspase 3的水平显著减弱,而红景天苷预处理组能够浓度依赖性的增强pro-caspase 3的含量。
|
图 1 红景天苷抑制H2O2诱导的PC12细胞凋亡 Figure 1 Salidroside inhibites PC12 cell apoptosis induced by H2O2. A: Cell nuclear morphology observed after DAPI staining; B: Expression levels of full PARP and pro-caspase 3 detected by Western blotting. *P<0.05 vs cells treated with H2O2. |
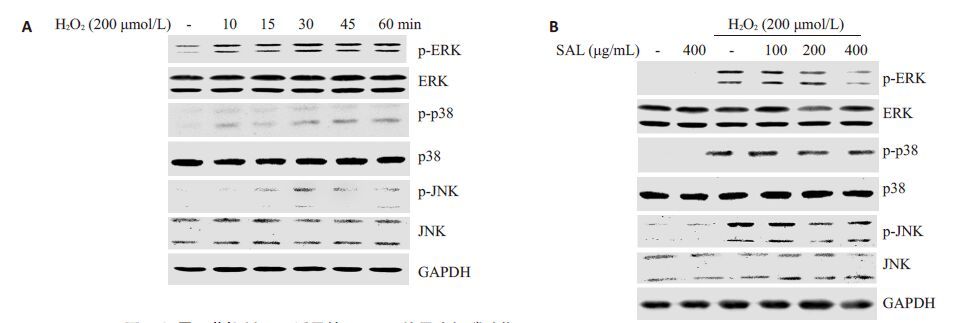
Western blotting 检测MAPKs信号途径的结果显示,H2O2刺激能够诱导MAPKs家族成员ERK,p38 和JNK的磷酸化,H2O2作用30 min左右,磷酸化水平达到最高点,然后开始下降(图 2A)。我们选取磷酸化水平最强的时间点用于后续实验。其次,PC12细胞预先用不用浓度的红景天苷作用2 h,再加入200 μmol/L H2O2刺激30 min,Western blotting检测MAPKs信号的活化。图 2B结果发现,红景天苷能够浓度依赖性的抑制H2O2诱导的p38,ERK和JNK的磷酸化,而对总p38,ERK,JNK的表达基本无影响。
|
图 2 红景天苷抑制H2O2诱导的MAPKs信号途径磷酸化 Figure 2 Salidroside suppresses phosphorylations of MAPK signaling pathway induced by H2O2. A: H2O2 induces the activation of MAPK signaling pathway; B: Salidroside suppresses the activation of MAPK signaling pathway induced by H2O2. |
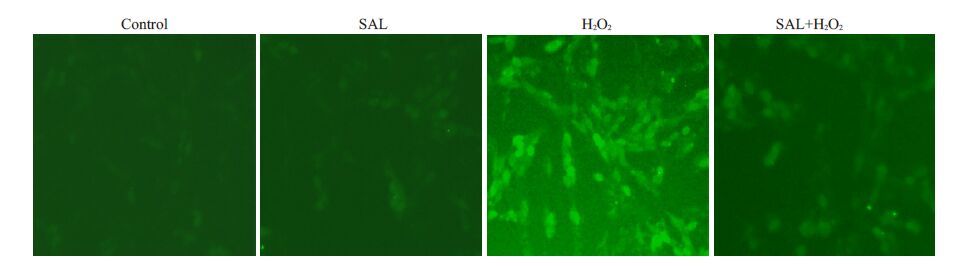
ROS检测试剂盒检测胞内ROS结果显示,H2O2刺激PC12细胞,胞内ROS的含量明显增强(绿色荧光增强),而红景天苷预处理的细胞,胞内ROS 的含量与H2O2处理的细胞相比显著下降(绿色荧光明显减弱)(图 3)。
|
图 3 红景天苷减弱H2O2诱导的ROS释放 Figure 3 Salidroside reduces the release of ROS induced by H2O2 |
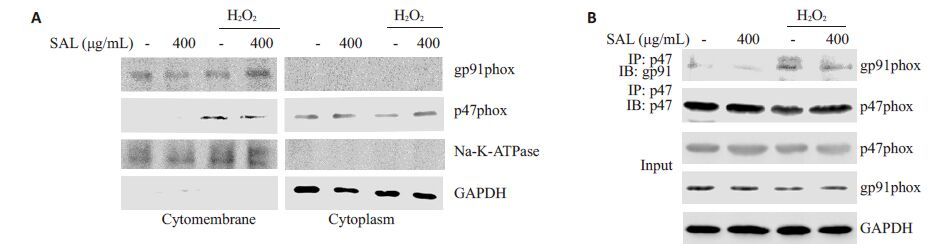
NOX2 是胞内ROS的主要来源,膜质分离试剂盒分别提取胞膜蛋白和胞质蛋白,分离提取的胞膜和胞质总蛋白进行Western blotting 检测。图 4A结果发现,H2O2刺激的PC12细胞,p47phox的在胞膜中的含量与对照组相比明显增加,而红景天苷预处理组,p47phox在胞膜中的水平与H2O2刺激组相比有所下降。提取的胞质总蛋白同样进行Western blotting 检测。结果表明,H2O2处理的PC12细胞,胞质蛋白p47phox的水平较对照组明显下降,而红景天苷预处理组能够明显逆转这一现象。该结果意味着,H2O2能够诱导p47phox向胞膜的募集,而红景天苷能够抑制p47phox的膜转位。免疫共沉淀实验探测红景天苷对gp91phox与p47phox结合的影响作用。图 4B结果证明,H2O2单独刺激组两者间的结合量增加,而红景天苷预处理的细胞,两者的结合量明显低于H2O2刺激组。免疫共沉淀结果说明,H2O2激能够诱导胞质蛋白p47phox与胞膜蛋白gp91phox的结合,而红景天苷能够抑制两者间的结合。总之,图 4结果表明,红景天苷能够抑制H2O2诱导的p47phox亚基从胞质向胞膜的募集,减弱gp91phox与p47phox的结合,进而抑制NOX2的活性。
|
图 4 红景天苷抑制H2O2诱导的NOX2活化 Figure 4 Salidroside inhibits the activation of NOX2 induced by H2O2. A: Levels of gp91phox and p47phox on the membrane and in the cytoplasm detected by membrane-cytoplasm separation experiment; B: Co immunoprecipitation experiment for determining binding between gp91phox and p47phox. |
本研究旨在探讨红景天苷能否通过抑制NOX2的活性,影响ROS的释放及其介导的下游信号途径,发挥神经保护作用。
我们首先验证红景天苷对H2O2诱导PC12细胞的保护作用。采用H2O2刺激PC12细胞,构建神经损伤模型,通过Western blotting检测凋亡相关蛋白Full PARP和pro-caspase 3的水平及DAPI染色检测细胞核的形态变化,评价红景天苷对H2O2诱导PC12细胞凋亡的保护作用。图 1A表明,对照组和红景天苷单独处理的PC12细胞,DAPI染色之后,细胞核呈现出均一蓝色,200 μmol/LH2O2刺激的PC12细胞,则表现出明显的细胞核浓缩,细胞核碎裂等典型的细胞凋亡形态改变。然而,红景天苷预处理的细胞,核浓缩与核碎裂现象较H2O2刺激组显著降低。PARP 是细胞凋亡核心成员半胱天冬酶(caspase)的切割底物,一旦被切割则失去其酶活力。PARP剪切被认为是细胞凋亡的一个重要指标。我们的实验结果发现,红景天苷预处理的PC12 细胞,全长PARP的含量呈现浓度依赖性的增强,pro-caspase 3的含量也呈现与全长PARP相同的趋势变化表明,H2O2刺激能够诱导PARP和pro-caspase 3的切割,从而使全长PARP和pro-caspase 3的含量下降。然而,红景天苷能够剂量依赖性的逆转该现象。其次,我们探索红景天苷发挥神经保护作用的信号途径。作为胞内非常重要的信号途径,MAPKs信号通路一直是众多研究的热点[12-13]。近年来有研究[14]报导,地骨皮乙素能够通过抑制MAPKs信号途径保护H2O2诱导的SH-SY5Y神经细胞凋亡;三甲基氯化锡能够通过MAPKs信号途径调控人神经母细胞瘤细胞的凋亡[15]。另外,也有研究发现,红景天苷可以通过抑制MAPKs信号途径的激活抑制炎症因子释放[7]。然而,在神经细胞中,红景天苷是否也能够通过影响该信号通路,保护H2O2诱导的神经细胞凋亡尚不明确。本研究中,我们首先用200 μmol/LH2O2刺激PC12细胞不同的时间(10,15,30,45,60 min),Western blotting 检测MAPKs 家族成员ERK,p38 及JNK 的磷酸化水平。结果表明,H2O2刺激能够诱导MAPKs家族成员磷酸化激活,30 min磷酸化最强(图 2A),与我们以前的研究[16]结果一致。其次,我们选取磷酸化变化最强的时间点,进一步检测红景天苷对MAPKs信号变化的影响。不同浓度的红景天苷(100,200,400μg/mL)预处理PC12细胞2 h,然后用200 μmol/L H2O2刺激细胞30 min。图 2B表明,红景天苷浓度依赖性的减弱ERK,p38及JNK的磷酸化水平。该结果意味着,红景天苷能够通过抑制H2O2诱导的MAPKs信号途径活化,保护H2O2诱导的PC12细胞凋亡。
ROS作为MAPKs信号途径的重要上游信号分子,有研究表明红景天苷能够抑制ROS的产生[17]。接下来,我们证明了红景天苷对ROS释放的抑制作用。实验结果表明,红景天苷能够减少H2O2诱导的ROS释放(图 3)。NOX家族是胞内ROS的重要来源,其中NOX2多表达于中枢神经系统疾病中。NOX2包含胞膜亚基gp91phox和p22phox以及胞质亚基p40phox,p47 phox,p67 phox和Rac。在外界刺激的作用下,胞质亚基向细胞膜募集与胞膜亚基结合成具有活性的NOX2,活化的NOX2通过NADPH辅酶不断的将电子传递给氧气,继而产生大量的ROS[18]。已有的研究发现,抑制NOX2的活性可以显著较少胞内ROS的生成,从而发挥神经保护作用[19-21]。因此,我们设想红景天苷是否也能通过抑制NOX2的活性,减弱胞内ROS的水平,在H2O2诱导的神经细胞凋亡中发挥保护作用?本研究中,我们通过膜质分离实验检测胞质亚基p47phox的膜转位,免疫共沉淀实验探测胞膜亚基gp91phox与胞质亚基p47phox的结合情况来评价红景天苷对NOX2活性的抑制作用。H2O2刺激PC12细胞,胞质中p47phox含量下降,而胞膜中该蛋白含量明显升高,说明H2O2刺激能够诱导胞质亚基p47phox向胞膜募集。然而,红景天苷预处理组与H2O2刺激组相比,胞质p47phox向胞膜募集的程度有所下降。该结果说明,红景天苷能够抑制胞质p47phox向胞膜的转位。为了进一步证明红景天苷对NOX2 活性的抑制作用,IP 检测gp91phox与胞质亚基p47phox的结合。结果表明,两者间的结合量在H2O2刺激增多,而红景天苷则可以减弱两者间的结合(图 4B)。因此,红景天苷能够通过抑制p47phox向胞膜的转位,减少p47phox 与gp91phox 的结合,抑制NOX2的生物学活性。据报道,p47phox的磷酸化是其发生膜转位的前提,而且PKC-AKT通路在调控p47phox的磷酸化中发挥重要作用[3]。红景天苷能否抑制p47phox的磷酸化,抑制作用是否与PKC/AKT等激酶有关尚不得而知。因此,探讨红景天苷是否能够影响p47phox的磷酸化,并进一步探明影响其磷酸化的上游信号分子将是我们下一步需要研究的问题。
总之,本研究证明了红景天苷能够通过抑制NOX2-ROS-MAPKs信号通路保护H2O2诱导的神经细胞凋亡,为红景天苷的神经保护机制提供新见解,为红景天苷在神经变性疾病中的应用提供新的理论依据。
| [1] | Chen X, Zhang Q, Cheng Q, et al. Protective effect of salidroside against H2O2-induced cell apoptosis in primary culture of rat hippocampal neurons[J]. Mol Cell Biochem, 2009, 332 (1/2): 85-93. |
| [2] | Sorce S, Krause KH, Jaquet V. Targeting NOX enzymes in the central nervous system: therapeutic opportunities[J]. Cell Mol Life Sci, 2012, 69 (14): 2387-407. DOI: 10.1007/s00018-012-1014-5. |
| [3] | Cai LP, Stevenson J, Geng XK, et al. Combining normobaric Oxygen with ethanol or hypothermia prevents brain damage from thromboembolic stroke via PKC-Akt-NOX modulation[J]. Mol Neurobiol, 2016 . DOI: 10.1007/s12035-016-9695-7. |
| [4] | Liu ZB, Li XE, Simoneau AR, et al. Rhodiola rosea extracts and salidroside decrease the growth of bladder cancer cell lines via inhibition of the mTOR pathway and induction of autophagy[J]. Mol Carcinog, 2012, 51 (3): 257-67. DOI: 10.1002/mc.20780. |
| [5] | Wang J, Li JZ, Lu AX, et al. Anticancer effect of salidroside on A549 lung cancer cells through inhibition of oxidative stress and phospho-p38 expression[J]. Oncol Lett, 2014, 7 (4): 1159-64. |
| [6] | Zhang L, Yu HX, Zhao XC, et al. Neuroprotective effects of salidroside against beta-amyloid-induced oxidative stress in SH-SY5Y human neuroblastoma cells[J]. Neurochem Int, 2010, 57 (5): 547-55. DOI: 10.1016/j.neuint.2010.06.021. |
| [7] | Li DP, Fu YH, Zhang W, et al. Salidroside attenuates inflammatory responses by suppressing nuclear factor-kappa B and mitogen activated protein kinases activation in lipopolysaccharide-induced mastitis in mice[J]. Inflamm Res, 2013, 62 (1): 9-15. DOI: 10.1007/s00011-012-0545-4. |
| [8] | Hu X, Lin S, Yu D, et al. A preliminary study: the anti-proliferation effect of salidroside on different human cancer cell lines[J]. Cell Biol Toxicol, 2010, 26 (6): 499-507. DOI: 10.1007/s10565-010-9159-1. |
| [9] | Senthilkumar R, Chandran R, Parimelazhagan T. Hepatoprotective effect of Rhodiola imbricata rhizome against paracetamol-induced liver toxicity in rats[J]. Saudi J Biol Sci, 2014, 21 (5): 409-16. DOI: 10.1016/j.sjbs.2014.04.001. |
| [10] | Zhang LL, Ding WJ, Sun HX, et al. Salidroside protects PC12 cells from MPP +-induced apoptosis via activation of the PI3K/Akt pathway[J]. Food Chem Toxicol, 2012, 50 (8): 2591-7. DOI: 10.1016/j.fct.2012.05.045. |
| [11] | Chen X, Liu J, Gu XS, et al. Salidroside attenuates glutamateinduced apoptotic cell death in primary cultured hippocampal neurons of rats[J]. Brain Res, 2008, 1238 : 189-98. DOI: 10.1016/j.brainres.2008.07.051. |
| [12] | Qi ZL, Shen L, Zhou HT, et al. Phosphorylation of heat shock protein 27 antagonizes TNF-alpha induced HeLa cell apoptosis via regulating TAK1 ubiquitination and activation of p38 and ERK signaling[J]. Cell Signal, 2014, 26 (7): 1616-25. DOI: 10.1016/j.cellsig.2014.03.015. |
| [13] | Qi ZL, Yin F, Lu LA, et al. Baicalein reduces lipopolysaccharideinduced inflammation via suppressing JAK/STATs activation and ROS production[J]. Inflamm Res, 2013, 62 (9): 845-55. DOI: 10.1007/s00011-013-0639-7. |
| [14] | Hu XL, Niu YX, Zhang Q, et al. Neuroprotective effects of Kukoamine B against Hydrogen peroxide-induced apoptosis and potential mechanisms in SH-SY5Y cells[J]. Environ Toxicol Pharmacol, 2015, 40 (1): 230-40. DOI: 10.1016/j.etap.2015.06.017. |
| [15] | Qing Y, Liang YF, Du QQ, et al. Apoptosis induced by Trimethyltin chloride in human neuroblastoma cells SY5Y is regulated by a balance and cross-talk between NF-kappa B and MAPKs signaling pathways[J]. Arch Toxicol, 2013, 87 (7): 1273-85. DOI: 10.1007/s00204-013-1021-9. |
| [16] | Qi ZL, Qi SM, Gui L, et al. Daphnetin protects oxidative stressinduced neuronal apoptosis via regulation of MAPK signaling and HSP70 expression[J]. Oncol Lett, 2016, 12 (3): 1959-64. |
| [17] | Sun C, Wang ZH, Zheng QS, et al. Salidroside inhibits migration and invasion of human fibrosarcoma HT1080 cells[J]. Phytomedicine, 2012, 19 (3/4): 355-63. |
| [18] | Bedard K, Krause KH. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology[J]. Physiol Rev, 2007, 87 (1): 245-313. DOI: 10.1152/physrev.00044.2005. |
| [19] | Han Z, Gao LY, Lin YH, et al. Neuroprotection of taurine against reactive Oxygen species is associated with inhibiting NADPH oxidases[J]. Eur J Pharmacol, 2016, 777 (1879/0712 (Electronic)): 129-35. |
| [20] | Kochanski R, Peng CY, Higashida T, et al. Neuroprotection conferred by post-ischemia ethanol therapy in experimental stroke: an inhibitory effect on hyperglycolysis and NADPH oxidase activation[J]. J Neurochem, 2013, 126 (1): 113-21. DOI: 10.1111/jnc.12169. |
| [21] | Chen H, Kim Gs, Okami N, et al. NADPH oxidase is involved in post-ischemic brain inflammation[J]. Neurobiol Dise, 2011, 42 (3): 341-8. DOI: 10.1016/j.nbd.2011.01.027. |
 2017, Vol. 37
2017, Vol. 37

