2. 军事医学科学院卫生与环境研究所, 北京 100850
2. Institute of Health and Environmental Medicine, Academy of Military Medical Science, Beijing 100850, China
以缺血、缺氧脑损伤为病理基础发生发展形成的各种脑血管疾病是非常严重的医疗和社会问题[1]。脑缺血、缺氧时,谷氨酸大量释放并在突触间隙堆积,造成钙超载[2-3]和和氧自由基增多[4-5],最终导致神经元坏死、凋亡,是脑损伤病理过程中的重要因素之一。PC12细胞具有典型的神经内分泌细胞结构和功能特征,被广泛应用于神经生理和药理学的研究[6]。右美托咪定(Dex)是一种新型的高选择性、高特异性α2肾上腺素受体激动剂,具有镇静、镇痛、抗交感等作用[7],其独特的药理特点使之可用作ICU患者镇静和手术患者麻醉[8]。近期大量临床和基础实验研究[9-11]表明,Dex具有一定的神经保护作用,并已引起广泛关注。但目前Dex发挥神经保护作用的具体机制尚不清楚,Dex能否保护神经元细胞拮抗过量谷氨酸引起的损伤尚未见报道。因此,本实验应用高浓度谷氨酸(Glu)处理PC12细胞,以建立神经元缺氧损伤模型,探讨Dex对缺氧损伤神经细胞的保护作用及其可能机制。
1 材料和方法 1.1 主要药品、试剂与实验仪器盐酸右美托咪定(上海阿拉丁生化科技股份有限公司,E1521017);谷氨酸(国药集团化学试剂有限公司,20150422);MTT(Amresco 公司,0905C424);DMEM培养基(Gibco公司,8116395);乳酸脱氢酶(LDH)活力定量测定试剂盒(普利莱基因技术有限公司,201303);细胞丙二醛(MDA)测试盒(南京建成生物工程研究所,20160711)、超氧化物歧化酶(SOD)测定试剂盒(南京建成生物工程研究所,2160714);活性氧检测试剂盒(碧云天生物技术有限公司,040116160612)、线粒体膜电位检测试剂盒(JC-1)(碧云天生物技术有限公司,052716160614);Fluo-8® Calcium Reagents and ScreenQuestTM Fluo-8 NW Calcium Assay Kits(AAT Bioquest,133091);酶标仪(美国Molecular Devices,FlexStation3);流式细胞仪(美国B-D)。
1.2 细胞培养PC12细胞(大鼠肾上腺髓质嗜铬细胞瘤细胞株)由南京医科大学胡刚教授惠赠。采用传统方法复苏并培养PC12 细胞,细胞培养液为含10%胎牛血清,105 U/L青霉素,100 mg/L链霉素,pH7.4的DMEM培养基。细胞长到约80%皿底时,弃去原培养液,PBS 洗两次,0.25%的胰酶消化后加新鲜培养液,用吸管轻轻吹打数次,使细胞完全分散,进行传代。
1.3 细胞缺氧模型的建立参考《药理实验新方法和技术》缺氧细胞模型,采用不同浓度Glu(5、10、20、30、40 mmol/L)处理PC12细胞24 h,用细胞活力进行评价,结果表明,20 mmol/L Glu使细胞存活率下降为正常组的(73.5±1.1)%,细胞损伤程度适中,以此建立模型进行实验。
1.4 实验分组(1)对照组:生理盐水预处理1 h后,弃去原培养液,加入等体积无血清的DMEM培养液;(2)Dex组:1 μmol/LDex 预处理1 h 后,弃去原培养液,加入等体积含Dex(1 μmol/L)的DMEM培养液;(3)模型组:生理盐水预处理1 h 后,弃去原培养液,加入等体积含20 mmol/LGlu 的无血清DMEM 培养液;(4)处理组:1 μmol/LDex 预处理1 h 后,弃去原培养液,加入等体积含Dex(1 μmol/L)和Glu(20 mmol/L)的无血清DMEM培养液。
1.5 细胞存活率测定将PC12细胞以l×105/mL的密度接种于96孔板中,每孔100 μL,置于37 ℃,5% CO2培养箱,24 h后换以无血清DMEM培养基继续培养24 h后用于实验。各组分别处理后,每孔加入10 μL含MTT(5 mg/mL)的无血清DMEM培养基,外源性的MTT可被活细胞线粒体中的琥珀酸脱氢酶还原为蓝紫色结晶甲瓒并沉积在细胞中。继续培养4 h后,弃去培养液,每孔加入100 μL二甲基亚砜(DMSO),待蓝紫色甲瓒完全溶解(震荡10 min),用酶标仪测定570 nm波长处的吸光度,计算细胞存活率。
1.6 LDH含量测定将PC12细胞以5×105/mL的密度接种于6孔板中,每孔2 mL,置于37 ℃,5% CO2培养箱,24 h后用于实验。各组分别处理后,收集上清液,3000 r/min 离心5 min,4 ℃,取离心后上清10 μL加入96孔板中,按试剂盒说明加入反应液,酶标仪读取570 nm波长A 值,计算可得LDH含量。
1.7 细胞样本收集将PC12细胞以5×105/mL的密度接种于6孔板中,每孔2 mL,置于37 ℃,5% CO2培养箱,24 h 后用于实验。各组分别处理后,弃去上清,用细胞刮将细胞直接刮下,收集到1.5 mL EP管中。2000 r/min离心5 min,弃上清,加入1% Triton 200 μL,冰浴裂解20 min,12 000 g离心10 min,4 ℃,将上清转移到新的离心管中用于测定。
1.8 MDA含量测定MDA是过氧化脂质降解产物,其高低间接反应了机体细胞受自由基攻击的严重程度。收集样本后,加入300 μL试剂五提取液,混匀2 min,取样0.1 mL于1.5 mLEP管中,按试剂盒说明加入各试剂后,吸取0.25 mL反应液于96孔板中,酶标仪读取530 nm波长A值。上述样本准备好后,同时用BCA试剂盒测定蛋白浓度。根据公式计算可得MDA含量。
1.9 SOD活力测定SOD活力的高低间接反应了机体清除氧自由基的能力。收集样本后,按试剂盒说明加入各试剂,酶标仪读取450 nm波长A值。同时用BCA试剂盒测定蛋白浓度。根据公式计算可得SOD活力。
1.10 ROS含量测定探针DCFH-DA本身没有荧光,可自由穿过细胞膜,被细胞内的酯酶水解生成DCFH,而DCFH不能通透细胞膜。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内活性氧的水平。收集样本后,按试剂盒说明,DCF-DA染色,采用流式细胞仪检测。
1.11 细胞内Ca2+含量测定收集样本后,按试剂盒说明,Fluo8染色,采用流式细胞仪检测。
1.12 线粒体膜电位含量测定线粒体膜电位较高时,JC-1形成聚合物,产生红色荧光;线粒体膜电位较低时,JC-1为单体,产生绿色荧光。常用红绿荧光的相对比例来衡量线粒体膜电位的变化。收集样本后,按试剂盒说明,JC-1染色,采用流式细胞仪检测。
1.13 数据处理实验数据处理采用SPSS 17.0软件,结果以均数±标准差表示,组间比较采用单因素方差分析和双因素方差分析,P<0.05认为差异有统计学意义。
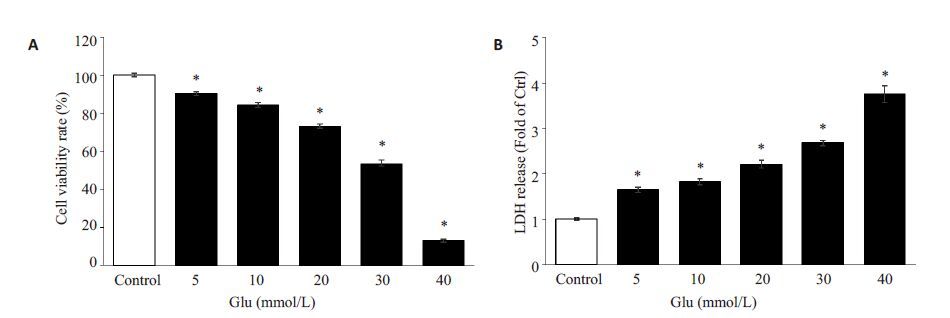
2 结果 2.1 谷氨酸对PC12细胞的损伤作用采用不同浓度Glu处理PC12细胞,观察细胞存活率和LDH释放。图 1结果显示,Glu 5、10、20、30、40 mmol/L浓度时分别使细胞存活率下降为对照组的(90.2±1.1)%、(84.1±1.5)%、(73.5±1.1)%、(53.6±2.0)%、(13.2±0.7)%,LDH释放分别为对照组的1.6±0.1、1.8±0.1、2.2±0.1、2.7±0.1、3.7±0.2 倍。因此,本实验采用20 mmol/L 的Glu作用于PC12细胞24 h作为细胞缺氧损伤模型,进一步探究Dex的保护作用。
|
图 1 不同浓度谷氨酸对PC12细胞存活率和LDH释放的影响 Figure 1 Effects of glutamate (Glu) on cell viability (A) and LDH release (B) in PC12 cells. *P<0.01 vs control group |
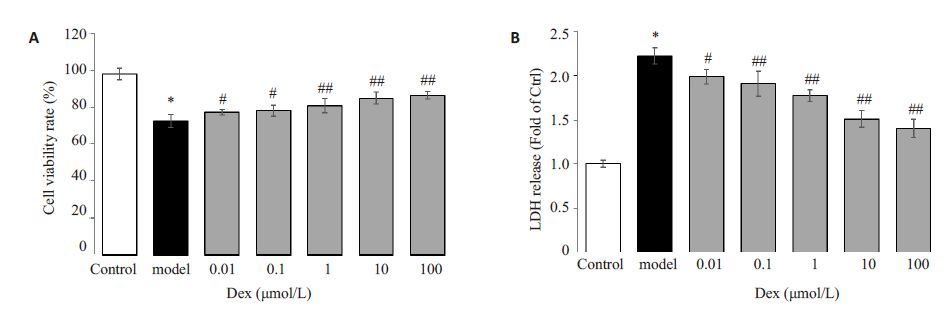
加入不同浓度的Dex(0.01~100 μmol/L)预处理1 h 后行Glu 造模,观察细胞存活率和LDH 释放量。图 2 结果表明,Dex 预处理Glu 损伤的PC12 细胞,在0.01 μmol/L 即表现出保护作用,浓度越高,保护作用越强,至100 μmol/L 时,细胞存活率达到对照组的(86.6±2.2)%,显著高于模型组(P<0.01),LDH释放量为对照组的1.4±0.1倍,显著低于模型组(P<0.01)。
|
图 2 右美托咪定对谷氨酸损伤PC12细胞存活率和LDH释放的影响 Figure 2 Effect of DEX on cell viability (A) and LDH release (B) in Glu-exposed PC12 cells. *P<0.01 vs control group; #P<0.05, ##P<0.01 vs model group |
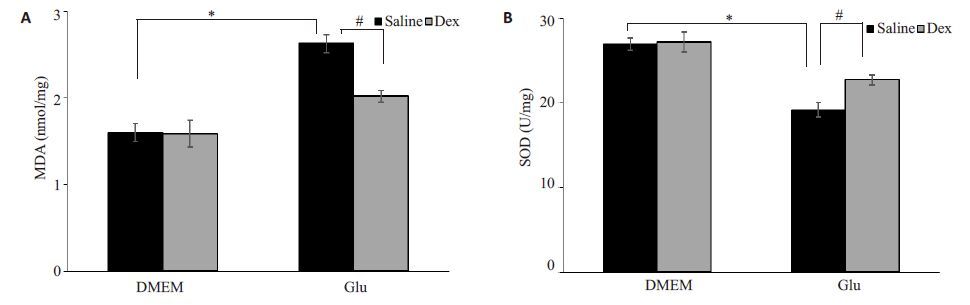
为观察Dex对Glu损伤细胞氧化应激的影响,检测细胞MDA含量和SOD活力。图 3结果显示,与对照组相比,模型组MDA含量增加到2.6±0.1 mmol/L(P<0.01),SOD活力降低到19.2±0.8 U/mg(P<0.01)。而与模型组相比,1 μmol/L Dex 预处理使细胞MDA含量降为2.0±0.1 mmol/L,显著低于模型组(P<0.01);SOD增加到22.7±0.6 U/L,显著高于模型组(P<0.01)。
|
图 3 右美托咪定对谷氨酸损伤PC12细胞MDA含量和SOD活力的影响 Figure 3 Effect of DEX on MDAcontent (A) and SOD activity (B) in Glu-exposed PC12 cells. *P<0.01; #P<0.01 |
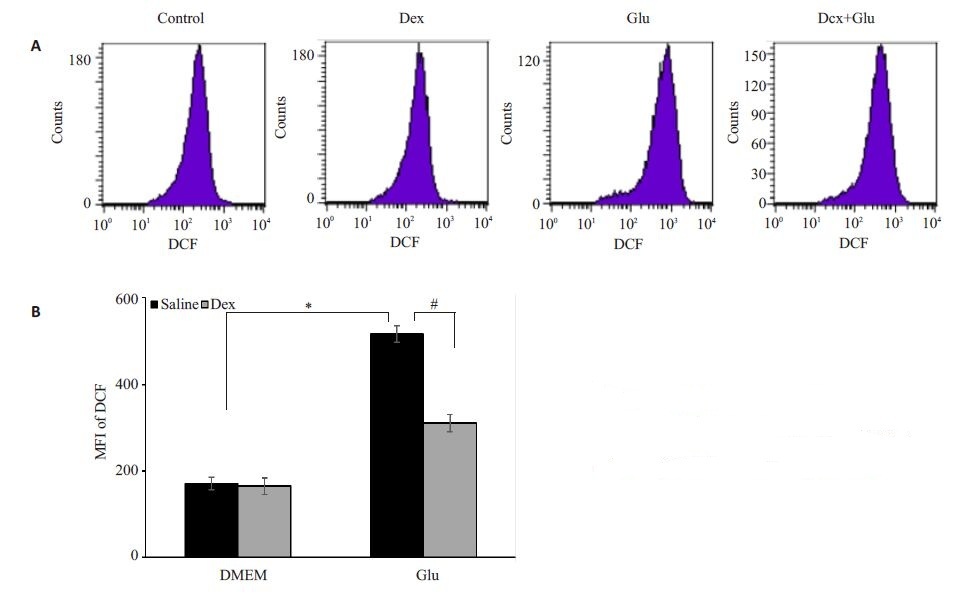
采用DCF的平均荧光强度(MFI)反映细胞内活性氧的水平。图 4结果显示,与对照组相比,模型组MFI从170.1±14.4增加到516.7±19.0(P<0.01)。与模型组相比,Dex预处理使MFI 降为310.4±19.5,显著低于模型组(P<0.01)。
|
图 4 右美托咪定对谷氨酸损伤PC12 细胞ROS水平的影响 Figure 4 Effect of DEX on ROS level measured by mean fluorescence intensity (MFI) of DCF in Glu-exposed PC12 cells. *P<0.01; #P<0.01. |
采用Fluo8的平均荧光强度反映细胞内钙离子的水平。图 5 结果显示,与对照组相比,模型组MFI 从103.1±7.8增加到160.0±8.0(P<0.01)。与模型组相比,Dex预处理使MFI降为129.9±5.6,显著低于模型组(P<0.01)。
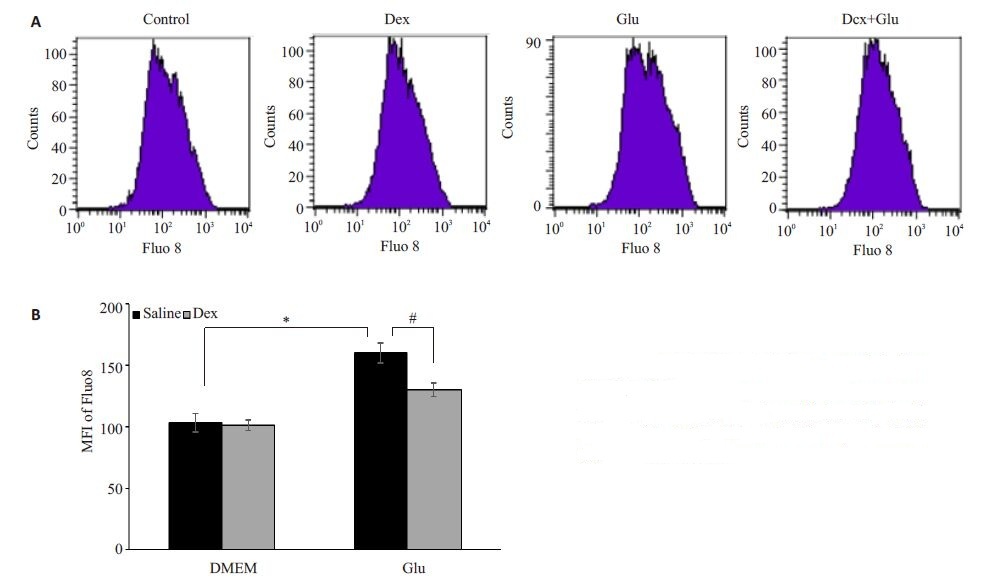
|
图 5 右美托咪定对谷氨酸损伤PC12细胞胞内钙离子水平的影响 Figure 5 Effect of DEX on intracellular Ca2+ level measured by MFI of Fluo8 in Glu-exposed PC12 cells. *P<0.01; #P<0.01. |
常用红绿荧光的相对比例来衡量线粒体膜电位的变化。图 6结果显示,与对照组相比,模型组MFI比值从3.4±0.1 降低到2.2±0.2(P<0.01)。与模型组相比,Dex 1 μmol/L使MFI增加到2.9±0.2,显著高于模型组(P<0.01)。
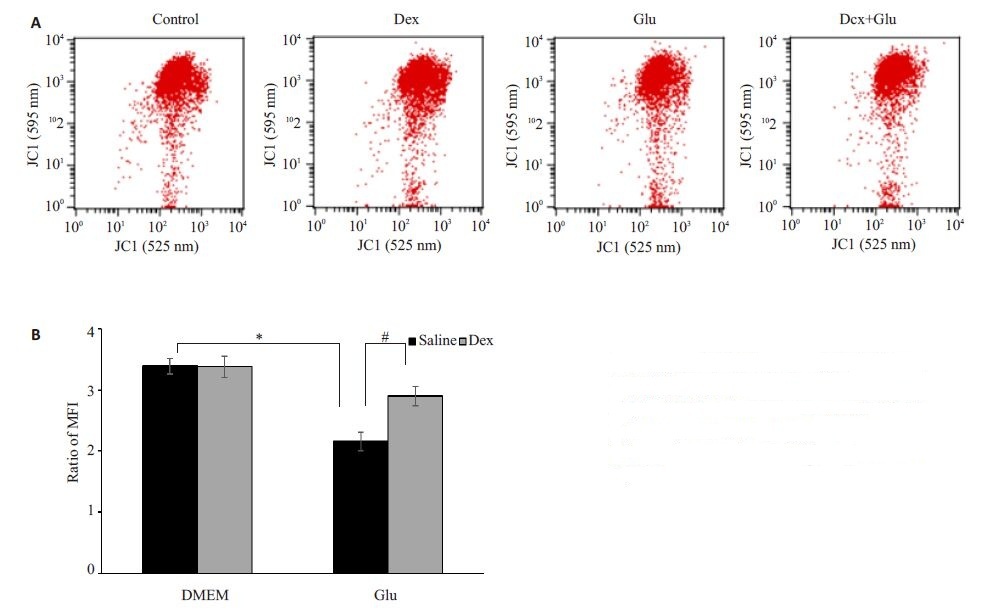
|
图 6 右美托咪定对谷氨酸损伤PC12细胞线粒体膜电位的影响 Figure 6 Effect of DEX on mitochondrial membrane potential (MMP) measured by MFI of J-aggregates to JC-1 ratio in Gluexposed PC12 cells. *P<0.01; #P<0.01. |
脑血管疾病是威胁人类健康的重大疾病之一,其中约70%为缺血性脑血管疾病[12]。然而,目前临床上神经保护药物疗效有限,此类药物的研究具有重要的临床价值和社会意义。Dex是一种新型的α2肾上腺素受体激动剂,作为一种崭新的麻醉辅助用药而广泛应用于临床。研究[13-16]发现,Dex对缺血缺氧脑损伤具有保护作用,其可能机制包括抑制儿茶酚胺释放、抑制神经元凋亡、抑制神经炎症反应等,但其具体机制仍不清楚。本实验采用高浓度Glu处理PC12细胞作为神经元缺氧损伤模型,进一步探讨Dex发挥神经保护作用的机制。
在本实验中,高浓度Glu处理PC12细胞,使细胞存活率显著下降,LDH释放显著增加,提示这可以作为神经元缺氧模型,这也与文献报道[2-5]相符。在0.01~100 μmol/L浓度范围内,Dex预处理能浓度依赖性地拮抗Glu所致PC12细胞损伤,使细胞存活率显著提高,LDH释放显著减少。最近Wei等[17]报道,应用Dex预处理大鼠原代培养神经元,能减弱丙泊酚诱导的神经毒性,这与本实验结果一致,表明在不同的细胞实验模型中,Dex均可发挥神经保护作用。
脑损伤时谷氨酸堆积可诱发氧化应激反应[18],引起氧自由基增多,ROS过度生成[19]。通过检测细胞ROS、MDA含量和SOD活力来评价细胞氧化应激损伤的程度。本实验结果显示,1 μmol/L Dex 能降低Glu 损伤PC12细胞MDA含量,提高SOD活力,抑制ROS过度生成,这提示Dex具有抗氧化应激作用。近年,在多种基础实验模型和临床研究中都观察到Dex具有抗氧化作用。Eser等[20]报道,在缺血再灌注损伤的大鼠,DEX具有抗氧化作用,使MDA水平降低,SOD活力增加,从而发挥神经保护作用。Rodríguez-González等[21]也发现,Dex能够通过降低细胞内ROS水平,抑制氧化应激,拮抗糖氧剥夺所致大鼠原代培养神经元损伤。Yagmurdur等[22]指出,Dex可以通过抑制氧化应激来减轻止血带所致上肢手术患者损伤。而本实验在Glu损伤PC12细胞模型上,进一步揭示了Dex的神经保护作用可能与其增加细胞氧自由基清除能力,抑制活性氧类物质过度产生,减轻氧化应激反应有关,这也与上述研究结论相互印证。
脑损伤时过量释放的Glu还促进Ca2+内流,造成胞内钙超载,导致神经元凋亡、坏死[23]。有文献报道[24],钙通道的激活是Dex发挥镇静催眠作用的机制之一。还有文献证实[25],Dex预处理可以抑制Ca2+内流,降低心肌细胞内钙浓度,发挥抗心律失常的作用。而本实验观察了Dex预处理对Glu损伤PC12细胞胞内Ca2+水平的影响,结果发现,Dex能够拮抗谷氨酸引起的胞内Ca2+浓度升高,这可能与Dex抑制Glu和其受体相结合,从而减少Ca2+进入细胞内,降低细胞内游离钙浓度有关,而其具体机制尚需进一步的研究。该实验结果提示,Dex的神经保护作用可能与其抑制钙超载有关,这为深入阐明Dex的神经保护作用机制提供了新的有意义的实验依据。
Glu对神经元细胞的毒性作用包括氧化应激和钙超载。氧化应激造成ROS生成过多,可通过线粒体通透性转换孔等途径损伤线粒体功能[26];钙超载可触发线粒体摄取Ca2+,累积形成不溶性磷酸钙,损伤线粒体功能。线粒体介导的凋亡途径是细胞凋亡的主要途径之一。Gerhart-Hines等[27]研究发现,Dex预处理能减轻心肌细胞粒体结构和功能损伤,从而改善心肌功能。Katare 等[28]进一步证实,Dex 预处理可能抑制心肌mPTP开放,维持线粒体结构的完整,减少线粒体介导细胞凋亡的发生。上述研究证实了Dex能减轻缺氧心肌线粒体功能受损,改善心肌功能,而本实验在Glu损伤PC12细胞缺氧模型上发现Dex能逆转Glu引起的线粒体膜电位丢失,稳定线粒体膜电位,从而保护线粒体功能,发挥神经保护作用,提示这可能是Dex发挥神经保护作用的另一机制。
综上所述,本实验发现右美托咪定可能通过抗氧化与抑制胞内钙超载,保护线粒体功能,从而对谷氨酸所致PC12损伤发挥保护作用,这为右美托咪定发挥神经保护作用的机制研究提供了新的实验证据,为其临床应用提供了理论依据。
| [1] | Su DF. Fundamental researches on the pathogenesis, prevention and treatment of cerebrovascular diseases[J]. Chin Bulletin Life Sci, 2009, 21 (4): 6. |
| [2] | Yu L, Wang N, Zhang Y, et al. Neuroprotective effect of muscone on glutamate-induced apoptosis in PC12 cells via antioxidant and Ca2+ antagonism[J]. Neurochem Int, 2014, 70 (8): 10-21. |
| [3] | Pakhomova ON, Gregory B, Semenov I, et al. Calcium-mediated pore expansion and cell death following nanoelectroporation[J]. Biochim Biophys Acta, 2014, 1838 (10): 2547-54. DOI: 10.1016/j.bbamem.2014.06.015. |
| [4] | Jy K, Kim HJ, Kim N, et al. Effects of radiofrequency field exposure on glutamate-induced oxidative stress in mouse hippocampal HT22 cells[J]. Int J Radiat Biol, 2016, 20 (4): 1-22. |
| [5] | Kim JJ, Kang YJ, Shin SA, et al. Phlorofucofuroeckol improves Glutamate-Induced neurotoxicity through modulation of oxidative Stress-Mediated mitochondrial dysfunction in PC12 cells[J]. PLoS One, 2016, 11 (9): e0163433. DOI: 10.1371/journal.pone.0163433. |
| [6] | Yu W, Deng X, Ma Z, et al. Equol protects PC12 neuronal cells against hypoxia/reoxygenation injury in vitro by reducing reactive Oxygen species production[J]. J South Med Univ, 2016, 36 (1): 1-7. |
| [7] | Carollo DS, Nossaman BD, Ramadhyani U. Dexmedetomidine: a review of clinical applications[J]. Curr Opin Anaesthesiol, 2008, 21 (4): 457-61. DOI: 10.1097/ACO.0b013e328305e3ef. |
| [8] | 斯妍娜, 韩流, 张媛, 等. 超声造影评价右美托咪定对兔肾缺血/再灌注损伤时微循环灌注的影响[J]. 南方医科大学学报, 2016, 36 (5): 628-32. |
| [9] | Chi OZ, Hunter C, Liu X, et al. The effects of dexmedetomidine on regional cerebral blood flow and Oxygen consumption during severe hemorrhagic hypotension in rats[J]. Anesth Analg, 2011, 113 (2): 349-55. |
| [10] | Chi OZ, Grayson J, Barsoum S, et al. Effects of dexmedetomidine on microregional O-2 balance during reperfusion after focalcerebral ischemia[J]. J Stroke Cerebrovasc Dis, 2015, 24 (1): 163-70. DOI: 10.1016/j.jstrokecerebrovasdis.2014.08.004. |
| [11] | Kang WS, Kim SY, Son JC, et al. The effect of dexmedetomidine on the adjuvant propofol requirement and intraoperative hemodynamics during remifentanil-based anesthesia[J]. Korean J Anesthesiol, 2012, 62 (2): 113-8. DOI: 10.4097/kjae.2012.62.2.113. |
| [12] | Zhou M, Offer A, Yang G, et al. Body mass index, blood pressure, and mortality from stroke: a nationally representative prospective study of 212,000 Chinese men[J]. Stroke, 2008, 39 (3): 753-9. DOI: 10.1161/STROKEAHA.107.495374. |
| [13] | Chiu KM, Lin TY, Lu CW, et al. Inhibitory effect of glutamate release from rat cerebrocortical nerve terminals by a2 adrenoceptor agonist dexmedetomidine[J]. Eur J Pharmacol, 2011, 670 (1): 137-47. DOI: 10.1016/j.ejphar.2011.08.012. |
| [14] | Ma D, Hossain M, Rajakumaraswamy N, et al. Dexmedetomidine produces its neuroprotective effect via the a2A-adrenoceptor subtype[J]. Eur J Pharmacol, 2004, 502 (1/2): 87-97. |
| [15] | Peng M, Wang YL, Wang CY, et al. Dexmedetomidine attenuates lipopolysaccharide-induced proinflammatory response in primary microglia[J]. J Surg Res, 2013, 179 (1): e219-25. DOI: 10.1016/j.jss.2012.05.047. |
| [16] | Sifringer M, von Haefen C, Krain M, et al. Neuroprotective effect of dexmedetomidine on hyperoxia-induced toxicity in the neonatal rat brain[J]. Oxid Med Cell Longev, 2015, 25 (8): 530371. |
| [17] | Wei Y, Hu J, Liang Y, et al. Dexmedetomidine pretreatment attenuates propofolinduced neurotoxicity in neuronal cultures from the rat hippocampus[J]. Mol Med Rep, 2016, 14 (4): 3413-20. |
| [18] | Talha S, Bouitbir J, Charles AL, et al. Pretreatment with brain natriuretic peptide reduces skeletal muscle mitochondrial dysfunction and oxidative stress after ischemia-reperfusion[J]. J Appl Physiol, 2013, 114 (2): 172-9. DOI: 10.1152/japplphysiol.00239.2012. |
| [19] | 鄢娜, 冯泽国, 颜光涛, 等. 重复性低氧预处理对大鼠肾缺血再灌注所致肝脏损伤的影响[J]. 南方医科大学学报, 2015, 35 (1): 149-53. |
| [20] | Eser O, Fidan H, Sahin O, et al. The influence of dexmedetomidine on ischemic rat hippocampus[J]. Brain Res, 2008, 1218 (7): 250-6. |
| [21] | Rodríguez-González R, Sobrino T, Veiga S, et al. Neuroprotective effects of dexmedetomidine conditioning strategies: Evidences from an in vitro model of cerebral ischemia[J]. Life Sci, 2016, 144 (10): 162-9. |
| [22] | Yagmurdur H, Ozcan N, Dokumaci F, et al. Dexmedetomidine reduces the ischemia-reperfusion injury markers during upper extremity surgery with tourniquet[J]. J Hand Surg Am, 2008, 33 (6): 941-7. DOI: 10.1016/j.jhsa.2008.01.014. |
| [23] | Heurteaux C, Lauritzen I, Widmann C, et al. Glutamate-induced overexpression of NMDA receptor messenger RNAs and protein triggered by activation of AMPA/kainate receptors in rat hippocampus following forebrain ischemia[J]. Brain Res, 1994, 659 (1/2): 67-74. |
| [24] | Horvàth G, Szikszay M, Benedek G. Calcium channels are involved in the hypnotic-anestheticaction of dexmedetomidinein rats[J]. Anesth Analg, 1992, 74 (6): 884-8. |
| [25] | 李霞, 刘芬, 董航, 等. 右美托咪定预处理对大鼠缺血再灌注心律失常的影响及机制研究[J]. 疑难病杂志, 2016, 15 (5): 514-7. |
| [26] | Crompton M. The mitochondrial permeability transition pore and its role in cell death[J]. Biochem J, 1999, 341 (2): 233-49. DOI: 10.1042/bj3410233. |
| [27] | Gerhart-Hines Z, Rodgers JT, Bare O, et al. Metabolic control of muscle mitochondrial function and fatty acid oxidation through SIRT1/PGC-1alpha[J]. EMBO J, 2007, 26 (7): 1913-23. DOI: 10.1038/sj.emboj.7601633. |
| [28] | Katare RG, Ando M, Kakinuma Y, et al. Vagal nerve stimulation prevents reperfusion injury through inhibition of opening of mitochondrial permeability transition pore Independent of the bradycardiac effect[J]. J Thorac Cardiovasc Surg, 2009, 137 (1): 223-31. DOI: 10.1016/j.jtcvs.2008.08.020. |
 2017, Vol. 37
2017, Vol. 37

