2. 南方医院放疗科,广东 广州 510515 ;
3. 基础医学院病理教研室,广东 广州 510515 ;
4. 南方医院病理科,广东 广州 510515 ;
5. 影像系,广东 广州 510515 ;
6. 暨南大学附属第一医院肿瘤科,广东 广州 510632
2. Department of Pathology, School of Basic Medical Sciences Southern Medical University, Guangzhou 510515, China ;
3. Department ofPathology, Nanfang Hospital Southern Medical University, Guangzhou 510515, China ;
4. Department of Medical Imaging, Nanfang Hospital Southern Medical University, Guangzhou 510515, China ;
5. Southern Medical University, Guangzhou 510515, China ;
6. Department of Oncology, First Affiliated Hospital of Jinan University, Guangzhou 510632, China
结直肠癌(colorectal cancer, CRC)是常见的恶性肿瘤之一,其发病率在我国平均水平居全部恶性肿瘤的第3位,占癌症死因的第5位[1]。手术切除是结直肠癌的主要治疗方式,然而临床上有一半以上的结直肠癌患者在发现是已出现了微转移,手术后患者中50%发生肝转移。即使Ⅱ期~Ⅲ期直肠癌根治术后局部区域复发率为15%~65%,行全直肠系膜切除术,Ⅲ期患者的局部复发率仍高达20%~30% [2]。为提高局部控制率和远期生存率,这部分患者应该同时进行标准的直肠癌辅助治疗。
放疗抵抗是肿瘤患者放疗治疗失败的主要原因,不同个体展示对放疗治疗反应的明显差异。放疗抵抗导致患者不但对治疗毫无反应,而且可能会错过肿瘤治疗的最佳时机。在结直肠癌的放射治疗中,放射抵抗是一个具有挑战性的课题。许多研究试图找到有关结直肠癌放疗敏感性的生物学标志物以更好的对病人进行选择,包括P53和P21等[3-4]。阐明辐射敏感或抵抗的分子机制,有助于提高治疗其效果。一些研究表明,miRNA能增加或降低肿瘤放射敏感性,与肿瘤放射敏感性密切相关。miR-124异常表达与多种恶性肿瘤相关,如脑肿瘤、胃癌、肝癌、乳腺癌、膀胱癌、结直肠癌、鼻咽癌[5-11]。
然而,目前miR-124的辐射抵抗原理几乎未见报告。本研究拟在探讨miR-124在结直肠中的表达及其对结直肠癌细胞辐射敏感性的影响,并进一步阐明其发挥作用的分子机制,为临床提高结直肠癌辐射敏感性提供一个靶点。
1 资料和方法 1.1 临床标本全部结直肠癌组织标本取自南方医科大学南方医院2010年~2014年,均未接受过放化疗。经病理诊断确诊为结直肠癌。
1.2 细胞株及试剂RPMI 1640培养基、 0.25%胰蛋白酶购自美国GIBCO公司,胎牛血清购自美国Hyclone公司,总RNA提取试剂购自北京天根公司,PrimeScript TM RT reagent Kit逆转录试剂盒、 SYBR@Premix Ex Taq TM实时定量PCR试剂盒购自TaKaRa公司,逆转录、荧光实时定量PCR引物由上海吉玛公司设计合成。人结直肠癌细胞系SW480、 LOVO、 SW620、 HCT-116、 HT-29、 LST-174等购自中国科学院上海细胞生物学研究所细胞库。细胞用含10%胎牛血清、 100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液,置于37 ℃、 CO2:体积分数为5%的饱和湿度培养箱中培养,每2~3 d用0.25%的胰蛋白酶消化、传代,取对数期细胞用于后续实验。真核表达载体pcDNA3.1(+)购自美国Invitrogen公司。PRRX1、 caspase-3、 Bcl-2抗体购均自美国Abcam公司,对照组慢病毒均购自中国上海吉凯公司。miR-124 mimics,mir-124 inhibitor,及对照均购自德国Qiagen公司。培养载玻片购自美国Costar公司。
1.3 结直肠癌组织及细胞中miR-124表达水平的检测采用TRIzol法裂解、氯仿抽提、异丙醇沉淀,提取结直肠癌细胞株和组织标本总RNA。采用逆转录试剂盒进行反应后进行聚合酶反应。运用Stratagene公司Mx3005P软件设计引物,以GAPDH和U6为内参照,参照试剂盒说明采用SYBR Green荧光染料法完成。miR-124上游引物序列: 5'GATACTCATAAGGCAC GCGG-3';下游引物序列: 5'GTGCAGGGTCCGAG GT'。PRRX1上游引物序列: CAGGCGGATGAGAAC GTGG,下游引物序列: AAAAGCATCAGGATAGTGT GTCC。PCR反应条件: 95 ℃变性5 min;95 ℃,10 s;60 ℃(预实验得到),20 s;72 ℃,20 s;78 ℃,20 s收集荧光,共40个循环。以2-△△Ct值表示miR-124的相对表达。
1.4 细胞辐射敏感性的检测取对数生长期结直肠癌细胞系SW480、 LOVO接种于6孔板中,待细胞贴壁后,分别给予0、 2、 4、 6、 8、 10 Gy的X线照射(用Varian 600C加速器6MV-X线,SSD为100 cm)。每个剂量点设3个平行样本,照射后常规培养2周后4%多聚甲醛固定、吉姆萨染色。将培养板置于低倍显微镜下计算出各细胞克隆数(细胞数> 50个的克隆为1个有效克隆):克隆形成率(planting efficiency, PE)=克隆形成数/细胞接种数×100%;细胞存活率(survival fraction, SF)=受照射的细胞克隆率/对照组细胞克隆形成率×100%。采用GraphPadPrism5软件通过“多靶单击模型”拟合细胞存活曲线,获得D0、 Dq、 SF2等放射敏感参数。
1.5 蛋白免疫印迹分析提取处理后的细胞总蛋白,蛋白质裂解后由10%~15% SDS-PAGE凝胶分离,湿转法将胶上的蛋白转移至聚偏二氟乙烯膜上,用5% BSA封闭1.5 h,加抗体温育,洗膜后加二抗温育。ECL显影液及高灵敏化学发光成像系统检测蛋白表达。
1.6 靶基因预测及验证运用生物信息学预测软件targetscanhuman6.0(http://www.Targetscan.org/),按照软件操作流程预测miR-124下游调控的靶基因,并通过文献筛选,最终选定PRRX1作为下一步研究的目标。分别构建成的psi CHEK-2 Vector和psi CHEK-2 Vector突变体2个重组质粒载体,分别转化感受态大肠埃希菌DH5a,挑取单个菌落培养,提取质粒,测序鉴定进行细胞经细胞裂解液裂解后,取5 μL与萤火虫荧光素酶缓冲液及底物5 μL混匀,测量荧光强度,然后加入海肾荧光素酶反应缓冲液及腔肠素底物5 μL混匀,再次测得海肾荧光素酶活性。将每个样品按照萤火虫荧光素酶活性进行均一化处理,比较海肾荧光素酶活性并绘制图表。不同时间重复试3次。
1.7 统计分析采用SPSS 13.0统计软件。数据比较采用单因素方差分方法分析,P < 0.05为差异有统计学意义。
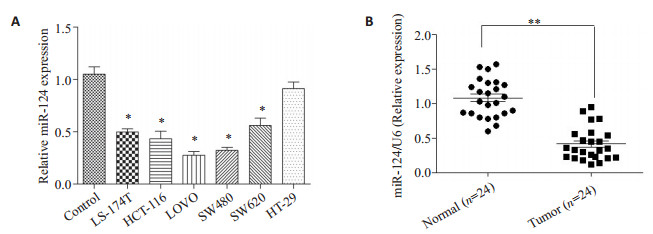
2 结果 2.1 miR-124在结直肠癌细胞株和组织中表达降低荧光定量PCR结果显示,miR-124在结直肠癌细胞株中表达下降(图 1A,P < 0.05)。与邻近正常结直肠标本相比,miR-124在癌组织标本中表达明显降低(图 1B,P < 0.05)。
|
图 1 miR-124在结直肠组织标本和细胞株中表达降低 Figure 1 miR-124 is down-regulated in both primary CRC tissues and CRC cell lines. A: miR-124 is expressed at significantly lower levels in 6 CRC cell lines in comparison with normal colonic mucosa pooled from 3 healthy individuals. Data represent averages from 3 experiments with similar results. **P < 0.01, *P < 0.05 vs control; B: Expression of miR-124 in CRC tissues and the matched normal tissues detected by qRT-PCR (normalized to U6 expression). Data are presented as individual samples (n=24) with the line indicating the mean level. |
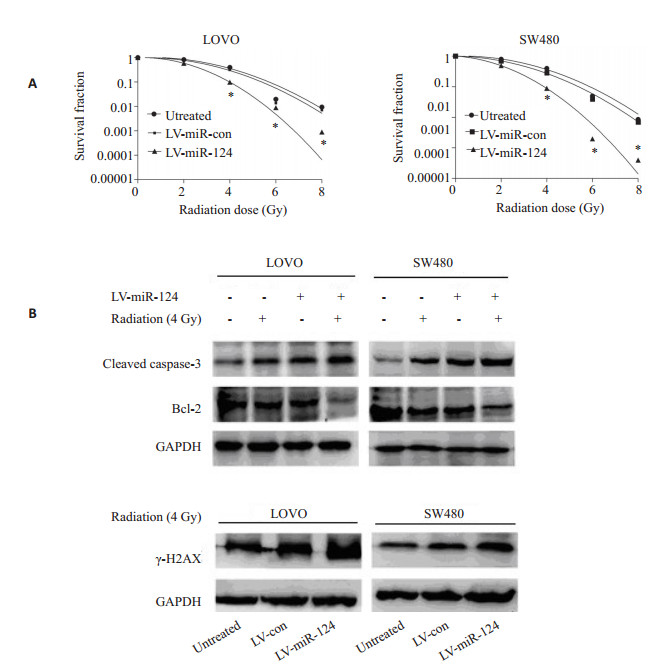
克隆形成实验结果证实:与对照组相比,过表达miR-124联合放疗(不同剂量下)可以降低细胞存活分数,提高辐射敏感性(图 2A)。H2AX是目前国内外研究细胞DNA损伤应激反应的热点之一。细胞在电离辐射或其他因素作用下直接诱导或是通过复制压力诱导形成的双链断裂(DSBs),在细胞辐射后6 h内检测蛋白水平的表达,可以了解DNA双链断裂的情况,即DNA损伤情况。Westernblot结果显示,过表达miR-124联合放疗可以降低Bcl-2的表达,而上调caspase-3和磷酸化的γ-H2AX(图 2B)。提示miR-124增强结直肠细胞辐射敏感性。
|
图 2 miR-124增强结直肠细胞辐射敏感性 Figure 2 miR-124 sensitizes colorectal cancer cells to irradiation in vitro. A: Survived cell fractions of LOVO and SW480 cells stably overexpressing miR-124 following exposure to radiation doses at 0, 2, 4, 6, or 8 Gy; B: Western blotting for analyzing the effect of miR-124 over-expression or/and radiation (4 Gy) on the expressions of caspase-3, Bcl-2 and c-H2AX. *P < 0.05. |
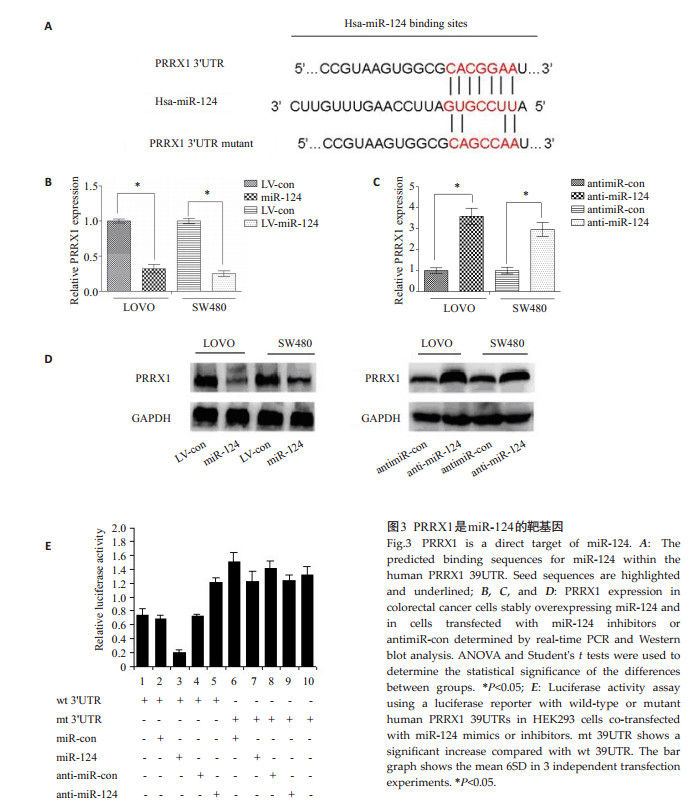
通过TargetScan在线软件预测miR-124与PRRX1 3'UTR区具有结合位点(图 3A)。为了进一步明确,我们构建了PRRX1 3'UTR野生型和突变型荧光素酶报告载体(图 3E)。将PRRX1 3'UTR野生型或突变型载体和miR-124mimics共转染。结果显示,与对照组相比,将PRRX1 3'UTR野生型及miR-124mimics共转染显著降低荧光素酶活性(图 3E,第2和3列,P < 0.05)。而PRRX1 3'UTR于突变型组荧光素酶活性无明显变化(图 3E,第7和8列,P < 0.05)。此外,共转染anti-miR-124和野生型PRRX1 3'’UTR荧光素酶活性升高(图 3E,第4和5列,P < 0.05)。而突变型组荧光素酶活性无明显变化,荧光定量PCR和Western blot显示,过表达miR-124可以降低检测PRRX1表达,反之,沉默miR-124可以上调PRRX1的表达(图 3B、C、 D)。以上结果证实,PRRX1是miR-124下游直接调控的靶基因。
|
图 3 PRRX1是miR-124的靶基因 Figure 3 PRRX1 is a direct target of miR-124. A: The predicted binding sequences for miR-124 within the human PRRX1 39UTR. Seed sequences are highlighted and underlined; B, C, and D: PRRX1 expression in colorectal cancer cells stably overexpressing miR-124 and in cells transfected with miR-124 inhibitors or antimiR-con determined by real-time PCR and Western blot analysis. ANOVA and Student's t tests were used to determine the statistical significance of the differences between groups. *P < 0.05; E: Luciferase activity assay using a luciferase reporter with wild-type or mutant human PRRX1 39UTRs in HEK293 cells co-transfected with miR-124 mimics or inhibitors. mt 39UTR shows a significant increase compared with wt 39UTR. The bar graph shows the mean 6SD in 3 independent transfection experiments. * P < 0.05. |
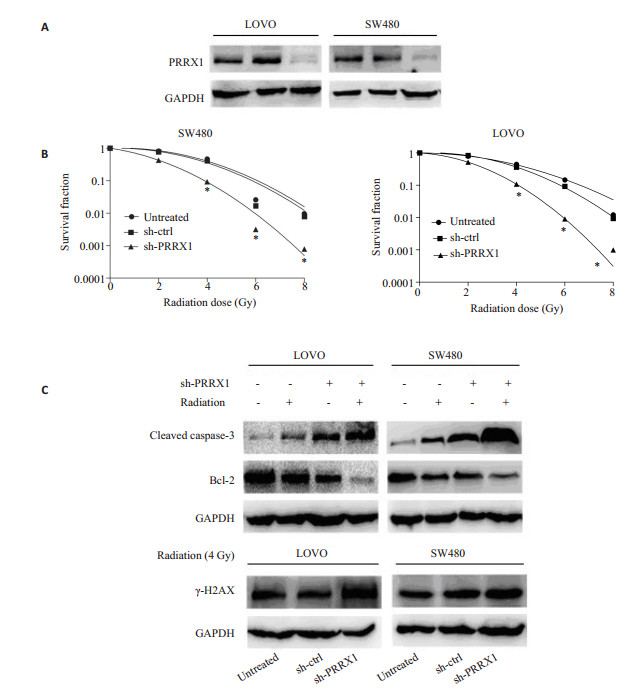
慢病毒转染技术建立稳定干扰PRRX1结直肠癌细胞株,Western blot进一步验证(图 4A)。细胞辐射及平板克隆形成实验结果发现,在细胞结直肠癌LOVO和SW480沉默PRRX1后,辐射后细胞存活分数降低,差异有统计学意义,提示细胞辐敏感性增强(图 4B)。Western blot结果显示,干扰PRRX1联合放疗后,与对照组及空白组相比,γ-H2AX和活性的caspase-3表达水平升高,Bcl-2表达水平降低(图 4C)。
|
图 4 PRRX1敲除后结直肠细胞辐射敏感性的变化 Figure 4 Effect of PRRX1 knockdown on radiosensitivity of CRC cells in vitro. A: Western blotting for analysis of PRRX1 interference efficiency in LOVO and SW480 cells; B: Quantification of CRC cells stably infected with empty vector lentiviruses (control shRNA) and PRRX1-shRNA lentiviruses (PRRX1 shRNA) or without lentiviral infection (untreated) that survived radiation exposure; C: Western blotting for analyzing the effect of PRRX1 knockdown or/ and radiation (4 Gy) on the expressions caspase-3, Bcl-2 and c-H2AX. *P < 0.05. |
为了进一步明确PRRX1为miR-124调节结直肠癌辐射敏感性的一个功能性靶基因,在稳定过表达miR-124的结直肠癌细胞中转染过表达质粒pCDNA3.1-PRXX1,恢复PRRX1的表达,Western blot进一步验证(图 5A)。细胞辐射和平板克隆实验结果显示,与对照组相比,细胞克隆形成率及存活分数升高,细胞辐射抵抗增强,提示PRRX1可以至少部分逆转miR-124引起的辐射敏感性增强(图 5B)。Western blot实验结果发现,PRRX1可以逆转过表达miR-124引起的凋亡相关基因的的表达(图 5C)。以上结果表示PRRX1为miR-124增强结直肠癌辐射性的一个功能想靶基因。
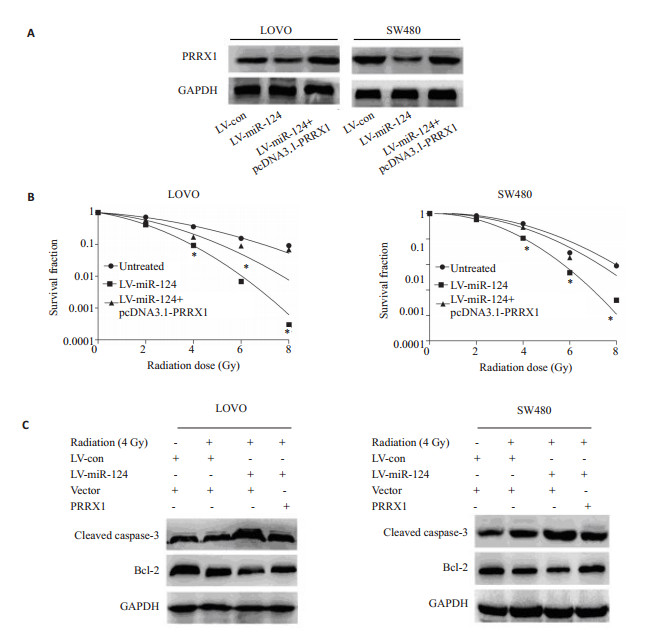
|
图 5 PRRX1可以逆转miR-124引起的辐射敏感性增强 Figure 5 Restoration of PRRX1 expression in miR-124-overexpressing cells rescues the effects of miR-124 on radiosensitivity. A: PRRX1 expression detected by Western blotting after transfection of pcDNA3.1-PRRX1 into miR-124-overexpressing cells; B: Surviving factions of radiation-exposed cells with different treatments; C: Western blotting for analyzing the effect of PRRX1 restoration or/and radiation (4 Gy) on the expressions of caspase-3, Bcl-2 andc-H2AX. *P < 0.05. |
临床中对于晚期结直肠癌患者,放疗抵抗是导致死亡的一个重要原因。辐射抵抗的发生是一个复杂的过程,包括DNA损伤的修复[12-13]、某些信号通路的异常激活、血管生成和自噬等。因此,辐射抵抗也成为临床中结直肠癌治疗急需解决的问题,如何提高结直肠辐射敏感性,提高临床放疗疗效,是我们需要努力的方向。
miRNA作为一类非编码单链小分子RNA,参与调控细胞增殖和凋亡等生物学行为相关的基因表达,且研究证实许多miRNA与肿瘤的发展、侵袭、转移等恶性生物学行为及肿瘤耐药相关,miRNA在调控放疗抵抗方面的作用是当前新的研究热点[14-19]。目前已证实,miRNA-21、 miR-20a、 miR-124等多种miRNAs能够调控各种肿瘤细胞包括结直肠癌的增殖、凋亡等信号途径从而参与调控肿瘤的放疗敏感性[20-21]。然而,miR-124所致辐射抵抗原因暂不明确。
在此研究中,我们发现与正常组织相比,结直肠癌细胞系与临床结直肠癌标本miR-124表达降低,通过过表达miR-124发现其可以增强结直肠细胞辐射敏感性。
根据一些研究报告,EMT与肿瘤干细胞相关,在人类肿瘤细胞中,细胞发生EMT引起辐射抵抗[22-25]。PRRX1是新近发现的EMT(上皮-间质转化)诱导剂和调节剂[22, 25-26],两者与放疗抵抗密切相关。结直肠中中PRRX1的过表达与不良预后及转移有关,但其在辐射敏感性方面发挥着什么样的作用,目前尚未见研究报道。由此我们推断miRNA-124通过下调PRRX1增强结直肠癌细胞的放疗敏感性与EMT及肿瘤干细胞相关。
在此研究中,我们通过生物信息学预测及双荧光素酶报告系统证实PRRX1是其下游直接调控的一个靶基因;通过恢复实验发现PRRX1是miR-124调节结直肠癌辐射敏感性的一个功能性靶基因,这预示着为临床提高结直肠癌辐射敏感性提供了一个重要的理论依据和靶点。
| [1] |
Anderson EC, Hessman C, Levin TG, et al. The role of colorectal cancer stem cells in metastatic disease and therapeutic response[J].
Cancers (Basel),2011, 3 (1) : 319-39.
( 0) 0)
|
| [2] |
Pessaux P, Chenard MP, Bachellier P, et al. Consequences of chemotherapy on resection of colorectal liver metastases[J].
J Visc Surg,2010, 147 (4) : e193-201.
DOI: 10.1016/j.jviscsurg.2010.06.004. ( 0) 0)
|
| [3] |
Kim NK, Park JK, Lee KY, et al. p53, BCL-2, and Ki-67 expression according to tumor response after concurrent chemoradiotherapy for advanced rectal cancer[J].
Ann Surg Oncol,2001, 2001 : 418-24.
( 0) 0)
|
| [4] |
Komuro Y, Watanabe T, Tsurita G, et al. Evaluating the combination of molecular prognostic factors in tumor radiosensitivity in rectal cancer[J].
Hepatogastroenterology,2005, 52 (63) : 666-71.
( 0) 0)
|
| [5] |
Feng T, Xu D, Tu C, et al. MiR-124 inhibits cell proliferation in breast cancer through downregulation of CDK4[J].
Tumour Biol,2015, 36 (8) : 5987-97.
DOI: 10.1007/s13277-015-3275-8. ( 0) 0)
|
| [6] |
Lv Z, Yang L. MiR-124 inhibits the growth of glioblastoma through the downregulation of SOS1[J].
Mol Med Rep,2013, 8 (2) : 345-9.
( 0) 0)
|
| [7] |
Peng XH, Huang HR, Lu J, et al. MiR-124 suppresses tumor growth and metastasis by targeting Foxq1 in nasopharyngeal carcinoma[J].
Mol Cancer,2014, 13 : 186.
DOI: 10.1186/1476-4598-13-186. ( 0) 0)
|
| [8] |
Wei J, Wang F, Kong LY, et al. miR-124 inhibits STAT3 signaling to enhance T cell-mediated immune clearance of glioma[J].
Cancer Res,2013, 73 (13) : 3913-26.
DOI: 10.1158/0008-5472.CAN-12-4318. ( 0) 0)
|
| [9] |
Xu X, Li S, Lin Y, et al. MicroRNA-124-3p inhibits cell migration and invasion in bladder cancer cells by targeting ROCK1[J].
J Transl Med,2013, 11 : 276.
DOI: 10.1186/1479-5876-11-276. ( 0) 0)
|
| [10] |
Zhang H, Wang Q, Zhao Q, et al. MiR-124 inhibits the migration and invasion of ovarian cancer cells by targeting SphK1[J].
J Ovarian Res,2013, 6 (1) : 84.
DOI: 10.1186/1757-2215-6-84. ( 0) 0)
|
| [11] |
Zhang J, Lu Y, Yue X, et al. MiR-124 suppresses growth of human colorectal cancer by inhibiting STAT3[J].
PLoS One,2013, 8 (8) : e70300.
DOI: 10.1371/journal.pone.0070300. ( 0) 0)
|
| [12] |
Zafar F, Seidler SB, Kronenberg A, et al. Homologous recombination contributes to the repair of DNA double-strand breaks induced by high-energy Iron ions[J].
Radiat Res,2010, 173 (1) : 27-39.
DOI: 10.1667/RR1910.1. ( 0) 0)
|
| [13] |
Beskow C, Skikuniene J, Holgersson A, et al. Radioresistant cervical cancer shows upregulation of the NHEJ proteins DNAPKcs, Ku70 and Ku86[J].
Br J Cancer,2009, 101 (5) : 816-21.
DOI: 10.1038/sj.bjc.6605201. ( 0) 0)
|
| [14] |
Wang P, Zhang J, Zhang L, et al. MicroRNA 23b regulates autophagy associated with radioresistance of pancreatic cancer cells[J].
Gastroenterology,2013, 145 (5) : 1133-43.
DOI: 10.1053/j.gastro.2013.07.048. ( 0) 0)
|
| [15] |
Shi L, Zhang S, Wu H, et al. MiR-200c increases the radiosensitivity of non-small-cell lung cancer cell line A549 by targeting VEGF-VEGFR2 pathway[J].
PLoS One,2013, 8 (10) : e78344.
DOI: 10.1371/journal.pone.0078344. ( 0) 0)
|
| [16] |
Oh JS, Kim JJ, Byun JY, et al. Lin28-let7 modulates radiosensitivity of human cancer cells with activation of K-Ras[J].
Int J Radiat Oncol Biol Phys,2010, 76 (1) : 5-8.
DOI: 10.1016/j.ijrobp.2009.08.028. ( 0) 0)
|
| [17] |
Liu YJ, Lin YF, Chen YF, et al. MicroRNA-449a enhances radiosensitivity in CL1-0 lung adenocarcinoma cells[J].
PLoS One,2013, 8 (4) : e62383.
DOI: 10.1371/journal.pone.0062383. ( 0) 0)
|
| [18] |
Guo P, Lan J, Ge J, et al. MiR-26a enhances the radiosensitivity of glioblastoma multiforme cells through targeting of ataxiatelangiectasia mutated[J].
Exp Cell Res,2014, 320 (2) : 200-8.
DOI: 10.1016/j.yexcr.2013.10.020. ( 0) 0)
|
| [19] |
Deng X, Ma L, Wu M, et al. miR-124 radiosensitizes human glioma cells by targeting CDK4[J].
J Neurooncol,2013, 114 (3) : 263-74.
DOI: 10.1007/s11060-013-1179-2. ( 0) 0)
|
| [20] |
Zhang Y, Zheng L, Huang J, et al. MiR-124 radiosensitizes human colorectal cancer cells by targeting PRRX1[J].
PLoS One,2014, 9 (4) : e93917.
DOI: 10.1371/journal.pone.0093917. ( 0) 0)
|
| [21] |
Zhang Y, Zheng L, Ding Y, et al. MiR-20a induces cell radioresistance by activating the PTEN/PI3K/Akt signaling pathway in hepatocellular carcinoma[J].
Int J Radiat Oncol Biol Phys,2015, 92 (5) : 1132-40.
DOI: 10.1016/j.ijrobp.2015.04.007. ( 0) 0)
|
| [22] |
Ansieau S. EMT in breast cancer stem cell Generation[J].
Cancer Lett,2013, 338 (1) : 63-8.
DOI: 10.1016/j.canlet.2012.05.014. ( 0) 0)
|
| [23] |
Guo J, Wang B, Fu Z, et al. Hypoxic microenvironment induces EMT and upgrades Stem-Like properties of gastric cancer cells[J].
Technol Cancer Res Treat,2016, 15 (1) : 60-8.
( 0) 0)
|
| [24] |
Marie-Egyptienne DT, Lohse I, Hill RP. Cancer stem cells, the epithelial to mesenchymal transition (EMT) and radioresistance: potential role of hypoxia[J].
Cancer Lett,2013, 341 (1) : 63-72.
DOI: 10.1016/j.canlet.2012.11.019. ( 0) 0)
|
| [25] |
Theys J, Jutten B, Habets R, et al. E-Cadherin loss associated with EMT promotes radioresistance in human tumor cells[J].
Radiother Oncol,2011, 99 (3) : 392-7.
DOI: 10.1016/j.radonc.2011.05.044. ( 0) 0)
|
| [26] |
Mani SA, Guo WJ, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stem cells[J].
Cell,2008, 133 (4) : 704-15.
DOI: 10.1016/j.cell.2008.03.027. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
