2. 南方医科大学 ;
3. 南方医科大学病理学系//广东省分子肿瘤病理学重点实验室,广东 广州 510515
2. Southern Medical University ;
3. Department of Pathology, College of Basic Medical Sciences, Key Laboratory of Molecular Tumor Pathology of Guangdong Province, Southern Medical University, Guangzhou 510515, China
子宫内膜癌在女性生殖系统肿瘤中占20%~30%,是发达国家女性的第4大常见恶性肿瘤,在发展中国家,子宫内膜癌发病率也居于女性肿瘤的第7位[1]。近年来,子宫内膜癌的发病率越来越高,并有明显的年轻化趋势。虽然早期子宫内膜癌经过规范治疗后,5年的生存率逐年升高,但晚期、低分化子宫内膜癌细胞预后极差,是导致子宫内膜癌患者死亡的重要因素。因此,子宫内膜癌的发病机理与有效治疗靶点成为改善子宫内膜癌预后的首要课题。
microRNA通过碱基互补配对的方式与靶基因的3'UTR区域结合,降解靶基因mRNA或阻遏靶基因mRNA的翻译,在转录后水平上负性调控靶基因的表达,从而影响肿瘤的增殖、凋亡、侵袭和转移[2]。近年来研究表明microRNA与子宫内膜癌的发生发展有密切的关系,参与调控子宫内膜癌的进程的分子机制和雌孕激素的表达[3]。miR-135b基因位于第l号染色体长臂第3区2号带的第1号亚带(1q32.1),其在骨肉瘤[4]、结肠癌[5]、前列腺癌[6]等多种肿瘤中表达上升。然而miR-135b在子宫内膜癌中的作用尚未报道。
FOXO1是一个转录因子,作为一种肿瘤抑制因子,在前列腺癌[7]、乳腺癌[8]、肝癌[9]、结肠癌[10]等肿瘤中表达下调,参与各种肿瘤的形成过程[11]。FOXO1通过调控下游的靶基因抑制细胞生长、调控细胞周期、促进凋亡、抗过氧化损伤等多重作用[12]。有研究证实FOXO1与子宫内膜癌的有密切的联系[13],但具有的机制尚未有研究。本研究通过探讨miR-135b和FOXO1在子宫内膜癌组织及4株细胞中表达情况,以及分子实验并进一步证实miR-135b通过靶向调控FOXO1基因促进子宫内膜癌细胞的增殖。
1 材料和方法 1.1 材料 1.1.1 临床标本、细胞系和细胞培养22例新鲜子宫内膜癌组织及配对的癌旁组织来处南方医院2014年9月~2015年9月子宫内膜癌手术切除标本,并经病理诊断证实,取材后立即置于液氮中保存。人子宫内膜癌JEC和Ishikawa细胞株由中山三院赠送,HEC-1-B和RL-952细胞株由广医三院赠送。细胞复苏后,用含10%胎牛血清的DMEM高糖培养基培养,置37℃、5%CO2、饱和湿度的恒温孵箱中培养。
1.1.2 试剂与仪器FOXO1抗体和BCA蛋白定量试剂盒购自BIOWORLD公司;FBS及DMEM培养基购自GIBCO公司;RNA分离试剂Trizol、miRNA逆转录及荧光定量PCR试剂盒(SYBR®PrimeScriptTMmiRNART-PCRKit)购自中国宝生物(tAKARA)公司;LipofectamineTM3000购自美国Invitrogen公司;micrONTMhsa-miR-135b-5pmimic、micrOFFTMhsa-miR-135b-5pinhibitor、micrONTMmimicNegativeControl、micrOFFTMinhibitorNegativeControl购自RiboBio公司;NanoDrop®ND-1000微量核酸定量仪均购自Thermo公司;9700型PCR仪购自ABI公司;罗氏lightCycler480Ⅱ荧光定量PCR仪器为瑞士罗氏公司产品。
1.1.3 RT-PCR检测基因miRNA-135b、FOXO1的引物序列通过PCR引物设计软件PrimerPremier5.0设计has-mir-135b、FOXO1的引物序列,并由Invitrogen公司合成。has-mir-135b-5p:5'-CCTGGCTTTTCATTCCTATGTGA-3';U6:5'-GCTTCGGCAGCACATATACTAAA-3';FOXO1:5'-GGCTTGGGAGAGGTATAATTACCCAGA-3',5'-TCAAGTCATGTGGAAAGCCCAA-3';GAPDH:5'-AGAAGGCTGGGGCTCATTTG-3',5'-AGGGGCCATCCACAGTCTTC-3'。
引物干粉离心后用DEPC水配制成20μmol/L,置于-20℃冰箱备用。
1.2 方法 1.2.1 RT-PCR检测miR-135b、FOXO1在子宫内膜癌组织与子宫内膜癌细胞内表达从子宫内膜癌组织和细胞中抽提总RNA,按宝生物公司逆转录及荧光定量PCR试剂盒说明书,经逆转录形成cDNA,根据SYBRGreen法进行荧光定量PCR,以2-ΔΔCt表示基因的相对表达水平。
1.2.2 RT-PCR检测瞬时转染miRNA135b的转染效率采用阳离子脂质体法,按照LipofectamineTM3000试剂说明书进行瞬时转染。转染前1d将处于对数生长期的子宫内膜癌细胞株RL-952和Ishikawa消化、离心、计数,约为2×105/孔接种至6孔板中并继续培养,当细胞融合度为30~50%时进行实验。弃上清,加入1.7mL含10%胎牛血清的DMEM高糖培养基;将购自于RiboBio公司的100nmol/LsiRNA加入到无血清培养基中配制混合液①150μL,吹打混匀;将5μLLipofectamineTM3000脂质体加入到另一无血清培养基中配制混合液②150μL,吹打混匀,室温孵育5min;将混合液②分别加入混合液①中,室温孵育20min,以形成转染复合物,并最终加入到1.7mL含10%胎牛血清的DMEM高糖培养基中,轻摇混匀。其中,mimicNC和inhibitorNC作为内参。48h后抽提细胞总RNA,逆转录成cDNA,qRT-PCR检测瞬时转染后miR-135b的表达变化。
1.2.3 噻唑蓝(MTT)比色实验检测细胞增殖能力将子宫内膜癌细胞以5×103/孔接种于96孔板中,12h细胞贴壁后转染细胞,分为mimic、mimicNC、inhibitor、inhibitorNC和空白组,6孔/组,分别于转染后0、24、48、72、96h检测1次。检测前每孔中加入5mg/mL的MTT溶液20μL,细胞培养箱中继续培养4h,弃上清,加入DMSO溶液150μL,摇床上室温轻摇10min充分溶解结晶物,以空白孔调零,酶标仪上测定490nm波长处的吸光度值,用来表示细胞增殖能力。各组取6孔平均值,绘制生长曲线。
1.2.4 RT-PCR检测瞬时转染miRNA135b后FOXO1的mRNA的变化子宫内膜癌细胞株RL-952和Ishikawa转染48h后提取细胞总RNA,按宝生物公司逆转录及荧光定量PCR试剂盒操作,采用△△CT法对荧光定量PCR结果进行定量分析,根据各样本的Ct值,以2-ΔΔCt表示基因的相对表达水平。
1.2.5 Westernblotting检测在FOXO1子宫内膜癌细胞内变化RL-952细胞株转染48h后,提取全蛋白,根据BCA蛋白定量试剂盒进行定量,测定A562。计算各浓度蛋白标准的平均吸光度,绘制标准曲线,计算回归方程。提取的总蛋白,加入2×SDS蛋白上样缓冲液(按1∶1比例),100℃煮沸5min,-20℃保存备用。Westernblotting检测各组FOXO1蛋白的表达。
1.2.6 统计学处理采用SPSS19.0软件对数据进行统计学分析。数值大小以均数±标准误来表示。22例子宫内膜癌组织及相应的癌旁组织中表达的比较采用两配对样本t检验,其余实验组间比较采用ANOVA单因素方差分析,MTT生长曲线比较采用析因设计的方差分析。所有数据均为3次独立重复实验的结果,P < 0.05为差异具有统计学意义。
2 结果 2.1 RT-PCR检测miR-135b和FOXO1在子宫内膜癌组织内表达应用RT-PCR检测22对配对的子宫内膜癌组织中miR-135b的表达,以1NC为参考值,2-ΔΔCt通过配对样本t检验分析,结果示子宫内膜癌组织中miR-135b的平均表达量为8.3559±10.6692,显著大于子宫内膜癌癌旁组织中miR-135b的平均表达量为4.1930±5.1132,具有统计学意义(t=2.247,P=0.036,图 1A)。应用RT-PCR检测22对配对的子宫内膜癌组织中FOXO1的表达,以1NC为参考值,2-ΔΔCt通过配对样本t检验分析,结果示子宫内膜癌组织中FOXO1的平均表达量为1.6654±1.6861,显著大于子宫内膜癌癌旁组织中FOXO1的平均表达量为3.2708±3.4159,具有统计学意义(t=-2.559,P=0.018,图 1B)。
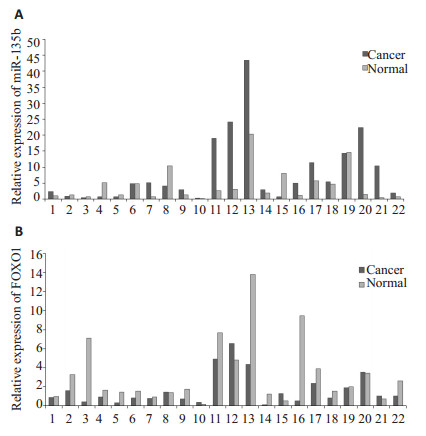
|
图 1 RT-PCR检测配对子宫内膜癌组织中的miR-135b(A)和FOXO1(B)的表达 Figure 1 Expression of miR-135b (A) and FOXO1 (B) inendometrial carcinoma tissues detected by RT-PCR. |
以JEC细胞为参照(图 1),miR-135b在不同细胞中的表达量分别为Ishikawa(111.5150±11.7878)、HEC-1-B(20.8096±5.7010)、RL-952(1.6737±0.3428),4株细胞之间miR-135b的表达水平有差异,差异有统计学意义(F=129.3,P < 0.0001,图 2A)。FOXO1在不同细胞中的表达量分别为Ishikawa(0.0640±0.0150)、HEC-1-B(0.2994±0.0592)、RL-952(0.4548±0.1053),4株细胞之间FOXO1的表达水平有差异,差异有统计学意义(F=85.36,P < 0.0001,图 2B)。
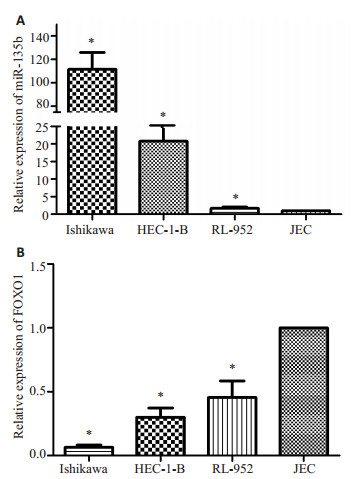
|
图 2 荧光定量PCR检测4种子宫内膜癌细胞中miR-135b(A)和FOXO1(B)的表达水平 Figure 2 Expression of miR-135b (A) and FOXO1 (B) in 4 endometrial carcinoma cell lines detected by real-time PCR. *P < 0.0001. |
采用脂质体法将miR-135bmimic和inhibitor及其对照mimicNC和inhibitorNC转染子宫内膜癌细胞株RL-952和Ishikawa。转染48h后,提取RNA,逆转录后qRT-PCR检测miR-135b的表达。结果显示,miR-135bmimic使RL-952、Ishikawa中miR-135b的表达分别提高了526.39倍(t=-20.189,p=0.002)和32.98倍(t=52.609,p=0.000);而转染miR-135binhibitor后,miR-135b的表达分别降低25.28%(t=-23.539,p=0.002)和95%(t=5.966,p=0.027,图 3)。
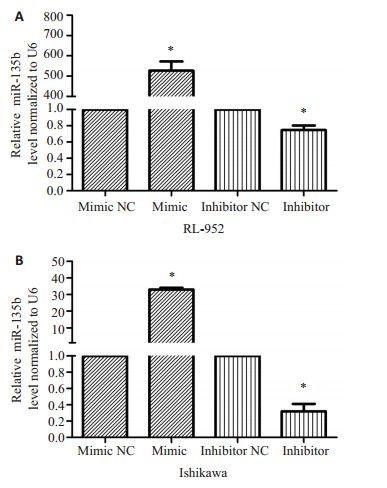
|
图 3 瞬时转染miR-135bmimic和inhibitor后细胞株RL-952(A)和Ishikawa(B)miR-135b的表达水平 Figure 3 Expression level of miR-135b in endometrial carcinoma cell lines RL-952 (A) and Ishikawa (B)transfected with miR-135b mimic, inhibitor, or a control construct for 48 h. *P < 0.05. |
采用MTT法检测细胞生长曲线,结果显示,转染miR-135bmimic后,RL-952和Ishikawa细胞生长加快(P=0.0000,0.0000);而转染miR-135binhibitor后,两种细胞生长速度减慢(P=0.0000,图 4)。
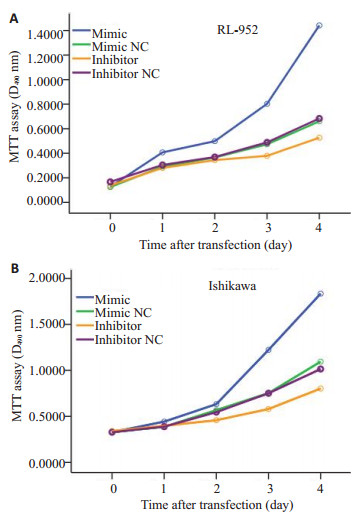
|
图 4 miRNAs瞬时转染RL-952(A)和Ishikawa(B)后的细胞生长曲线 Figure 4 Growth curves of RL-952(A) and Ishikawa(B) cells after miRNAs transfection. |
通过qRT-PCR检测miR-135b过表达或抑制后的子宫内膜癌细胞株RL-952和Ishikawa中FOXO1mRNA的表达,我们发现,miR-135b过表达后可显著增加子宫内膜癌细胞株中FOXO1mRNA的表达,而抑制miR-135b后FOXO1mRNA的表达降低(图 5)。即miR-135b对FOXO1的表达具有负向调控作用。
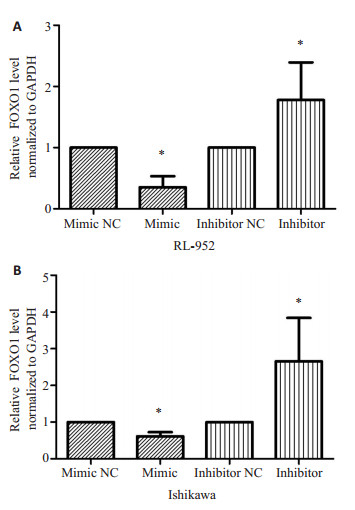
|
图 5 瞬时转染miRNAs后子宫内膜癌细胞RL-952(A)和Ishikawa(B)中FOXO1基因的表达水平 Figure 5 qRT-PCR analysis of FOXO1 expression in endometrial carcinoma cell lines RL-952 (A) and Ishikawa (B) after miRNAs transfection, *P < 0.05. |
对RL-952细胞株各组细胞提取全蛋白,具体步骤同前。Western blotting检测不同转染细胞后对FOXO1蛋白表达的影响。我们发现,miR-135b过表达后可显著增加子宫内膜癌细胞株中FOXO1蛋白的表达,而抑制miR-135b后FOXO1蛋白的表达降低(图 6)。即miR-135b对FOXO1的表达具有负向调控作用。
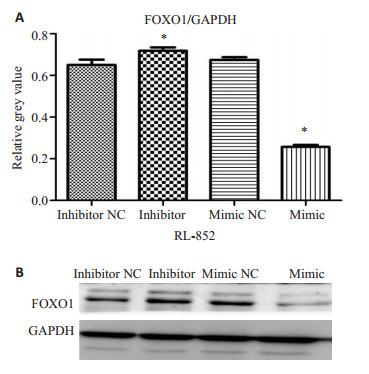
|
图 6 瞬时转染miRNAs后子宫内膜癌细胞RL-952(A)和Ishikawa(B)中FOXO1蛋白的表达水平 Figure 6 Western blot analysis of FOXO1 expression in endometrial carcinoma cell lines RL-952 (A) and Ishikawa (B) after miRNAs transfection *P < 0.05. |
miRNAs通过在转录后水平调节基因的表达而在生物的组织器官发育、脂肪代谢、细胞分化、增殖和凋亡等过程中发挥重要作用。miR-135b在非小细胞肺癌中,miR-135b通过激活Hippo信号通路,和调控靶基因LZTS1促进肺癌转移[14]。Arigoni等[15]发现miR-135b表达上调,并通过靶向雌激素受体、雄激素受体和缺氧诱导因子1α(hypoxia-inducible factor 1α, HIF-1α)促进乳腺癌和前列腺癌细胞的增殖。miR-135b在人头颈鳞癌细胞中,促进肿瘤细胞的增殖、转移、克隆,以及通过下调FIH的表达、HIF通路的活性,成为致瘤miRNA[16]。Valeri等[17]的研究显示,miR-135b的过度表达触发了老鼠和人体APC的缺失,PTEN/PI3K通路的反常,SRC的过度表达及促进肿瘤的转化和进展,miR-135b的上调在与人类结直肠癌相关的炎症中是普遍事件,并且与肿瘤分期及欠佳的临床结果有密切关系。粪便中的miR-135b,可作为结直肠癌及高级别腺瘤的非侵袭性的生物学标记物[18]。但是miR-135b在子宫内膜癌中表达尚未报道。
为了探讨miR-135b在子宫内膜癌细胞中的生物学功能,我们首先采用荧光定量PCR实验对22对配对的子宫内膜癌组织及癌旁组织进行定量分析,发现miR-135b在子宫内膜癌组织中的表达显著高于癌旁组织,具有统计学意义,表明miR-135b可能在子宫内膜癌的发生发展中起一定作用。
通过瞬时转染的方法将miR-135b模拟物和抑制物及其对应的阴性对照导入子宫内膜癌细胞中,荧光定量PCR证明了模拟物和抑制物的转染效率,为探讨子宫内膜癌的生物学功能和分子机制奠定了基础。通过MTT实验我们发现下调miR-135b的表达可以抑制子宫内膜癌细胞的增殖,上调miR-135b的表达可以促进子宫内膜癌细胞的增殖。这些结果显示,miR-135b可能发挥类似癌基因的作用参与了对子宫内膜癌的增殖作用的调控。
另外我们通过mirBase、TargetScan和PicTar等生物信息网站预测FOXO1是miR-135b可能的靶基因,Jung等[19]通过双荧光素酶报告基因证实miR-135b直接与FOXO1的3'UTR种子区结合而抑制其翻译。有研究证实FOXO1与子宫内膜癌的有密切的联系,但具有的机制尚未有研究。本实验同时运用荧光定量PCR实验检测上述22对配对的子宫内膜癌组织中FOXO1的表达,发现FOXO1在子宫内膜癌组织中表达显著低于癌旁组织,在子宫内膜癌中可能起到抑癌的作用。
通过qRT-PCR和Westernblotting证实了上调miR-135b可以促进FOXO1的表达,下调miR-135b的表达可以抑制FOXO1的表达。证明miR-135b对子宫内膜癌的增殖作用是通过靶向FOXO1来调控的,相应的,FOXO1在子宫内膜癌的作用受miR-135b调控。这为我们进一步研究miR-135b在子宫内膜的调控作用的分子机制提供了方向。
由于没有正常的子宫内膜细胞做对照,检测4株子宫内膜癌细胞株的表达,并不能说明miR-135b在子宫内膜癌细胞株中高表达和FOXO1的低表达。但结合几种细胞株的miR-135b的表达情况,我们可以看出在ER(-)PR(-)的JEC细胞中,miR-135b的表达明显低于其他细胞株,FOXO1的表达明显高于其他细胞株,而ER(+)PR(+)的Ishikawa则完全相反,表明miR-135b的作用可能与雌孕激素受体相关。细胞实验研究采用ER(+)PR(+)的Ishikawa细胞株与ER(+)的RL-952细胞株的实验结果只适用于ER(+)的子宫内膜癌。
总之,本研究表明miR-135b在子宫内膜癌组织中高表达, 发挥着癌基因的作用,促进子宫内膜癌的增殖作用。相反,FOXO1在子宫内膜癌组织中低表达, 发挥着抑癌基因的作用。因此, 我们认为miR-135b在子宫内膜癌的发生发展中发挥重要的作用,可作为子宫内膜癌基因治疗的靶点,其部分分子机制可能是通过调控靶基因FOXO1而发挥作用,也可能与雌孕激素受体相关,但详细作用机制仍需要进一步研究。
| [1] |
Jemal A, Bray F, Center MM, et al. Global cancer statistics[J].
CA Cancer J Clin,2011, 61 (2) : 69-90.
DOI: 10.3322/caac.v61:2. ( 0) 0)
|
| [2] |
Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J].
Cell,2004, 116 (2) : 281-97.
DOI: 10.1016/S0092-8674(04)00045-5. ( 0) 0)
|
| [3] |
王建军, 刘麒薇, 杨敏. 微小RNA与子宫内膜癌相关性的研究进展[J].
国际妇产科学杂志,2014 (04) : 401-4.
( 0) 0)
|
| [4] |
Lulla RR, Costa FF, Bischof JM, et al. Identification of differentially expressed MicroRNAs in osteosarcoma[J].
Sarcoma,2011 : 732690.
( 0) 0)
|
| [5] |
Sarver AL, French AJ, Borralho PM, et al. Human colon cancer profiles show differential microRNA expression depending on mismatch repair status and are characteristic of undifferentiated proliferative states[J].
BMC Cancer,2009, 9 : 401.
DOI: 10.1186/1471-2407-9-401. ( 0) 0)
|
| [6] |
Tong AW, Fulgham P, Jay C, et al. MicroRNA profile analysis of human prostate cancers[J].
Cancer Gene Ther,2009, 16 (3) : 206-16.
( 0) 0)
|
| [7] |
Modur V, Nagarajan R, Evers BM, et al. FOXO proteins regulate tumor necrosis factor-related apoptosis inducing ligand expression-Implications for PTEN mutation in prostate cancer[J].
J Biol Chem,2002, 277 (49) : 47928-37.
DOI: 10.1074/jbc.M207509200. ( 0) 0)
|
| [8] |
Mazumdar A, Kumar R. Estrogen regulation of Pak1 and FKHR pathways in breast cancer cells[J].
FEBS Lett,2003, 535 (1/3) : 6-10.
( 0) 0)
|
| [9] |
Yamaguchi F, Hirata Y, Akram H, et al. FOXO/TXNIP pathway is involved in the suppression of hepatocellular carcinoma growth by glutamate antagonist MK-801[J].
BMC Cancer,2013, 13 : 468.
DOI: 10.1186/1471-2407-13-468. ( 0) 0)
|
| [10] |
Agostini M, Bedin C, Pucciarelli S, et al. APC I1307K mutations and forkhead box gene (FOXO1A): another piece of an interesting correlation[J].
Int J Biol Markers,2012, 27 (1) : 13-9.
DOI: 10.5301/JBM.2011.8908. ( 0) 0)
|
| [11] |
Katoh M, Igarashi M, Fukuda H, et al. Cancer genetics and genomics of human Fox family genes[J].
Cancer Lett,2013, 328 (2) : 198-206.
DOI: 10.1016/j.canlet.2012.09.017. ( 0) 0)
|
| [12] |
Coffer PJ, Burgering BM. Forkhead-box transcription factors and their role in the immune system[J].
Nat Rev Immunol,2004, 4 (11) : 889-99.
DOI: 10.1038/nri1488. ( 0) 0)
|
| [13] |
刘微微. FOXO1在各型增生子宫内膜和子宫内膜腺癌中的表达[D].武汉:华中科技大学, 2013.
http://cdmd.cnki.com.cn/article/cdmd-10487-1014028931.htm
( 0) 0)
|
| [14] |
Lin CW, Chang YL, Chang YC, et al. MicroRNA-135b promotes lung cancer metastasis by regulating multiple targets in the Hippo pathway and LZTS1[J].
Nat Commun,2013, 4 : 1877.
DOI: 10.1038/ncomms2876. ( 0) 0)
|
| [15] |
Aakula A, Leivonen SK, Hintsanen PA, et al. MicroRNA-135b regulates ER alpha, AR and HIF1AN and affects breast and prostate cancer cell growth[J].
Mol Oncol,2015, 9 (7) : 1287-300.
DOI: 10.1016/j.molonc.2015.03.001. ( 0) 0)
|
| [16] |
Zhang L, Sun ZJ, Bian YS, et al. MicroRNA-135b acts as a tumor promoter by targeting the hypoxia-inducible factor pathway in genetically defined mouse model of head and neck squamous cell carcinoma[J].
Cancer Lett,2013, 331 (2) : 230-8.
DOI: 10.1016/j.canlet.2013.01.003. ( 0) 0)
|
| [17] |
Valeri N, Braconi C, Gasparini P, et al. MicroRNA-135b promotes cancer progression by acting as a downstream effector of oncogenic pathways in colon cancer[J].
Cancer Cell,2014, 25 (4) : 469-83.
DOI: 10.1016/j.ccr.2014.03.006. ( 0) 0)
|
| [18] |
Wu CW, Ng SC, Dong YJ, et al. Identification of microRNA-135b in stool as a potential noninvasive biomarker for colorectal cancer and adenoma[J].
Clin Cancer Res,2014, 20 (11) : 2994-3002.
DOI: 10.1158/1078-0432.CCR-13-1750. ( 0) 0)
|
| [19] |
Jung HS, Seo YR, Yang YM, et al. G alpha(12) gep oncogene inhibits FOXO1 in hepatocellular carcinoma as a consequence of miR-135b and miR-194 dysregulation[J].
Cell Signal,2014, 26 (7) : 1456-65.
DOI: 10.1016/j.cellsig.2014.02.022. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
