2. 南方医科大学南方医院心内科,广东 广州 510515
2. Department of Cardiology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
既往关于白介素-6(IL-6)、白介素-18(IL-18)等促炎因子参与冠心病炎症反应的研究甚多,最近研究发现IL-10、IL-33等抗炎因子在冠心病炎症中亦扮演重要角色[1-3],冠心病促炎与抗炎平衡的研究逐渐成为热点[4]。白介素-37(IL- 37)是最新发现的能调节炎症因子表达的白介素1家族成员,主要由单核细胞、淋巴细胞及树突状细胞分泌。大量细胞实验证实,IL-37能调节不同功能炎症因子的表达[5],在肝炎、肠炎、休克等动物模型中证实其具有广泛的抗炎作用[6-7];并发现其与多种人类疾病有关,其可能是一种抗炎因子或多功能的炎症因子。但其在冠心病中的研究极少,目前尚无IL-37 在ASTEMI患者外周血循环中表达及其与CRP关系的报道,然而ASTEMI过程是炎症的级联放大过程,探明IL-37 在该类患者外周血循环中的时间变化有重要意义,本文测定了急性ST 段抬高型心肌梗死患者血清IL-37的浓度,观察了心梗不同时间IL-37表达的变化,分析了IL-37与CRP的关系。对IL-37及其与冠心病的关系的研究具有重要意义。
1 对象和方法 1.1 对象本研究连续入选2012年6月~2013年12月因胸痛入院的患者,经询问病史、体格检查、心肌肌钙蛋白l(cTnl)检测、12导或18导心电图、心脏彩超以及冠脉造影检查,选择符合纳入标准且不符合排除标准的ASTEMI患者作为研究对象,另选同期因胸痛入院,心电图、心肌酶、冠脉造影检查均正常,性别、年龄等相匹配的患者做为对照组。ASTEMI患者的诊断根据WHO标准,并同时满足:a、入院时胸痛不超过1 d,b、为ST段抬高型心肌梗死,c、心梗后24 h之内(第1天)成功行冠脉内支架成形术。排除标准(具有以下任一情况者):a、急慢性感染性疾病,自身免疫性疾病;b、严重血压、血糖紊乱;c、重度心功能不全;d、合并心肌病、瓣膜病;e、肝肾功能异常、消化道疾病者;f、甲状腺功能异常及肿瘤患者;g、既往有心梗病史及PCI病史者。患者住院过程中均服用拜阿司匹林、氢氯吡格雷、阿托伐他汀、质子泵抑制剂及皮下注射低分子肝素治疗。根据患者具体情况,选择性使用β受体阻断剂,血管紧张素转化酶抑制剂(ACEI)和(或)血管紧张素受体拮抗剂(ARB)及硝酸酯类等药物治疗,伴有糖尿病、高血压的患者以相应药物治疗达标。
1.2 主要试剂IL-37 ELISA 试剂盒及CRP ELISA 试剂盒,均属国产Biocalvin 公司原装,编号分别为EIA-1596,EIA-1108。
1.3 方法 1.3.1 标本采集、处理及保存以及临床资料的收集用促凝生化管按胸痛后1、3、5、7 d收集心梗组患者清晨、空腹肘静脉血约3 mL/人,对照组只收集胸痛后1 d的血标本。收集的标本于4~8 h之内在室温下以3000 r/min离心处理15 min,吸取上层淡黄色血清分装至200 μL规格的灭菌EP管中,每管约150 μL,编号标记后直接放入-80 ℃冰箱低温保存待测。同时收集标本对应患者的相关临床资料。
1.3.2 标本测量用酶联免疫吸附法(ELISA法)检测血清标本中IL-37 和CRP的浓度。因为样本量较多,每个样本均只测定1 次,CRP 和IL-37 的测定次数是一致的。往预先包抗体(IL-37抗体或CRP抗体)的微孔中,依次加入血清样品、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在HRP的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的被检测物(IL-37或CRP)呈正相关。用酶标仪在450 nm 波长下测定吸光度(A值),计算血清样品的浓度。
1.4 统计学处理所得数据使用SPSS 13.0统计分析软件进行整理分析,临床数据计量资料用均数±标准误来表示,计数资料以率(%)为单位表示。计量资料组间的比较首先经方差齐性检验,方差齐的两组间比较用Unpaired t test,组间多重比较用Bonferroni's Multiple ComparisonTest;方差不齐时两组间比较用Mann Whitney test,多重比较采用Dunn's T3 Multiple Comparison Test。以P<0.05 作为有统计学意义的显著性差异。IL-37 与CRP之间的相关性采用Spearman相关分析。
2 结果 2.1 患者一般资料表 1示入选研究对象的一般临床资料。对照组和心梗组在性别(Man)、年龄(Age)、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)、脉搏(Pulse)、吸烟(Smoke)、既往病史(高血压Hypertension、糖尿病Diabetes、高脂血症Hyperlipidemia)及服药史(硝酸酯类Nitrates、美托洛尔metoprolol、血管紧张素转换酶抑制剂&血管紧张素受体拮抗剂ACEI&ARB、他汀类Statins、抗凝及血小板药物Anticoagulant antiplateletdrugs)均无明显差异(P>0.05)。
| 表 1 一般资料比较 Table 1 Comparison of the demographic and clinical data between the two groups (Mean±SE) |
表 2示对照组和心梗组的生化指标(心梗组生化指标为入院后1 d内抽血所查)。脑钠肽(BNP)、心肌肌钙蛋白l(cTnl)、肌酸激酶同工酶(CK-MB)均高于对照组(P<0.05),而肌酐(Cr)、尿酸(UA)、糖化血红蛋白(HbAlc)、总胆固醇(TCHOL)、低密度脂蛋白(LDL)、左室射血分数(EF)及左室短轴缩短率(FS)组间没有显著差异(P>0.05)。
| 表 2 生化指标比较 Table 2 Comparison of the biochemical indices between the two groups (Mean±SE) |
IL-37的浓度:对照组为8.08±0.51 pg/mL;心梗组为17.47±0.85 pg/mL;CRP 的浓度:对照组为2.39±0.26 μg/mL;心梗组为38.36 ± 4.68 μg/mL。心梗组IL-37和CRP浓度均显著高于对照组(P<0.05)。
2.4 心梗不同时间点IL-37和CRP的表达水平心梗组患者在第1天IL-37与CRP的浓度分别为12.28±0.75 pg/mL和9.66±3.21 μg/mL,均明显高于对照组的IL-37与CRP(8.08±0.51 pg/mL和2.39±0.26 μg/mL)(P<0.05);第3 天IL-37 与CRP均达高峰,它们分别为25.62±1.88 pg/mL 和81.74±10.59 ug/mL;与第3 天比较,第5 天和第7 天的IL-37 与CRP均显著降低(19.2±1.32 pg/mL 和46.45±7.73 μg/mL,14.75±0.94 pg/mL和15.59±2.89 μg/mL)(P<0.05)。表明心梗组患者在第1天IL-37与CRP的浓度均急速升高,第3天达到高峰,第5天出现降低,第7天显著降低。
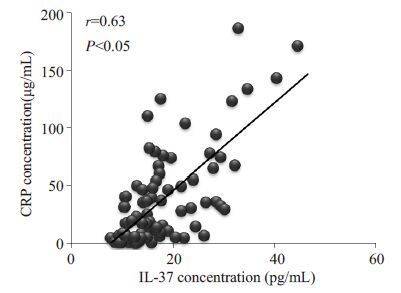
2.5 心梗组中IL-37与CRP的相关性图 1示心梗组患者血清中IL-37与CRP的相关性。Spearman相关分析显示:心梗组患者血清IL-37与CRP呈正相关(r=0. 63,P<0.05)。
|
图 1 心梗组中IL-37与CRP的相关性 Figure 1 Correlation between serum IL-37 and CRP levels in myocardial infarction group. |
炎症在冠状动脉粥样硬化的形成,冠脉血管狭窄后心肌细胞缺血、缺氧坏死损伤中起着关键作用[4]。在临床上冠心病表现最危急的是ASTEMI,患者的炎症反应主要是心肌细胞缺血坏死和动脉粥样斑块不稳定,而且呈现级联放大的过程。既往关于IL-6、IL-18等促炎因子调节急性心肌梗死患者炎症反应以及时间变化的研究甚多,例如:早在1992年,Ikeda等[8]发现IL-6参与心梗炎症的进展或梗死心肌的愈合。血清中IL-6浓度升高几乎与炎症和心肌组织损伤成正比,有研究者报道IL-6在AMI患者血清中的表达呈现出先升高后降低的趋势,其高峰值出现在胸痛发生后第3天[9]。本研究测量并比较心梗组不同时间点与对照组血清IL-37 和CRP的表达水平,结果发现:同对照组相比,心梗组患者血清IL-37的表达升高;IL-37在心梗第1天急速升高,第3天达到高峰,第5天出现降低,第7天显著降低,呈现先升高后降低的动态变化。
进一步的研究显示:IL- 37在心梗组患者外周血循环中的时间变化与CRP的动态变化一致;且Spearman相关分析显示患者血清IL-37与CRP具有正相关性(r=0.63,P<0.05)。CRP的升高与冠状动脉炎症反应程度和心肌组织损伤程度有关,临床上可以用CRP来粗略评估患者的炎症反应程度,以及冠心病患者冠脉狭窄程度、斑块不稳定性及心肌组织损伤程度。因此,本研究结果提示IL-37可能参与ASTEMI过程中的炎症反应。
IL-37是IL-1家族的最新成员,最早于2000年被发现,2010年更名为IL-37。它主要存在于人单核细胞、淋巴细胞、树突状细胞。内源性的IL-37 与IL-1R8、IL-18Rα形成内源性配体-受体复合物,抑制信号转导蛋白、转录激活物、转录因子以及促丝裂原活化蛋白激酶等的磷酸化,从而影响了基因的转录[10-13],由此推论,IL-37可能是一个具有强大抗炎作用的炎症因子。大量的实验表明IL-37与炎症性疾病相关,可能在自身免疫性疾病、慢性炎症相关疾病以及心肌梗死疾病中发挥抗炎作用[14]。IL-37详细的抗炎机制以及其在炎症性疾病中的具体作用还不清楚。我们探讨ASTEMI患者心梗不同时间血清IL-37的水平及其与CRP的关系,揭示其在心梗急性期浓度水平变化,对分析IL-37与ASTEMI的关系具有重要意义。
本研究中对照组选自同期因胸痛入院并高度怀疑心肌梗死的患者,这些对照组患者均服用了他汀与抗凝/抗血小板药物。一旦确诊急性心梗,所有患者均应服用强化他汀治疗,而很多冠脉造影正常者在明确冠脉病变后不应继续服用他汀,这就导致两组受试者之间他汀强度有显著差别。由于他汀治疗可以显著影响白介素与CRP等炎症因子水平及其变化曲线,故本研究所得的结论难以排除他汀治疗的影响。本研究未做特殊的干预,病例数有限,且临床难以避免混杂多方面的因素,因此,IL-37在ASTEMI中的确切作用及功能,仍需要进一步的研究。
综上所述,IL-37在急性ST段抬高型心肌梗死患者血清中的表达升高,在心梗7 d内呈现先升高后降低的动态变化,并与CRP的表达变化一致且呈正相关。结合IL-37与炎症性疾病相关,可能具有强大的抗炎作用,由此我们推论:IL-37是ASTEMI相关的炎症因子,可能参与该过程中的炎症反应。
| [1] | Hingorani, AD and JP Casas, The interleukin-6 receptor as a targetfor prevention of coronary heart disease: a mendelianrandomisation analysis[J]. Lancet, 2012, 379(9822): 1214-24. |
| [2] | Heeschen C, Dimmeler S, Hamm CW, et al. Serum level of theantiinflammatory cytokine interleukin-10 is an importantprognostic determinant in patients with acute coronary syndromes[J]. Circulation,2003, 107 (16) : 2109-14. DOI: 10.1161/01.CIR.0000065232.57371.25. |
| [3] | Demyanets S, Speidl WS, Tentzeris I, et al. Soluble ST2 andinterleukin-33 levels in coronary artery disease: relation to diseaseactivity and adverse outcome[J]. PLoS One,2014, 9 (4) : 95055. DOI: 10.1371/journal.pone.0095055. |
| [4] | Ridker PM, Lüscher TF, Anti-inflammatory therapies forcardiovascular disease[J]. Eur Heart J, 2014, 35(27): 1782-91. |
| [5] | Nold MF, Nold-Petry CA, Zepp JA, et al. IL-37 is a fundamentalinhibitor of innate immunity[J]. Nat Immunol,2010, 11 (11) : 1014-22. DOI: 10.1038/ni.1944. |
| [6] | McNamee EN, Masterson JC, Jedlicka P, et al. Interleukin 37expression protects mice from colitis[J]. Proc Natl Acad Sci USA,2011, 108 (40) : 16711-6. DOI: 10.1073/pnas.1111982108. |
| [7] | Bulau AM, Fink M, Maucksch C, et al. In vivo expression ofinterleukin-37 reduces local and systemic inflammation inconcanavalin A-induced hepatitis[J]. ScientificWorldJournal,2011, 11 : 2480-90. DOI: 10.1100/2011/968479. |
| [8] | Ikeda U, Ohkawa F, Seino Y, et al. Serum interleukin 6 levelsbecome elevated in acute myocardial infarction[J]. J Mol CellCardiol,1992, 24 (6) : 579-84. DOI: 10.1016/0022-2828(92)91042-4. |
| [9] | Kotajima N, Kimura T, Kanda T, et al. Reciprocal increase ofcirculating interleukin-10 and interleukin-6 in patients with acutemyocardial infarction[J]. Heart,2001, 86 (6) : 704-5. DOI: 10.1136/heart.86.6.704. |
| [10] | Kumar S, Hanning CR, Brigham-Burke MR, et al. Interleukin-1F7B (IL-1H4/IL-1F7) is processed by caspase-1 and matureIL-1F7B binds to the IL-18 receptor but does not induceIFN-gamma production[J]. Cytokine,2002, 18 (2) : 61-71. DOI: 10.1006/cyto.2002.0873. |
| [11] | Sharma S, Kulk N, Nold MF, et al. The IL-1 family member 7btranslocates to the nucleus and down-regulates proinflammatorycytokines[J]. J Immunol,2008, 180 (8) : 5477-82. DOI: 10.4049/jimmunol.180.8.5477. |
| [12] | Akdis M, Burgler S, Crameri R, et al. Interleukins, from 1 to 37,and interferon-gamma: receptors, functions, and roles in diseases[J]. J Allergy Clin Immunol,2011, 127 (3) : 701-21. DOI: 10.1016/j.jaci.2010.11.050. |
| [13] | Nold-Petry CA, Lo CY, Rudloff I, et al. IL-37 requires the receptorsIL-18Rα and IL-1R8 (SIGIRR) to carry out its multifacetedanti-inflammatory program upon innate signal transduction[J]. Nature Immunology,2015, 16 (4) : 354-65. DOI: 10.1038/ni.3103. |
| [14] | Wu B, Meng K, Ji Q, et al. Interleukin-37 ameliorates myocardialischaemia/reperfusion injury in mice[J]. Clin Exp Immunol,2014, 176 (3) : 438-51. DOI: 10.1111/cei.12284. |
 2015, Vol. 35
2015, Vol. 35

