肺腺癌是非小细胞肺癌最常见的类型[1],晚期肺腺癌患者诊治时大多数已并发胸腔积液。对于这些患者来说,很难获取组织学标本,细胞学标本较容易获取。在实际工作中,细胞学涂片常因细胞重叠、退变、与间皮混淆等因素难以辨认肿瘤细胞,导致肺腺癌胸水诊断阳性率低下,影响临床诊断治疗。沉渣包埋切片中细胞的形态接近于常规组织病理切片中的细胞形态,并且保持着肿瘤的组织排列方式,可以进行免疫组化染色检测[2]。甲状腺转录因子(TTF-1)、新天冬氨酸蛋白酶A(napsin A)是诊断肺腺癌最常用的指标,大多数文献对TTF-1 和napsin A蛋白的研究是在肺腺癌组织蜡块中[3-4],而其在肺腺癌胸水细胞蜡块中研究甚少。因此,本文回顾性分析45例肺腺癌性胸水涂片及相对应的细胞蜡块免疫组织化学,用定量和定性的方法较客观地评估了TTF-1 和napsin A在肺腺癌胸水细胞蜡块中敏感性和特异性,探讨其对肺腺癌胸水的诊断价值,以期对晚期肺腺癌患者准确的病理诊断提供一定的依据。
1 材料和方法 1.1 材料收集郑州人民医院病理科2013~2015年肺腺癌性胸水涂片及对应的细胞蜡块,样本含量如下:45例有肺腺癌病史的胸水,经免疫组织化学最终确定为反应性间皮增生的胸水7例,肺腺癌性胸水38例。所有胸水均行细胞涂片,剩余胸水沉渣制成细胞蜡块,行CK、CR、 TTF-1、napsin A免疫组织化学染色。本研究中诊断标准如下:肺腺癌性胸水肿瘤细胞TTF-1和/或napsin A阳性,且CK阳性、CR阴性;反应性间皮增生CR阳性,CK、 TTF-1、napsin A均阴性;如果细胞CR、TTF-1、napsin A 均阴性,但CK阳性,且细胞有具有异型性,结合病史,仍诊断为肺腺癌性胸水。
1.2 蜡块制作离心,常规涂片,剩余沉淀物制成细胞蜡块。
1.3 疫组化流程切片、烤片、脱蜡并水化,抗原修复,滴加一抗、二抗并孵育,DAB显色。本研究中所用napsin A和TTF-1均购自福州迈新生物科技有限公司,用已知阳性napsin A 和TTF-1的肺癌组织和PBS分别代替一抗作为阳性和空白对照。
1.4 免疫组化结果判定根据空白、阳性和阴性对照的显色情况,在确定无假阳性和假阴性的前提下,TTF-1蛋白以细胞核染成棕褐色或棕黑色为阳性,napsin A蛋白以细胞浆染成棕黄色或棕褐色为阳性。
1.5 TTF-1和napsin A定量测试用ImagePro Plus 图像分析软件测TTF-1 和napsin A表达强度的阳性单位(Positive Unit,PU)方法如下:用ImagePro Plus图像分析软件在40倍物镜下,对于阳性病例,从每例切片中选取取阳性细胞输入计算机,把其转换成灰色照片;对于阴性病例,每个视野随机选取一个细胞进行测试。用交互式测试法测试每个阳性细胞的灰度Gα,同时在相应的视野中测试背景灰度Gβ并取其平均值。本研究中测试软件设定的Gmax为256,按下列公式计算每个阳性细胞的阳性单位PU值。PU=(Gα-Gβ)/Gmax×100。
1.6 统计学分析应用SPSS 17.0统计软件对实验数据进行处理,定性资料组间比较采用χ2检验,定量资料两组间比较采用独立样本t检验,P<0.05为差异具有统计学意义。
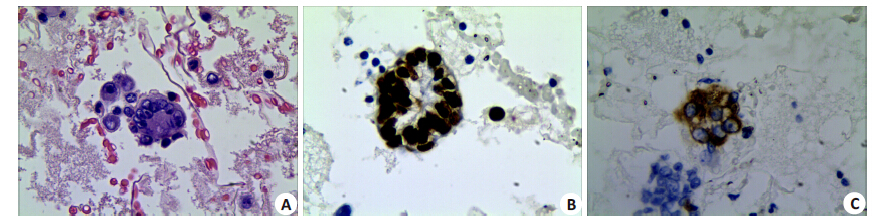
2 结果 2.1 细胞蜡块免疫组化结果细胞蜡块切片显示肺腺癌细胞呈散在或腺样结构排列。免疫组化显示TTF-1在肺腺癌细胞蜡块中呈棕黑色,颗粒均匀定位于细胞核,napsin A呈棕黄色,颗粒粗细不等,定位于胞浆(图1)。免疫组化结合图像定量分析显示TTF-1蛋白含量(56.33±23.56)高于napsin A 蛋白含量(41.15±2.77),差异具有统计学意义(t=8.57, P=0.000)。
|
图 1 肺腺癌胸水细胞蜡块HE镜下形态及免疫组化TTF-1和napsin A的表达 Figure 1 HE staining of a pleural fluid cell block section and immunohistochemistry for TTF-1 and napsin A. A: Some of the cancer cells in the pleural fluid cell block were aligned in an adenoid pattern (HE staining, original magnification: ×40); B, C: TTF-1 and napsin Aexpression in the cell blocks, respectively. |
在未行免疫组化之前,45例有肺腺癌病史的胸水中仅靠细胞涂片诊断为恶性肿瘤细胞的阳性率为55.56%(25/45),细胞蜡块行免疫组织化学染色CK、 CR、TTF-1 和napsin A 诊断为恶性肿瘤的阳性率为84.44%(38/45),其中细胞蜡块行napsin A和TTF-1 检测后诊断为恶性肿瘤的阳性率为82.22%(37/45),3组间相比较差异均具有统计学意义(χ2=12.11,P=0.002)。细胞蜡块免疫组化CK、CR、TTF-1和napsin A、细胞蜡块免疫组化TTF-1和napsin A诊断恶性肿瘤阳性率均高于细胞涂片,差异均具有统计学意义(χ2=8.94,P= 0.003;χ2=7.47,P=0.006),7例反应性间皮增生在未行细胞免疫组织化学检测前有2例被判断为恶性肿瘤细胞,误判率28.57%(2/7)。
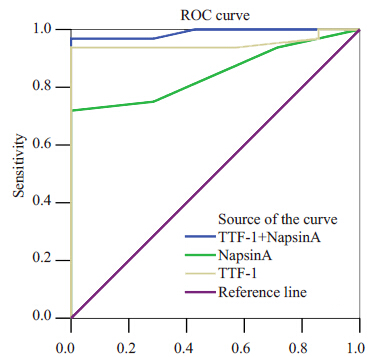
2.3 细胞蜡块TTF-1、napsin A及联合TTF-1 和napsinA诊断肺腺癌的灵敏度和特异度45例有肺腺癌病史的胸水细胞蜡块中,经免疫组织化学确定为癌性胸水的有38例,间皮反应性增生的7 例。TTF-1的阳性率为80%(36/45),TTF-1在反应性间皮细胞增生的病例中均不表达(0/7),二者比较差异具有统计学意义(χ2=33.16,P=0.000),其诊断肺腺癌的灵敏度和特异度分别为94.74%和100%,见表2;napsin A 的阳性率为66.67%(30/45),napsin A在反应性间皮细胞增生的病例中均不表达(0/7),二者比较差异具有统计学意义(χ2=29.30,P=0.000),其诊断肺腺癌的灵敏度和特异度分别为78.95%和100%,见表1;联合napsin A 和TTF-1 检测,其诊断肺腺癌的灵敏度和特异度为97.37%和100%。免疫组化napsin A、TTF-1、TTF-1和NapsinA联合检测3种情况检测肺腺癌细胞蜡块受试者测试工作曲线下面积分别为0.861,0.979,0.991(图2)。
| 表 1 TTF-1和napsin A在45例有肺腺癌病史胸水沉细胞蜡块中的表达 Table 1 TF-1 and napsin A expression in 45 pleural fluid cell blocks from patients with a history of pulmonary adenocarcinoma |
|
图 2 肺腺癌胸水沉细胞蜡块检测TTF-1、napsin A、 TTF-1+napsin A 3种情况受试者测试工作曲线 Figure 2 Receiver-operating characteristic curve for TTF-1 and napsin A expression in pleural fluid cell blocks and their combination for diagnosis of pulmonary adenocarcinoma. |
肺腺癌性胸水是我国最常见的肿瘤性胸水,传统细胞学检测具有快速、简单、标本易于采集等优点,在临床上发挥重要的诊断作用。但是传统细胞学阳性检出率一直很低。细胞石蜡包埋技术[5]应用在国外该技术已成为细胞学常规诊断必做的技术,而在国内仅有少数医院开展。
本文通过对45例胸水细胞蜡块免疫组化与传统细胞涂片比较,结果显示胸水细胞蜡块切片结合免疫组织化学检测较传统细胞涂片能够很大程度的提高肺腺癌的阳性率,降低误判率。结合本研究,传统细胞涂片的阳性率不高原因如下:(1)肿瘤细胞有时跟间皮细胞或组织细胞很容易相混淆;(2)受制片的影响,背景脏,尤其是血性胸水时,涂片太厚,细胞易重叠导致不好辨认; (3)涂片面积过大,阅片工作量加大,容易漏诊;(4)有些送检的胸水本来肿瘤细胞就少,也不排除肿瘤细胞存在于胸水涂片剩余后的胸水中。细胞蜡块与细胞涂片相比有以下优势:(1)细胞经过充分固定,部分癌细胞排列有结构,更加接近组织学形态,跟间皮细胞或组织细胞容易鉴别;(2)切片厚度可以控制,很少受到背景中的红细胞影响;(3)组织块大小有限,节省医生的阅片时间,不易漏诊;(4)由于剩余胸水全部制成细胞蜡块,避免了胸水因肿瘤过少而造成的漏诊;(5)蜡块可以长期保存,便于后续免疫组织化学和基因检测。
本文观察了45例胸水细胞蜡块中TTF-1与napsin A 免疫组织化学对肺腺癌诊断的灵敏度和特异度。本文中TTF-1 和napsin A 诊断肺腺癌的灵敏度分别为94.74%和80.45%,特异度均为100%,这一结果与以往文献报道较一致[6-8]。该结果与TTF-1和napsin A在原发性肺腺癌组织学中的有较高灵敏度和特异度也基本相似[9-11]。研究结果显示TTF-1 灵敏度较napsin A高,这一点以往大多数文献报道napsin A灵敏度较TTF-1 高不同[12-15],其原因可能是不同研究中肺腺癌的异质性比较大,也可能是由于TTF-1和napsin A在不同分化程度的肺腺癌中表达差异所致。
本研究中我们认为单一指标TTF-1较napsin A除了其在诊断肺腺癌性胸水灵敏度上较高的优势外,另外一个原因还在于TTF-1定位与细胞核,其染色均匀,在低倍镜下就能识别;而napsin A染色定位于胞浆,其染色颗粒粗细不等,需在高倍镜下才能识别,如果免疫组化染色出现非特异着色时,napsin A染色很容易被误判。此外,本文定量分析结果显示TTF-1的阳性强度明显高于napsin A,定量更加直观[16]的反应了TTF-1在肺腺癌细胞蜡块中的高表达,这与以往文献TTF-1在肺腺癌原发灶中的定量表达结果相似[17],同时也说明了定位于核的TTF-1较napsin A容易判读。与单一指标相比,联合napsin A和TTF-1检测价值诊断最高,其诊断肺腺癌的灵敏度和特异度为97.37%和100%,应用受试者测试工作曲线显示联合napsin A和TTF-1诊断肺腺癌性胸水曲线下面积最大,表明二者联合起来诊断价值较高。本研究中,38例肺腺癌性胸水细胞蜡块中37例有TTF-1 和/或napsin A的表达,其中1 例未见二者表达(CK有表达,且CR阴性),其原因可能是该患者肺腺癌在疾病进展过程中肿瘤的抗原表达丢失所致。基于以上分析,我们认为在诊断肺腺癌性胸水中应当联合检测napsin A和TTF-1,在诊断时应结合其他免疫学指标、病史及细胞异型性等情况综合判断。
综上所述,细胞蜡块切片结合免疫组织化学检测较传统细胞涂片检测有助于提高肺腺癌胸水阳性率,联合检测napsin A和TTF-1对肺腺癌胸水有较高的诊断价值。
| [1] | Herbst RS, Heymach JV, Lippman SM, et al. Lung cancer[J]. N Engl J Med,2008, 359 (13) : 1367-80. DOI: 10.1056/NEJMra0802714. |
| [2] | 张福田, 赖续文, 张伟, 等. 胸腹水脱落细胞学瘤包石蜡切片免疫组织化学的应用[J]. 中国组织化学与细胞化学杂志,2011, 20 (5) : 507-8. |
| [3] | Zhao W, Wang H, Peng Y, et al. ΔNp63, CK5/6, TTF-1 and napsin A, a reliable panel to subtype non-small cell lung cancer in biopsy specimens[J]. Int J Clin Exp Pathol,2014, 7 (7) : 4247-53. |
| [4] | Ao M H, Zhang H, Sakowski L, et al. The utility of a novel triple marker (combination of TTF1, napsin A, and p40) in the subclassification of non-small cell lung cancer[J]. Hum Pathol,2014, 45 (5) : 926-34. DOI: 10.1016/j.humpath.2014.01.005. |
| [5] | Nathan NA, Narayan E, Smith MM, et al. Cell block cytology -Improved preparation and its efficacy in diagnostic cytology[J]. Am J Clin Pathol,2000, 114 (4) : 599-606. DOI: 10.1309/G035-P2MM-D1TM-T5QE. |
| [6] | 张丽华, 王雪晴, 王国庆, 等. 细胞蜡块在晚期腺癌诊断和肺腺癌个体化治疗中的应用价值[J]. 临床与实验病理学杂志,2014, 30 (2) : 166-70. |
| [7] | 王文军, 张伟, 陈玉娟, 等. 细胞蜡块免疫标记在浆膜腔积液腺癌细胞病理诊断中的临床价值[J]. 山西医科大学学报,2014, 45 (4) : 288-90. |
| [8] | 周秋媛, 张惠箴, 蒋智铭, 等. 胸腹水沉渣包埋切片中Napsin-A, CK7, TTF-1等的表达及临床意义[J]. 临床与实验病理学杂志,2013, 29 (6) : 671-3. |
| [9] | Xu XY, Yang GY, Yang JH, et al. Analysis of clinical characteristics and differential diagnosis of the lung biopsy specimens in 99 adenocarcinoma cases and 111 squamous cell carcinoma cases: Utility of an immunohistochemical panel containing CK5/6, CK34 beta E12, p63, CK7 and TTF-1[J]. Pathol Res Pract,2014, 210 (10) : 680-5. DOI: 10.1016/j.prp.2014.06.021. |
| [10] | 肖芹, 顾学文, 田秀春, 等. p40, TTF-1, Napsin-A在肺非小细胞癌中的表达[J]. 诊断病理杂志,2014, 21 (3) : 182-3. |
| [11] | 张同海, 王劲松, 黄文斌, 等. 联合检测TTF1, CK5/6, p63和NapsinA在肺鳞癌和腺癌鉴别诊断中的价值[J]. 临床与实验病理学杂志,2012, 28 (8) : 918-20. |
| [12] | Mukhopadhyay S, Katzenstein AL. Comparison of monoclonal napsinA, polyclonal napsin A, and TTF-1 for determining lung origin in metastatic adenocarcinomas[J]. Am J Clin Pathol,2012, 138 (5) : 703-11. DOI: 10.1309/AJCPKVBXTI9O3TEM. |
| [13] | Dejmek A, Naucler P, Smedjeback A, et al. Napsin a (TA02) is a useful alternative to thyroid transcription factor-1(TTF-1) for the identification of pulmonary adenocarcinoma cells in pleural effusions[J]. Diagn Cytopathol,2007, 35 (8) : 493-7. DOI: 10.1002/(ISSN)1097-0339. |
| [14] | Fatima N, Cohen C, Lawson D, et al. TTF-1 and NapsinA double stain:a useful marker for diagnosing lung adenocarcinoma on fine-needle aspiration cell blocks[J]. Cancer Cytopathol,2011, 19 (2) : 127-33. |
| [15] | Kim MY, Go H, Koh J, et al. Napsin a is a useful marker for metastatic adenocarcinomas of pulmonary origin[J]. Histopathology,2014, 65 (2) : 195-206. DOI: 10.1111/his.2014.65.issue-2. |
| [16] | 李玉梅, 齐文娟, 申洪. Tiam1蛋白在肺癌组织中表达的定量分析及临床意义[J]. 南方医科大学学报,2011, 31 (10) : 1774-7. |
| [17] | 白晓燕, 申洪. 组织芯片检测甲状腺转录因子-1蛋白在肺癌细胞核中表达的定量研究[J]. 南方医科大学学报,2006, 26 (10) : 1423-6. |
 2015, Vol. 35
2015, Vol. 35

