2. 安徽中医药大学中医临床学院,安徽 合肥 230038 ;
3. 安徽省安庆市中医院内科,安徽 安庆 246000 ;
4. 安徽中医药大学中西医结合医院,安徽 合肥 23000
2. College of Clinical Chinese Medicine, Anhui University of Chinese Medicine, Hefei 230038, China ;
3. Department of Internal Medicine, Anqing Hospital of Traditional Chinese Medicine, Anqing 246000, China ;
4. Department of Internal Medicine, Anqing Hospital of Traditional Chinese Medicine, Anqing 246000, China
类风湿关节炎(RA)是一种以关节慢性病变为主的自身免疫疾病,可最终导致关节畸变及功能丧失,其病变除关节外尚可累及其他组织、脏器[1]。肺由于其富含结缔组织与血管,又有着密集联系的循环体系,因而成为RA较易累及的器官之一。RA肺部病变呈起病隐匿、病情进展快、病死率高的特点,严重危及患者生命而成为RA首要死因。RA累及至肺组织主要侵犯周边肺泡、肺泡间隔、邻近小气道和小血管,从而引起肺功能降低。RA肺病变早期呼吸系统症状及肺部X线片、CT表现不典型,而肺功能降低早于临床表现及胸部影像学异常。因此,针对RA肺部病变早期无症状或不典型,较易被忽视的特点,有必要对RA肺功能降低进行研究。RA肺病变引起肺功能降低的发病机制尚不明确,其机制可能与RA炎症反应、免疫损伤,涉及细胞、细胞因子、细胞外基质及信号传导通路等因素相互作用。前期研究表明RA发生、发展可能与Notch 信号传导通路有关[2]。Notch通路传导失衡导致调控Treg不足,促使免疫调节功能紊乱,最终导致RA肺功能降低。因此,从Notch信号通路对Treg调节途径研究RA肺功能降低具有重要意义。治疗RA肺功能降低应用西药如糖皮质激素、免疫抑制剂等有一定的疗效,但长期应用副反应增多,患者多不能耐受或依存性差,远程疗效不理想。而中医药在治疗RA肺病变中优势明显。中药如雷公藤制剂应用于临床治疗RA及其肺病变疗效显著[3-4]。雷公藤有效成分之一雷公藤甲素(TPT)具有抗炎及抑制细胞免疫和体液免疫等作用[5]。TPT能显著抑制关节肿、抑制组织胺所致的毛细血管通透性增加及棉球肉芽增殖[6]。同时,TPT具有抗肺间质纤维化作用,减少炎性介质对组织脏器的刺激。为了进一步探讨TPT对RA肺病变的作用机制,本文通过复制类风湿关节炎动物模型,观察该药对佐剂性关节炎大鼠肺功能及肺组织Notch受体/配体的影响,现将研究结果作简要阐述。
1 材料及方法 1.1 实验动物体质量160±20 g、鼠龄5~6月的清洁级雄性SD大鼠40只(南京医科大学实验动物中心提供,许可证号:SCXK苏2010-0008)。清洁级标准饲养。
1.2 药品及试剂TPT 由南京康惟盛生物技术公司提供(纯度≥98%),CAS号38748-32-2;甲氨喋呤(MTX):2.5 mg/片,由上海医药(集团)有限公司信谊制药总厂生产,国药准字H31020644,批号20090104;弗氏完全佐剂(FCA):由美国SIGMA出品,批号:104k8527;Trizol总RNA提取液:上海英杰公司提供,批号:1382757;PCR试剂盒:美国DUPONT,批号:11DP0376;组织石蜡包埋机:LEICA,型号:A130395;石蜡切片机:德国LEICA,型号:RM2245;染色机:德国SLEE,型号:MAS;显微镜:日本OLYMPUS公司,型号:BX53。
1.3 关节炎模型复制及给药40只大鼠随机均分为正常对照组(NC)、模型对照组(MC)、TPT组、MTX组,除NC组外,其余大鼠右足跖皮内注射FCA 0.1 mL致炎,复制成佐剂关节炎(AA)大鼠模型[7]。致炎后第12天开始给药,通过人体体表面积计算动物给药剂量。TPT组给药浓度为1 mg/100 g,1 次/d;MTX组:浓度为0.3 mg/100 g,1 次/周;NC组及MC组给予生理盐水浓度为1 mL/100 g,1次/d。各组连续用药30 d。
1.4 检测指标 1.4.1 足跖肿胀度(E)、关节炎指数(AI)、肺功能的测定分别在造模前1 d、致炎后第12天、给药后测量各组大鼠后足跖的容积,计算各组大鼠E[8]。E=(造模后足趾容积—造模前足趾容积)/造模前足趾容积。AI[9]:致炎后第12天开始观察并记录全身病变。根据未注射佐剂的其余3只肢体的病变程度累积积分5级评分法评价。肢体或关节无红肿(0分),小趾关节红肿(1分),趾关节和足跖关节肿胀(2分),踝关节以下的足爪肿胀(3分),包括踝关节在内的全部足爪肿胀(4分)。肺功能测定[10]:采用大鼠肺功能仪检测肺功能水平。肺功能测定参数包括用力肺活量(FVC)、25%肺活量的最大呼气流量(FEF25)、50%肺活量的最大呼气流量(FEF50)、75%肺活量的最大呼气流量(FEF75)、最大呼气中期流量(MMF)、用力最大呼气流量(PEF)。
1.4.2 关节病理学观察各组大鼠取后足远端趾间关节,用4%多聚甲醛固定24 h后,10%乙二胺四乙酸(EDTA)脱钙5周;石蜡包埋,切片,HE染色。显微镜观察大鼠关节滑膜及软骨组织病理形态变化。
1.4.3 大鼠肺组织Notch信号通路的表达Notch受体、配体引物设计与合成由上海生工完成。肺组织总RNA提取、反转录及PCR参照试剂说明书完成。
1.5 统计学处理采用SPSS 17.0处理,实验数据为连续性变量用均数±标准差表示,样本均采用正态性检验,计量资料采用t检验;等级计数资料转化为计量资料,检验水准为0.05。
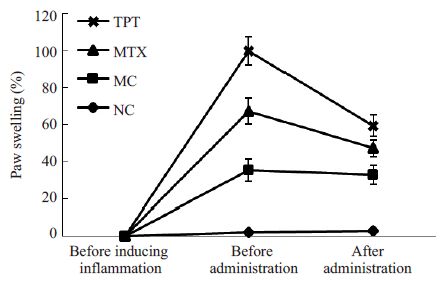
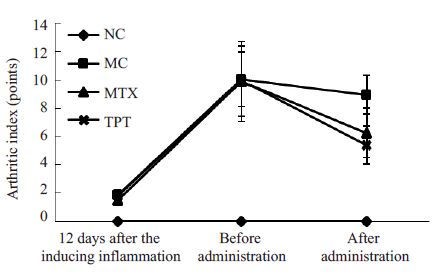
2 结果 2.1 AA大鼠E、AI的变化及TPT对其的影响给药前,除NC组外,其余大鼠均造模成功,给药前,MC组、MTX组、TPT组大鼠E、AI显著高于NC组(P<0.05或P<0.01)。给药后,与NC组比较,MC组大鼠E、AI显著升高(P<0.01);与MC组比较,MTX组、TPT组大鼠E、AI显著降低;与MTX组比较,TPT组大鼠E、AI显著降低(P<0.05,图 1、2)。
|
图 1 各组大鼠足趾肿胀度的变化 Figure 1 Changes of the paw edema volume in the rats. |
|
图 2 各组大鼠关节炎指数的变化 Figure 2 Changes of the arthritis index in the rats |
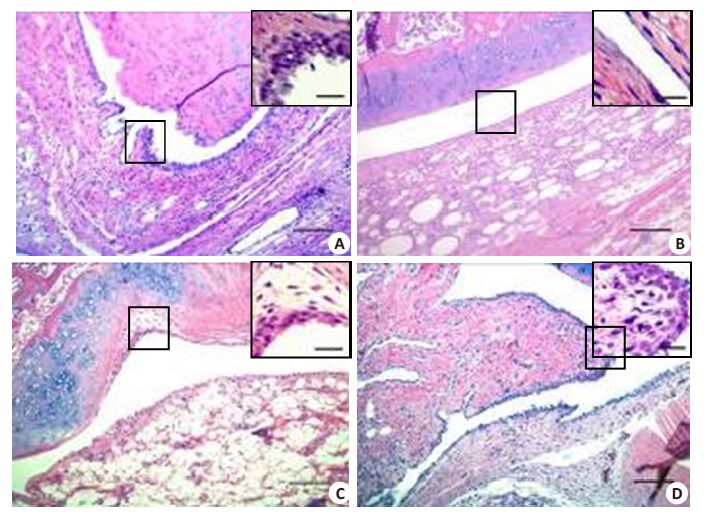
MC组大鼠关节滑膜可见大量炎性细胞浸润;滑膜血管增多,血管壁及其周围附属组织可见大量炎细胞浸润;滑膜组织增生,呈绒毛状突起,部分滑膜组织嵌入关节腔内;滑膜衬细胞分层增多并增厚;部分关节软骨可见血管翳形成(图 3A)。NC组大鼠关节滑膜组织结构清晰,滑膜无肥大、突起,无炎细胞浸润;滑膜细胞分界清楚,分层较少;关节面平整无损伤,关节软骨、软骨下骨及周围肌腱结构完整(图 3B);TPT组大鼠关节滑膜可见少量中性粒细胞等炎细胞浸润,部分滑膜组织嵌入关节腔内;关节面较规整(图 3C);MTX组大鼠关节滑膜可见嗜中性粒细胞等炎细胞浸润,同时浸润其周围附属组织,滑膜血管增多,血管翳形成并增生,滑膜组织呈绒毛状突起并嵌入至关节腔内,滑膜衬细胞增厚(图 3D)。
|
图 3 各组大鼠关节滑膜光镜下观察 Figure 3 HE staining of the synovial membrane in the rats (Original magnification: × 200). A: MC group; B: NC group; C: TPT group; D: MTX group |
给药30 d 后,MC组大鼠肺功能参数FVC、FEF25、FEF50、FEF75、MMF、PEF显著降低。经TPT治疗后,TPT组FVC、FEF25、FEF50、FEF75、MMF、PEF升高(P<0.05或P<0.01,表 1)。
| 表 1 各组大鼠肺功能的比较 Table 1 Comparison of pulmonary function between the groups (Mean±SD, n=10) |
与NC 组相比,MC 组、MTX 组Notch3、Notch4、Delta1 表达升高,TPT 组Notch3、Delta1 升高(P<0.05,P<0.01);MC 组、MTX 组、TPT 组Notch1、Jagged1、Jagged2降低(P<0.05,P<0.01)。与MC组相比,MTX组Jagged1升高,TPT组Notch1、Jagged1、Jagged2、Jagged1升高(P<0.05,P<0.01);TPT 组Notch3、Notch4、Delta1降低(P<0.05,P<0.01)。与TPT组相比,MTX组Notch1、Jagged1降低(P<0.05,P<0.01,表 2)。
| 表 2 各组大鼠肺组织Notch受体及配体的表达的比较 Table 2 Comparison of expressions of Notch receptors and ligands in the rats (Mean±SD, n=8) |
多元相关分析结果显示,肺功能参数FVC 与Notch3、Delta1呈反比(r=-0.584,P=0.034; r=-0.647,P=0.028),PEF 与Notch4 呈反比(r=-0.651,P=0.027);FEF50 与Notch1 呈正比(r=0.682,P=0.023),FEF75 与Jagged1呈正比(r=0.595,P=0.031)。
3 讨论Notch信号传导通路在各种免疫细胞中有广泛表达,可影响发育过程中多种细胞的分化、增殖和凋亡。通过Notch(1-4)受体及Jagged1-2/Delta1配体的相互作用产生旁侧抑制效应,控制细胞对各种内、外源信息的反应,从而导致细胞特异性分化,是一种影响胚胎发育、器官形成的普遍机制[11-12]。
Notch信号途径可调控RA的免疫系统[13-14]。Notch信号在RA外周免疫系统的分化和调节中起作用,在成熟的淋巴细胞和APCs的表面均有Notch受体及其配体的表达。同时,Notch信号途径可调控肺泡上皮细胞的分化,在肺的生长发育中起重要作用[15]。研究表明[16-17],Notch1信号可能通过介导碱式螺旋-回旋-螺旋(bHLH)转录因子的表达,调控肺泡上皮和血管内皮细胞的增殖、分化、迁移等生物学活动。Notch1阳性反应主要定位在肺泡上皮细胞,支气管上皮细胞表达较少;Notch2均匀分布于上皮细胞、血管内皮及间质细胞;Notch3则在血管内皮细胞内呈强表达;Jagged1主要分布于成纤维细胞及肺泡腔、间质,在肺泡上皮细胞仅为弱阳性表达。在Notch 组中Notch1、Jagged1、Jagged2 升高,Notch3、Notch4、Delta1的表达降低,通过保护肺泡上皮细胞、支气管上皮细胞免于炎症刺激,减少RA成纤维细胞增生和肺间质纤维化的发生。在本组研究中我们发现,AA大鼠E及AI明显升高,同时肺功能检测结果显示,FEF25、FEF50、FEF75、MMF、PEF 明显降低,表明AA大鼠在关节炎症反应的基础上可进一步导致肺功能下降,其肺功能的变化主要是表现为小气道功能的严重损伤,并伴有限制性通气功能障碍。而AA大鼠肺功能降低的过程可能与Notch通路的参与有关。本次研究中相关分析显示肺功能参数FVC与Notch3、Delta1呈反比,PEF 与Notch4 呈反比;FEF50 与Notch1 呈正比,FEF75与Jagged1呈正比。说明AA中肺组织Notch1、Notch3、Notch4、Delta1、Jagged1-2的表达部位具有高度一致性,推测肺组织细胞可能同时携带Notch受体和配体,与相邻肺细胞之间互相传递信息。Notch1、Jagged1、Jagged2的表达较正常对照组显著下调,Notch3、Notch4、Delta1的表达显著上调,说明在AA大鼠在关节处于病变期时,Notch信号通过级联放大效应促进肺组织损害作用。
雷公藤生理活性是由二萜内酯、生物碱、三萜等多种成分协同产生[18-19],雷公藤制剂广泛应用于治疗RA疾病中,特别是类风湿关节炎合并肺间质病变,疗效显著。雷公藤甲素是雷公藤干燥去皮根经提取、纯化后得到的有效组分[20]。本次研究我们发现,TPT治疗后AA大鼠肺功能参数FEF25、FEF50、FEF75、MMF、PEF明显升高,提示TPT能显著改善AA大鼠肺功能的水平,提高肺功能。同时,与MC组相比,TPT 组E、AI 及Notch3、Notch4、Delta1的表达降低,Notch1、Jagged1、Jagged2及Treg的表达升高。并且在与MTX组比较,TPT组在调节Notch信号通路方面明显优于MTX组。说明TPT 改善AA大鼠关节局部症状的机制跟激活Notch 信号传导通路有关,可能是通过上调Notch1、Jagged1、Jagged2的表达,下调Notch3、Notch4、Delta1的表达。雷公藤具有免疫抑制作用,可抑制RA患者体内异常免疫反应。TPT通过抗炎、抗氧化等发挥免疫调节作用[21]。雷公藤多甙能改善肺泡炎和纤维化,雷公藤制剂单体可减轻肺泡炎和肺纤维化程度。雷公藤毛单体可减轻肺纤维化模型大鼠肺组织病理学改变,降低肺泡炎和肺纤维化程度,具有一定的抗肺纤维化的疗效[22-23]。使肺泡壁重新上皮化以恢复气血屏障的重要功能。本次研究结果显示,TPT作用于AA大鼠后,调节Notch信号通路中受体、配体表达,可能是通过抑制AECⅡ和血管内皮细胞的增殖、分化,使得肺泡上皮细胞分泌肺表面活性物质及转分化功能趋于正常,致使肺泡上皮细胞数量进一步增加,改善肺泡通气/换气功能障碍,从而提高肺功能参数FVC、FEF25、FEF50、MMF、PEF等,改善肺功能水平。
综上所述,TPT改善AA大鼠肺功能水平的机制可能是通过调节Notch信号传导通路受体、配体表达,从而改善关节局部症状和肺部损伤。
| [1] | Wang JX, Du CG. A retrospective study of clinical characteristics of interstitial lung disease associated with rheumatoid arthritis in Chinese patients[J]. Med Sci Monit,2015, 21 (6) : 708-15. |
| [2] | Wan L, Liu J, Huang C, et al. Effects of xinfeng capsule on pulmonary function based on treg-mediated notch pathway in a rat model of adjuvant arthritis[J]. J Trad Chin Med,2012, 32 (3) : 430-6. DOI: 10.1016/S0254-6272(13)60050-3. |
| [3] | 刘史佳, 戴国梁, 孙冰婷, 等. 基于PK-PD模型研究雷公藤治疗类风湿 关节炎生物靶标[J]. 中国中药杂志,2015, 2 (2) : 334-8. |
| [4] | 姜泉, 曹炜, 唐晓颇, 等. 雷公藤提取物治疗类风湿关节炎的系统评 价[J]. 中国中药杂志,2009 (20) : 2637-43. |
| [5] | 赵庆华, 李晓宇, 冯群, 等. 基于剂量的雷公藤抗小鼠免疫性炎症“效- 毒”关联性评价[J]. 中国中药杂志,2015, 6 (6) : 1139-43. |
| [6] | 李春杏, 李太生, 朱珠, 等. 雷公藤抗炎免疫调节活性单体的研究进展[J]. 中国中药杂志,2014 (21) : 4159-64. |
| [7] | 李仪奎. 中药药理实验方法学[M]. 上海: 上海科学技术出版社, 1991 : 305 . |
| [8] | 徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 北京: 人民卫生出版社, 1991 : 719 -25. |
| [9] | 张均田. 现代药理实验方法[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1997 : 1383 . |
| [10] | 刘健, 万磊, 盛长健, 等. 佐剂性关节炎大鼠肺功能变化与Th1/Th2 细胞、调节性T细胞的相关性研究[J]. 细胞与分子免疫学杂志,2011, 27 (1) : 56-60. |
| [11] | Yen WC, Fischer MM, Axelrod F, et al. Targeting notch signaling with a notch2/notch3 antagonist (tarextumab) inhibits tumor growth and decreases tumor-initiating cell frequency[J]. Clin Cancer Res,2015, 21 (9) : 2084-95. DOI: 10.1158/1078-0432.CCR-14-2808. |
| [12] | Geng X, Sun T, Li JH, et al. Electroacupuncture in the repair of spinal cord injury: inhibiting the Notch signaling pathway and promoting neural stem cell proliferation[J]. Neural Regeneration Research,2015, 10 (3) : 394-403. DOI: 10.4103/1673-5374.153687. |
| [13] | Zhang H, Hilton MJ, Anolik JH, et al. NOTCH inhibits osteoblast formation in inflammatory arthritis via noncanonical NF-κB[J]. J Clin Invest,2014, 124 (7) : 3200-14. DOI: 10.1172/JCI68901. |
| [14] | Jiao Z, Wang W, Ma J, et al. Notch signaling mediates TNF- α-induced IL-6 production in cultured fibroblast-like synoviocytes from rheumatoid arthritis[J]. Clin Dev Immunol,2012, 11 : 350209. |
| [15] | Zhu F, Wang J, Qiu X, et al. Smoke inhalation injury repaired by a bone marrow-derived mesenchymal stem cell paracrine mechanism: Angiogenesis involving the Notch signaling pathway[J]. J Trauma Acute Care Surg,2015, 78 (3) : 565-72. DOI: 10.1097/TA.0000000000000547. |
| [16] | Capaccione KM, Hong X, Morgan KM, et al. Sox9 mediates Notch1-induced mesenchymal features in lung adenocarcinoma[J]. Oncotarget,2014, 5 (11) : 3636-50. DOI: 10.18632/oncotarget. |
| [17] | Hassan WA, Yoshida R, Kudoh S, et al. Notch1 controls cell invasion and metastasis in small cell lung carcinoma cell lines[J]. Lung Cancer,2014, 86 (3) : 304-10. DOI: 10.1016/j.lungcan.2014.10.007. |
| [18] | Su MX, Song M, Yang DS, et al. Simultaneous LC-MS/MS determination of five tripterygium pyridine alkaloids in dog plasma and its application to their pharmacokinetic study after oral administration of tripterygium glycosides tablets[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2015, 990 (10) : 31-8. |
| [19] | Su MX, Zhou WD, Lan J, et al. Rapid and sensitive analysis of multiple bioactive constituents in tripterygium glycosides tablets using liquid chromatography coupled with time-of-flight mass spectrometry[J]. J Sep Sci,2015, 38 (5) : 804-12. DOI: 10.1002/jssc.v38.5. |
| [20] | Li HM, Wan DW, Li RT. New abietane-type diterpene glycosides from the Roots of Tripterygium wilfordii[J]. J Asian Nat Prod Res,2015, 17 (7) : 761-6. DOI: 10.1080/10286020.2014.1001379. |
| [21] | Wei D, Huang Z. Anti-inflammatory effects of triptolide in LPSinduced acute lung injury in mice[J]. Inflammation,2014, 37 (4) : 1307-16. DOI: 10.1007/s10753-014-9858-5. |
| [22] | Wang X, Zhang L, Duan W, et al. Anti-inflammatory effects of triptolide by inhibiting the NF-κB signalling pathway in LPSinduced acute lung injury in a murine model[J]. Mol Med Rep,2014, 10 (1) : 447-52. |
| [23] | Ma M, Chen XY, Gu C, et al. Biochemical changes of oxidative stress in premature ovarian insufficiency induced by tripterygium glycosides[J]. Int J Clin Exp Pathol,2014, 7 (12) : 8855-61. |
 2015, Vol. 35
2015, Vol. 35

