乳腺癌在中国女性人群中发病率排在首位,死亡率则排在第5位[1]。新辅助化疗(NAC)的主要目的是减少原发瘤大小、增加保乳可能性,评估治疗效果并据此制定治疗策略。NAC后获得病理完全缓解(pCR)的原发性乳腺癌预后更佳。因此,对患者进行NAC疗效预测并鉴定出NAC敏感患者,对于实现乳腺癌的个体化治疗极具现实意义,但是探讨NAC后达到pCR的独立预测因素的报道尚存争议。
细胞凋亡是一个积极的、引起细胞程序化死亡的生命机制。细胞凋亡失败可导致癌症发生发展,抗凋亡蛋白的上调则有助于肿瘤生存。凋亡抑制蛋白(IAP)为一个拥有1至3个杆状病毒IAP重复(BIR)结构域、通过直接捆绑并抑制caspase 活性以抑制细胞凋亡的蛋白家族[2-5]。Apollon是一个巨大的、相应地在氨基端及羧基端包含BIR结构域及泛素结合酶结构域的IAP成员,其编码基因位于染色体2p22。Apollon不仅可抑制Smac所诱导的细胞凋亡,还可捆绑pro- caspase-9并抑制其裂解,阻断caspase级联反应[6-8]。研究显示,apollon过表达不仅是结肠癌干细胞的特征之一[9],还与儿童急性髓系白血病不良预后有关[10],而沉默apollon基因则可活化p53 及caspase-3 并诱导乳腺癌发生细胞凋亡[11]。现有的研究提示apollon与肿瘤的发生发展关系密切。
最新研究显示,与apollon 同家族的IAP 成员survivin过表达不仅与乳腺癌不良预后有关[12],还可作为乳腺癌疗效的预测指标[13-15],但关于apollon与乳腺癌关系的体内研究尚未见发表。在本研究中,作者首次检测了乳腺癌术前活检癌组织内apollon的表达情况,并探讨了apollon对pCR的预测价值。
1 材料与方法 1.1 一般资料回顾性分析本院2012年1月~2014年9月124例可切除原发性浸润性导管癌女性患者的病例资料。所有患者均接受了TE方案NAC,临床分期为Ⅱ、Ⅲ期,无远处转移,就诊前未接受过化疗、放疗或内分泌治疗,年龄32~69岁,平均年龄49.7岁,中位年龄50.5岁。NAC前,所有患者经空心针穿刺活检确诊为乳腺癌。NAC后B超、MRI评价临床疗效,手术后经组织病理学检查确定疗效。
1.2 疗效判定标准按RECIST制订的标准,测定乳腺癌患者化疗前后肿块大小变化。采用体检和B超测量肿瘤最大直径予以判断:完全缓解(CR),部分缓解(PR),稳定(SD),进展(PD),CR+PR为临床有效,以乳房肿块及腋淋巴结术后病理检查无浸润癌成分为pCR。
1.3 免疫组化Apollon:取上述所选患者存档的经福尔马林固定、石蜡包埋的术前活检及手术切除癌组织标本,4 μm厚连续切片,脱蜡,浸于0.01 mol/L 枸橼酸盐缓冲液内,微波炉加热至沸腾并保持该状态15 min修复抗原;切片冷却后洗涤,采用abcam公司封闭缓冲液封闭非特异性的背景染色;滴加abcam公司兔抗人apollon多克隆抗体(稀释400倍),4 ℃过夜;洗涤,浸于含0.3% H2O2的甲醇中灭活内源性过氧化物酶;洗涤,加VECTOR公司ImmPRESS 试剂抗兔二抗(稀释1000 倍),室温反应15 min;洗涤,DAB显色,苏木精轻染,封片。
Her-2、ER 及PR:仅取上述术前活检癌组织标本,采用福州迈新生物技术开发有限公司相关试剂盒并按试剂盒所附操作指南进行检测。
1.4 结果判定Apollon评分系统和标准:apollon蛋白定位于胞核和(或)胞质。采用双评分半定量分析,根据阳性细胞百分比及显色程度计分,200倍镜下随机取5个视野,计算阳性细胞平均数,阳性细胞平均数为0计为0 分,≤25%记为1 分,26%~50%记为2 分,51%~75%记为3分,≥76%记为4分;显色程度为无着色记0分,淡黄色记为1分,棕黄色记为2分,棕褐色记为3分。2种分数相加后综合判定,0~1分为(-),2~3 分为(+),4~7分为(++)。(-~+)定义为阴性染色,(++)定义为阳性染色。
Her-2评分系统和标准:阴性(-~+)为没有染色,或<10%细胞的细胞膜染色,或>10%细胞部分细胞膜的轻度染色;可疑(++)为>10%细胞轻到中度的全细胞膜染色;阳性(+++)为>10%细胞重度的全细胞膜染色。定义(+++)为Her-2阳性、(-~++)为Her-2阴性。
ER、PR的评估系统和标准:ER、PR阳性标准为≥1%的肿瘤细胞核染色(+),阴性标准为肿瘤细胞核染色<1%(-)。
1.5 统计学方法应用SPSS 12.0统计软件进行数据处理。采用列联表分析比较生物标志物表达水平、病理参数的不同是否导致pCR率的不同,采用kendall等级相关分析检测apollon表达与其他分子标志物、病理参数的相关性,采用配对样本t检验分析NAC前后乳腺癌组织内apollon表达变化。
2 结果 2.1 Apollon、Her-2、ER及PR在乳腺癌组织内的表达在乳腺癌组织内,apollon表达阳性的细胞胞核和(或)胞质呈棕黄色,124例乳腺癌有58例表达阳性,阳性表达率为46.8%。Her-2、ER及PR的阳性表达率则分别为23.4%、61.3%及52.4%(图 1、表 1)。
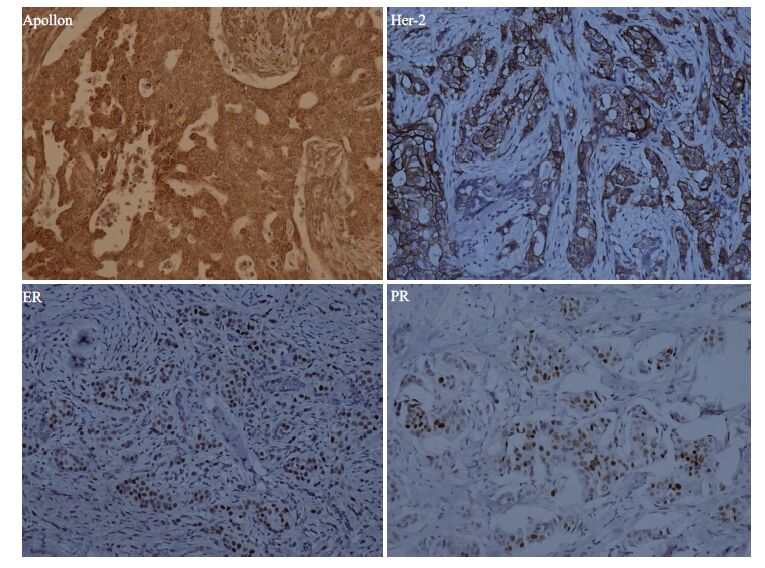
|
图 1 Apollon、Her-2、ER及PR在乳腺癌中的阳性表达 Figure 1 Positive expression of apollon,Her-2,ER and PR in breast cancer (Original magnification: ×200). |
| 表 1 NAC后获得pCR的预测因素之免疫组化信息、淋巴结状态及肿瘤大小的列联表分析 Table 1 Cross-tabulation analysis of the association of theimmunohistochemical data,lymph node status and tumor sizewith pCR after NAC |
对124 例患者评价疗效,总有效率(CR+PR)为79.0%(98/124),SD 为19.4%(24/124),PD 为2 例,术后经病理评估pCR为18.5%(23/124)。列联表分析发现,apollon阴性、ER阴性及PR阴性者pCR率更高,而Her-2、N分期及T分期与pCR之间没有显著性关系(表 1)。
2.3 新辅助化疗前apollon表达状态与Her-2、ER、PR、淋巴结状态及肿瘤大小的相关性如表 2 所示,apollon 阳性表达与Her-2、ER、PR阳性表达及淋巴结转移显著相关,但与肿瘤大小无关。
| 表 2 在乳腺癌中Apollon与Her-2、ER、PR、淋巴结状态及肿瘤大小的相关性 Table 2 Correlations of apollon with Her-2,ER,PR,lymph node status and the tumor size in breast cancer |
Apollon显色程度计为0~7分。NAC前apollon平均计分为3.40,NAC后apollon平均计分为2.59,二者比较具有显著性差异(P=0.000)。NAC 显著降低了乳腺癌组织内apollon的表达(图 2)。
|
图 2 化疗后apollon蛋白显著下降 Figure 2 Apollon protein decrease was significant afterchemotherapeutic treatment. |
乳腺癌在分子水平上具有高度异质性,组织学形态、临床分期尽管相同而生物学特性也许不尽一致,从而导致肿瘤治疗反应及预后差异。利用基因芯片技术,Perou 等[16]将乳腺癌分为临床预后各不相同的不同亚型,包括Luminal A、Luminal B、Basal-like、HER-2过表达型及正常乳腺型。Carey等[17-18]采用免疫组化技术将乳腺癌分为Luminal 亚型、Basal-like 亚型、HER-2过表达亚型,发现Basal-like及HER2过表达亚型乳腺癌对化疗敏感,但预后却较差。虽然目前固有分型可以提供乳腺癌的不同的疗效预测及预后信息,但是利用该分型指导临床治疗方案的制定现在还存在一定的局限性。鉴于此,近年来,从不同角度反映乳腺癌特征的分子分型也不断提出。
在本研究中,apollon阳性者pCR率显著降低,提示apollon过表达提高了肿瘤细胞生存能力并对细胞凋亡产生抗性,从而影响了新辅助化疗的抗癌效果。由于目前还未见apollon与乳腺癌关系的体内研究发表,于是作者比较了survivin,一个与apollon同家族的著名IAP成员,在乳腺癌中的表达情况。最新一项基于多西他赛为新辅助化疗药物的回顾性研究显示,68 例乳腺癌活检标本中survivin 表达阳性者获得pCR 率更低[13]。一项同样采用多西他赛作为新辅助化疗药物的研究也表明,乳腺癌中survivin 阳性表达者NAC有效率更低[14]。而另一项采用蒽环类药物用于新辅助化疗的98例乳腺癌研究结果则显示,化疗前活检癌组织中survivin高表达者具有更低的pCR获得率[15]。鉴于此,我们不难得出这样的结论:在乳腺癌中,包括apollon在内的IAP 家族成员的高表达可能预示较差的NAC反应。
在本研究中,除了apollon外,pCR率还与ER及PR表达关系密切,但与Her-2状态、淋巴结状态及肿瘤大小无关。虽然Her-2状态、ER状态、PR状态、淋巴结状态及肿瘤大小均为乳腺癌重要的生物学或病理学参数,但它们与pCR获得率之间关系的研究结果尚不一致。例如Her-2,一个判断乳腺癌预后的重要分子标记物,在有的研究中显示其过表达可获得更高的pCR率[19-20],但在另一些研究中则显示Her-2状态与pCR获得率之间无关[13, 15]。造成这种不一致的原因可能存在以下原因:较小的样本、新辅助化疗方法的不同、免疫组化的方法不同、所用抗体不同及生物学分子标志物阳性表达的定义不同。
在本研究中,apollon过表达与Her-2、ER、PR的阳性表达及淋巴结转移显著相关,则进一步提示了apollon 与乳腺癌的发生发展关系密切。有报道称,Her-2可通过NF-κB及c-myc调控survivin的表达[21],鉴于apollon与survivin为同一家族成员,拥有结构及功能上的众多共性,因此存在Her-2 通过类似机制影响apollon活性的可能。
在本研究中,与活检癌组织相比,NAC后的手术切除乳腺癌组织内apollon表达显著降低,该结果可能与NAC能够诱导乳腺癌细胞发生凋亡有关。发生凋亡的细胞其线粒体膜通透性提高,导致包括HtrA2在内的促凋亡因子由线粒体释出,而释出的HtrA2与apollon相互作用并下调彼此表达水平[22]。与本研究类似,有研究称TE方案后survivin表达明显下降[23],提示抑制IAP家族成员表达可能是TE方案NAC杀灭乳腺癌细胞的重要机制。
综上所述,apollon作为IAP家族的重要成员,在新辅助化疗前,通过检测其在活检乳腺癌组织中的表达,可能为预测NACT疗效提供一个有用选择。
| [1] | Chen WQ, Zheng RS, Zhang SW, et al. Annual report on status of cancer in China, 2010[J]. Chin J Cancer Res,2014, 26 (1) : 48-58. |
| [2] | Zhang HG, Wang J, Yang X, et al. Regulation of apoptosis proteins in cancer cells by ubiquitin[J]. Oncogene,2004, 23 (11) : 2009-15. DOI: 10.1038/sj.onc.1207373. |
| [3] | Nachmias B, Ashhab Y, Ben-Yehuda D. The inhibitor of apoptosis protein family (IAPs): an emerging therapeutic target in cancer[J]. Semin Cancer Biol,2004, 14 (4) : 231-43. DOI: 10.1016/j.semcancer.2004.04.002. |
| [4] | Yang YL, Li XM. The IAP family: endogenous caspase inhibitors with multiple biological activities[J]. Cell Res,2000, 10 (3) : 169-77. DOI: 10.1038/sj.cr.7290046. |
| [5] | Deveraux QL, Reed JC. IAP family proteins--suppressors of apoptosis[J]. Genes Dev,1999, 13 (3) : 239-52. DOI: 10.1101/gad.13.3.239. |
| [6] | Qiu XB, Goldberg AL. The membrane-associated inhibitor of apoptosis protein, BRUCE/Apollon, antagonizes both the precursor and mature forms of Smac and caspase-9[J]. J Biol Chem,2005, 280 (1) : 174-82. DOI: 10.1074/jbc.M411430200. |
| [7] | Hao Y, Sekine K, Kawabata A, et al. Apollon ubiquitinates SMAC and caspase-9, and has an essential cytoprotection function[J]. Nat Cell Biol,2004, 6 (9) : 849-60. DOI: 10.1038/ncb1159. |
| [8] | Qiu XB, Markant SL, Yuan J, et al. Nrdp1-mediated degradation of the gigantic IAP, BRUCE, is a novel pathway for triggering apoptosis[J]. EMBO J,2004, 23 (4) : 800-10. DOI: 10.1038/sj.emboj.7600075. |
| [9] | Van Houdt WJ, Emmink BL, Pham TV, et al. Comparative proteomics of colon cancer stem cells and differentiated tumor cells identifies BIRC6 as a potential therapeutic target[J]. Mol Cell Proteomics,2011, 10 (12) : M111.011353.. DOI: 10.1074/mcp.M111.011353. |
| [10] | Sung KW, Choi J, Hwang YK, et al. Overexpression of apollon, an antiapoptotic protein, is associated with poor prognosis in childhood de novo acute myeloid leukemia[J]. Clin Cancer Res,2007, 13 (17) : 5109-14. DOI: 10.1158/1078-0432.CCR-07-0693. |
| [11] | Lopergolo A, Pennati M, Gandellini P, et al. Apollon gene silencing induces apoptosis in breast cancer cells through p53 stabilisation and caspase-3 activation[J]. Br J Cancer,2009, 100 (5) : 739-46. DOI: 10.1038/sj.bjc.6604927. |
| [12] | Song J, Su H, Zhou YY, et al. Prognostic value of survivin expression in breast cancer patients: a meta-analysis[J]. Tumour Biol,2013, 34 (4) : 2053-62. DOI: 10.1007/s13277-013-0848-2. |
| [13] | Lin Q, Liu Y, Chen H, et al. Survivin, Ki-67 and tumor grade as predictors of response to docetaxel-based neoadjuvant chemotherapy in locally advanced breast cancer[J]. Mol and Clin Oncol,2013, 1 (5) : 839-44. |
| [14] | Yuan SF, Zhu LJ, Zheng WE, et al. Expression of β-tubulin III and survivin in advance stage breast cancer correlates with chemotherapeutic effects of docetaxel[J]. Asian Pac J Cancer Prev,2012, 13 (1) : 361-5. DOI: 10.7314/APJCP.2012.13.1.361. |
| [15] | Zhao YC, Wang Y, Ni XJ, et al. Clinical significance of Smac and survivin expression in breast cancer patients treated with anthracycline-based neoadjuvant chemotherapy[J]. Mol Med Rep,2014, 9 (2) : 614-20. |
| [16] | Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumours[J]. Nature,2000, 406 (6797) : 747-52. DOI: 10.1038/35021093. |
| [17] | Carey LA, Dees EC, Sawyer L, et al. The triple negative paradox: primary tumor chemosensitivity of breast cancer subtypes[J]. Clin Cancer Res,2007, 13 (8) : 2329-34. DOI: 10.1158/1078-0432.CCR-06-1109. |
| [18] | Livasy CA, Karaca G, Nanda R, et al. Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma[J]. Mod Pathol,2006, 19 (2) : 264-71. DOI: 10.1038/modpathol.3800528. |
| [19] | 葛文凯, 杨奔, 左文述, 等. 乳腺癌穿刺活检对HR和HER-2及Ki-67 评价可靠性以及化疗对其影响研究[J]. 中华肿瘤防治杂志,2014, 21 (11) : 847-53. |
| [20] | 刘钊, 尉承泽, 黄焰, 等. 乳腺癌新辅助化疗疗效与临床特征的相关 性研究[J]. 军事医学,2013, 37 (9) : 700-3. |
| [21] | Papanikolaou V, Iliopoulos D, Dimou I, et al. Survivin regulation by HER2 through NF-κB and c-myc in irradiated breast cancer cells[J]. J Cell Mol Med,2011, 15 (7) : 1542-50. DOI: 10.1111/jcmm.2011.15.issue-7. |
| [22] | Sekine K, Hao Y, Suzuki Y, et al. HtrA2 cleaves Apollon and induces cell death by IAP-binding motif in Apollon-deficient cells[J]. Biochem Biophys Res Commun,2005, 330 (1) : 279-85. DOI: 10.1016/j.bbrc.2005.02.165. |
| [23] | 凡庆东, 姜军, 杨新华, 等. 新辅助化疗对乳腺癌Survivin、p53表达影 响及意义[J]. 第三军医大学学报,2007, 29 (11) : 1096-8. |
 2015, Vol. 35
2015, Vol. 35