系统性红斑狼疮(systemic lupus erythematosus, SLE)是累及多器官、多系统的自身免疫性疾病。抗原抗体复合物产生后沉积在小血管、皮肤基底膜、肾脏等各个器官系统,肾脏受累十分常见。BATF是激活蛋白-1(AP-1)转录因子超家族中的一员,在调控免疫球蛋白转换类别和免疫细胞增殖分化中发挥十分重要的作用[1]。最近研究表明,BATF是调控Thl7细胞增殖分化和IL-17产生的重要转录因子,在自身免疫性疾病的发病中起重要作用[2]。但在狼疮性肾炎中BATF的表达情况及其与Th17的关系的相关研究尚少。为了明确其在狼疮肾炎中的作用,本研究检测碱性亮氨酸拉链转录因子ATF样蛋白(BATF)、RORγt、IL-17在狼疮小鼠肾脏组织中的表达情况,以了解其在狼疮性肾炎发病中的作用。
1 材料和方法 1.1 研究对象及分组正常对照组:正常小鼠(C57BL/6,清洁级,雌性);狼疮肾炎模型组:狼疮小鼠(MRL/1pr,清洁级,雌性)。各5只。
1.2 主要试剂及仪器BATF单克隆抗体(Proteintech);GAPDH多克隆抗体(中山金桥生物技术公司)、HRP标记的羊抗鼠、羊抗兔IgG(Santa Cruz);裂解液和蛋白酶抑制剂混合物(康为世纪生物科技公司);BCA蛋白质定量测定试剂盒(上海博彩生物科技公司);PVDFWestern转印膜(Roche);Trizol提取液、SYBR PremixEx TaqTM Ⅱ试剂盒、PrimeScript RT Master Mix Perfect Real Time试剂盒(TakaRa);RORγt、BATF、IL-17、ACTB引物均由英潍捷基上海有限公司合成;垂直电泳仪、转膜仪(BAYGENE,美国);Odyssey红外成像系统(LICOR,美国);荧光实时定量PCR仪(ABI7500,美国);多功能酶标仪(MDS,美国)。
1.3 标本采集用膀胱按摩法收集小鼠清晨中段尿,小鼠眼眶取血分离血清检测抗ds-DNA抗体。小鼠以颈椎脱位处死,取左侧肾脏组织10%中性福尔马林溶液固定,石蜡包埋;其余肾脏组织液氮冷冻,-80 ℃保存。
1.4 实验室检查指标检测采用考马斯蓝法测定小鼠尿蛋白,ELISA检测血清抗ds-DNA抗体含量。
1.5 观察肾脏组织病理变化肾组织石蜡切片行HE染色,于光镜下对小鼠肾组织常规病理进行分析。
1.6 Western blot检测小鼠肾脏组织BATF蛋白的表达小鼠肾脏组织加入裂解液和PMSF用玻璃匀浆器研磨并测定总蛋白浓度后,取相同总量总蛋白的各组样品经不连续十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)并转移至PVDF膜。洗膜后加入于封闭液(TBST+5% BSA)封闭1 h。分别加入稀释度1:500 BATF、1:1000 GAPDH的Ⅰ抗孵育,4 ℃轻摇过夜。TBST溶液漂洗PVDF膜3次,每次10 min,二抗稀释液室温杂交1 h。TBST溶液漂洗PVDF膜3次,每次10 min,使用ODYSSEY红外成像系统扫膜,最后采用ImageJ软件分析图片并测定灰度值。取BATF与GAPDH灰度值之比作为蛋白的相对表达量,对比分析各组间蛋白表达的差异情况。
1.7 实时荧光定量聚合酶链反应(RT-PCR)检测肾脏组织RORγt、BATF、IL-17 mRNA的表达RORγt、BATF、IL-17、ACTB引物均由英潍捷基上海有限公司合成。RORγt引物序列:上游5'-TGAGGGGTGCAAGGGCTTCTTC-3',下游5'-CAGTTCTGCTGACGCGTGCAGG-3',扩增片段为75 bp。BATF引物序列:上游5'-GCCGACACCCTTCACCTG GAGA-3',下游5'-TGGGCACTGTATACCACCTCG G-3',扩增片段为131 bp。ACTB引物序列:上游5'-GAAGATCAAGATCATTGCTCCT-3',下游5'-TACTCCTGCTTGCTGATCCACA-3',扩增片段为111 bp。IL-17引物序列:上游5'-CAACCGTTCCACGTCACCCT-3',下游5'-CCAGCTTTCCCTCCGCATT-3'。参照Trizol试剂说明书提取总RNA。以管家基因ACTB为内参进行数据标准化,以正常对照组为参照样本,计算各目的基因mRNA的相对表达量。
1.8 统计学分析所有数据采用SPSS 13.0软件进行分析,数据以均数±标准差来表示,如果数据符合正态分布和方差齐性,样本均数的比较采用两独立样本间t检验,否则采用秩和检验,以P < 0.05为差异有统计学意义。肾脏组织BATF mRNA表达量与RORγt、IL-17 mRNA水平的相关性用直线相关进行分析。
2 结果 2.1 两组小鼠实验室指标比较狼疮小鼠的尿蛋白、抗ds-DNA水平均高于正常对照组(P < 0.05,图 1)。
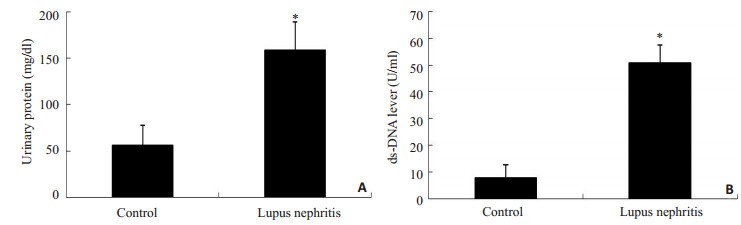
|
图 1 小鼠实验室指标 Figure 1 Urinary protein (A) and ds-DNA (B) levels in the control and MRL/lpr mice. *P < 0.05 vs control. |
HE染色显示正常对照小鼠肾小球血管袢薄而清晰,内皮和系膜细胞及肾小管均正常。而狼疮肾炎小鼠肾脏病理表现为肾小球硬化、肾小球系膜细胞增殖、基质增宽,并可见新月体形成,肾间质内大量淋巴细胞浸润(图 2)。
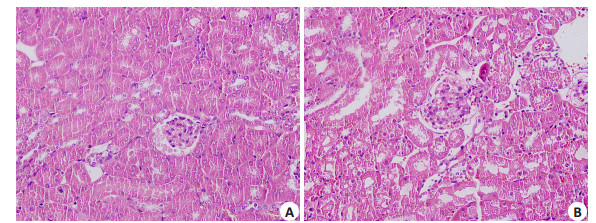
|
图 2 小鼠肾脏病理 Figure 2 Renal histopathology in control (A) and MRL/lpr (B) mice (HE staining, original magnification: ×400). |
狼疮小鼠BATF蛋白表达水平高于正常对照组(P < 0.05,图 3)。
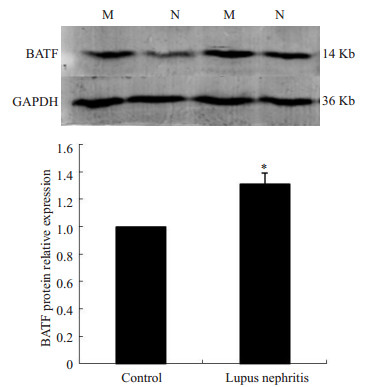
|
图 3 小鼠肾脏组织BATF蛋白的表达 Figure 3 Expression of BATF protein in the kidneys of control and MRL/lpr mice detected by Western blotting. M: Lupus nephritis group; N: Normal group. *P < 0.05 vs control. |
狼疮小鼠的BATF、RORγt及IL-17A mRNA表达较正常对照组升高(P < 0.05)。
2.5 相关性分析肾脏组织BATF mRNA的表达量与RORγt、IL-17mRNA的表达量呈正相关(r=0.945、0.876,P < 0.05)。
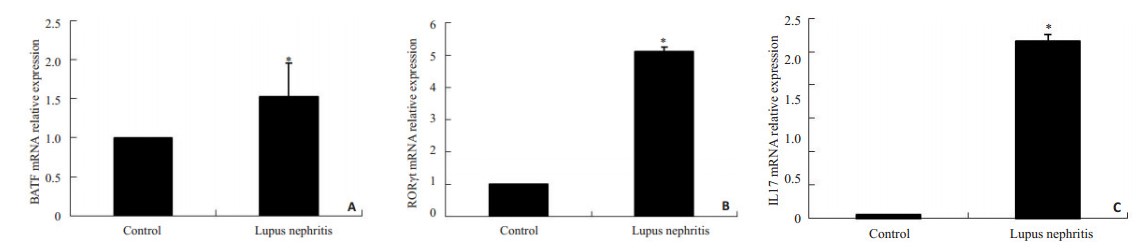
|
图 4 小鼠肾脏组织BATF、RORγt及IL-17 mRNA的相对表达量 Figure 4 Relative expression of BATF (A), RORγt (B) and IL-17 (C) mRNA in the kidney of control and MRL/lpr mice. *P < 0.05 vs control. |
狼疮性肾炎确切的免疫发病机理目前并未确切阐明,由于免疫监视或免疫抑制的不足,导致机体的免疫细胞处于持续不间断地激活状态,可能在其发病中有着相当重要作用[3-4]。IL-17是Th17细胞分泌的特征性细胞因子。在狼疮肾炎模型小鼠及系统性红斑狼疮患者的肾脏组织中均有IL-17的高表达[5],本实验的结果与之相符。IL-17缺失的小鼠不能诱导出以狼疮抗体表达升高、狼疮性肾炎为表现的系统性红斑狼疮,并且CD3+CD4-CD8-双阴性T细胞减少、CD4+调节性T细胞增多,Amarilyo等[6]最近的研究结果为IL-17在SLE的发病机制中发挥作用提供直接证据。抗CD3抗体经鼻给药或一定剂量的组蛋白肽治疗狼疮鼠,能抑制T细胞产生IL-17、IL-21,同时明显减少肾脏组织的IL-17+浸润细胞,从而使临床症状得到改善[7]。
RORγt是调控Th17细胞分化及主要效应细胞因子IL-17表达的关键性转录因子[8-9],并能维持Th17细胞的分泌功能[10]。Leppkes等[11]给小鼠输注RORγt基因缺失的T细胞,不能使粘膜细胞分泌的IL-17水平增高, 不能诱导结肠炎, 提示RORγt可通过调节IL-17对受Th17细胞影响的疾病发挥作用。在狼疮小鼠肾脏组织中RORγt mRNA表达水平明显高于对照组,且IL-17水平较对照组增高,说明了RORγt作为Th17的特征性转录因子在狼疮性肾炎的发生发展中发挥着一定的作用。
BATF作为Thl7细胞不可缺少的一个核转录因子,是Th17细胞分化和生产IL-17的关键因素。SchramlBU等[12]的研究结果显示BATF-/-小鼠Th1、Th2分化正常,但Th17分化不明显,能使Thl7细胞过表达所致的试验性自身免疫性脑脊髓炎(EAE)完全抵抗。并且BATF-/-T细胞不能产生Th17分化所必须的RORγt、IL-21,BATF的有无直接影响IL-17的产生。Schraml等[12]还利用逆转录病毒表达,发现了BATF和RORγt在IL-17生产中的协同关系。Zhi等[13]的研究也表明BATF对Th17细胞分化及IL-17产生的调控与RORγt相关。Thl7细胞是哮喘的重要的致病因素[14],Ubel C等[15]的研究发现BATF-/-小鼠Thl7细胞免疫反应和IL-17分泌均降低,BATF基因敲除可使小鼠不发生哮喘。说明BATF可通过调节Th17细胞的免疫反应参与相关疾病的发生发展。本实验发现,狼疮小鼠肾脏组织中BATF蛋白及mRNA的表达量均高于对照组,同时RORγt及IL-17mRNA的表达量较对照组增高,且BATF mRNA的表达量与RORγt、IL-17mRNA的表达量呈显著正相关。上述结果提示BATF可能通过与RORγt协同作用,诱导Th17细胞分化,以此使得IL-17的分泌增加,从而参与狼疮性肾炎的发病过程。
| [1] | Ise W, Kohyama M, Schraml BU, et al. The transcription factor BATF controls the global regulators of class-switch recombination in both B cells and T cells[J]. Nat Immunol,2011, 12 (6) : 536-43. DOI: 10.1038/ni.2037. |
| [2] | Miao T, Raymond M, Bhullar P, et al. Early growth response gene-2 controls IL-17 expression and Th17 differentiation by negatively regulating Batf[J]. J Immunol,2013, 190 (1) : 58-65. DOI: 10.4049/jimmunol.1200868. |
| [3] | Tsokos GC. Systemic lupus erythematosus[J]. N Engl J Med,2011, 365 (22) : 2110-21. DOI: 10.1056/NEJMra1100359. |
| [4] | Nowling TK, Gilkeson GS. Mechanisms of tissue injury in lupus nephritis[J]. Arthritis Res Ther,2011, 13 (6) : 250. DOI: 10.1186/ar3528. |
| [5] | Yang J, Chu Y, Yang X, et al. Th17 and natural Treg cell population dynamics in systemic lupus erythematosus[J]. Arthritis Rheum,2009, 60 (5) : 1472-83. DOI: 10.1002/art.v60:5. |
| [6] | Gil Amarilyo, Elaine V. Lourenço, Lourenço, Fu-Dong Shi. IL-17 promotes murine lupus[J]. J Immunol,2014, 193 (2) : 540-3. DOI: 10.4049/jimmunol.1400931. |
| [7] | Wu HY, Quintana FJ, Weiner HL. Nasal anti-CD3 antibody ameliorates lupus by inducing an IL-10-secreting CD4 + CD25-LAP+ regulatory T cell and is associated with down-regulation of IL-17 + CD4 + ICOS + CXCR5 + follicular helper T cells[J]. J Immunol,2008, 181 (9) : 6038-50. DOI: 10.4049/jimmunol.181.9.6038. |
| [8] | Ruan Q, Kameswaran V, Zhang Y, et al. The Th17 immune response is controlled by the Rel-RORγ-RORγ T transcriptional axis[J]. J Exp Med,2011, 208 (11) : 2321-33. DOI: 10.1084/jem.20110462. |
| [9] | Kom T, Bettelli E, Oukka M, et al. IL-17 and Thl7 Cells[J]. Annu Rev Immunol,2009, 27 : 485-517. DOI: 10.1146/annurev.immunol.021908.132710. |
| [10] | Manel N, Unutmaz D, Littman DR. The differentiation of human T (H) -17 cells requires transforming growth factor-beta and induction of the nuclear receptor RORgammat[J]. Nat Immunol,2008, 9 (6) : 641-9. DOI: 10.1038/ni.1610. |
| [11] | Leppkes M, Becker C, Ivanov Ⅱ, et al. RORgamma-expressing Th17 cells induce murine chronic intestinal inflammation via redundant effects of IL-17A and IL-17F[J]. Gastroenterology,2009, 136 (1) : 257-67. DOI: 10.1053/j.gastro.2008.10.018. |
| [12] | Schraml BU, Hildner K, Ise W, et al. The AP-1 transcription factor Batf controls T (H) 17 differentiation[J]. Nature,2009, 460 (7253) : 405-9. |
| [13] | Zhi L, Ustyugova IV, Chen X, et al. Enhanced Th17 differentiation and aggravated arthritis in IEX-1-deficient mice by mitochondrial reactive Oxygen species-mediated signaling[J]. J Immunol,2012, 189 (4) : 1639-47. DOI: 10.4049/jimmunol.1200528. |
| [14] | Moon HG, Tae YM, Kim YS, et al. Conversion of Th17-type into Th2-type inflammation by acetyl salicylic acid via the adenosine and uric acid pathway in the lung[J]. Allergy,2010, 65 (9) : 1093-103. |
| [15] | Ubel C, Sopel N, Graser A, et al. The activating protein 1 transcription factor basic leucine zipper transcription factor, ATF-like (BATF), regulates lymphocyte-and mast cell-driven immune responses in the setting of allergic asthma[J]. Journal of Allergy and Clinical Immunology,2014, 133 (1) : 198-206. DOI: 10.1016/j.jaci.2013.09.049. |
 2016, Vol. 35
2016, Vol. 35
