长期以来胶质瘢痕被认为是中枢神经系统损伤后神经再生的主要障碍之一,其形成的标志是星形胶质细胞的增殖、肥大及其中间丝蛋白的表达上调[1]。胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)与波形蛋白(vimentin)是星形胶质细胞两种主要的中间丝蛋白成分。脊髓损伤(spinal cord injury, SCI)后,随着星形胶质细胞增殖、肥大及GFAP、vimentin表达的增加,产生反应性胶质化,最终导致胶质瘢痕的形成。抑制GFAP、vimentin的表达可抑制胶质瘢痕形成,从而可能有利于神经轴突的再生。细胞凋亡信号调节蛋白1(apoptosis signal regulating kinase 1, ASK1)属促分裂原活化蛋白激酶激酶激酶家族成员,在细胞内信号通路和多种生物学功能中发挥着重要作用[2]。一些研究提示ASK1可能在星形胶质细胞反应性增生并及其GFAP和vimentin的表达中起重要作用[3-5]。SCI后胶质瘢痕形成的分子机制至今仍不清楚,揭示胶质瘢痕分子调节机制对于深入理解其形成机理、探寻抑制胶质瘢痕形成的方法非常关键。本实验通过大鼠脊髓夹伤模型,利用ASK1特异性抑制剂和ASK1单克隆抗体两种方法抑制ASK1信号通路,探讨ASK1在大鼠SCI后胶质瘢痕形成中对GFAP、vimentin表达的调控作用,为抑制GFAP、vimentin的表达从而减轻胶质瘢痕形成提供理论依据。
1 材料与方法 1.1 研究对象健康成年Sprague Dawley雌性大鼠100只(购自重庆医科大学实验动物中心),体质量220±25 g,随机分为ASK1特异性抑制剂Thioredoxin组(Trx组)、ASK1单克隆抗体组(Anti-ASK1组)、生理盐水对照组(Model组)及假手术组(Sham组),每组24只大鼠,术后1、7、14、28 d各6只(3只用于免疫荧光分析,3只用于WesternBlot分析)。实验过程中共有4只大鼠死亡(麻醉过度致死2只,膀胱按压辅助排尿过程中膀胱破裂致死1只,不明原因死亡1只),均立即以符合实验要求的雌性大鼠在相同的实验条件下再次造模并给予相应的实验处理。
1.2 主要试剂试剂:ASK1特异性抑制剂Thioredoxin、ASK1小鼠单克隆抗体、GFAP小鼠单克隆抗体和vimentin小鼠单克隆抗体购自Abcam,HRP标记兔抗小鼠二抗、FITC标记兔抗小鼠二抗、蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司,Western blot凝胶试剂盒购自北京康为世纪生物科技有限公司,PBS、PBST、4%血清封闭液为实验室配制。
1.3 大鼠SCI模型构建及损伤后干预参考Usul等[6]的方法并加以改进,苯巴比妥钠麻醉大鼠(40 mg/kg,ip.)并消毒后,在手术显微镜下打开T11-T12节段椎板并暴露硬脊膜,以0.88 N力Yasargil动脉瘤夹持续夹持脊髓30 s,打开硬脊膜并于损伤局部硬膜下分别以10 μL微量注射器缓慢注射Thioredoxin(200 ng/mL)、ASK1小鼠单克隆抗体(稀释比1:100)及生理盐水各10 μL,注射时间为10 min。Sham组只打开椎板,不进行其他操作。术后给予膀胱按摩辅助排尿及常规护理。
1.4 蛋白质印迹技术(Western Blot)检测GFAP、vimentin的表达将大鼠深度麻醉后处死,取出脊髓组织(以损伤区为中心头尾端各10 mm),提取脊髓组织总蛋白,加入蛋白酶抑制剂,-80 ℃保存备用。Bradford考马斯亮蓝法测定蛋白质浓度,调整样本蛋白质浓度,保证上样量一致,SDS聚丙烯酰胺凝胶电泳,Bio-Rad转膜装置将蛋白转移至PVDF膜上,Western Blot封闭液37 ℃封闭90 min,加入相应一抗4 ℃孵育过夜,PBST洗涤3次(每次5 min),辣根过氧化物酶标记的二抗37 ℃孵育90 min,PBST洗涤3次(每次5 min),DAB显色后,扫描各免疫印迹条带。GAPDH为内参,以Quantity One 4.6.2软件进行结果分析。
1.5 免疫荧光标记技术检测损伤区脊髓GFAP的表达大鼠深度麻醉后,用4%多聚甲醛经心脏灌注固定后,取出脊髓组织(以损伤区为中心头尾端各10 mm)置于4%多聚甲醛后固定4 h,然后放入30%蔗糖溶液中脱水至其沉底。行矢状位冰冻切片冷贴片(片厚20 μm),PBS漂洗切片3次(每次5 min),0.3% Triton x-100破膜5 min,PBS漂洗切片3次(每次5 min)后以4%山羊血清封闭液37 ℃封闭60 min,GFAP一抗(1:200)4 ℃孵育过夜,PBS漂洗切片3次(每次5 min),相应二抗37 ℃孵育90 min,PBS漂洗切片3次(每次5 min)后封片。在LEICA TCS SP2激光共聚焦显微镜下观察并照相,用Image Pro Plus 6.0软件分析计算免疫荧光图片中GFAP阳性染色面积率(GFAP阳性染色面积/总面积)。1.6 SCI后后肢运动功能BBB评分
SCI后1、7、14、28 d,大鼠取材前(用于WesternBlot和免疫荧光),对其进行后肢运动功能BBB评分[7],观察各组大鼠后肢运动功能。BBB评分为一项针对大鼠脊髓损伤后运动功能的评分标准,主要观察指标为后肢、尾部及后部躯干的活动能力及协调性。完全丧失运动能力为0分,完全正常为21分,以此间接反应脊髓损伤的恢复情况。实验采用双盲、双人独立评估,以两者评分结果的平均值记为最终BBB的评分结果,以减少评分误差。
1.7 体感及运动诱发电位的检测SCI后28 d,以KEYPOINT 4诱发电位仪测定体感和运动诱发电位。体感诱发电位检测时刺激电极固定于后肢,记录电极安放于冠状缝和矢状缝交汇处皮下(即皮层后肢感觉区),参考电极置于其后方0.5 cm处。予直流方波电脉冲刺激,以后肢抽动为宜,电流强度5~15 mA,波宽0.2 ms,频率3 Hz,叠加次数50~60次,记录体感诱发电位潜伏期和波福变化。运动诱发电位检测时刺激电极置于冠状缝前2 mm、矢状缝旁2 mm处头皮下(即皮层后肢运动区),电流强度40 mA,波宽0.1 ms,频率1 Hz,叠加次数300~500次,记录体感诱发电位潜伏期和波福变化。
1.8 统计学方法结果以均数±标准差表示,用SPSS 17.0软件进行单因素方差分析,各组间两两比较采用LSD法,P < 0.05被认为有统计学差异。
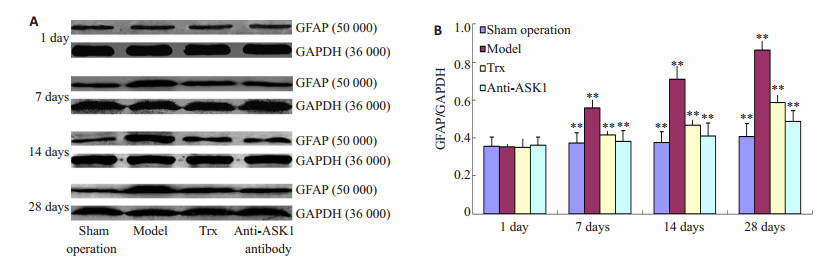
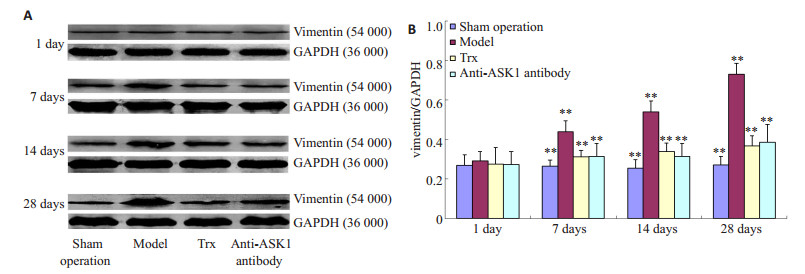
2 结果 2.1 Western bolt法检测损伤局部GFAP、vimentin的表达SCI后1 d,各实验组之间GFAP、vimentin的表达无显著差异;SCI后7、14、28 d除Sham组外,各SCI损伤组GFAP、vimentin的表达均明显升高,且随时间延长逐渐增长,28 d时达到最高;与Model组相比,Trx组、Anti-ASK1组在相应时间点GFAP、vimentin的表达明显降低(P < 0.01,图 1、2)。
|
图 1 Western blot检测损伤局部各组GFAP蛋白的表达 Figure 1 Western blotting (A) and quantitative analysis (B) of GFAP expression at the injury site of rat spinal cords in different groups. |
|
图 2 Western blot检测损伤局部各组Vimentin蛋白的表达 Figure 2 Western blotting (A) and quantitative analysis (B) of vimentin expression at the injury site of injured rat spinal cords in different groups. |
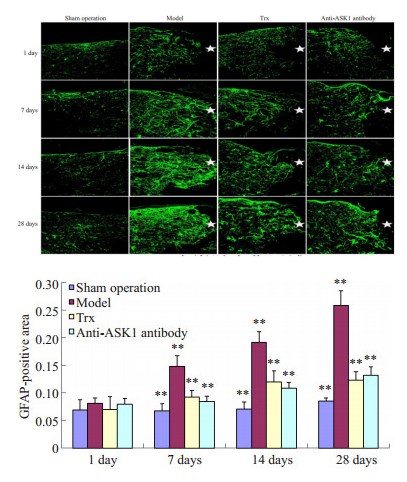
SCI后1 d,免疫荧光检测提示各损伤组GFAP阳性细胞形态发生变化,同时表达未见明显增强,各组间GFAP阳性染色面积率未见明显差异;SCI后7、14、28 d,除Sham组外,各SCI损伤组GFAP表达均明显升高,且随时间逐渐增长,28 d时达到最高;SCI后7、14、28 d,与Model组相比,Trx组、Anti-ASK1组GFAP的表达均明显降低(P < 0.01,图 3)。
|
图 3 免疫荧光法检测损伤局部各组GFAP的表达 Figure 3 Immunofluorescence assay of GFAP expression at the injury site in injured rat spinal cords (A) and histogram of the area positive for GFAP. |
各观察时间点,Sham组大鼠BBB评分均基本正常;SCI后1、7、14 d,各实验组大鼠后肢运动功能BBB评分逐渐升高,但各组间无显著差异;28 d,与Model组相比,Trx组、Anti-ASK1组大鼠后肢运动功能BBB评分显著增高(P < 0.05,表 1)。
| 表 1 SCI后1、7、14、28 d各组大鼠后肢运动功能BBB评分 Table 1 BBB scores of rats in each group at 1, 7, 14 and 28 days after SCI (Mean±SD, n=6) |
SCI后28 d,与Sham组相比,Model组大鼠体感及运动诱发电位潜伏期显著延长,同时波幅显著降低(P < 0.01);与Model组相比,Trx组及Anti-ASK1组大鼠体感及运动诱发电潜伏期明显缩短,同时波幅明显升高(P < 0.05或P < 0.05,表 2)。
| 表 2 SCI后28 d各组大鼠体感及运动诱发电位 Table 2 Results of somatosensory and motor evoked potential tests in each group at 28 days after SCI (Mean±SD, n=6) |
SCI是临床上常见的高致残性损伤,好发于中青年,预后不佳,往往遗留瘫痪等神经功能障碍,造成沉重的社会和经济负担。针对SCI的治疗至今仍未获得较为满意的效果。SCI后损伤局部产生反应性胶质化,最终导致胶质瘢痕形成,从而成为中枢神经轴突再生的物理及化学障碍,如何有效的去除胶质瘢痕是神经科学研究领域的热点之一。胶质瘢痕中最主要的构成成份是星形胶质细胞,中枢神经系统损伤后,星形胶质细胞发生反应性胶质增生,其细胞骨架的两种关键中间丝成分GFAP、vimentin的表达明显上调,成为胶质瘢痕的标志[1, 7-8]。研究提示ASK1可能在星形胶质细胞反应性增生并上调表达GFAP、vimentin的过程中起重要作用[3-5],因此本实验运用大鼠脊髓夹伤模型探讨了抑制ASK1对SCI大鼠胶质瘢痕中GFAP、vimentin表达的影响,及其对大鼠行为学和神经电生理的作用。
本实验结果进一步证实SCI后随时间延长损伤局部GFAP、vimentin的表达明显上调,在28 d时表达最强,同时在7、14、28 d显著高于Sham组的表达水平。采用ASK1特异性抑制剂Thioredoxin和其单克隆抗体两种方法,在大鼠SCI后对ASK1进行抑制,可明显降低SCI后7、14、28 d GFAP、vimentin的表达,28 d大鼠运动功能恢复开始明显有所改善。从ASK1被抑制后7 dGFAP、vimentin才开始出现表达差异,至28 d时行为学出现改善,推测可能原因为由ASK1在损伤局部受到抑制开始经过其下游细胞信号传导抵制GFAP、vimentin基因的转录和翻译最终才可能出现中间丝蛋白出现表达的变化,而神经轴突的生长也需要适当的时间才能与损伤远端神经元建立神经传导才可能出现行为学的改变[8]。另外本实验对Usul等[6]建立的大鼠脊髓夹伤模型方法稍作改进,原因为在本实验中采用原方法建立模型后大鼠大鼠脊髓损伤过重,造成局部神经组织缺失,严重影响实验大鼠存活率。分析其原因可能为本实验所采用的动脉瘤夹有细微差别,如叶片宽度不同可能造成损伤局部所承受的压强不同。本实验中根据具体实验条件稍作改进,避免造成大鼠脊髓过轻或过重的损伤,以期对各实验组获得更好的差异性结果。大鼠SCI模型对脊髓的损伤使伤后运动功能恢复缓慢,这与临床相符合,SCI越重的病人恢复效果越差,恢复周期越长。上述实验结果表明,大鼠SCI后阻断ASK1可抑制胶质瘢痕中GFAP、vimentin的表达,抑制胶质瘢痕的形成,促进后肢运动功能的恢复。
目前针对ASK1影响大鼠SCI后胶质瘢痕形成的具体机制尚待进一步研究。SCI后反应性胶质增生并上调GFAP、vimentin表达可能与ASK1-JNK/P38通路的激活密切相关。ASK1分子结构中包含丝氨酸/苏氨酸激酶结构域,其磷酸化后可激活c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和P38促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK),从而发挥多种生物学功能[9]。在对海马癫痫灶的研究中发现,反应性胶质增生的区域同时伴有ASK1-JNK/P38通路的明显活化[5],同时体外研究中发现JNK激活可促进GFAP、vimentin的表达,从而加剧星形胶质细胞增生及反应性胶质化形成[10]。SCI后的胶质瘢痕形成过程在发生上与其他器官的纤维化类似,有研究提示ASK1-JNK参与了调控哺乳动物发育期外胚层上皮细胞骨架重排,而ASK1基因敲除小鼠的研究发现,ASK1在心肌炎症反应及纤维化过程中起重要作用[11-12]。
炎症反应是胶质瘢痕形成的重要原因之一,中枢神经系统损伤后以小胶质细胞为主的炎症细胞活化,释放出多种促炎症介质引起损伤局部炎症反应,损伤局部炎症反应可激活星形胶质细胞引起GFAP和vimentin的表达上调[13]。Lucrezi等[14]人发现抗炎物质能减少巨噬细胞内P物质诱导的肿瘤坏死因子(炎症因子),ASK1-JNK/P38活化受到抑制,说明抗炎物质可通过减少炎症因子的释放,来抑制ASK1-JNK/P38信号通路的活化。有研究[15-16]提示ASK1-JNK/P38信号通路的活化或抑制,也可影响炎症反应进程,加剧或减轻炎症反应。因此,炎症因素是否是通过与ASK1-JNK/P38的相互作用启动星形胶质细胞增生及中间丝GFAP和vimentin的表达上调,最终导致胶质瘢痕的形成还需要实验来进一步证明。
综上所述,本实验证实了大鼠SCI后阻断ASK1可抑制胶质瘢痕中GFAP和vimentin的表达,改善胶质瘢痕形成运动功能的恢复,但ASK1通过何种具体机制影响SCI后胶质瘢痕的形成还需要进一步研究。
| [1] | Sofroniew MV, Vinters HV. Astrocytes: biology and pathology[J]. Acta Neuropathol,2010, 119 (1) : 7-35. DOI: 10.1007/s00401-009-0619-8. |
| [2] | Fujisawa T, Ichijo H. ASK1-MAP kinase signaling pathway as a therapeutic target for human diseases[J]. Nihon Rinsho,2014, 72 (5) : 957-65. |
| [3] | Lee KW, Zhao X, Im JY, et al. Apoptosis signal-regulating kinase 1 mediates MPTP toxicity and regulates glial activation[J]. PLoS One,2012, 7 (1) : e29935. DOI: 10.1371/journal.pone.0029935. |
| [4] | Um JW, Im E, Park J, et al. ASK1 negatively regulates the 26 S proteasome[J]. J Biol Chem,2010, 285 (47) : 36434-46. DOI: 10.1074/jbc.M110.133777. |
| [5] | Cole-Edwards KK, Musto AE, Bazan NG. c-Jun n-terminal kinase activation responses induced by hippocampal kindling are mediated by reactive astrocytes[J]. J Neurosci,2006, 26 (32) : 8295-304. DOI: 10.1523/JNEUROSCI.1986-05.2006. |
| [6] | Usul H, Cakir E, Arslan E, et al. Effects of clotrimazole on experimental spinal cord injury[J]. Arch Med Res,2006, 37 (5) : 571-5. DOI: 10.1016/j.arcmed.2005.11.007. |
| [7] | Basso DM, Beattie MS, Bresnahan JC. Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection[J]. Exp Neurol,1996, 139 (2) : 244-56. DOI: 10.1006/exnr.1996.0098. |
| [8] | Steward O, Zheng B, Tessier-Lavigne M. False resurrections: distinguishing regenerated from spared axons in the injured central nervous system[J]. J Comp Neurol,2003, 459 (1) : 1-8. DOI: 10.1002/(ISSN)1096-9861. |
| [9] | Shiizaki S, Naguro I, Ichijo H. Activation mechanisms of ASK1 in response to various stresses and its significance in intracellular signaling[J]. Adv Biol Regul,2013, 53 (1) : 135-44. DOI: 10.1016/j.jbior.2012.09.006. |
| [10] | Gadea A, Schinelli S, Gallo V. Endothelin-1 regulates astrocyte proliferation and reactive gliosis via a JNK/c-Jun signaling pathway[J]. J Neurosci,2008, 28 (10) : 2394-408. DOI: 10.1523/JNEUROSCI.5652-07.2008. |
| [11] | Bakal C, Linding R, Llense F, et al. Phosphorylation networks regulating JNK activity in diverse genetic backgrounds[J]. Science,2008, 322 (590) : 453-6. |
| [12] | Kataoka K, Tokutomi Y, Yamamoto E, et al. Apoptosis signalregulating kinase 1 deficiency eliminates cardiovascular injuries induced by high-salt diet[J]. J Hypertens,2011, 29 (1) : 76-84. DOI: 10.1097/HJH.0b013e32833fc8b0. |
| [13] | Zhang D, Hu X, Qian L, et al. Astrogliosis in CNS pathologies: is there a role for microglia?[J]. Mol Neurobiol,2010, 41 (2/3) : 232-41. |
| [14] | Lucrezi JD, Burns TJ, Matesic DF, et al. Inhibition of JNK and p38 MAPK phosphorylation by 5-(acetylamino)-4-oxo-6-phenyl-2-hexenoic acid methyl ester and 4-phenyl-butenoic acid decreases substance P-induced TNF-α upregulation in macrophages[J]. Int Immunopharmacol,2014, 21 (1) : 44-50. DOI: 10.1016/j.intimp.2014.04.007. |
| [15] | Zeng KW, Wang S, Dong X, et al. Sesquiterpene dimer (DSF-52) from Artemisia argyi inhibits microglia-mediated neuroinflammation via suppression of NF-κB, JNK/p38 MAPKs and Jak2/Stat3 signaling pathways[J]. Phytomedicine,2014, 21 (3) : 298-306. DOI: 10.1016/j.phymed.2013.08.016. |
| [16] | Lee DS, Cui X, Ko W, et al. A new sulfonic acid derivative, (Z)-4-methylundeca-1, 9-diene-6-sulfonic acid, isolated from the cold water sea urchin inhibits inflammatory responses through JNK/ p38 MAPK and NF-κB inactivation in RAW 264.7[J]. Arch Pharm Res,2014, 37 (8) : 983-91. DOI: 10.1007/s12272-013-0269-1. |
 2016, Vol. 35
2016, Vol. 35
