2. 广东医学院 附属医院血液内科,广东 湛江 524000
2. Department of Hematology, Affiliated Hospital, Guangdong Medical University, Zhanjiang 524000, China
CDX2基因(cadual type homeobox gene-2,尾型同源盒-2)属于同源盒基因(HOX)家族中的一员,是发育相关基因,其表达失调与结直肠癌、急性白血病发病关系密切[1-4],在急性白血病中CDX2的主要作用是促进细胞增殖、增强克隆形成能力[4-5]。Wnt/β-catenin信号通路是一条在进化中较为保守的通路,参与胚胎发育调节,其异常激活与多种肿瘤发病相关,如结直肠癌、白血病等[6-7],该信号通路在急性白血病中也具有促进细胞增殖的作用[8-9]。CDX2基因和Wnt/β-catenin信号通路在急性白血病中的功能有相似之处,两者是否有协同作用?β-catenin是Wnt/β-catenin信号通路的关键分子,其表达增高可反映该通路的激活,为研究急性髓系白血病(AML)CDX2表达上调与Wnt/β-catenin信号通路激活的相关性,本文对CDX2和β-catenin基因从表达水平、临床意义、与疗效关系及不同病程表达变化几个方面进行了分析。
1 材料与方法 1.1 病例资料收集我科2011年12月~2013年12月期间诊治的初发AML患者骨髓标本92例,诊断符合张之南主编的《血液病诊断及疗效标准》。其中男性54例、女性38例,中位年龄48岁(9~87岁)。按照FAB分型:M1型1例、M2型20例、M3型9例、M4型25例、M5型22例、M6型3例、AML未定型12例。诱导治疗非M3患者采用标准剂量DA(柔红霉素+阿糖胞苷)、DAE(柔红霉素+阿糖胞苷+依托泊苷)、CAG(吡柔比星+阿糖胞苷)、IA(去甲氧柔红霉素+阿糖胞苷)方案;M3患者予以全反式维甲酸联合DA方案化疗。对照组30例为同期诊治的非恶性血液病患者(增生性贫血21例,特发性血小板减少性紫癜9例),其中男性16例、女性14例,中位年龄42岁(15~82岁)。
1.2 主要试剂和仪器TRIzol、逆转录试剂盒、SYBR@Premix Ex TaqTMⅡ试剂盒均购自TaKaRa公司,兔抗人CDX2抗体购自美国Abcam公司(ab76541)、兔抗人β-catenin抗体购自美国Proteintech公司(#51067-2-AP)、兔抗人GAPDH抗体购自Proteintech公司(#10494-1-AP),BCA蛋白定量及ECL发光试剂盒购自碧云天公司,化学发光成像系统为美国Proteinsimple公司。
1.3 方法 1.3.1 骨髓单个核细胞分离取抗凝骨髓液2~5 ml,淋巴细胞分离液分离单个核细胞,加TRIzol或蛋白裂解液提取RNA或蛋白。
1.3.2 实时定量PCR1×107细胞加1 ml TRIzol吹打混匀提取总RNA,紫外分光光度计检测RNA质量和浓度,按照逆转录酶试剂盒说明书中的步骤逆转录cDNA。PCR引物设计好后由广州Invitrogen公司合成,CDX2上游:5'-TTCACTACAGTCGCTACATCA CC-3',下游:5'-GCTGCAACTTCTTCTTGTTGATT-3',扩增片段141 bp;β-catenin上游:5'-TGCAGTTCGCC TTCACTATG-3',下游:5'-ACAGTCGTGGAATGGCA CC-3',扩增片段162 bp;内参基因GAPDH上游:5'-GTCAGTGGTGGACCTGACCT-3',下游:5'-TGA GCTTGACAAAGTGGTCG-3',扩增片段212 bp;。按SYBR@Premix Ex TaqTMⅡ试剂盒说明书进行PCR反应,总体系10 μl,其中SYBR@Premix Ex TaqTMⅡ(2×)5 μl,上下游引物(10 μmol/L)各0.4 μl,cDNA 1 μl,灭菌蒸馏水3.2 μl。PCR扩增条件:95 ℃预变性30 s,95 ℃ 5 s,60 ℃ 30 s,共45个循环。计算2-ΔCT值作为各标本mRNA相对表达量,-ΔCT=(目的基因CT值-内参基因CT值)。
1.3.3 Western blot取1×107细胞,PBS洗涤后悬浮于RIPA裂解液冰上裂解30 min,10 000 r/min离心10 min后取上清,BCA法测定蛋白浓度。取50~70 μg总蛋白进行聚丙烯酰胺凝胶电泳,电转至PVDF膜。5%脱脂奶封闭90 min,加入抗CDX2(1:500稀释)、β-catenin(1:1000稀释)、GAPDH(1:1000稀释)一抗4 ℃孵育过夜,TBST洗涤后室温孵育二抗2 h,TBST再次洗涤后ECL法显色。蛋白相对表达量=灰度值(母的蛋白)/灰度值(内参蛋白)。
1.4 统计学处理采用SPSS17.0软件进行统计学分析。样本不符合正态分布,组间比较用Mann-Whitney U检验,AML各亚型整体比较用Kruskal-Wallis H检验,相关性分析用Spearman相关,高表达与低表达组间完全缓解率比较用χ2检验,初诊与治疗后的比较用配对的非参数分析。P < 0.05认为有统计学差异。
2 结果 2.1 RNA质量及方法可靠性分析所提RNA经分光光度计检测,A260nm/A280nm值均在1.8~2.0之间,纯度好,可用于定量PCR检测。熔解曲线分析显示,各基因PCR扩增产物熔解温度均一,熔解峰为锐利的单一峰,说明扩增产物均一,无非特异扩增及引物二聚体。
2.2 CDX2、β-catenin基因在AML中的表达定量PCR法检测92例初发AML和30例非恶性血液病患者(对照)CDX2和β-catenin表达,CDX2 mRNA在AML组的阳性率为84.78%,对照组无1例者表达(Z=-7.125,P=0.000)。β-catenin mRNA在两组均有表达,但AML组显著高于对照组(Z=-6.222,P=0.001)。CDX2和β-catenin mRNA表达水平在AML各亚型间(除外M1)均无统计学差异(P < 0.05,表 1)。收集到初发AML患者蛋白标本26例,非恶性血液病患者8例。Western blot检测显示,AML组有20例标本可检测到CDX2蛋白表达,阳性率为76.92%,对照组未检测到CDX2蛋白表达(Z=-4.103,P=0.001)。β-catenin蛋白在两组均有表达,AML组显著于对照组(Z=-3.662,P=0.001,表 2、图 1)。β-catenin、CDX2在蛋白水平的表达趋势基本与mRNA水平一致。
| 表 1 CDX2和β-catenin mRNA在AML组和对照组中的表达 Table 1 Expressions of CDX2 and β-catenin mRNA in AML and control groups |
| 表 2 CDX2和β-catenin蛋白在AML组和对照组中的表达 Table 2 Expressions of CDX2 and β-catenin protein in AML and control groups |
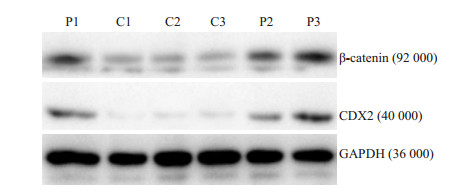
|
图 1 Western blotting检测AML组与对照组CDX2、β-catenin蛋白表达 Figure 1 Expressions of CDX2 and β-catenin protein in AML (P) and control (C) groups detected by Western blotting. |
CDX2 mRNA表达与AML临床特征的关系基本与β-catenin一致,两者均与AML患者性别、年龄、骨髓幼稚细胞比例无显著性相关,与初诊时白细胞数、LDH水平呈显著正相关(表 3)。这说明CDX2、β-catenin mRNA表达水平能反映白血病肿瘤负荷情况,肿瘤负荷越高,CDX2、β-catenin mRNA表达水平越高。
| 表 3 CDX2、β-catenin mRNA表达与AML临床特征的关系 Table 3 Correlations of CDX2 and β-catenin mRNA expressions with clinical characteristics in AML patients |
可评估疗效的AML患者54例,CDX2 mRNA表达阳性45例,阴性9例。45例阳性表达患者中首疗程完全缓解(complete remission, CR)31例,CR率为68.89%;9例阴性表达患者首疗程CR 7例,CR率为77.78%,两组比较差异无统计学意义(χ2=0.284,P=0.594)。
配对分析同一AML患者初诊时和首疗程治疗后CDX2和β-catenin mRNA表达变化,共收集到符合标准的AML患者39例,首疗程达CR 23例,未达CR 16例(PR 7例、NR 9例)。患者获CR时CDX2 mRNA下降至检测不到,β-catenin mRNA表达下降至与对照组水平无显著差异(Z=-1.828,P=0.068),而未获CR患者CDX2和β-catenin mRNA表达水平介于初诊和CR时之间(表 4)。
| 表 4 初诊、首疗程治疗后及对照组CDX2、β-catenin mRNA表达水平比较 Table 4 Comparison of CDX2 and β-catenin mRNA expressions among new diagnosis, after first chemotherapy and control groups |
跟踪5例首疗程未达CR患者(初诊时CDX2均阳性),第二疗程均达CR,此时CDX2 mRNA表达转阴,β-catenin mRNA表达下降至与对照组水平接近。收集到复发标本2例,这2例患者初诊时CDX2均阳性,CR时CDX2 mRNA表达转阴,β-catenin mRNA表达显著下降,分别于诊断7、10个月后复发,复发时CDX2 mRNA由阴转阳,β-catenin mRNA表达显著升高。
2.5 AML中CDX2与β-catenin表达的相关性分析Spearman相关分析显示,无论在mRNA水平还是蛋白水平,CDX2与β-catenin表达均呈显著正相关(r=0.793,P=0.001;r=0.804,P=0.001)。
3 讨论CDX2基因属于尾型同源框基因家族中的一员,是一种转录因子,参与胚胎发育、造血调控等。CDX2最初在胚胎的3个胚层均广泛表达,以后逐渐集中在内胚层表达,从新生儿早期开始至整个成年期基本只表达于小肠和结肠,调控肠道组织发育[10]。CDX2基因表达下调与肠道肿瘤密切相关[1-2],被认为是肠道肿瘤的抑癌基因[11]。近年来的研究发现,急性白血病患者可检测到CDX2的异常表达,CDX2具有促进细胞增殖和克隆形成的作用,并可直接诱发小鼠AML[4-5]。由此可见,CDX2基因在不同细胞背景下功能不同[12-13],其在肠道肿瘤发病中起的是抑癌基因作用,而在AML发病中起的是原癌基因作用。Wnt/β-catenin通路是体内重要的信号转导通路,其异常激活与白血病发病相关。
为研究CDX2表达上调与Wnt/β-catenin信号通路异常激活的相关性,本文分析了AML患者CDX2和β-catenin基因的表达、临床意义、与疗效的关系,并观察了两基因在AML不同病程的表达变化。结果显示,84.78%的AML患者表达CDX2 mRNA,而非恶性血液病对照无1例表达,与黎国伟等[14]报道的基本一致;同时AML患者有β-catenin的过度表达,且CDX2与β-catenin无论在mRNA还是蛋白表达水平均呈显著正相关。在临床意义方面,CDX2与β-catenin基本相同,两者均与反映肿瘤负荷的指标如初诊时白细胞数、LDH水平呈正相关,而与性别、年龄、骨髓幼稚细胞比例无显著性相关。在基因表达与AML疗效方面,CDX2基因表达阳性与否对首疗程CR率无显著影响。CDX2与β-catenin表达的动态变化均可反映疾病进程,当患者获得CR时,CDX2表达转阴、β-catenin下降至正常水平,复发时CDX2、β-catenin表达再次增高。CDX2与β-catenin基因在AML中的临床意义、不同病程表达变化基本一致,这也从另一个方面反映了CDX2与β-catenin之间存在相关性。两者之间究竟是怎样一种联系呢?查阅文献发现,在爪蟾胚胎和结肠腺癌细胞,Wnt/β-catenin信号通路调控CDX2表达[15-16],AML细胞中CDX2基因表达上调是否是由Wnt/β-catenin异常激活引起的是我们下一步要研究的重点。
另外,绝大部分AML患者表达CDX2基因,且CDX2表达在各亚型间无显著差异,提示CDX2基因有可能成为广谱的白血病标志物。正常人和非恶性血液病患者不表达CDX2基因,CDX2基因仅在白血病细胞表达,且其表达水平与肿瘤负荷密切相关,并随疾病病程呈动态变化,提示CDX2基因有可能成为监测白血病微小残留的指标之一,但尚需扩大标本量、定期检测CDX2表达(如每隔3个月)、延长跟踪时间进一步观察。
| [1] | Werling RW, Yaziji H, Bacchi CE, et al. CDX2, a highly sensitive and specific marker of adenocarcinomas of intestinal origin: an immunohistochemical survey of 476 primary and metastatic carcinomas[J]. Am J Surg Pathol,2003, 27 (3) : 303-10. DOI: 10.1097/00000478-200303000-00003. |
| [2] | Hinoi T, Tani M, Lucas PC, et al. Loss of CDX2 expression and microsatellite instability are prominent features of large cell minimally differentiated carcinomas of the colon[J]. Am J Pathol,2001, 159 (6) : 2239-48. DOI: 10.1016/S0002-9440(10)63074-X. |
| [3] | Thoene S, Rawat VP, Heilmeier B, et al. The homeobox gene CDX2 is aberrantly expressed and associated with an inferior prognosis in patients with acute lymphoblastic leukemia[J]. Leukemia,2009, 23 (4) : 649-55. DOI: 10.1038/leu.2008.355. |
| [4] | Scholl C, Bansal D, Döhner K, et al. The homeobox gene CDX2 is aberrantly expressed in most cases of acute myeloid leukemia and promotes leukemogenesis[J]. J Clin Invest,2007, 117 (4) : 1037-48. DOI: 10.1172/JCI30182. |
| [5] | Rawat VP, Thoene S, Naidu VM, et al. Overexpression of CDX2 perturbs HOX gene expression in murine progenitors depending on its N-terminal domain and is closely correlated with deregulated HOX gene expression in human acute myeloid leukemia[J]. Blood,2008, 111 (1) : 309-19. DOI: 10.1182/blood-2007-04-085407. |
| [6] | Smith K, Bui TD, Poulsom R, et al. Up-regulation of macrophage wnt gene expression in adenoma-carcinoma progression of human colorectal cancer[J]. Br J Cancer,1999, 81 (3) : 496-502. DOI: 10.1038/sj.bjc.6690721. |
| [7] | Simon M, Grandage VL, Linch DC, et al. Constitutive activation of the Wnt/beta-catenin signalling pathway in acute myeloid leukaemia[J]. Oncogene,2005, 24 (14) : 2410-20. DOI: 10.1038/sj.onc.1208431. |
| [8] | Chung EJ, Hwang SG, Nguyen P, et al. Regulation of leukemic cell adhesion, proliferation, and survival by beta-catenin[J]. Blood,2002, 100 (3) : 982-90. DOI: 10.1182/blood.V100.3.982. |
| [9] | Ysebaert L, Chicanne G, Demur C, et al. Expression of beta-catenin by acute myeloid leukemia cells predicts enhanced clonogenic capacities and poor prognosis[J]. Leukemia,2006, 20 (7) : 1211-6. DOI: 10.1038/sj.leu.2404239. |
| [10] | James R, Erler T, Kazenwadel J. Structure of the murine homeobox gene cdx-2. Expression in embryonic and adult intestinal epithelium[J]. J Biol Chem,1994, 269 (21) : 15229-37. |
| [11] | Bonhomme C, Duluc I, Martin E, et al. The Cdx2 homeobox gene has a tumour suppressor function in the distal colon in addition to a homeotic role during gut development[J]. Gut,2003, 52 (10) : 1465-71. DOI: 10.1136/gut.52.10.1465. |
| [12] | Renouf B, Soret C, Saandi T, et al. Cdx2 homeoprotein inhibits non-homologous end joining in colon cancer but not in leukemia cells[J]. Nucleic Acids Res,2012, 40 (8) : 3456-69. DOI: 10.1093/nar/gkr1242. |
| [13] | Faber K, Bullinger L, Ragu C, et al. CDX2-driven leukemogenesis involves KLF4 repression and deregulated PPARγ signaling[J]. J Clin Invest,2013, 123 (1) : 299-314. DOI: 10.1172/JCI64745. |
| [14] | 黎国伟, 王东宁, 叶玉蝶, 等. 急性髓细胞白血病CDX2基因表达及临床意义的探讨[J]. 中华肿瘤防治杂志,2009, 16 (16) : 1253-5. |
| [15] | Keenan ID, Sharrard RM, Isaacs HV. FGF signal transduction and the regulation of Cdx gene expression[J]. Dev Biol,2006, 299 (2) : 478-88. DOI: 10.1016/j.ydbio.2006.08.040. |
| [16] | Blache P, Van De Wetering M, Duluc I, et al. SOX9 is an intestine crypt transcription factor, is regulated by the Wnt pathway, and represses the CDX2 and MUC2 genes[J]. J Cell Biol,2004, 166 (1) : 37-47. DOI: 10.1083/jcb.200311021. |
 2015, Vol. 35
2015, Vol. 35
