人雄激素非依赖性前列腺癌(androgenindependent prostate cancer, AIPC)药物治疗效果差,对放疗、化疗不敏感,中位存活时间短,寻找积极有效的分子靶向治疗手段是目前研究的一个重点。近年来发现,除B淋巴细胞可分泌免疫球蛋白外,多种上皮来源的肿瘤组织、传代细胞系及部分上皮细胞均存在Ig的表达[1]。癌细胞源性Ig的研究是一个新兴领域,许多问题的探索刚刚起步。PC3是研究AIPC常用的细胞株,我们前期的工作证实体外培养的前列腺癌PC3细胞表达有IgG,干扰IgG表达可致细胞生长抑制[2]。本研究旨在通过RNA干扰技术下调PC3细胞株IgG的表达水平,观察PC3细胞对放射敏感性的变化,为进一步探索癌源性Ig的生物特性、寻觅新的治疗靶点提供理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞株与细胞培养人前列腺癌细胞PC3由广州莱德尔生物科技有限公司提供,用含100 mg/L青链霉素、0.3 mg/L谷氨酰胺、体积分数为10%胎牛血清的RPMI 1640培养基,培养于37 ℃、5% CO2条件下的恒温恒湿培养箱中,取对数生长期细胞进行实验。
1.1.2 质粒和主要试剂FCGR1AshRNA由莱德尔生物科技有限公司克隆组提供,(正向)5'CUACACAUC AGCAGGAAUAdTdT3';(反向)3'dTDTGAUGUGUA GUCGUCCUUAU5'。胎牛血清、RPMI 1640培养基购自Hyclone;逆转录试剂盒、Trizol RNA分离试剂、Lipofectamine 2000为Invitrogen产品;BCA法蛋白含量检测试剂盒由南京凯基生物发展有限公司提供;Annexin V-FITC细胞凋亡检测试剂盒购自Keygen。
1.1.3 实验仪器苏州安泰洁净工作台(SW-CJ-IFD)、细胞恒温培养箱及multiscan MK3酶标仪(Thermo Fisher Scientific)、流式细胞仪(BD calibur)、紫外分光光度计(Beckman Du640)等。
1.2 方法 1.2.1 细胞转染实验分为3组空白对照组,阴性质粒对照组(NCshRNA组),实验组(FCGR1AshRNA组)。转染前1 d对细胞株进行传代,将PC3细胞接种于6孔板(5.0×105个/孔)、96孔板(1.0×104个/孔),待细胞生长密度为70%~80%时转染。转染过程按LipofectamineTM 2000转染试剂盒说明书进行,Opti-MEMI分别稀释质粒和脂质体后混合,室温下孵育20 min;吸尽原培养液,实验组及阴性对照组加入混合物,空白对照组以Opti-MEMI代替,有效质粒与脂质体的比例为1:2.5(m :v)。孵育4~6 h后换为10%胎牛血清的RPMI 1640培养基。24 h后收样进行基因水平检测,48 h后收样进行蛋白水平检测。
1.2.2 Q-PCR检测干扰效率按试剂说明完成RNA的抽提纯化和cDNA的合成。反应条件:95 ℃ 5 min;40个循环(95 ℃,15 s;60 ℃,15 s;72 ℃,32 s)。重复3次。目的片段:IgG-150 bp;内参片段:18SrRNA-112 bp。IgG上游引物5'-GCAGCCGGAGAACAACTACA-3',下游引物5'-TGGTTGTGCAGAGCCTCATG-3';18SrRNA上游引物5'-CCTGGATACCGCAGCTAG GA-3',下游引物5'-GCGGCGCAATACGAATGCCC C-3'。
1.2.2 Western blot检测蛋白表达收集3组细胞,经预冷的PBS清洗3遍,置于冰上经RIPA充分裂解,收集细胞碎片及裂解液后于4 ℃下14 000 r/min离心5 min,上清-80 ℃保存;取部分上清加入上样buffer,煮沸10 min,缓慢恢复室温后稍离心,放于-20 ℃保存。用BCA蛋白定量试剂盒测定各组蛋白浓度;加入上样缓冲液煮沸变性后,SDS-PAGE电泳;转膜,5%脱脂奶粉溶液室温封闭1 h,TBST洗膜5 min、反复3次,加入一抗37 ℃孵育2 h,TBST洗3次,二抗37 ℃孵育1 h,先后分别以TBST和蒸馏水洗膜3次,加入发光液,暗室中曝光成像。
1.2.4 放射线照射采用Varian CD2300 6 MeV电子直线加速器照射3组细胞,每组分别给予0,2,4,6,8,10 Gy单剂量照射,置于培养箱中继续培养,分别于照射后的12、24、48 h进行检测。
1.2.5 MTS法检测细胞增殖收集不同时间点的各组细胞,消化后吹打散、计数,调整细胞浓度为1×105/ml,接种于96孔板,每孔100 μl。向每孔加入MTS溶液20 μl,再孵育4 h后,在multiscan MK3酶标仪上选择490 nm波长测定各孔吸光度(A)值,比较各组细胞增殖活性。增殖率=其它时间点OD值/0 h OD值×100%(同一样品);抑制率=(1-实验组OD值/对照组OD值)×100%(同一时间);实验重复3次。
1.2.6 流式细胞术检测细胞凋亡将各组细胞消化,收获,调整待测细胞密度大约为1×106/ml。取0.5 ml细胞悬液,加入1.25 μl Annexin V-FIFC,室温避光反应15 min,1000×g离心5 min,弃上清;加入0.5 ml预冷的PBS,轻轻震荡使细胞悬浮;加入10 μl Propidium lodide,样本置于冰上避光保存。用BD calibur流式细胞仪进行检测,实验重复3次。
1.2.7 统计学分析应用SPSS13.0统计软件进行相关数据分析,计量资料以均数±标准差表示,组间数据采用单因素方差分析,以P < 0.05为差异有统计意义。
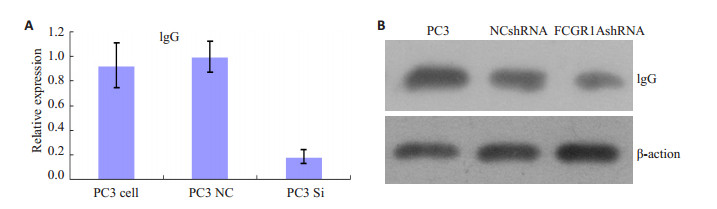
2 结果 2.1 siRNA显著抑制PC3细胞IgG的表达Q-PCR检测RNA干扰后PC3细胞IgGHG1mRNA水平见图 1A,siRNA转染组相对表达量(0.12±0.03)与阴性对照组(0.62±0.08)和空白对照组(0.57±0.11)相比明显减少(P < 0.01)。IgG蛋白水平如图 1B,空白组(2.7±0.13)与阴性对照组(2.43±0.12)相比无显著性差异(P>0.05),均明显大于siRNA转染组(1.42±0.11,P < 0.05)。提示转染siRNA后,空白组和阴性对照组IgG表达量无明显变化,siRNA干扰组IgG表达受到抑制。
|
图 1 空白组、阴性对照组、RNA干扰组PC3细胞IgG mRNA及蛋白的表达 Figure 1 IgGHG1 mRNA (A) and protein (B) expression in blank control group, negative control group and siRNA group. |
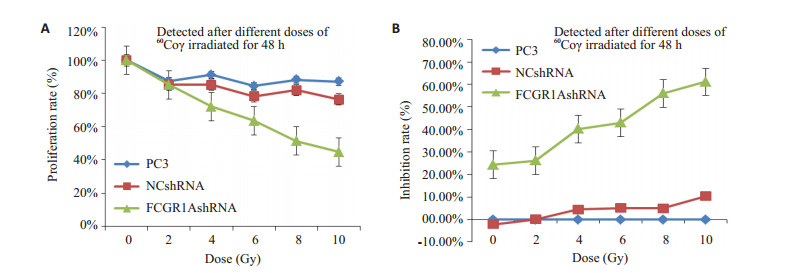
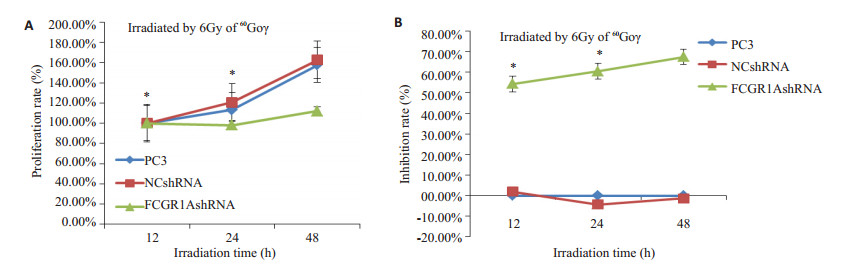
3组PC3细胞在不同照射剂量下48 h后的增殖率、抑制率如图 2所示,提示不同剂量60Co γ射线照射3组细胞48 h后,空白组和阴性对照组敏感性无明显差异(P>0.05),RNA干扰组对射线的敏感性增强(P < 0.05)。6 Gy射线照射后的12、24、48 h MTS检测,显示随时间延长,空白组和阴性对照组增殖率增加,生长无明显抑制(P>0.05);干扰组增殖减缓、生长明显受到抑制(P < 0.05,图 3)。表明RNA干扰PC3细胞表达IgG后,在不同放射剂量条件下的同一时间点及同一放射剂量下的不同时间点,实验组PC3细胞的增殖均受到明显抑制。
|
图 2 不同剂量60Co γ照射48 h后3组细胞的增殖率及生长抑制率 Figure 2 Proliferation rate and growth suppression rate of the 3 groups of cells at 48 h after 60Co γ ray radiation at different doses. A: Proliferation rate (%); B: Inhibition rate (%). |
|
图 3 6Gy 60Co γ射线照射后12、24、48 h后3组细胞的增殖率及生长抑制率 Figure 3 Proliferation rate and growth suppression rate in the 3 groups of cells at 12, 24 and 48 h after exposure to 6 Gy 60Co γ ray. P < 0.05. A: Proliferation rate (%); B: Inhibition rate (%) Compared with control group, *P < 0.05. |
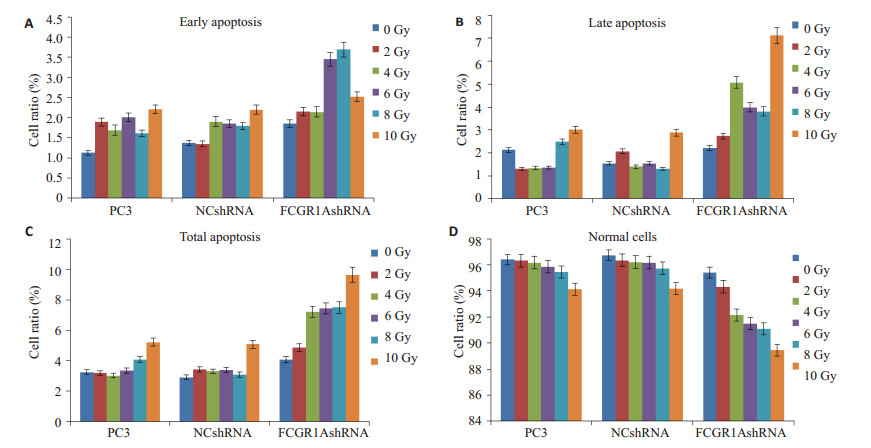
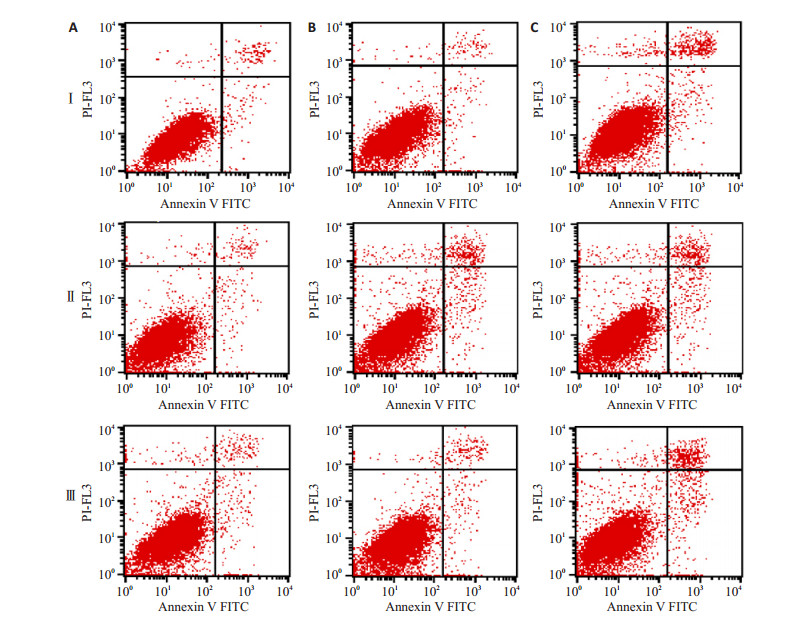
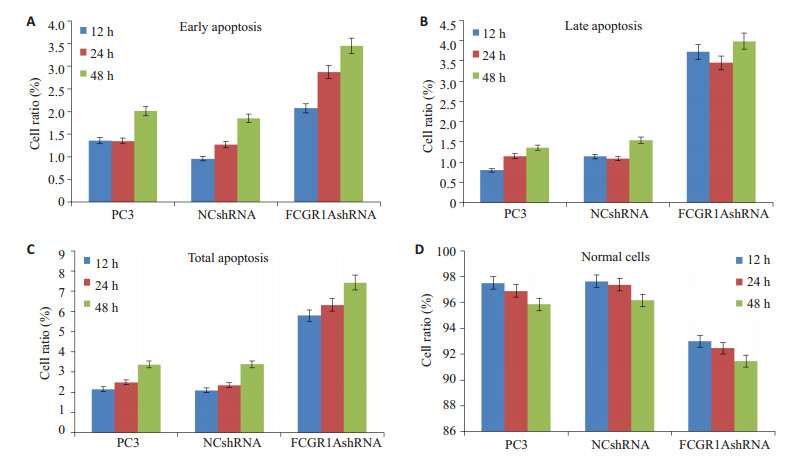
流式凋亡检测到经0、2、4、6、8、10 Gy放射线处理后48 h,空白组、阴性对照组正常细胞比例无明显变化(P>0.05),FCGR1AshRNA组正常细胞比例随射线量增加而明显下降(P < 0.05);与空白组和阴性对照组相比,不同剂量条件下,FCGR1AshRNA组的早期凋亡、晚期凋亡与总凋亡细胞比例均明显增加(P < 0.05,图 4)。3组细胞6Gy射线照射后12、24、48 h后流式细胞检测(图 5),FCGR1AshRNA组在3个时间点的正常细胞比例均显著低于空白组和阴性对照组(P < 0.05),早期凋亡、晚期凋亡与总凋亡细胞比例均高于空白组和阴性对照组(P < 0.05,图 6)。提示与空白组和阴性对照组相比,干扰PC3细胞表达IgG后,其接受放射线照射后的凋亡比例,在同一时间点随接受的射线量的增加而增长,在同样剂量条件下随时间的延长而增加。
|
图 4 不同剂量60Co γ照射48 h后3组细胞的凋亡比率 Figure 4 Apoptosis rates of the 3 groups of cells 48 h later after 60Co γ ray radiation at different doses. Early apoptotic rates (A), late apoptotic rates (B) and total apoptotic rates (C) and nomal cells (D) were significantly higher in the siRNA group (P < 0.05), significantly decreased in the siRNA group (P < 0.05). |
|
图 5 流式细胞仪检测6Gy 60Co γ射线照射后12、24、48 h后3组细胞凋亡率变化 Figure 5 Apoptotic rates of the cells at 12 (Ⅰ), 24 (Ⅱ) and 48 h (Ⅲ) after exposure to 6Gy 60Co γ ray assayed by flow cytometry. A: Blank control group; B: Negative control group; C: siRNA group. |
|
图 6 6Gy 60Co γ射线照射12、24、48 h后3组细胞的凋亡比率 Figure 6 Apoptosis rates of the cells at 12 h, 24 and 48 h after exposure to 6 Gy 60Co γ ray.Early apoptotic rates (A), late apoptotic rates (B) and total apoptotic rates (C) were significantly higher in the siRNA group (P < 0.05), and nomal cells (D) significantly decreased in the siRNA group (P < 0.05). |
鉴于AIPC中位存活时间短、死亡率高、对药物、放射治疗均不敏感,分子靶向与放射增敏研究是当前相关肿瘤治疗学的一个热点问题。放射增敏研究旨在发现提高癌细胞、尤其是放射抗拒的癌细胞对电离辐射内在敏感性的作用物。业已发现靶向抑制血管内皮生长因子、酪氨酸激酶及内皮素受体等均有部分抗AIPC的作用;然而前列腺癌(prostate cancer, PCa)成因及转化的复杂性,提示相关靶向治疗手段多途径、多通道、多靶点的特性。癌细胞源性Ig的研究是一个新兴领域,许多问题的探索刚刚起步,业已发现不少癌细胞合成的Ig对其自身的存活具有促进作用[3-5]。目前涉及到PCa相关Ig的研究相对偏少,Beneduce与Golda等[6-7]注意到PCa患者血清IgG、IgA或IgM抗体的浓度通常升高;Chen等[8]发现PCa细胞株表达的IgG与正常人的IgG大小相当,并存于胞质内与胞膜上,但以胞质内为主。我们前期的工作证实,干扰人PCa细胞IgG表达可以抑制细胞生长、加速细胞凋亡[2]。
本实验以免疫球蛋白G的Fc段受体Ⅰ(FCGR1A)为靶点,采用靶向FCGR1A-shRNA的表达载体,应用RNA干扰技术,探讨体外环境下从基因水平抑制IgG表达后人前列腺癌PC3细胞株放射敏感性的变化。shRNA是相对较为稳定表达的siRNA,由一茎环(loop)序列自中间分隔两个短反向重复序列。实验发现,将FCGR1AshRNA干扰质粒转染入PC3细胞后,经Q-PCR检测,可见IgG mRNA的表达量较空白组和阴性质粒对照组明显减少(P < 0.05);Western-blot检测到正常及转染阴性对照质粒的PC3细胞的IgG表达量无明显差异,RNA干扰组IgG的表达量降低(P < 0.05)。提示靶向RNA干扰达到了预期目的,同时抑制了IgG基因mRNA和蛋白的表达。
关于癌源性IgG可以促进相应肿瘤细胞增殖、抑制凋亡与增加侵袭能力,已在食管癌[4]、甲状腺癌[5]、膀胱癌[9]、肺癌[10]、乳腺癌[11]等的研究中得到证实,尚未发现关于癌细胞自主分泌的Ig对细胞本身放射敏感性影响的报告。为研究抑制IgG基因的表达对PC3细胞放射敏感性的影响,本实验以不同剂量的60Co γ射线单次照射空白组、阴性质粒对照组及FCGR1A-shRNA干扰组PC3细胞,采用MTS法和流式细胞术于照射后的12、24、48 h检测3组细胞的增殖和凋亡情况,发现不同实验剂量射线照射后同一时间点,以及同等剂量放射线照射后的不同时间点,FCGR1AshRNA组PC3细胞增殖受抑制、凋亡增加、正常细胞比例减少,与阴性对照组及空白质粒组相比差异显著(P < 0.05)。提示IgG基因在人前列腺癌PC3细胞株中可能发挥放射抵抗的作用,沉默该基因可增加PC3细胞对放射线的内在敏感性。
PCa放射抵抗的研究一直是相关领域的热点,众多的学者从不同的方向和侧重点对此作了有益的探索:Cheng等[12]发现抑制酸性酰胺酶(AC)基因的过表达可以增加PCa的放射敏感性,减缓PCa生长速度;Mahajan等[13]发现活化的Cdc42酪氨酸激酶1(ACK1)介导的雄激素受体(AR)酪氨酸磷酸化促进了激素抵抗型PCa的生长,抑制ACK1/AR通路增加了PCa的放射敏感性;Holley等[14]发现RelB蛋白通过刺激前列腺癌细胞表达锰超氧化物歧化酶(Mn-SOD),参与前列腺放疗抵抗性的产生,抑制RelB基因可以增加AIPC的放射敏感性;而Kong等[15]发现肿瘤抑制基因DAB2IP可以增加PC3细胞的放射敏感性,下调DAB2IP基因的表达会增加PC3的放射抵抗性,提示针对DAB2IP表达正常PCa患者的放射治疗效果较为确切。诸多研究提醒我们,PCa放射抵抗的维持可能是多因素、多靶点联合作用的结果,我们发现的癌源性IgG对PC3放射抵抗的正性维持作用可能只是其中的部分环节;抑或现有的研究都只是冰山一角,尚需要一个总体的探索与整合,以达到整体解释的目的。
总之,本研究结果表明PC3细胞自主合成的IgG对其放射抵抗能力具有维持作用,抑制IgG表达可以增加PC3细胞的放射敏感性,这为AIPC甚至其他恶性肿瘤的分子靶向联合放射治疗提供了新的思路。
| [1] | Hu D, Duan Z, Li M, et al. Heterogeneity of aberrantimm-unoglobulin expression in cancer cells[J]. Cell Mol Immunol,2011, 8 : 479-85. DOI: 10.1038/cmi.2011.25. |
| [2] | Pan B, Zheng SB, Liu CX, et al. Suppression of IGHG1 gene expression by siRNA leads to growth inhibition and apoptosis induction in human prostate cancer cell[J]. Mol Biol Rep,2013, 40 (1) : 27-33. DOI: 10.1007/s11033-012-1944-x. |
| [3] | Ma C, Wang Y, Zhang G, et al. Immunoglobulin G expression and its potential role in primary and metastatic breast cancers[J]. Curr Mol Med,2013, 13 (3) : 429-37. |
| [4] | Zhang LY, Hu SP, Korteweg C, et al. Expression of immunoglobulin G in esophageal squamous cell carcinomas and its association with tumor grade and Ki67[J]. Hum Pathol,2012, 43 (3) : 423-34. DOI: 10.1016/j.humpath.2011.05.020. |
| [5] | Qiu YM, Korteweg C, Chen ZS, et al. Immunoglobulin G expression and its colocalization with complement proteins in papillary thyroid cancer[J]. Mod Pathol,2012, 25 (1) : 36-45. DOI: 10.1038/modpathol.2011.139. |
| [6] | Beneduce L, Prayer-Galetti T, Giustinian AM, et al. Detection of prostate-specific antigencoupled to immunoglobulin M in prostate cancer patients[J]. Cancer Detect Prev,2007, 31 : 402-7. DOI: 10.1016/j.cdp.2007.10.005. |
| [7] | Golda R, Wolski Z, Wyszomirska-Golda M, et al. The presence and structure of circulating immune complexes in patients with prostate tumors[J]. Med Sci Monit,2004, 10 (3) : CR123-7. |
| [8] | Chen Z, Gu J.. Immunoglobulin G expression in carcinomas and cancer cell lines[J]. FASEB J,2007, 21 (11) : 2931-2938. DOI: 10.1096/fj.07-8073com. |
| [9] | Liang PY, Li HY, Zhou ZY, et al. Over expression of immunoglobulin G prompts cell proliferation and inhibits cell apoptosis in human urothelial carcinoma[J]. Tumour Biol,2013, 34 (3) : 1783-91. DOI: 10.1007/s13277-013-0717-z. |
| [10] | Jiang CF, Huang T, Wang Y, et al. Immunoglobulin G expression in lung cancer and its effects on metastasis[J]. PLoS One,2014, 9 (5) : e97359. DOI: 10.1371/journal.pone.0097359. |
| [11] | Ma C, Wang Y, Zhang G, et al. Immunoglobulin G expression and its potential role in primary and metastatic breast cancers[J]. Curr Mol Med,2013, 13 (3) : 429-37. |
| [12] | Cheng JC, Bai AP, Beckham TH, et al. Radiation-induced acid ceramidase confers prostate cancer resistance and tumor relapse[J]. J Clin Invest,2013, 123 (10) : 4344-58. DOI: 10.1172/JCI64791. |
| [13] | Mahajan K, Coppola D, Rawal B, et al. Ack1-mediated androgen receptor phosphorylation modulates radiation resistance in castration-resistant prostate cancer[J]. J Biol Chem,2012, 287 (26) : 22112-22. DOI: 10.1074/jbc.M112.357384. |
| [14] | Holley AK, Xu Y, St Clair DK, et al. RelB regulates Manganese superoxide dismutase gene and resistance to ionizing radiation of prostate cancer cells[J]. Ann NY Acad Sci,2010, 12 (1) : 129-36. |
| [15] | Kong ZL, Xie DX, Boike T, et al. Downregulation of human DAB2IP gene expression in prostate cancer cells results in resistance to ionizing radiation[J]. Cancer Res,2010, 70 (7) : 2829-39. DOI: 10.1158/0008-5472.CAN-09-2919. |
 2015, Vol. 35
2015, Vol. 35