肾细胞癌是起源于肾实质泌尿小管上皮系统的恶性肿瘤,又称肾癌,占成人恶性肿瘤的2%~3%,占肾脏恶性肿瘤的80%~90%,在泌尿外科肿瘤中,仅次于膀胱癌。男女患者发病率比例约为1.83:1;城市地区是农村地区发病率的4.31倍,发病年龄可见于各个年龄段,高发年龄50~70岁。肾透明细胞癌是肾癌中最常见的一种分型,约占89.6% [1]。肾透明细胞癌的主要治疗方式为手术治疗,多对放化疗均不敏感,近年来用于临床的靶向药物疗效有限,缺乏有效的肿瘤标记物用于早期诊断,其发生发展的机制尚未完全明确[2]。因此,寻找一个有效的生物标记物用于临床早期诊断,风险评估,预后评估等十分必要。近年来对microRNA(miRNA)的研究越来越深入,许多研究表明miRNA在细胞发育、代谢、细胞衰老及死亡等重大事件中有着重要的作用。过去十几年的研究发现大量的miRNA介导肿瘤的发生和发展,譬如miR146a可能抑制结肠癌细胞的增殖,miR216-a在胰腺癌的发生发展中可能起着重要作用等[3-4]。所以挖掘miRNA和肾透明细胞癌的关系有重要意义。
成熟的miRNA是不编码蛋白的单链小RNA,通常由22个左右的碱基组成,通过完全或不完全地结合靶基因的mRNA3'UTR(3'端非编码区),从而抑制靶基因的翻译或使mRNA降解,属于转录后调控机制的重要组成部分。miRNA成熟过程较为复杂,由基因转录生成的pri-miRNA在Drosha酶的作用下生成pre-miRNA,经核孔复合体到达细胞质,在Dicer酶的作用下形成成熟的miRNA并加入RISC复合物,发挥其生物学作用[5]。
查阅文献发现miR-223在免疫系统中有着突出作用,和炎症、感染及肿瘤的关系密切[6]。已报道的miR-223和乳腺癌、食管癌、和肝细胞癌等有着密切关系[7-9],但在肾透明细胞癌中的表达情况及机制还不明确。因此,我们将研究miR-223在肾透明细胞癌中的表达及功能,探索其在临床中的作用。
1 材料与方法 1.1 肿瘤组织与瘤旁组织收集2013年1月~2013年12月在解放军总医院行肾癌根治术的肾癌患者的肾透明细胞癌临床组织标本及其正常瘤旁组织46例,毗邻瘤旁组织距肿瘤至少5 cm,标本摘取获得病人知情同意,并经过严格病理科标本验证和伦理委员会的批准。
1.2 细胞培养及转染人源肾透明细胞癌786-O、Caki-1、Sn12-pm6、ACHN细胞系及正常人近段肾小管上皮细胞系HKC均购买于协和细胞库,用含10%胎牛血清的PRMI 1640或DMEM培养基培养,37 ℃,5% CO2培养,待细胞状态良好时用于功能研究。miR-223的模拟物和对照物购买于上海吉玛公司,使用invitrogen公司的lipo2000转染试剂,miR-223终浓度为50 nmol/L,6 h后使用普通培养基换液,规定时间收细胞。
1.3 RNA提取及逆转根据康为CW0581 RNA提取试剂盒说明书,提取肿瘤组织及瘤旁组织及细胞系的总RNA,并使用Thermo NANO DROP1000紫外分光光度计测量其浓度。取100 ng总RNA,Stem-loop RT引物0.5 μl,天根逆转录试剂5 × First-strand Buffer 2 μl,TIANScript M-MLV 0.25 μl,dNTP混合物0.25 μl,Takara RNA酶抑制剂0.25 μl,DEPC水补足10 μl体系,按以下程序逆转:16 ℃×30 min;42 ℃×45 min;85 ℃×5 min。
1.4 real-time RT-PCR采用MaximaTM SYBR Green/ROX qPCR Master Mix(2X)的染料法在ABI 7500平台上开展荧光定量PCR,试剂为transgene AQ131-03试剂盒,按以下体系:mix 10 μl,50×ROX DYE II 0.4 μl,无菌去离子水7.6 μl,引物1 μl,底物模板1 μl,按以下扩增程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,循环重复第2,3步,共40~45次,第3步采集信号,引物第1次使用时,增加融解曲线,检测引物的特异性,溶解曲线程序:95 ℃ 60 s,55 ℃ 10 s,55 ℃10 s。循环重复第3步,每次循环时温度+0.5 ℃,共81次,第3步采集信号。每组实验设置3个复孔。
1.5 transwell迁移实验将转染后48 h的细胞用无血清培养基重悬,取100 μl细胞悬液用无血清培养基稀释10倍,载玻片细胞计数,取细胞悬液加入transwell小室(细胞数约1×106),24孔板下室加入5% FBS培养基,培养6 h后用棉签取出上室的细胞,风干20 min,用结晶紫染色20 min,水洗3遍,显微镜下取5个视野拍照计数。以转染模拟物的786-O为实验组,NC序列及空白组为阴性对照组,该实验重复3次。
1.6 体外划痕愈合实验用无菌100 μl枪头在长满细胞的6孔板垂直划痕,PBS洗细胞3次,去除划痕脱落的细胞,加入[5]无血清培养基,37 ℃,5% CO2培养箱培养培养,在0,8,24,32 h显微镜下拍照。以转染模拟物的786-O为实验组,NC序列及空白组为阴性对照组,该实验重复3次。
1.7 细胞增殖实验将转染miR-223模拟物和NC对照组以及空细胞均匀的铺在96孔版,计数每孔约1×104个细胞,设定3个复空,用MTS发分别在0,24,48,72,96 h测定细胞数量。
1.8 细胞周期实验按照BD公司Cycle TEST PLUS DNA Reagent kit说明书,用FACSC Calibur流失细胞分析测细胞周期,该实验重复3次。
1.9 统计学处理采用SPSS19.0对数据进行统计,数据以均数±标准差表示,以P < 0.05为差异有统计学意义。
2 结果 2.1 miR-223在肿瘤组织中高表达为检测miR-223在组织中的表达情况,我们测量了46例肾透明细胞癌组织及其毗邻瘤旁组织中的miR-223的表达量,以U6作为内参,结果显示瘤旁组织miR-223相对表达量为0.014±0.002,肾透明细胞癌组织的miR-223相对表达量为0.094±0.020(P=0.0003),miR-223在肾透明细胞癌中表达量较瘤旁组织高。
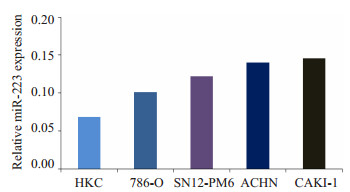
2.2 mir-223在肾透明细胞癌细胞系中高表达为检测miR-223在肾透明细胞癌细胞系中的表达情况,我们选取了四珠肾透明细胞癌的细胞系及正常肾小管上皮细胞HKC,以U6作为内参,用real-timeRTPCR法测定了五种细胞系中miR-223的相对表达量。结果显示Caki-1及ACHN细胞系中miR-223的相对表达量高于786-O及Sn12-pm6细胞系,正常人近段肾小管上皮细胞系HKC中miR-223相对表达量最低,表明miR-223在肾透明细胞癌细胞系中的表达量高于正常肾小管上皮细胞,并且转移性肾透明细胞癌细胞中高于非转移的肾透明细胞癌细胞(图 1)。
|
图 1 miR-223在细胞中的相对表达量 Figure 1 Relative expression of miR-223 in different cell lines. |
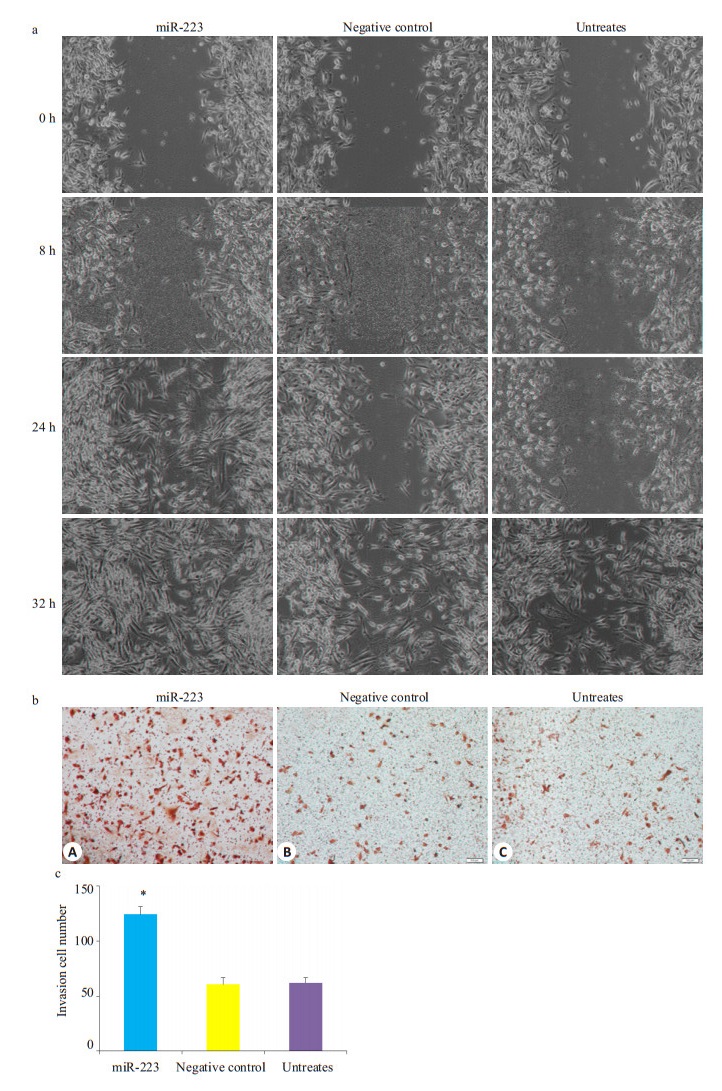
为研究miR-223对肿瘤迁移能力的影响,用瞬时转染miR-223模拟物的786-O细胞为实验组,转染NC的786-O细胞以及空白对照为阴性对照组,体外划痕实验及transwell迁移实验测定其迁移能力。发现转染miR-223模拟物的786-O细胞组迁移能力明显快于阴性对照组,miR-223有促进,肿瘤细胞迁移的作用(P < 0.0001,图 2)。
|
图 2 miR-223能促进786-O细胞的迁移 Figure 2 miR-223 enhanced the migration of 786-O cells. A: The wound closure was photographed at different time points (0、8、24、32 h after scraping). In 786-O cells miR-223 over-expressing significantly increased a number of viable cells. B: 786-O cells transfected with miR-223 gained more invasion capacity than cells transfected with negative control (NC) or nothing.C: The number of invasive cells in three groups are shown in bars. Data are presented as the Mean±SD. *P < 0.05. |
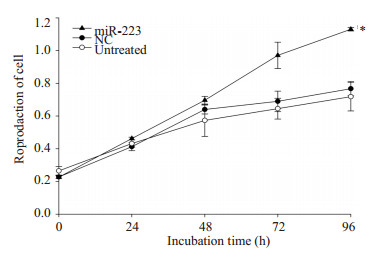
为了分析miR-223对肾透明细胞癌增殖作用的影响,以转染miR-223模拟物的786-O细胞为实验组,NC模拟物的786-O细胞以及未经过处理的786-O细胞为对照组,用MTS法测定细胞增殖情况,发现过表达miR-223能促进细胞增殖(P=0.006,图 3)。
|
图 3 miR-223显著促进786-O细胞增殖 Figure 3 miR-223 significantly enhanced the proliferation of 786-O cells. |
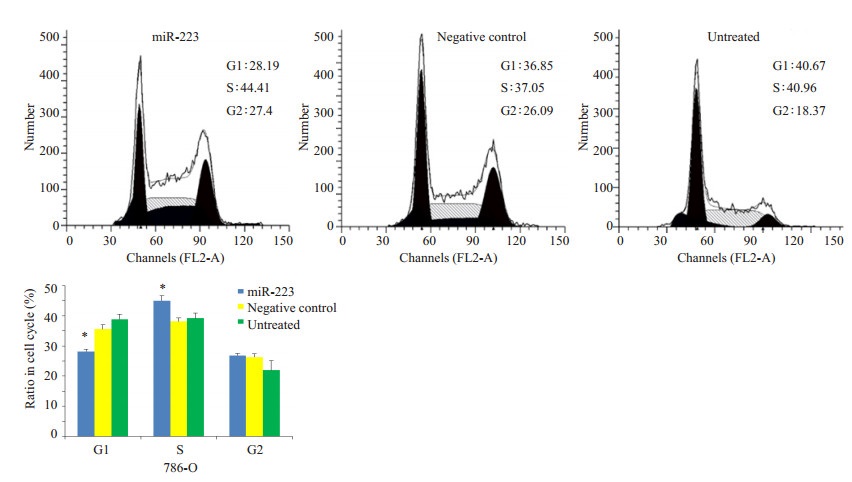
为了分析miR-223对肾透明细胞癌细胞周期的影响,用流式细胞仪分析转染miR-223模拟物的786-O细胞,NC模拟物的786-O细胞以及未经过处理的786-O细胞,结果显示转染miR-223模拟物的实验组相对于对照组而言,G1期细胞数较少,S期细胞数增加,显示其处于增殖期细胞多于对照组(P < 0.05,图 4)。
|
图 4 miR-223对786-O细胞周期的影响 Figure 4 Effect of miR-223 on cell cycle of 786-O cells. *P < 0.05 vs control. |
分析了miR-223与46例肾透明细胞癌患者的临床特征的关系,发现miR-223表达量与肿瘤大小有关,肿瘤直径大于4 cm的患者miR-223表达量高于肿瘤直径小于4 cm的患者(P=0.0028,表 1)。
| 表 1 46例肾透明细胞癌患者部分临床特征 Table 1 Clinical characteristics of the 46 ccRcc patients |
肾透明细胞癌是肾癌中最常见的一种分型,约占89.6%。肾透明细胞癌的主要治疗方式为手术治疗,多对放化疗均不敏感,近年来用于临床的靶向药物疗效有限,缺乏有效的肿瘤标记物用于早期诊断,目前肾透明细胞癌的诊断和治疗有一定的局限性。过去十年的研究显示多数miRNA在肾癌中的表达上调或者下调。这种miRNA的异常调节导致的细胞效应是多种多样的,常常导致肾癌的一些典型特征。如在缺氧诱导机制中,miR-17-5P和miR-224共同作用于缺氧诱导因子1α(HIF1α)和Von Hippel-Landau(VHL),引起这两个在肾癌发生中起关键作用的基因沉默,研究显示,在所有肾癌患者中,VHL缺失接近70% [10]。有学者发现miR-199a在肾癌中表达下调,并与原发肿瘤浸润程度、复发及预后不良有关[11]。可见,miRNA和肾癌的发生发展有着密切的关系。我们的研究发现miR-223在肾透明细胞癌组织中呈高表达,也有其他学者发现miR-223在结织肠癌等其他肿瘤中也呈高表达,并有促癌的作用[12]。Fedra Gottardo等学者在早期的膀胱癌芯片中发现了miR-223在膀胱癌组织中比正常膀胱组织中平均上调1.49倍[13]。同时我们发现miR-223在肾透明细胞癌系的细胞中表达也比正常细胞系高,可见miR-223有很重要的促癌作用。一篇关于miRNA在骨髓生物学功能方面的作用的综述中,O'Connell等者也发现了在急性白血病中,miR-223起着促分化的作用[14]。在一些其他肿瘤如胃癌、乳腺癌、胶质瘤等的研究中发现miR-223有着促增殖和促侵袭的作用[12, 15-17],我们的体外功能实验研究也证实miR-223在肾透明细胞癌细胞系中也起着促增殖及促侵袭的作用。我们同时对mir-223在细胞周期方面做了研究,结果表明miR-223能是细胞G1期缩短,S期增长,使处于增殖期的细胞增多,可以推测miR-223有可能通过调控其下游靶基因,进而调控细胞增殖迁移的作用。可见miR-223在肾透明细胞癌中可能起着重要的作用。在比较46例临床病人的临床治疗中我们发现肿瘤直径大于4 cm的患者比小于4 cm的患者miR-223的表达量要高很多。由于所选病人多为临床分期1、2期的患者,我们未对临床分期、病理分级和转移等资料进行分析。这46个病人均为2013年手术病人,肾癌患者5年生存率尚可,所以本研究未对生存分析进行评估。综上所述,miR-223在肾透明细胞癌中可能起着促进肿瘤发生发展的作用,过表达miR-223能促进细胞增殖及迁移等。但是本研究有一定的局限性,此次研究的样本量较少,且不能覆盖全部人体特征,功能实验局限在体外,缺乏体内实验的支持,并且没有对miR-223的下游靶基因做研究。还需要进一步的研究和分析。
| [1] | 那彦群, 叶章群, 孙颖浩, 等. 中国泌尿外科疾病诊断治疗指南[M]. 北京: 人民卫生出版社, 2013 : 3 -4. |
| [2] | Huang QB, Ma X, Zhang X, et al. Down-Regulated miR-30a in clear cell renal cell carcinoma correlated with tumor hematogenous metastasis by targeting Angiogenesis-Specific DLL4[J]. PLoS One,2013, 8 (6) : e67294. DOI: 10.1371/journal.pone.0067294. |
| [3] | 曾长青, 黄良祥, 郑羽, 等. miR-146a在结肠癌中的表达及意义[J]. 南方医科大学学报,2014, 34 (3) : 396-400. |
| [4] | 侯宝华, 简志祥, 崔鹏, 等. miR-216a在胰腺癌组织中的表达及临床意义[J]. 南方医科大学学报,2012 (11) : 1628-31. |
| [5] | Zhang BH, Pan X, Cobb GP, et al. microRNAs as oncogenes and tumor suppressors[J]. Dev Biol,2007, 302 (1) : 1-12. DOI: 10.1016/j.ydbio.2006.08.028. |
| [6] | Haneklaus M, Gerlic M, O'Neill LA, et al. miR-223: infection, inflammation and cancer[J]. J Intern Med,2013, 274 (3) : 215-26. DOI: 10.1111/joim.12099. |
| [7] | Pinatel EM, Orso F, Penna E, et al. miR-223 is a coordinator of breast cancer progression as revealed by bioinformatics predictions[J]. PLoS One,2014, 9 (1) : e84859. DOI: 10.1371/journal.pone.0084859. |
| [8] | Wu C, Li M, Hu C, et al. Clinical significance of serum miR-223, miR-25 and miR-375 in patients with esophageal squamous cell carcinoma[J]. Mol Biol Rep,2014, 41 (3) : 1257-66. DOI: 10.1007/s11033-013-2970-z. |
| [9] | Dong YW, Wang R, Cai QQ, et al. Sulfatide epigenetically regulates miR-223 and promotes the migration of human hepatocellular carcinoma cells[J]. J Hepatol,2014, 60 (4) : 792-801. DOI: 10.1016/j.jhep.2013.12.004. |
| [10] | Ress AL, Gerger A. MicroRNAs in renal cell carcinoma: implications for pathogenesis, diagnosis, prognosis and therapy[J]. Anticancer Res,, 32 (2012) : 3727-32. |
| [11] | 司彤, 刘春晓, 许凯, 等. miR-199a在肾细胞癌中的表达与临床病理特征及预后的关系[J]. 南方医科大学学报,2012, 32 (11) : 1568-71. |
| [12] | Zhang J, Luo X, Li H, et al. MicroRNA-223 functions as an oncogene in human colorectal cancer cells[J]. Oncol Rep,2014, 32 (1) : 115-20. |
| [13] | Gottardo F, Liu CG, Ferracin M, et al. Micro-RNA profiling in kidney and bladder cancers[J]. Urol Oncol,2007, 25 (5) : 387-92. DOI: 10.1016/j.urolonc.2007.01.019. |
| [14] | O'connell RM, Zhao JL, Rao DS. MicroRNA function in myeloid biology[J]. Blood,2011, 118 (11) : 2960-9. DOI: 10.1182/blood-2011-03-291971. |
| [15] | Li JH, Guo Y, Liang XD, et al. MicroRNA-223 functions as an oncogene in human gastric cancer by targeting FBXW7/hCdc4[J]. J Cancer Res Clin Oncol,2012, 138 (5) : 763-74. DOI: 10.1007/s00432-012-1154-x. |
| [16] | Gong B, Hu H, Chen J, et al. Caprin-1 is a novel microRNA-223 target for regulating the proliferation and invasion of human breast cancer cells[J]. Biomed Pharmacother,2013, 67 (7) : 629-36. DOI: 10.1016/j.biopha.2013.06.006. |
| [17] | Huang BS, Luo QZ, Han Y, et al. microRNA-223 promotes the growth and invasion of glioblastoma cells by targeting tumor suppressor PAX6[J]. Oncol Rep,2013, 30 (5) : 2263-9. |
 2016, Vol. 35
2016, Vol. 35
