雌激素是一种能够调节细胞内多种生理过程的信号分子。它可以介导细胞发育,增殖,分化以及在激素依赖疾病的病理进程中扮演着至关重要的角色。雌激素通过其受体--雌激素受体(estrogen receptors, ERs)发挥它的生物学功能[1]。雌激素受体有2种亚型,即:ERα与ERβ。雌激素可以结合并激活这些受体从而使受体体能够在细胞核内结合靶基因启动子上的雌激素反应元件调节靶基因的表达[2]。最近的研究表明ERβ在特定的细胞及组织中不仅定位在细胞核而且也存在于线粒体中,例如人非小细胞肺癌[3],乳腺癌[4],肝癌[5]等。相反,ERα作为核转录因子主要定位在细胞核。近年来,多项研究揭示雌激素可以上调线粒体电子传递链复合物基因的表达促进线粒体的氧化磷酸化[6-7]。此外,线粒体ERβ可能通过调节锰超氧化物歧化酶的表达从而保护线粒体免于氧化应激造成的损伤[8]。然而,ERβ在线粒体的具体功能及其作用的精确分子机制尚未完全阐明。尤其是人非小细胞肺癌中线粒体ERβ保护肿瘤细胞凋亡的作用鲜见报道。
本文利用顺铂与十字孢碱(staurosporine, STS)诱导人非小细胞肺癌细胞系A549及201T的凋亡,探究线粒体ERβ抵抗化疗药物及保护肿瘤细胞凋亡的分子机制。本文发现线粒体ERβ通过与凋亡因子Bad相互作用抑制凋亡蛋白Bax转位到线粒体从而抵抗顺铂与十字孢碱诱导的细胞凋亡。本文为非小细胞肺癌的靶向治疗提供了一个新的治疗靶点。
1 材料与方法 1.1 主要实验材料细胞培养基DMEM购自英国Gibco;顺铂(cisplatin)与十字孢碱(staurosporine, STS)购自美国SIGMA;ERβ及β-actin单克隆抗体购自美国Santa Cruz;COX IV,Bad,Bax,GAPDH,GFP抗体购自美国Cell Signaling Technology;活化型Bax(6A7)抗体购自美国Abcam。GFP-ERβ质粒由Ken-Ichi Matsuda教授馈赠[9]。
1.2 细胞培养与转染A549及201T细胞培养在含10%胎牛血清,50 units/ml青霉素,50 μg/ml链霉素的DMEM的培养皿中,培养环境为5% CO2以及37 ℃。质粒转染使用转染试剂X-tremeGENE HP DNA(购自德国罗氏公司),转染方法参照转染试剂明书的要求操作。将转染完成后的细胞在恒温培养箱内培养48 h,使外源转染的质粒在细胞内充分表达并进行下一步实验。
1.3 免疫荧光为了分析ERβ在细胞内的定位情况,本研究使用免疫荧光技术检测细胞内源ERβ与线粒体的共定位。首先将线粒体荧光探针Mito-Tracker Deeper Red 633(10 nmol/L;购自美国Molecular Probes公司)加入到细胞中并于37 ℃避光孵育30 min。其次,使用3.7%的多聚甲醛将细胞在室温下固定15 min,然后用预冷的PBS清洗3次,接着使用预冷的甲醇-20 ℃通透化10 min,随后使用封闭液(含5% BSA的PBS)将样品在室温下封闭1 h。封闭完成后,加入ERβ及β-actin的抗体并在4 ℃轻轻摇动孵育过夜。一抗孵育完成后,加入羊抗鼠及羊抗兔标记的荧光二抗(购自美国Life Technology公司)并在室温下孵育2 h,最后使用激光共聚焦扫描显微镜进行检测。
1.4 细胞活性分析A549和201T细胞接种于96孔板中,其密度为5× 103个细胞每孔。使用顺铂及STS处理细胞后在不同的时间点进行细胞活性分析。细胞活性分析使用CCK-8试剂盒(购自凯基生物有限公司),试剂使用方法参见试剂使用说明并按照操作执行。使用酶标仪在D450 nm处检测96孔板内细胞的吸光值,此值可以很好的反应出细胞当时的活性状态。
1.5 亚细胞器的分离为了分离细胞核、细胞质与线粒体,本研究使用细胞组分分离试剂盒(购自美国Millipore公司)。A549和201T细胞使用预冷的不含Ca2+,Mg2+的PBS清洗两次并使用500 μl分离裂解液(10 mmol/L Tris, pH 7.5, 10 mmol/L NaCl, 3 mmol/L MgCl2, 0.05% Nonidet P-40, 1 mmol/L EGTA, 1 mmol/L sodium orthovanadate, 50 mmol/L 50 sodium fluoride, 100 μmol/L phenylmethylsulfonyl fluoride, 10 μg/ml leupeptin, 10 μg/ml aprotinin, 5 μg/ml pepstatin A和1 nmol/L okadaic acid)裂解细胞。随后按照分离说明进行操作并获得相应组分后进行Western blotting实验。
1.6 RNA干扰ERβ-shRNA质粒由Steven L. Carroll教授[10]馈赠。使用X-tremeGENE HP DNA试剂将ERβ-shRNA转染进入细胞内。48 h后,使用含1 μg/ml G418(购自SIGMA)的DMEM培养基培养转染后的细胞2周并筛选稳沉默ERβ基因的细胞。利用Western blotting分析ERβ的蛋白表达水平并进行下一步实验。
1.7 Western blotting从每个处理组中取出等量的蛋白样品(大约每个样品槽中加入50 μg蛋白样品)进行聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳结束后将凝胶中的蛋白转移到PVDF膜上并加入适量的一抗在4 ℃条件下轻轻摇动过夜。一抗孵育完成之后清洗PVDF膜并加入适量的荧光二抗(IRDyeTM700与IRDyeTM800购自美国LICOR)于室温下避光孵育1.5 h。最后利用Odyssey红外双色检测系统(LI-COR Odyssey Infrared Imaging System CLX)检测结果。
1.8 免疫共沉淀将IgG,Bad,Bax或ERβ抗体加入到分离的线粒体组分(400 μg)及全细胞裂解液(600 μg)中并于室温孵育2 h。随后将蛋白A/G琼脂糖(购自德国罗氏公司)加入上述混合液中用于收集免疫复合物并在4 ℃条件下轻轻摇动过夜。使用预冷PBS将免疫复合物清洗3次,12 000 r/min离心1 min并收集上清。最后,在上清液中加入上样缓冲液后进行Western blotting分析。
1.9 统计分析实验数据均用Origin 8.0软件进行分析。数据统计分析采用Student's t-test。P < 0.05有统计学意义。本部分的所有结果均在不同的实验组内重复过至少3次。
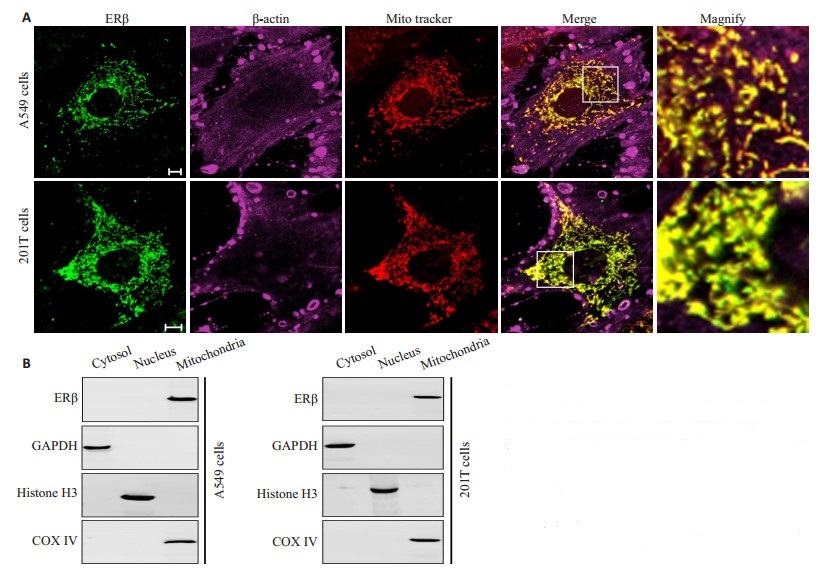
2 结果 2.1 非小细胞肺癌细胞中ERβ的线粒体定位。为了证明ERβ是否定位在非小细胞肺癌细胞系的线粒体中,本研究使用免疫荧光检测细胞内源ERβ的表达。实验结果表明,在A549细胞与201T细胞中ERβ(绿色荧光)与线粒体(红色荧光)完全共定位(黄色荧光),如图 1A所示。此外,分离亚细胞组分后利用Western blotting检测细胞质、细胞核与线粒体中ERβ的表达。实验结果表明,ERβ主要存在于A549细胞与201T细胞的线粒体中,细胞质与细胞核中几乎不表达,如图 1B所示。这些结果证明,ERβ的确存在于非小细胞肺癌细胞的线粒体中。
|
图 1 ERβ的线粒体定位 Figure 1 Identification of mitochondrial localization of ERβ. A: Identification of the localization of ERβ in 549 and 201T cells using immunofluorescence (Bar=10 μm). B: ERβ expression detected with Western blotting in 549 and 201T cells. GAPDH, Histone H3 and COX Ⅵ were used as the cytoplasmic, nuclear and mitochondrial loading control, respectively. n=3. |
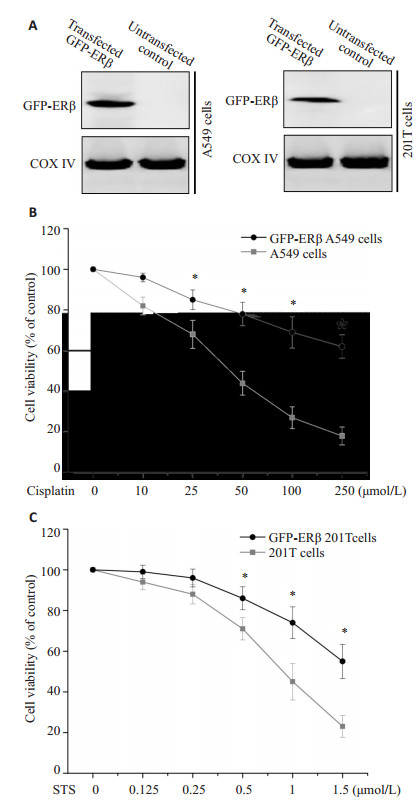
线粒体在细胞凋亡过程中扮演着关键性的角色。既然ERβ定位在线粒体中,那么其是否会影响凋亡刺激诱导非小细胞肺癌细胞的凋亡呢?本研究将GFP-ERβ质粒转染进入A549细胞与201T细胞,分离线粒体组分,并利用Western blotting检测GFP-ERβ的表达。实验结果表明,在A549细胞与201T细胞中GFP-ERβ在线粒体中高表达,如图 2A所示。顺铂及STS是诱导肿瘤细胞凋亡的经典试剂。接下来,本研究利用这2种试剂探究ERβ在线粒体凋亡途径中的作用。如图 2B,C所示,不同浓度的顺铂与STS处理A549细胞与201T细胞后引起明显的细胞凋亡。然而在过表达GFP-ERβ的A549细胞与201T细胞中顺铂与STS引发的细胞凋亡与未过表达组相比显著下降。这些结果表明线粒体ERβ保护非小细胞肺癌细胞抵抗凋亡刺激引起的细胞死亡。
|
图 2 A549及201T细胞中过表达ERβ降低顺铂及STS诱导的细胞凋亡 Figure 2 Overexpression of ERβ reduced cisplatin-or STS-induced apoptosis of 549 and 201T cells. A: Mitochondrial GFP-ERβmeasured by Western blotting in 549 and 201T cells (n=3); B: Viability of A549 cells measured after exposure to different does of cisplatin and STS (n=3, *P < 0.05); C: Viability of 201T cells measured under exposure to different doses of STS (n=3, *P < 0.05). |
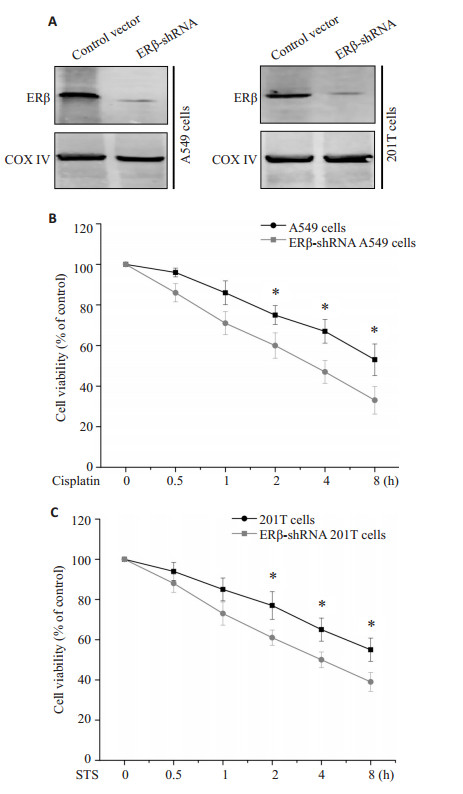
过表达ERβ可以阻抑顺铂与STS诱导的细胞凋亡,那么沉默细胞内源的ERβ是否可以增加顺铂与STS诱导的细胞凋亡呢?将ERβ-shRNA转染进入A549细胞与201T细胞,分离线粒体组分并利用western blotting检测ERβ在线粒体中的表达。如图 3A所示,沉默ERβ后A549细胞与201T细胞线粒体中ERβ的表达显著下调,大约沉默了90%以上的ERβ。接下来,本研究使用同一浓度的顺铂与STS处理A549细胞与201T细胞并在不同时间点检测细胞凋亡的情况。如图 3B和2C所示,不同时间点时顺铂与STS处理A549细胞与201T细胞后引起明显的细胞凋亡。然而在沉默ERβ的A549细胞与201T细胞中,顺铂与STS引发的细胞凋亡与未沉默的细胞相比显著提高。这些结果表明沉默线粒体ERβ增加非小细胞肺癌细胞对凋亡刺激的敏感性。同时也表明线粒体ERβ对非小细胞肺癌细胞的保护作用。
|
图 3 A549及201T细胞中沉默ERβ增加顺铂及STS诱导的细胞凋亡 Figure 3 Knockdown of ERβ increased apoptosis induced by cisplatin and STS in 549 and 201T cells. A: Mitochondrial ERβ measured by Western blotting in 549 and 201T cells with ERβ down-regulation by ERβ-shRNA (n=3); B: Viability of A549 cells treated with cisplatin measured at different time points (n=3, *P < 0.05); C: Viability of 201T cells treated with STS measured at different time points (n=3, *P < 0.05). |
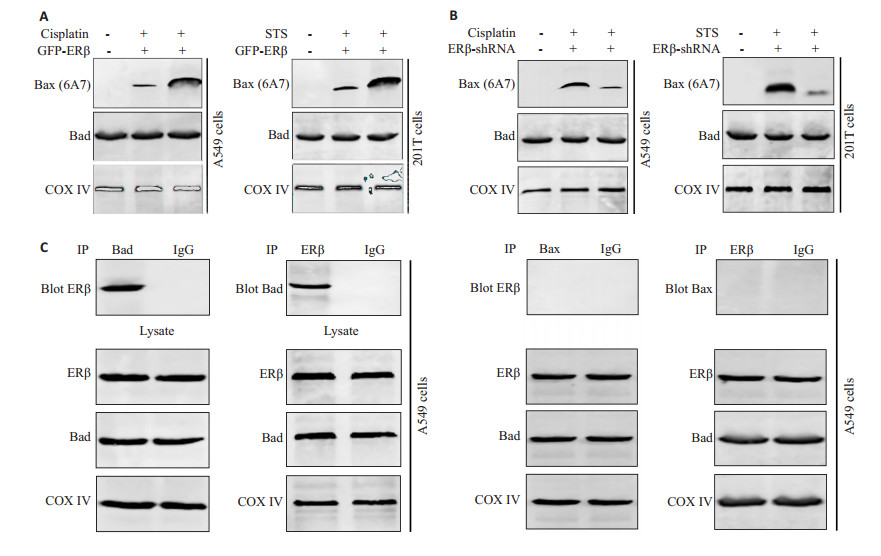
线粒体ERβ可以保护非小细胞肺癌细胞的凋亡,那么其作用的分子机制是什么呢?由于顺铂与STS都可以激活线粒体凋亡途径,其中Bax是该途径中的一个关键凋亡分子,活化的Bax可以由细胞质转位到线粒体并使线粒体膜通透化,细胞色素c释放从而诱导细胞凋亡。那么过表达或沉默ERβ是否会影响Bax向线粒体的转位呢?如图 4A所示,顺铂与STS处理细胞后活化的Bax(6A7)在线粒体的表达明显增加。然而过表达GFP-ERβ后显著降低了活化Bax(6A7)在线粒体的含量。然而Bad的表达量无明显变化。此外,与未沉默组相比,沉默线粒体ERβ后显著提高顺铂与STS诱导Bax在线粒体的表达。然而Bad的表达量也无明显改变。如图 4B所示。接下来,本研究利用蛋白质免疫共沉淀实验发现线粒体ERβ可以与另一个激活Bax的Bcl-2家族成员Bad相互作用,并保持紧密的结合。另外,我们也检测了ERβ与Bax之间的相互作用,实验结果显示ERβ与Bax之间并没有直接的作用关系。如图 4C所示。这些结果表明非小细胞肺癌细胞中线粒体ERβ通过与Bad相互作用阻抑Bax的激活以及后续向线粒体的转位,从而保护细胞免于凋亡。
|
图 4 线粒体ERβ通过与Bad相互作用抑制Bax的激活 Figure 4 Mitochondrial ERβ interacted with Bad and prevented Bax activation. A: Overexpression of GFP-ERβ suppressed Bax activation in 549 and 201T cells with cisplatin and STS treatment (n=3). B: Knockdown of ERβ promoted Bax activation in 549 and 201T cells with cisplatin and STS treatment (n=3); C: The interaction between ERβ and Bad or Bax measured with co-immunoprecipitation in A549 cells. n=3. |
最近的研究表明ERβ是一种由雌激素激活的细胞核内的转录因子[11],对其在细胞内的定位了解甚少。本文结合免疫荧光、亚细胞器分离及Western blotting技术在非小细胞肺癌中阐明ERβ主要定位在线粒体并起到保护线粒体抵抗凋亡刺激的作用。有研究表明ERβ可以结合线粒体DNA并转录出线粒体细胞色素c氧化酶的亚基,增加呼吸链的活性,参与氧化磷酸化[7]。此外,线粒体ERβ还可以抑制转化生长因子β诱导的细胞凋亡[12]以及保护线粒体抵抗氧化应激造成的损伤[8]。总之,这些证据都表明ERβ作为一种线粒体组分发挥着保护线粒体的完整性及其功能的重要作用。
近来的研究发现ERβ以配体依赖的方式增加细胞的存活率并抵抗紫外辐射诱导的细胞凋亡[4]。本文揭示了线粒体ERβ通过与线粒体促凋亡蛋白Bad直接相互作用从而抑制顺铂与STS诱导的细胞凋亡。过表达ERβ显著减少顺铂与STS诱导的细胞凋亡,相反沉默ERβ明显增加顺铂与STS诱导的细胞凋亡。此外,有研究报道下调ERβ的表达能够降低线粒体膜电位[13]。线粒体膜电位的丧失是导致细胞凋亡的早期信号之一。所有这些证据都表明线粒体定位的ERβ可以以配体依赖及非依赖的方式调节细胞凋亡并且ERβ作为线粒体组分可能是内源凋亡途径的一个新的关键信号分子。
众所周知,线粒体凋亡途径在细胞死亡过程中占据主导地位。这个过程是由Bcl-2家族蛋白介导的,例如Bax,Bcl-2,Bcl-xl等。本文利用免疫共沉淀揭示了线粒体ERβ与促凋亡蛋白Bad直接相互作用,而与凋亡因子Bax没有直接的相互作用,这可能是导致减少Bax向线粒体转位,细胞色素c释放及后续细胞死亡的原因。总之,这些结果进一步阐明ERβ作为线粒体组分从而保护线粒体的完整性及细胞的凋亡。同时,本文也为以线粒体ERβ作为靶点治疗非小细胞肺癌提供了一个新的治疗策略。
| [1] | Mangelsdorf DJ, Thummel C, Beato M, et al. The nuclear receptor superfamily:the second decade[J]. Cell,1995, 83 (6) : 835-9. DOI: 10.1016/0092-8674(95)90199-X. |
| [2] | Thomas C, Gustafsson JÅ. The different roles of ER subtypes in cancer biology and therapy[J]. Nat Rev Cancer,2011, 11 (8) : 597-608. DOI: 10.1038/nrc3093. |
| [3] | Ivanova MM, Mazhawidza W, Dougherty SM, et al. Sex differences in estrogen receptor subcellular location and activity in lung adenocarcinoma cells[J]. Am J Respir Cell Mol Biol,2010, 42 (3) : 320-30. DOI: 10.1165/rcmb.2009-0059OC. |
| [4] | Pedram A, Razandi M, Wallace DC, et al. Functional estrogen receptors in the mitochondria of breast cancer cells[J]. Mol Biol Cell,2006, 17 (5) : 2125-37. DOI: 10.1091/mbc.E05-11-1013. |
| [5] | Solakidi S, Psarra AM, Sekeris CE. Differential subcellular distribution of estrogen receptor isoforms:localization of ERalpha in the nucleoli and ERbeta in the mitochondria of human osteosarcoma SaOS-2and hepatocarcinoma HepG2cell lines[J]. Biochim Biophys Acta,2005, 1745 (3) : 382-92. DOI: 10.1016/j.bbamcr.2005.05.010. |
| [6] | Chen JQ, Yager JD, Russo J. Regulation of mitochondrial respiratory chain structure and function by estrogens/estrogen receptors and potential physiological/pathophysiological implications[J]. Biochim Biophys Acta,2005, 1746 (1) : 1-17. DOI: 10.1016/j.bbamcr.2005.08.001. |
| [7] | Chen JQ, Delannoy M, Cooke C, et al. Mitochondrial localization of ERalpha and ERbeta in human MCF7cells[J]. Am J Physiol Endocrinol Metab,2004, 286 (6) : E1011-22. DOI: 10.1152/ajpendo.00508.2003. |
| [8] | Robb EL, Stuart JA. Resveratrol interacts with estrogen receptorbeta to inhibit cell replicative growth and enhance stress resistance by upregulating mitochondrial superoxide dismutase[J]. Free Radic Biol Med,2011, 50 (7) : 821-31. DOI: 10.1016/j.freeradbiomed.2010.12.038. |
| [9] | Matsuda K, Nishi M, Takaya H, et al. Intranuclear mobility of estrogen receptor alpha and progesterone receptors in association with nuclear matrix dynamics[J]. J Cell Biochem,2008, 103 (1) : 136-48. DOI: 10.1002/(ISSN)1097-4644. |
| [10] | Byer SJ, Eckert JM, Brossier NM, et al. Tamoxifen inhibits malignant peripheral nerve sheath tumor growth in an estrogen receptor-independent manner[J]. Neuro Oncol,2011, 13 (1) : 28-41. DOI: 10.1093/neuonc/noq146. |
| [11] | Damdimopoulos AE, Spyrou G, Gustafsson JA. Ligands differentially modify the nuclear mobility of estrogen receptors alpha and beta[J]. Endocrinology,2008, 149 (1) : 339-45. DOI: 10.1210/en.2007-0198. |
| [12] | Stirone C, Duckles SP, Krause DN, et al. Estrogen increases mitochondrial efficiency and reduces oxidative stress in cerebral blood vessels[J]. Mol Pharmacol,2005, 68 (4) : 959-65. DOI: 10.1124/mol.105.014662. |
| [13] | Yang SH, Sarkar SN, Liu R, et al. Estrogen receptor beta as a mitochondrial vulnerability factor[J]. J Biol Chem,2009, 284 (14) : 9540-8. DOI: 10.1074/jbc.M808246200. |
 2015, Vol. 35
2015, Vol. 35
